磁性納米Fe3O4-SiO2載體的改性及其在脂肪酶固定化中的應用
甘露菁,田韓,榮菡,彭佳敏,肖曉欣,黃海雯
北京理工大學珠海學院,材料與環境學院(珠海 519088)
磁性納米Fe3O4-SiO2載體材料具有優異的超順磁性能。所謂超順磁性,即在磁場中有較強的磁性,撤離磁場時,磁性很快消失,而不會被永久磁化[1],它們在外磁場作用下可方便進行定位反應和高效回收,因此近年來在這一領域的研究日益活躍,成為生物材料研究領域中最具應用前景的發展方向之一[2-3]。但就研究狀況而言,磁性納米Fe3O4-SiO2載體材料的研究主要集中在磁性微球的合成和表征方面,而對偶聯劑修飾的磁性微球的研究報道不多[4-5]。
磁性納米Fe3O4-SiO2載體材料是在磁性納米Fe3O4粒子表面包覆一層SiO2后形成,而SiO2由于表面具有大量羥基,導致親水性極強,不容易在油相或有機溶劑中分散,易聚團,難以發揮其優良的性能,因此必須對其進行改性[6-8]。偶聯劑(KH-550)是一種典型的硅烷偶聯劑,常用于氧化物表面的氨基化改性,經過KH-550修飾后的磁性納米Fe3O4-SiO2載體材料表面含有大量氨基和有機鏈臂,大幅拓展和提高磁性納米Fe3O4-SiO2載體材料的應用領域[9-10]。
大部分的酶的本質是蛋白質,它作為一種生物催化劑,具有較高催化效率。但由于在生產使用中游離酶有易失活和難以與底物分離的缺點。近些年研究表明,酶分子被固定化后,可以反復循環利用,且在產物分離純化上增加便利[11-12]。因此酶固定化技術得到迅速發展[13]。在酶分子固定化領域,用KH-550改性后的磁性納米Fe3O4-SiO2載體表面含有大量氨基,由于活性氨基可以與蛋白質、DNA等生物分子偶聯,在一定程度上,以化學鍵形式結合脂肪酶,使酶不易脫落,克服傳統的載體吸附酶法易脫落、使用周期短的弱點[14-16]。因此該復合載體材料在生物材料分離、酶和抗體等生物分子的固定等方面有重要應用。
1 材料與方法
1.1 材料、設備與儀器
磁性納米Fe3O4-SiO2載體(99.5%,北京理工大學珠海學院實驗室制得);正己烷、石油醚、無水乙醇、KH-550、甲醇、磷酸二氫鈉、磷酸二氫鉀(均為分析純,天津市大茂化學試劑廠);氫氧化鉀、酚酞(均為分析純,廣州化學試劑;廢油脂(北京理工大學珠海學院,煎炸多次);脂肪酶Novozyme 435(諾維信(中國)生物技術有限公司)。
電熱恒溫水浴鍋(常州奧華);電動攪拌器(上海恒科學儀器有限公司);高功率數控超聲波清洗器;電子天平(紀銘);電熱恒溫鼓風干燥箱(上海齊歡);超純水與去離子水制水機(Millipore);磁鐵(青島磁鋼廠);冰箱(青島海爾集團公司);恒溫震蕩器(上海恒科學儀器有限公司);高速離心機(江蘇安信)。
1.2 載體的去油、表面活化
將3~5 g磁性納米Fe3O4-SiO2載體加入至3% NaOH溶液中,室溫下超聲分散洗滌5~10 min,磁分離,回收物用去離子水洗滌至中性得到去油的磁性納米Fe3O4-SiO2載體。
將去油的磁性納米Fe3O4-SiO2載體加入雙氧水堿性溶液[V(H2O2)∶V(NH3)∶V(H2O)=1.5∶4.5∶94]中,50~70 ℃加熱攪拌30 min,磁分離后回收物用去離子水洗滌至中性,60 ℃真空干燥6 h得到活化的磁性納米Fe3O4-SiO2載體。
1.3 載體的表面氨基化改性
按質量將47%乙醇、47%去離子水和4.0% Kh-550混合后,在80 ℃條件下攪拌反應1.5 h,使Kh-550充分水解,溫度降為65 ℃后加入2%活化磁性納米Fe3O4-SiO2載體,攪拌反應1.5 h,待其充分反應,磁分離,回收物用乙醇洗滌2次,在60 ℃真空干燥6 h,得到改性成功后的氨基化磁性納米Fe3O4-SiO2載體,將其命名為G0。
1.4 改性前、后的載體固定化脂肪酶
分別用改性前的磁性納米Fe3O4-SiO2載體和改性后的磁性納米Fe3O4-SiO2載體對脂肪酶進行固定化。
先配制0.2 mol/L pH 7.5的PBS緩沖液:儲備液A,0.2 mol/L的磷酸二氫鈉(35.814 g Na2HPO4用去離子水定容至500 mL),儲備液B,0.2 mol/L的磷酸二氫鉀(15.6 g的KH2PO4用去離子水定容至500 mL),將儲備液A、B液混合即得到pH 7.5的PBS緩沖液。將3 mL的液體脂肪酶置于55 ℃的100 mL PBS緩沖液中攪拌活化10~15 min,在50 ℃條件下加入1 g載體,攪拌反應4 h,磁分離回收固定化脂肪酶,在4 ℃保存備用。將改性前的載體固定化脂肪酶命名為G1,將改性后的載體固定化脂肪酶命名為G2。
1.5 G1、G2固定化脂肪酶在生物柴油制備中的應用
廢油脂預處理:在北京理工大學珠海學院街客小店中收取一定量餐飲廢油,于高速離心機中離心,除去餐飲廢油中的固體雜質,用旋轉蒸發除水和一定量的哈喇氣味。
生物柴油制備酯化反應:設計A、B 2組對比試驗,分別加入93%預處理廢油脂和4%甲醇,其中甲醇的量按酯化反應的時間分成5次加入,在反應物中分別加入3%固定化酶G1(酯化反應A組)和G2(酯化反應B組),將反應物置于60 ℃搖床反應6 h進行酯化反應,反應結束后離心處理,取上層液體進行酸價測定;下層固體用磁鐵回收,用正己烷洗滌2~3遍,50℃烘干,4 ℃保存備用。
酸價的測定:取預處理過的廢油脂或酯化反應產物3~5 g,加入乙醇乙醚混合溶劑50 mL,搖勻后,加入2~3滴酚酞,用0.05 mol/L KOH標準溶液滴定,根據式(1)計算得酸價。

式中:V為消耗KOH使酚酞變色30 s不變色時的體積,mL;C為KOH濃度,mol/L;M為油脂質量,g。
酯化率的測定,分別計算出A、B 2組試驗的酯化率。根據式(2)計算。

1.6 G2固定化脂肪酶重復利用
將G2固定化脂肪酶按照1.5的方法反復10次進行生物柴油制備的酯化反應,每次利用后的G2固定化脂肪酶均用正己烷洗滌2~3遍,50 ℃烘干,4 ℃保存備用。同時計算出每次酯化反應后酯化率。
1.7 載體的表征
1.7.1 X-射線衍射儀(XRD)
對去油和活化后的磁性納米Fe3O4-SiO2載體的晶型進行判斷,用X-射線衍射儀(XRD)表征磁性納米Fe3O4-SiO2載體在去油和活化的過程中磁性納米Fe3O4的晶型結構是否發生變化,按文獻[17]對樣品進行處理和測定。
1.7.2 電子透射顯微鏡(TEM)
采用電子透射顯微鏡(TEM)對去油和活化后的磁性納米Fe3O4-SiO2載體的包裹情況進行直觀的判斷,按文獻[17]對樣品進行處理和測定。
1.7.3 改性前后的載體分散在正己烷和水中
將改性前、后的磁性納米Fe3O4-SiO2載體分別分散在正己烷和水中,對比和直觀判斷氨基化改性是否成功。
1.7.4 傅立葉紅外光譜儀(FT-IR)
用傅立葉紅外光譜儀(FT-IR)分別對磁性納米Fe3O4-SiO2載體和改性后的磁性納米Fe3O4-SiO2載體進行測試,找到最優的改性反應時間,按文獻[18]進行處理。
2 結果與分析
2.1 X-射線衍射儀(XRD)
圖1為去油和活化后的磁性納米Fe3O4-SiO2載體的XRD圖譜,衍射峰分別出現在30.00,35.50,43.20,53.80,57.1和62.9處,與黃菁菁等[19]制備的磁性納米Fe3O4晶體反尖晶石結構的衍射面相同,可以確定SiO2殼層中的磁性納米Fe3O4的晶型為反尖晶石結構,可知SiO2殼層中的Fe3O4的晶型在去油和活化的過程中沒有發生變化,依舊是磁鐵礦型。同時標志峰明顯,沒有出現其他雜峰,說明合成材料內核Fe3O4純度非常高。

圖1 去油和活化后的磁性納米Fe3O4-SiO2載體(XRD)
2.2 電子透射顯微鏡(TEM)
采用電子透射顯微鏡(TEM)對去油與活化后的磁性納米Fe3O4-SiO2載體的包裹情況進行直觀的判斷,圖2和圖3分別為30 K下和400 K下去油與活化后的磁性納米Fe3O4-SiO2載體的TEM圖,其粒徑約30 nm,包裹厚度3~5 nm,磁性納米Fe3O4平均粒徑20~25 nm,其分散性良好,且去油和活化過程沒有讓磁性納米Fe3O4表面包裹的SiO2完全溶解腐蝕。

圖2 去油和活化后的磁性納米Fe3O4-SiO2載體(30 K-TEM)

圖3 去油和活化后的磁性納米Fe3O4-SiO2載體(400 K-TEM)
2.3 改性前后的載體在正己烷和水中的分散性
圖4 顯示磁性納米Fe3O4-SiO2載體與改性后的磁性納米Fe3O4-SiO2載體分別分散在正己烷和去離子水中的情況,磁性納米Fe3O4-SiO2載體分散在正己烷中時磁性納米Fe3O4-SiO2載體聚團成較大顆粒狀,且易于沉降,在正己烷中不能分散,不具有超順磁性,推測其原因是磁性納米Fe3O4-SiO2載體聚團后使得質量變大,重力過大使得超順磁性難以展示[6-8];磁性納米Fe3O4-SiO2載體分散在去離子水中時能均勻分散,且一段時間內不沉降,具有超順磁性。改性后的載體均可均勻分散在正己烷中和水中,且一段時間內不沉降,具有超順磁性,說明用該種方法改性磁性納米Fe3O4-SiO2載體具有兩親性,可應用水/油2種分散體系中。

圖4 改性前、后的載體分散在正己烷和水中圖
2.4 傅立葉紅外光譜儀(FT-IR)
由圖5所示曲線a表示納米Fe3O4、曲線b表示磁性納米Fe3O4-SiO2載體曲線、曲線c表示氨基改性的磁性納米Fe3O4-SiO2載體的傅里葉變換紅外光譜圖,與張小強[16]在磁性高分子微球的合成及其用于脂肪酶固定化的研究的傅里葉變換紅外光譜儀(FT-IR)對比,可知a、b、c在580 cm-1處都有吸收,說明三者都有相同成分存,其本質為四氧化三鐵,即可知a、b、c都是由四氧化三鐵合成而來;b、c在1 080 cm-1有相同吸收峰,說明兩者有相同成分,其本質為SiO2,即可知b、c都包埋上SiO2;由c可知在1 384,1 490和1 582 cm-1處都有吸收峰,此3處的吸收峰為亞甲基、甲基的伸縮振動峰,因此可知載體表面已連接上氨基,說明對磁性納米Fe3O4-SiO2載體表面氨基改性成功。
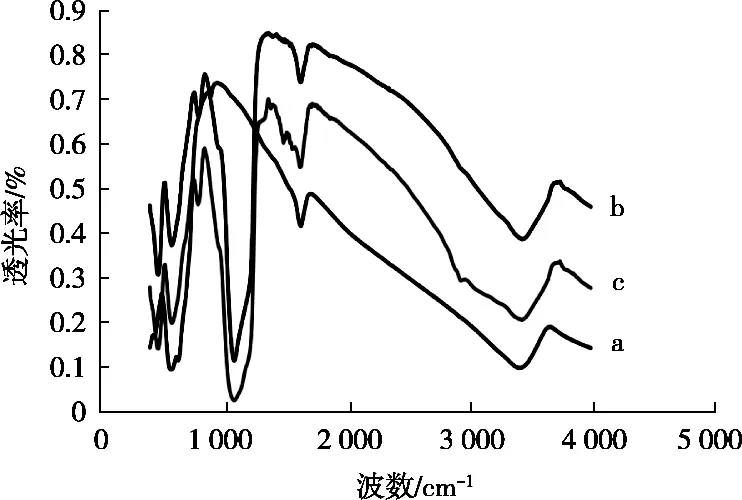
圖5 納米Fe3O4(曲線a)、納米Fe3O4-SiO2(曲線b)、改性后的納米Fe3O4-SiO2(曲線c)的FT-IR表征圖
2.5 G1、G2固定化酶的生物柴油酯化率對比
將G1、G2固定化酶分別應用于生物柴油的酯化反應中,對每種固定化酶進行3次平行試驗,如圖6所示,其G1固定化脂肪酶酯化率為26.78%;G2固定化脂肪酶酯化率為56.4%。
是G1固定化脂肪酶酯化率的2.1倍,因此可知改性后的載體固定化酶對酯化反應有很大的促進作用,推測其原因可能是,未改性載體在油/水體系中易發生聚團,聚團后的固定化酶與反應物的接觸面積減小,使得酯化率大大減小,而載體氨基化改性后,載體表面連接上較長的碳鏈臂,能均勻分散在油/水體系,固定化酶與反應物的接觸面積增大,使酯化率大大提高。另一個原因可能是由于改性載體表面連接上大量氨基,使得載體以肽鍵方式連接上大量酶分子,從而使酯化率大幅提升[14]。
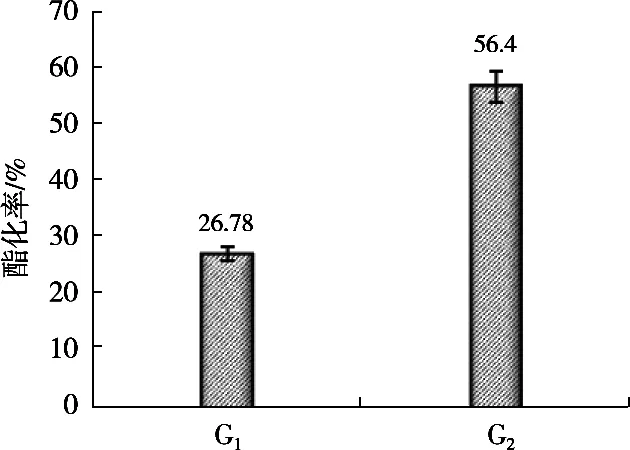
圖6 改性前、后載體固定化脂肪酶進行生物柴油的酯化率對比
2.6 G2固定化酶重復利用
將G2固定化酶重復進行生物柴油酯化反應,用每次反應的酯化率來評價固定化酶的使用壽命和利用率。其10次重復使用后的酯化率變化趨勢圖如圖7。
由G2固定化酶重復使用10次的酯化率可知,10次平均酯化率達50.65%,重復使用10次后酯化率未有明顯下降,較第1次使用的酯化率下降15.8%。因為酯化率的高低與酶活力的大小成正相關,此處用酯化率來評價酶的活性大小,可知重復使用10次后的酶活回收率為71.99%。而馮超[13]提出固定化的脂肪酶重復使用8次后的酶活回收率只有36.4%,重復使用10次后的酶活回收率幾乎接近0;王燕佳等[20]的研究結果顯示固定化脂肪酶重復使用5次后其相對酶活為初始時的57.8%。改性后的磁性納米Fe3O4-SiO2載體固定化酶效率高,使用周期長,能在實際應用中節約成本,推測其原因是由于氨基化改性后,載體連接上氨基,在一定程度上,以化學鍵形式結合脂肪酶,使酶不易脫落,克服傳統載體吸附酶法易脫落、使用周期短的缺點,這與試驗結論相吻合。
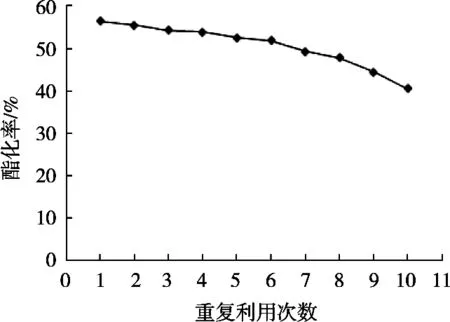
圖7 G2固定化酶重復使用的酯化率
3 結論與討論
磁性納米Fe3O4-SiO2載體由于表面的包裹材料SiO2含有大量羥基,因此該復合材料是親水性材料,為了能使磁性納米Fe3O4-SiO2載體的應用范圍更為廣泛,需對載體進行改性,試驗將載體去油和活化后用KH-550對載體進行氨基化改性,用改性后的載體和改性前的載體分別固定化脂肪酶,用這2種固定化酶催化酯化反應,對比其二者的酯化率,用酯化率來評價改性的效果。結果表明,改性后,磁性納米Fe3O4-SiO2載體表面連接上大量氨基和有機碳鏈臂,使得載體在油相中能均勻分散性,其酯化率比未改性的載體固定化的脂肪酶的酯化率高2倍。改性后的載體固定化的脂肪酶重復使用10次后,酯化率只下降15.8%,改性后的載體固定化脂肪酶的固定效果好,不易脫落、回收利用率更高、酯化率高、使用壽命長,在實際應用中能節約成本。

