外周血Th17相關炎性因子在慢性乙型肝炎患者接受Peg-IFNα治療前后的變化及臨床意義
黃菁 張永臣 虞玲
HBV感染導致的慢性乙型肝炎(CHB)是一個重要的全球性公共衛生問題[1]。輔助性T淋巴細胞17(Th17)是近年來新發現的CD4+T細胞亞群,研究表明,CHB患者外周血中Th17細胞的比例較正常人升高,且與病情嚴重程度相關[2-3],說明Th17參與了機體應答HBV感染的過程。本研究收集、整理76例本院收治并進行聚乙二醇干擾素α(Peg-IFNα)治療的CHB患者資料,對治療過程中患者外周血Th17細胞的主要效應因子IL-17A及IL-22水平進行檢測,旨在探討這些Th17相關細胞因子在預測Peg-IFNα治療效果中的作用,以更好地協助臨床調整用藥方案,提高治療效率。
資料與方法
一、 研究對象及治療方法
收集南京市第二醫院2014年10月至2017年6月收治的初治CHB患者76例為研究對象,所有患者診斷均符合《慢性乙型肝炎防治指南(2015版)》標準[4]:(1)HBeAg陽性者HBV DNA≥20 000 IU/mL, HBeAg陰性者HBV DNA≥2 000 IU/mL;(2)ALT水平在正常值上限(ULN)的2~10倍。所有入組患者均排除以下情況:(1)患有其他病毒性肝炎;(2)患有酒精性肝炎、自身免疫性肝病、藥物性肝炎或其他原因引起的肝臟疾病;(3)正在服用其他抗病毒藥物或降轉氨酶類藥物;4)患有可引起血小板減少的血液性疾病,或正在服用可降低血小板的藥物;(5)正在妊娠期或哺乳期。所有患者在入院后給予皮下注射Peg-IFNα-2a(180 μg/周,商品名:派羅欣,購于上海羅氏制藥有限公司,規格為180 μg/0.5 mL,國藥準字J20160077),連續治療48周。
二、 檢測指標
所有患者在治療前及治療后隨訪時間點(4、12、24、48周)留取10 mL靜脈血,以檢測血常規、肝功能、HBV血清標志物、HBV DNA、IL17A和IL-22細胞因子。采用全自動血細胞分析儀(Syxmex XT-1800i)進行血常規檢測,檢測指標包括白血胞計數(WBC)、血紅蛋白(Hb)和血小板(PLT);采用全自動生化分析儀(Beckman AU5800)進行肝功能檢測,檢測指標包括ALT、AST和總膽紅素(TBil);采用化學發光免疫檢測儀(Abbott ARCHITECT i2000)檢測HBV血清標志物;采用熒光實時定量PCR(ABI 7500 real-time PCR儀)檢測HBV DNA水平,檢測下限為1 000 IU/mL;采用ELISA試劑盒(Abcam)檢測IL-17A和IL-22。
三、 治療效果評價指標
根據指南的要求對患者的治療效果進行評價[4]。治療24周時,根據患者血清HBV DNA水平,將患者分為部分病毒學應答組和病毒學不應答組,其中部分病毒學應答的定義為HBV DNA水平較治療前基線水平下降>2 log10IU/mL,病毒學不應答組HBV DNA水平與基線水平的差異≤2 log10IU/mL。
四、 統計分析方法
應用SPSS 16.0軟件和Excel 2012對數據進行整理和統計學分析。連續性變量以平均數±標準差或中位數(四分位間距, IQR)表示,兩組之間的差異比較采用t檢驗或Kruskal-Wallis秩和檢驗;分類變量以構成比表示,兩組之間的差異比較采用卡方檢驗。采用Kaplan-Meier法比較IL-17A水平對病毒學變化的影響。P<0.05為差異有統計學顯著意義。
結 果
一、CHB患者病毒學應答情況與基線指標的關系
76例接受Peg-IFNα治療的CHB患者在進行24周治療后,35例達到部分病毒學應答標準,應答比例為46.05%,未實現病毒學應答的為41例(53.94%)。比較部分應答組和不應答組的基線資料(見表1),結果顯示,兩組患者的性別構成和平均年齡差異無統計學意義,治療前血常規指標(WBC、Hb、PLT)、AST和TBil、基線HBeAg水平、基線IL-22水平差異均無統計學意義(P>0.05)。在有差異的指標中,部分應答組基線ALT水平為248.47 U/L(IQR 135.13~306.99),顯著高于不應答組的基線ALT水平147.33 U/L(IQR 87.6~225.81)(P<0.01);部分應答組的基線HBsAg水平和血清HBV DNA載量均明顯低于不應答(P分別為0.046和<0.01);部分應答組的血清IL-17A水平也顯著低于不應答組(P<0.01)。以上結果表明,基線ALT水平、基線HBsAg水平、血清HBV DNA載量和基線IL-17A水平可能是影響CHB患者抗病毒治療效果的預后因素。
二、 CHB患者接受Peg-IFNα治療前后相關預后因素的動態變化
進一步對上述4個可能的預后因素進行動態分析(見圖1),結果顯示,兩組患者在接受治療后,ALT都出現快速下降,部分應答組雖然基線ALT水平較高,但在治療4周后就下降到與不應答組相同的水平,并且一直維持到整個治療結束;部分應答組的HBsAg水平、HBV DNA載量和血清IL-17A水平在治療后呈現明顯下降,而不應答組的這三個指標水平雖有下降但變化程度不大,且一直高于部分應答組。結果提示,ALT的動態變化趨勢并不能說明治療的病毒學改善情況,而患者IL-17A水平則與HBsAg水平和HBV DNA載量有一致的變化趨勢。
三、CHB患者IL-17A與抗病毒治療效果的相關性分析
以CHB患者的基線IL-17A水平的中位數(41.56 ng/L)為截止點進行分組,以治療出現部分病毒學應答為結局事件,應用Kaplan-Meier曲線進一步分析IL-17A對治療結局的預測作用(見圖2)。在治療12周及以后,基線IL-17A水平低的CHB患者比基線水平高的患者更容易出現部分病毒學應答的結局事件,說明IL-17A水平對于CHB患者接受Peg-IFNα治療后的預后有指示意義。

表1 部分病毒學應答組與病毒學不應答組基線資料的比較
注:所有數據除了性別與年齡外,均表示為中位數(四分位間距)。a卡方檢驗;bt檢驗;ckruskal-Wallis秩和檢驗

圖1 部分病毒學應答組與病毒學不應答組在抗病毒治療期間ALT、HBsAg、HBV DNA、IL-17A的動態變化
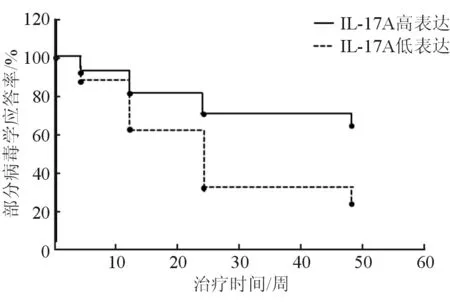
圖2 基線IL-17A表達水平預測部分病毒學應答率的變化曲線
討 論
CHB的發生和轉歸與宿主免疫系統的抑制與激活密切相關。本研究發現,Th17分泌的主要效應因子IL-17A與CHB患者接受Peg-IFNα治療的轉歸結局相關,基線血清IL-17A水平較低的患者更可能在治療后達到病毒學應答的目標,Th17分泌的另一種細胞因子IL-22則與病毒學應答沒有明顯關聯。
本研究結果表明,CHB患者經Peg-IFNα治療后,血清IL-17A水平下降,這與文獻報道的CHB患者接受干擾素治療后,Th17細胞分化受抑制、血清中IL-17水平下降的結果一致[5]。另有報道,CHB患者經恩替卡韋治療后,血清IL-17及Treg/Th17比例下降,且Treg/Th17比值與HBV DNA、HBsAg和HBeAg呈正相關[6-7]。但郭如意等報道,CHB患者接受核苷(酸)類似物治療12周后,IL-17水平略有上升,24周后呈現下降趨勢,IL-17動態變化趨勢不同可能與不同的藥物作用機制有關[8]。
本研究同時發現,基線ALT水平較高、基線HBsAg水平和HBV DNA水平較低有利于CHB患者接受Peg-IFNα治療后發生病毒學應答,這與之前的報道一致[9]。根據之前的文獻報道,IL-17A與ALT、HBsAg和HBV DNA沒有明顯線性關聯,因此IL-17A在抗病毒治療中的作用很可能是一種間接作用,即通過誘導其他免疫反應從而發揮細胞毒作用,而不是直接參與HBV的殺滅[10]。
本研究也存在一些局限。首先本研究僅僅探討了IL-17A水平與CHB患者達到病毒學應答的情況,并沒有討論IL-17A與HBeAg血清學轉換(HBeAg轉陰且出現抗-HBe)是否存在關聯,主要是因為治療前HBeAg陽性的患者數量比較少(37例),在治療后發生血清學轉換的僅有8例,樣本量太小導致統計分析的把握度不夠。其次,本研究沒有對停藥后的病毒學應答情況進一步分析,主要是因為隨訪工作難度比較大,在今后的研究工作中還需加強隨訪工作。

