凝膠原位探測c-Myc G-四鏈體的結構多態性
常天俊 武 俐 卞文秀 邴 濤 趙同謙 上官棣華*
1(河南理工大學資源環境學院, 焦作 454000)2(中國科學院化學研究所, 北京分子科學國家實驗室, 活體分析化學院重點實驗室, 北京 100190)
1 引 言
G-四鏈體(G-quadruplex, G4)是由富鳥嘌呤(G)的核酸通過Hoogsteen氫鍵形成的高級結構[1]。G4 DNA具有高度的結構多態性,包括一條DNA鏈形成的分子內平行、反平行或混合平行/反平行G4,兩條或四條DNA鏈(每條鏈不能單獨形成G4)聚集形成的分子間平行或反平行單體G4等多種拓撲構型[2]。其中,由一條DNA序列形成的分子內平行G4一般較穩定,近年來研究發現,這種序列的多個分子也可聚集在一起形成G4聚集體。Gabelica等[2]的研究表明,具有短Loop的平行G4可形成由四鏈體單體堆積成的多聚體。原癌基因c-kit啟動子區的一段序列(c-kit2)既可形成分子內平行G4,也可同時形成由兩條鏈交叉纏繞的分子間平行G4[3]。在本研究組前期工作中,發現不同末端序列可導致平行G4組裝成多種分子內和分子間結構,“Blunt end”的平行G4 (即3'和5'末端堿基為參與四鏈體形成的G)易形成由四鏈體單體堆積的結構,而兩末端有其它堿基時則可抑制G4單體的堆積,但同時形成了少量新的分子間結構[4]。平行G4的不同聚集形式具有多種功能,如具有抗HIV病毒和抗癌活性的序列d(GGGT)4, 活性結構為單個平行G4堆積的二聚體[5]; 分子內平行G4具有普遍的細胞結合活性,而分子間平行G4的細胞結合能力較差[6]; 分子內平行G4結合Hemin形成的過氧化物酶活性遠高于分子間平行的G4[7]。 具有廣譜抗癌活性的G4序列AS1411在K+溶液中可形成包括分子內平行G4在內的8種構型, 但目前尚不清楚起關鍵作用的結構成分[8]。平行G4結構的多態性,尤其是同一序列在溶液中同時形成分子內和分子間的結構,影響其結構-活性研究,然而研究者對分子內平行G4形成的包括聚集結構在內的多態性關注較少。探測這些結構成分,發現起關鍵作用的結構及形成規律,將為G4的可控自組裝及生物活性研究提供支持。
目前,已有可直接或間接測定G4構型的方法,如核磁共振(Nuclear magnetic resonance spectrum, NMR)[9]或X-射線衍射(X-ray diffraction, XRD)[10]可在原子水平測定G4解析結構; 質譜(Mass spectrometry)可直接測定G4的分子數以及與配體的結合狀態[11]; 圓二色光譜(Circular dichroism, CD)是分析G4二級結構最常用的技術之一,在G4結構、離子依賴性以及配體誘導的結構變化等領域廣泛應用[12]; 此外,G4折疊和解折疊的紫外-可見吸收光譜不同,通過測定兩個狀態的差異光譜,可以分析其折疊狀態及變化[13]; 形成G4的核酸在295 nm處的紫外吸收增加,通過測定該處的光吸收值隨溫度的變化曲線(UV-melting),可用于分析G4的折疊狀態及其熱力學[14]。這些方法能很好地測定溶液中的單一G4結構,但對于溶液中多種構型共存則不易分辨具體成分[2,4]。凝膠電泳在檢測從未折疊狀態到折疊成分子內或分子間G4變化等方面廣泛應用[15]。為了研究多種結構共存的G4,Kuryavyi等[3]用非變性凝膠電泳分離不同的構型,再用NMR解析其在溶液中的結構。然而,這些DNA片段在重新溶解過程中結構可能轉化。若能在分離的同時原位分析DNA構型,將有助于克服上述問題。特異性結合G4并產生“熒光打開(Fluorescence ON)”信號的小分子探針近年來得到快速發展[16~19],已成為探測G4在體外,甚至活細胞內折疊的重要技術[20,21]。硫磺素T (Thioflavin T, ThT)是常用于檢測淀粉樣蛋白的苯并噻唑類熒光分子,自Mohanty等[22]發現其能特異性結合人端粒G4并產生強熒光信號以來,已在基于G4的生化分析與生物傳感研究中廣泛應用[23~28]。ThT除對混合平行/反平行的G4有高親和力外[29],還能識別RNA G4[30]及i-motif DNA[31],為在凝膠中對不同G4進行原位染色提供了可能。
c-Myc G4是原癌基因c-Myc啟動子區的一段富G序列,能形成典型的分子內平行G4結構[32],具有抑制多種腫瘤細胞增殖的活性[6],與Hemin結合具有高DNAzyme活性[33]。與許多平行G4相似,末端堿基也影響其形成多種分子間結構[4],這些分子間結構的具體類型、形成規律以及是否具有生物活性并不清楚。為進一步闡明c-Myc的結構多樣性,本研究以熒光分子ThT作為G4探針,采用熒光光譜、CD光譜等方法比較ThT與典型分子內和分子間G4,以及含不同A/T末端堿基的c-Myc的相互作用; 在此基礎上,用ThT對非變性凝膠電泳分離的G4直接染色,再用全染色劑Stains-all對所有DNA條帶進行顯色,比較同一DNA條帶經兩種染色的光密度值,分析判斷DNA條帶的拓撲構型,并探討末端堿基對c-Myc G4自組裝結構的影響。
2 實驗部分
2.1 儀器與試劑
UV-2550紫外-可見分光光度計、S-1700精密控溫裝置(日本Shimadzu公司); F-7000熒光儀(日本Hitachi公司); J-815圓二色光譜儀(日本JASCO公司); DYCZ-24DN型雙垂直電泳儀(北京六一公司); AlphaImagerTM凝膠成像系統(美國Alpha Innotech公司)。
DNA由生工生物(上海)有限公司合成與純化(序列見表1); ThT (分析純,北京百靈威化學科技有限公司); Stains-all(純度97%,美國ACROS 公司),ThT與Stains-all的分子式見圖1; 其它試劑均為分析純,購自國藥(上海)化學試劑公司。實驗用水為超純水 (18.2 MΩ cm,美國Millipore超純水系統制備)。
表1 所用寡核苷酸序列
Table 1 Oligonucleotides used in this study
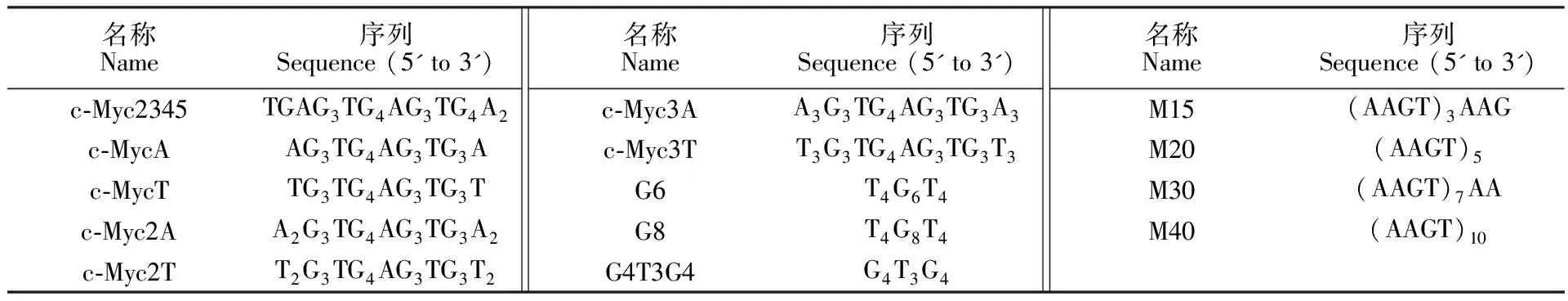
名稱Name序列Sequence (5' to 3')c-Myc2345TGAG3TG4AG3TG4A2c-MycAAG3TG4AG3TG3Ac-MycTTG3TG4AG3TG3Tc-Myc2AA2G3TG4AG3TG3A2c-Myc2TT2G3TG4AG3TG3T2名稱Name序列Sequence (5' to 3')c-Myc3AA3G3TG4AG3TG3A3c-Myc3TT3G3TG4AG3TG3T3G6T4G6T4G8T4G8T4G4T3G4G4T3G4名稱Name序列Sequence (5' to 3')M15(AAGT)3AAGM20(AAGT)5M30(AAGT)7AAM40(AAGT)10
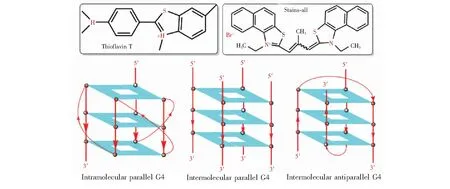
圖1 ThT和Stains-all分子式以及分子內與分子間平行、提籃式分子間反平行G4結構示意圖Fig.1 Schematic of thioflavin T (ThT), Stains-all, intramolecular parallel G-quadruplex (G4), intermolecular parallel G4 and intermolecular antiparallel G4
2.2 DNA樣品溶液制備
DNA溶解于Tris-HCl緩沖液 (25 mmol/L, pH=7.6) 中。用紫外-可見分光光度計測定DNA樣品在260 nm的吸光度值,根據相應序列的摩爾吸光系數計算得到DNA的濃度。為了形成穩定的G4結構,在適當濃度的DNA溶液中加入終濃度為20 mmol/L的 KCl或NaCl,95℃變性10 min,緩慢冷卻至室溫,備用。
2.3 熒光光譜的測量
將DNA樣品(1 μmol/L)與ThT在室溫孵育5 min后,測量溶液的熒光光譜或熒光強度。 熒光光譜測量采用400 μL、1 cm光程的石英四通比色皿,激發波長為425 nm,掃描并收集發射波長在440~650 nm范圍的熒光光譜或490 nm的熒光強度數據。所得數據為3次重復測量的平均值。
2.4 CD光譜測量
5 μmol/L DNA樣品(含20 mmol/L KCl或NaCl)經變性/復性處理后,于25℃測試CD光譜。在1 cm光程的石英比色皿中,加入400 μL樣品,以200 nm/s的速度掃描3次,收集220~320 nm的CD信號。為了測量ThT對DNA構型的影響,不同濃度的ThT與DNA樣品在室溫孵育5 min后測定CD光譜。 CD光譜數據為掃描3次的平均值,經OriginPro 8.0軟件平滑處理,并預先扣除緩沖液背景吸收。
2.5 凝膠電泳與染色分析
采用非變性聚丙烯酰胺凝膠電泳(Native-PAGE)分析DNA(20 μmol/L,含20 mmol/L KCl或NaCl),使用7 cm × 10 cm的20%聚丙烯酰胺凝膠(丙烯酰胺-甲叉雙丙烯酰胺,19∶1,m/m)。 4℃下以9 V/cm電泳4~5 h。電泳緩沖液為1×TBE (89 mmol/L Tris,2 mmol/L EDTA,89 mmol/L硼酸,pH=8.3)。為了維持G4結構,凝膠和電泳緩沖液中分別加入20 mmol/L的相應離子。
在室溫下, 用ThT (6 μmol/L)對凝膠染色15 min,在紫外光照射下, 與G4 DNA結合的ThT分子熒光被激發,通過凝膠成像系統觀測被染色的G4 DNA。將上述凝膠用超純水洗滌后,再用全染色劑Stains-all進行染色; 在日光光照下,未與DNA結合的染料分子褪成無色,結合在DNA上的分子仍為藍色[34],利用凝膠成像儀記錄所有DNA條帶被染色的圖像。ThT或Stains-all染色條帶的光密度值(OD)用ImageJ 軟件(ImageJ 1.48V, Wayne Rasband, National Institutes of Health, 美國)進行定量分析。
3 結果與討論
3.1 熒光法分析ThT與c-Myc序列的相互作用
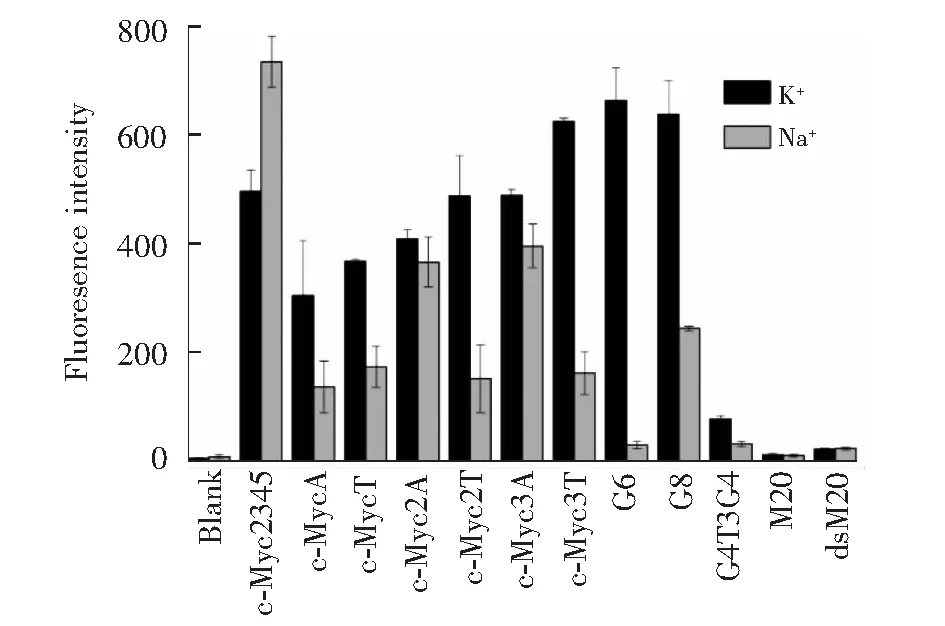
圖2 不同DNA序列存在下的ThT的熒光強度Fig.2 Fluorescence intensity of ThT in the presence of various DNAsλex=425 nm; λem=490 nm
為了實現在分離的同時可視化探測G4多種構型,進而研究末端堿基在G4自組裝中的作用,首先考察了溶液狀態下ThT對含不同末端堿基的c-Myc G4的識別。考慮到在G4末端增加C或G堿基可能導致形成雙鏈或更復雜的G4類型,本研究僅在c-Myc G4的核心序列d(G3TG4AG3TG3)末端加上不同數目的A或T(序列見表1)。為了分析多種可能的結構形式,選擇以下序列為對照: 可形成分子內平行G4的序列c-Myc2345[1],可形成四分子間平行G4的序列G6、G8[7],可形成提籃式雙分子間反平行G4的序列G4T3G4[1](G4不同結構示意圖見圖1); 非G4的對照單鏈序列M20和雙鏈dsM20(序列見表1,dsM20為M20與互補鏈配對所形成)。首先測試了在K+或Na+溶液中不同DNA激活ThT熒光的效果(圖2)。 ThT在水溶液中熒光很弱,非G4單鏈和雙鏈增強ThT的熒光約為背景值2倍; 在K+溶液中,含有不同末端堿基的c-Myc衍生序列(c-MycA、c-MycT、c-Myc2A、c-Myc2T、c-Myc3A和c-Myc3T)能使ThT熒光增強100~200倍,其中末端A或T堿基數增加有利于熒光增強,且T堿基的增強效果略大于A堿基。與K+相比,在Na+溶液中c-Myc2345對ThT的熒光增強效果更高,與文獻[29]報道一致; 但其它衍生序列的熒光增強效應都減弱, c-Myc2A和c-Myc3A對ThT熒光增強的效果高于其它序列。此外,可形成分子間結構的G6和G8在K+中對ThT熒光增強高達200倍以上,但在Na+溶液中,其增強效果發生了顯著降低; 雙分子間反平行G4(G4T3G4)在兩種離子中激活ThT熒光的能力都很差,僅略高于非G4的單鏈或雙鏈序列。
3.2 CD光譜表征c-Myc序列的結構
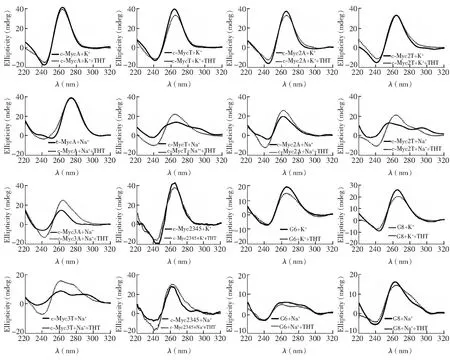
圖3 DNA在與ThT作用前后的CD光譜及CD光譜變化,DNA與ThT濃度均為5 μmol/LFig.3 Circular dichroism (CD) spectra of 5 μmol/L DNAs in the absence or presence of 5 μmol/L ThT
CD光譜可表征典型G4二級結構及構象變化,反平行G4在295 nm 處顯示正峰,在260 nm 處為負峰; 平行G4在260 nm 附近顯示正峰,在240 nm 處顯示負峰[1]。為了進一步研究ThT的熒光增強與G4的關系,本研究測量了G4 DNA的CD光譜及其與相同濃度的ThT作用后的CD光譜變化(圖3)。K+溶液中,所有序列的CD光譜在260 nm為正峰,240 nm為負峰,表明此條件下形成平行G4; 加入ThT后各序列CD光譜變化很小(圖3),表明與ThT作用后并未影響這些序列已形成的結構。Na+溶液中,CD光譜顯示,含不同末端堿基的c-Myc序列形成了多種結構: c-MycA的CD正峰在280 nm附近,負峰在250 nm處,主要為非G4結構; c-Myc2A與c-Myc3A在260 nm處為正峰,240 nm附近為負峰,主要為平行G4結構; c-MycT、c-Myc2T與c-Myc3T除了295 nm正的肩峰外,還在255~280 nm有寬的正峰,提示為非G4、平行和反平行G4等多種結構共存。加入同樣濃度的ThT后,c-Myc2A、c-Myc3A、c-MycT、c-Myc2T、c-Myc3T及c-Myc2345在Na+溶液中260 nm附近的吸收增加并形成正峰,而且c-MycT、c-Myc2T和c-Myc3T在290 nm的肩峰降低,說明ThT能促進這些序列形成平行G4; c-MycA的CD光譜變化不大。另外,CD光譜顯示,G6在K+溶液中存在260 nm的正峰,表明能形成平行的分子間G4,但Na+溶液中260 nm的正峰消失,表明未形成G4; G8在兩種離子條件下都存在平行G4的特征CD信號,且在K+中信號更強,表明在K+中形成G4的能力更強; 加入ThT對兩個序列的CD光譜影響較小。
3.3 組合染色分析c-Myc G4多態性及末端堿基對其自組裝的影響
上述結果已表明,末端序列對c-Myc與ThT的識別有較大影響,與文獻[35]報道現象類似; 此外,分子間與分子內平行的G4結構均可增強ThT的熒光,但分子間平行結構更強。本研究組的前期工作中,發現含有不同末端堿基的c-Myc除了能形成分子內平行G4外,還能形成部分分子間聚集結構[4]。因此,需考察末端序列不同的c-Myc與ThT的不同識別能力是由末端序列與ThT的作用引起,還是末端序列引起c-Myc形成了不同的分子間聚集結構所引起。由于CD光譜不能分辨同一個序列在溶液中存在的多種結構,例如由同一個序列形成的分子間與分子內平行結構,為了進一步探討不同末端堿基是否導致c-Myc序列產生不同拓撲結構,進而引起不同的ThT熒光增強效果,本研究在凝膠中分離上述序列所形成的結構,并用ThT直接染色凝膠中的DNA條帶。
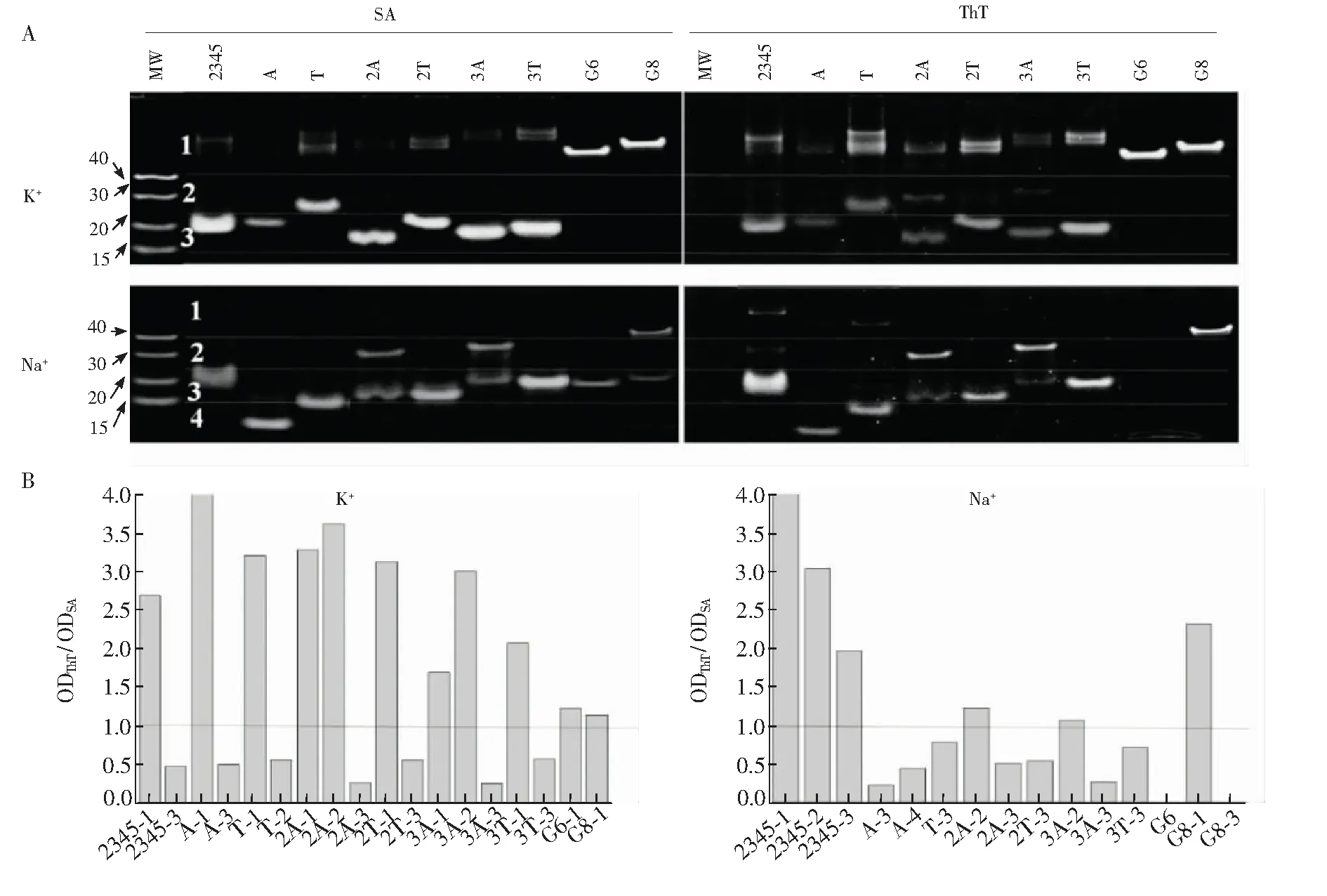
圖4 組合染色分析DNA在K+或Na+溶液中的多態性結構(A) ThT和Stains-all對同一凝膠分別染色的圖像; (B)同一電泳條帶分別經ThT與Stains-all染色的灰度比值,DNA分子量Marker為40、30、20和15堿基長的單鏈非G4 DNAFig.4 Double-staining of DNA structures by ThT and Stains-all in 20 mmol/L KCl (left) or NaCl (right)(A) Images of gels stained in turn by ThT and Stains-all. (B) TheOD ratio of the DNA bands stained by ThT and SA. Molecular weight (MW) ladder was ssDNA mixtures with 40, 30, 20 and 15 bases, respectively. “c-Myc2345”, “c-MycA”, “c-MycT”, “c-Myc2A”, “c-Myc2T”, “c-Myc3A” and “c-Myc3T” are abbreviated to “2345”, “A”, “T”, “2A”, “2T”, “3A” and “3T”(已替換)
為了觀測所有DNA片段,用非特異性染色劑Stains-all對ThT染色后的凝膠進行顯色(圖4)。Stains-all染色可清楚顯示出不被ThT染色的分子量Marker(MW,序列見表1,分別用M40、M30、M20和M15命名),根據其片段大小將遷移速率不同的條帶進行分區: 發現c-Myc系列衍生序列在K+溶液中以分子內結構為主,但都能形成部分分子間結構(> 40 bases); 而在Na+溶液中,c-Myc2A和c-Myc3A形成了另一種分子間結構(~ 30 bases),其它衍生序列主要是分子內結構(圖4A)。從ThT染色結果可知,以上序列形成的分子間或分子內結構都能被熒光特異性染色,而在Na+溶液中,G6和 G8中的單鏈成分(凝膠中第3區域的片段,分子量在15~25堿基之間)都不能被熒光染色。Stains-all是一種陽離子羰花青染料,可通過靜電作用與所有DNA非特異性結合,以末端堆積結合G4的ThT不干擾Stains-all對DNA的進一步染色,因此可用Stains-all染色的DNA條帶光密度值評估該條帶的含量。考慮到 G4 DNA對ThT的熒光增強除了與其結構特征有關,也與G4的含量有關,為了比較G4的不同結構類型與ThT的結合差別,以Stains-all染色條帶的光密度值表示DNA的含量,以該條帶分別經ThT與Stains-all染色的光密度比值對熒光增強進行歸一化處理。從圖4B可見,所有分子間平行G4結構(包括G6和G8在K+中)或分子間聚集體的光密度比值都大于1,分子內平行G4結構類型的光密度比值約0.5,不能被ThT染色的非G4條帶光密度比值為0。這些數據表明,單位濃度G4的分子間結構對ThT熒光的增強能力最強,分子內結構次之,非G4不能增強ThT的熒光。由于18堿基的c-MycA在Na+溶液中不能形成G4(圖3),但其在凝膠中的片段所在位置小于15個堿基,也小于同為18個堿基的c-MycT(圖4A); 其光密度比值較低(~ 0.2)(圖4B),介于非G4的單鏈序列(Marker)與分子內G4之間。進一步測試了不同濃度的ThT在Na+溶液中與c-MycA作用的CD光譜,結果表明,高濃度ThT可誘導其形成G4,而非G4的單鏈受影響很小(圖5),提示ThT誘導c-MycA形成了部分G4,進而引發自身熒光,使得凝膠中其光密度比值介于非G4和分子內G4之間。
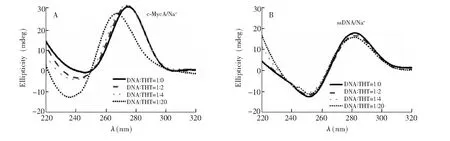
圖5 Na+溶液中c-MycA及對照單鏈DNA(M20)與不同濃度比例的ThT作用的CD光譜及變化 Fig.5 CD spectra of 5 μmol/L c-MycA or ssDNA (M20) in the presence of various concentrations of ThT in Na+ solution
以上結果表明,在K+溶液中, 末端堿基數增加對ThT熒光的影響也增強,末端堿基數相同的序列中T堿基表現出更強的熒光增強能力(圖2); 在Na+溶液中,末端為2個以上A的c-Myc2A和c-Myc3A對ThT熒光增加影響更大(圖2); 這些對ThT熒光增強影響大的序列具有相對較多的分子間結構成分(圖4),且都能形成平行G4(圖3)。上述結果提示末端堿基引起c-Myc形成不同的分子間G4聚集體可能是其結合ThT產生不同熒光增強的主要原因,而且這種影響存在離子和序列選擇性,即在K+溶液中,增加末端堿基的數目有利于形成分子間聚集體,其中T堿基的作用更強; 而在Na+溶液中,兩個或以上的A堿基可引起c-Myc形成分子數較小的分子間結構,T堿基則不能。這表明在涉及末端堿基影響的G4分子識別研究中,若缺少對DNA構型多態性的分析,這種差異可能會被認為僅由末端堿基與配體的相互作用所致。
本研究中,熒光光譜(圖2)與凝膠電泳分析(圖4)結果均顯示ThT對分子間平行G4或分子間平行G4聚集體具有高選擇性,已有的研究也指出ThT對反平行或混合平行/反平行G4的選擇性優于分子內平行G4結構[22,29]。近期研究發現,RNA aptamer“Corn”形成的二聚體可強烈激活ThT的熒光,與僅有一個G4結構的Aptamer“Spinach”比較,ThT與“Corn”二聚體結合位點兩側的G4能更好束縛光激熒光團,使G4二聚體具有更強的ThT熒光激活能力[36]。本研究組之前的研究發現,反平行G4或未折疊成G4結構的G4形成序列與小分子BMSP(2,9-bis[4-(4-methylpi-perazin-1-yl)styryl]-1,10-phenanthroline)的結合可強烈激活其熒光,且遠高于穩定的分子內平行G4結合BMSP產生的熒光[37]。通常, 同等構型下分子間G4的穩定性弱于分子內G4結構,反平行或混合平行/反平行G4結構的穩定性弱于分子內平行結構。上述研究結果說明,G4最穩定的構像不一定是最佳的配體結合結構。
相對于分子內平行G4結構,平行G4結構形成的分子間聚集體受關注較少,也缺乏簡單有效的研究方法。本研究初步建立了原位多重染色與G4探針、CD光譜結合的方法,并用圖像分析工具進行分析,可實現多種構型的同時分離與分析,并能用于G4自組裝規律的研究。然而,本研究在拓撲結構的基礎上對分子間G4聚集進行分析,雖可區分分子間與分子內結構,但不能準確測定聚集的分子數以及聚集狀態。此外,ThT雖然可結合不同G4產生強的熒光,但ThT對一些非G4結構的識別[38]可能限制其進一步應用; 開發特異識別不同G4聚集體的新型熒光探針[39,40],將有助于系統深入探討G4自組裝的規律。
4 結 論
平行G4結構是很多核酸藥物以及核酸適配體的活性結構,然而, 平行G4結構受溶液條件和序列等因素的影響可形成不同形式的分子間聚集體,不利于其結構與功能研究。本工作研究了具有重要生物活性且能形成平行G4結構的c-Myc序列,以ThT為熒光探針,結合DNA非選擇性染料Stains-all和光密度定量分析工具,在凝膠中直接分析了其結構多態性及末端堿基對自組裝的影響。本研究策略可較好地實現c-Myc G4多種構型的同時分離與探測,有助于理解多種構型共存的G4自組裝及其構效關系。本研究表明,ThT除對多種平行G4有一定識別能力外,對分子間和分子內平行G4之間也有一定的選擇性,在G4多態性結構的分析中有良好的應用前景。此外,本方法采用對DNA具有不同識別能力的商業化染料組合,通過凝膠電泳直接染色分析G4結構多態性,價格低廉,操作簡便,實用性強。

