羧乙基殼聚糖蒙脫石吸附養殖水體中Cu2+的應用
李儉平, 周忻宇, 代婧煒, 沈慶洲
羧乙基殼聚糖蒙脫石吸附養殖水體中Cu2+的應用
李儉平, 周忻宇, 代婧煒, 沈慶洲
(河北農業大學 海洋學院, 秦皇島 河北 066003)
為了尋求性能良好、環保吸附劑, 用于去除養殖水體中重金屬Cu2+, 作者利用蒙脫石負載羧乙基殼聚糖制備成復合吸附劑, 并利用IR、SEM、XRD等手段分析其表面性能, 將其用于處理Cu2+溶液, 考察了環境因子對其吸附性能的影響, 并從吸附動力學和吸附熱力學角度分析吸附劑對Cu2+的吸附機理, 最后考察其再生利用效果。結果表明: 羧乙基殼聚糖成功進入到蒙脫石層間; 在羧乙基殼聚糖與蒙脫石質量比為1︰25、40℃恒溫水浴攪拌60 min、pH=6.0、最佳投加量為4.0 g/L、處理濃度不超過30 mg/L Cu2+溶液時, 復合吸附劑對Cu2+去除率可以達到96.23%, 將其用于淡水養殖魚塘水體中, Cu2+去除后可達到《漁業水質標準》規定; 吸附劑對Cu2+吸附熱力學實驗結果表明, 符合Langmuir模型, 反應過程為自發、吸熱反應; 吸附動力學結果表明該吸附符合準二級動力學方程, 反應屬于化學吸附; 再生實驗中NaOH的再生效果優于HCl。
復合吸附劑; Cu2+; 吸附; 機理; 再生
由于硫酸銅作為藥物使用不當等原因, 水生動物銅中毒屢見發生[1]。重金屬銅也會在魚體中進行富集, 通過生物鏈進入高級生物體, 從而對人類健康及其他生物種類產生危害[2]。根據《漁業水質標準》規定, 養殖水體中銅的含量應控制在 0.01 mg/L以內[3]。吸附法是一種既簡便又適用的治理和回收廢水中的重金屬離子方法。
蒙脫石儲量大、價格低廉、制備簡單、穩定性好、天然無害, 殼聚糖無毒害、可自然降解、具有良好的環境兼容性[4], 但蒙脫石在水中固-液分離速度慢、絮凝物脫水效果差, 并且殼聚糖的密度小、造粒難、不易與溶液中金屬離子接觸以及酸性條件下殼聚糖分子中的-NH2易質子化而使殼聚糖溶于水等問題也限制了它們的使用[5]。
現將制得的羧乙基殼聚糖與蒙脫石進行負載, 使二者相互結合, 不但很大程度上使體積變得更大, 更擴大了層間距和比表面積, 從而達到吸附能力增大的目的[6]。
作者擬以蒙脫石負載羧乙基殼聚糖, 制備成復合吸附劑, 通過紅外光譜分析(IR)、掃描電子顯微鏡分析(SEM)、X-射線粉末衍射分析(XRD)等手段分析其表面性能和復合機理, 通過改變兩者的配比、投加量、時間、Cu2+濃度、pH值等探討影響其吸附性能的條件, 并從吸附動力學和吸附熱力學角度分析吸附劑對Cu2+的吸附機理, 最后考察其再生利用效果。
1 實驗材料與方法
1.1 試劑和儀器
分析使用的是符合國家標準的分析純試劑, 實驗用水為新鮮3次蒸餾水。
實驗中的玻璃器皿均用鹽酸溶液或硫酸溶液浸泡, 用自來水沖洗后再用蒸餾水沖洗數次。
水浴恒溫振蕩器(SHZ), 雙光束紅外分光光度計(WGH-30A型), 掃描電鏡(Hitachi-S4800, 日立), X-射線衍射儀(D8advance, 德國Buker公司), 原子吸收分光光度計(4510F)。
1.2 羧乙基殼聚糖的制備
準確稱取8 g丙烯酸溶于30 mL蒸餾水。在磁力攪拌器攪拌下用膠頭滴管滴加溶于20 mL蒸餾水的10 g固體氫氧化鈉水溶液到丙烯酸水溶液中, 調至pH=6[7]。將2.0 g殼聚糖溶于已調節pH=6的丙烯酸水溶液中, 攪拌使其混合均勻后, 將溶液轉移到3口燒瓶中, 用恒溫加熱磁力攪拌器水浴恒溫90℃下反應, 持續加熱回流5 h。冷卻, 調至pH=10后再4 000 r/min離心10 min, 向上清液中倒入2倍體積的無水乙醇沉淀, 洗滌后, 真空烘干24 h, 研磨成粉末, 儲存備用[8]。
1.3 復合吸附劑的制備
稱取定量蒙脫石及羧乙基殼聚糖, 用適量水使其充分浸潤, 攪拌直至成為糊狀, 真空干燥箱中充分干燥48 h后, 將其研磨成粉末, 過直徑0.125 mm篩, 即得到不同配比的復合吸附劑, 放置陰涼干燥處儲存備用[9]。
1.4 實驗方法
移取一定量的Cu2+溶液放入錐形瓶中, 向其中投加適量羧乙基殼聚糖蒙脫石復合吸附劑, 水浴恒溫振蕩器震蕩一定時間后, 離心取上清液, 用火焰原子吸收分光光度法測其吸光度, 計算其吸附率和吸附容量。
吸附率為:
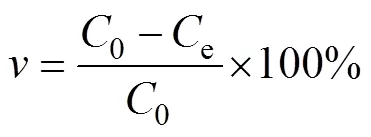
吸附容量為:
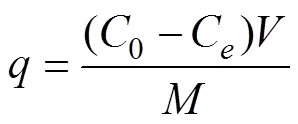
代表去除率,0代表最初Cu2+濃度(mg/L);e代表最終Cu2+濃度(mg/L);代表整體反應結束后的吸附容量(mg/g);代表錐形瓶中溶液體積(L);代表加入的吸附劑的總質量(g)。
2 結果分析與討論
2.1 復合吸附劑的表征
2.1.1 傅里葉紅外光譜分析
從圖1中可以看出殼聚糖中3 350 cm–1是N-H伸縮振動和O-H伸縮振動的特征吸收峰部分重疊的結果, 1 636 cm–1為-NH2的變角振動峰, 1 085 cm–1是C-O-C 的伸縮振動吸收峰, 通過羧乙基化改性后譜圖中3 500 cm–1~3 400 cm–1處的吸收峰寬度變小, 說明-NH 和-OH 間氫鍵遭到破壞, 而1 697 cm–1為-C=O 伸縮振動吸收峰, 1 602 cm–1為 COO–的反對稱伸縮振動峰。這些結果證明, 羧乙基被成功引入殼聚糖的胺基之上。
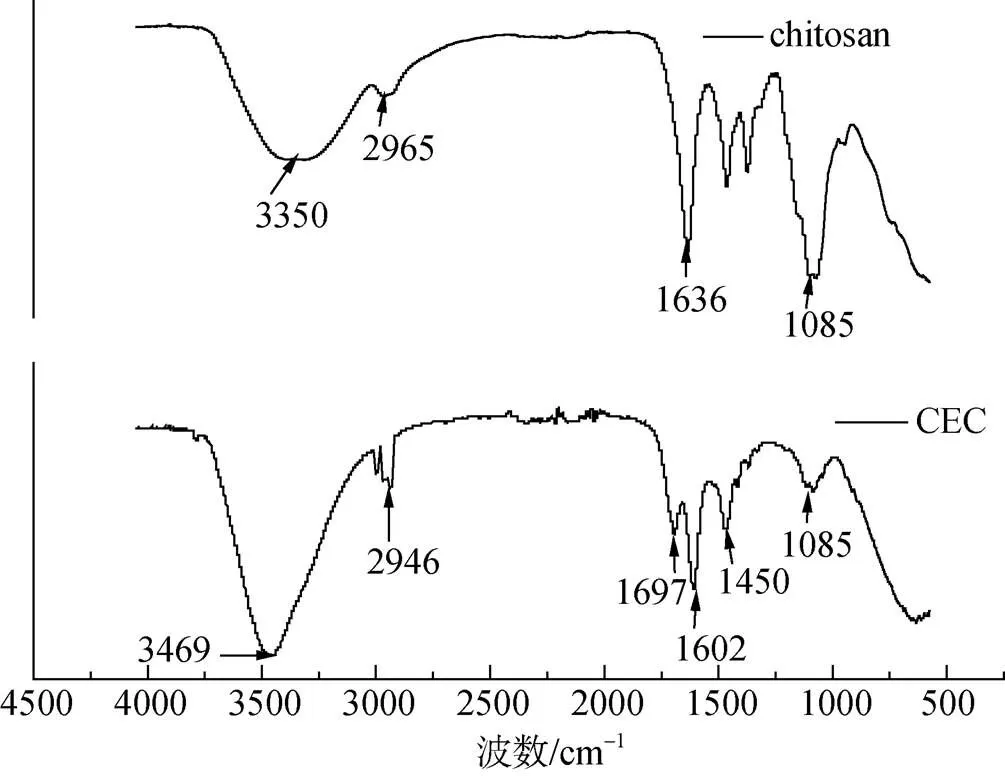
圖1 殼聚糖(chitosan)和羧乙基殼聚糖(CEC)的紅外光譜圖
由于制備蒙脫石負載羧乙基殼聚糖時, 羧乙基殼聚糖的加入量很小, 其對紅外的吸收信號較弱, 負載羧乙基殼聚糖前后出峰位置基本沒有太大的變化, 只能從峰強弱分析, 圖2-b中 1 570 cm–1是羧乙基殼聚糖的特征吸收峰, 為 C=O的不對稱伸縮振動峰, 在 3 618 cm–1和 3 400 cm–1處吸收峰明顯變強, 峰面積變大, 說明羧乙基殼聚糖插入蒙脫石層間, 使其結構中-OH基團增多[10, 11]; 另外 783 cm–1和 990 cm–1處, 峰面積明顯變大, 說明蒙脫石晶格間Al-O八面體與羧乙基殼聚糖有明顯的化學吸附作用[11]。
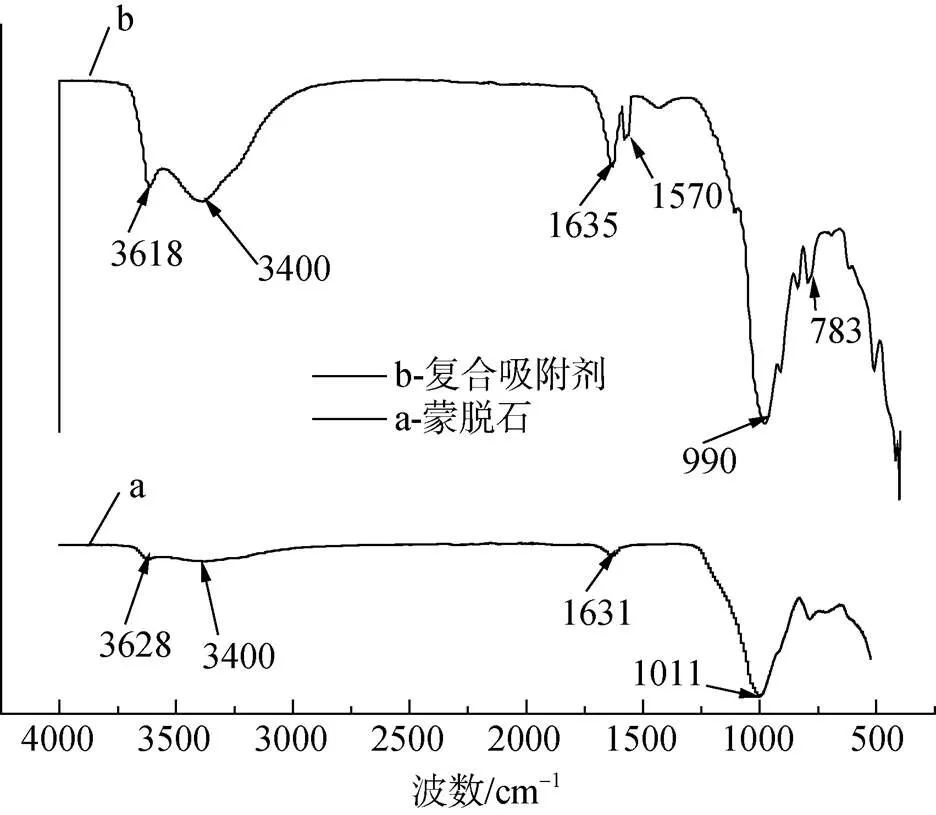
圖2 蒙脫石和蒙脫石-羧乙基殼聚糖復合吸附劑的紅外波譜圖
2.1.2 SEM表征分析
通過圖3發現殼聚糖形貌是片狀形, 表面致密均勻, 無孔洞出現, 而產物羧乙基殼聚糖形貌是顆粒小不規整, 表面疏松多孔, 這說明羧乙基化后的殼聚糖, 更有利于吸附[10]。
從圖4可以看出蒙脫石顆粒分布緊密, 有團聚現象, 而復合吸附劑, 呈不規則的片狀結構, 層間狀態更為分散, 表面積增大, 有利于吸附, 說明羧乙基殼聚糖成功進入到蒙脫石層間。
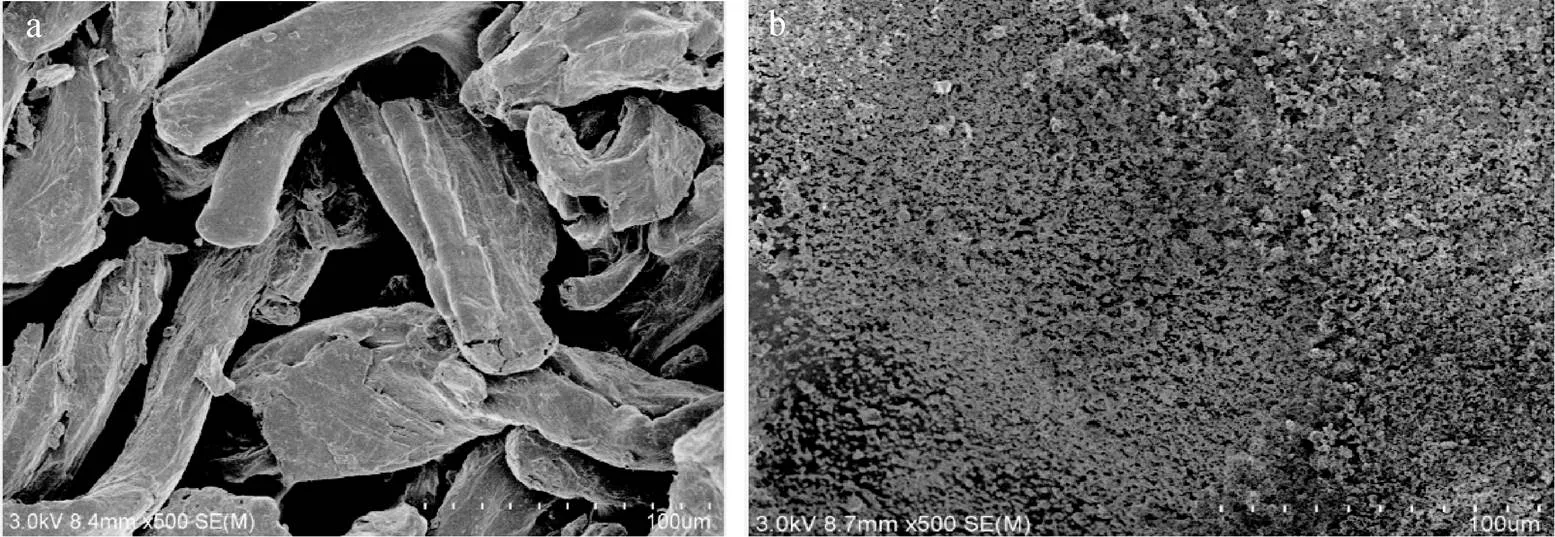
圖3 殼聚糖和羧乙基殼聚糖的SEM圖
a. 殼聚糖, b. 羧乙基殼聚糖 a. chitosan, b. CEC
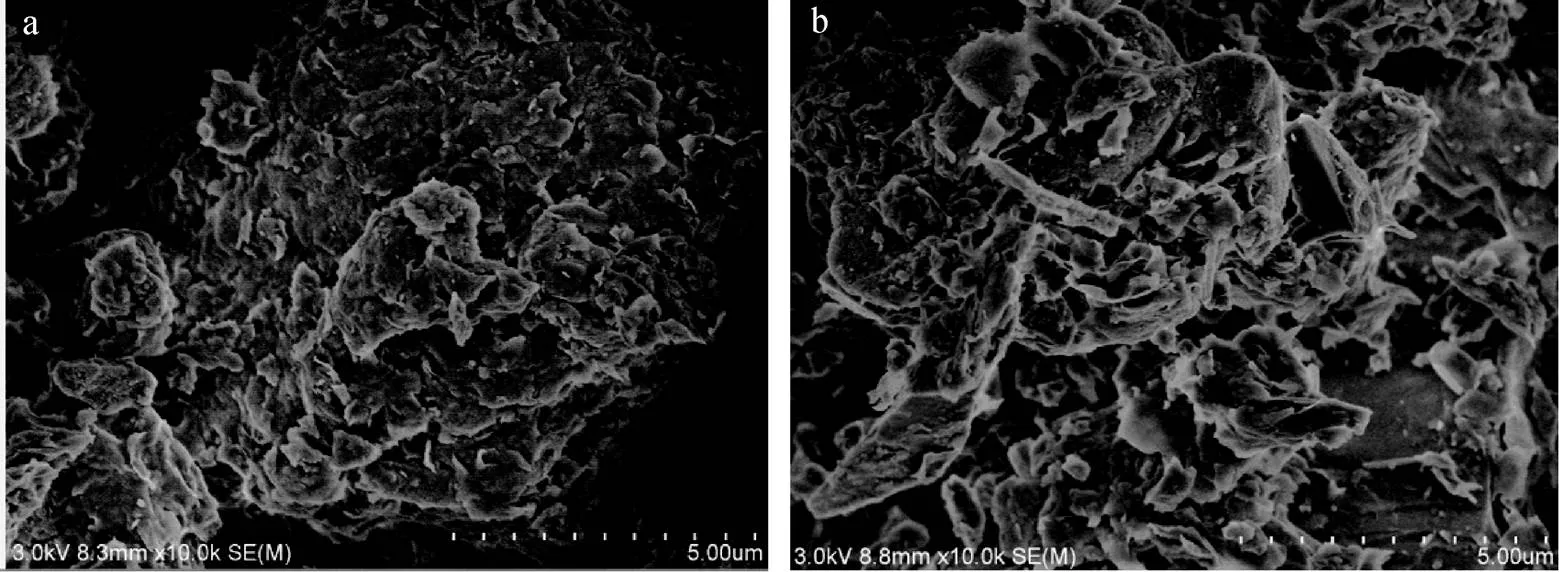
圖4 蒙脫石(a)和蒙脫石-羧乙基殼聚糖復合吸附劑(b)的SEM圖
2.1.3 XRD表征分析
從圖5中可以看出復合吸附劑d(001)面衍射特征峰的2θ角位置由蒙脫石的6.07°變為5.81°。根據布拉格方程 2dsinθ=nλ, 可以計算得復合吸附劑對應的晶體層間距比蒙脫石有所增加[12], 但增長幅較小, 這可能是羧乙基殼聚糖插層進入蒙脫石層間后導致層間距增大。
2.2 Cu2+的標準曲線
用火焰原子吸收分光光度法測Cu2+的吸光度值, 繪制標準曲線。
實驗結果如圖6。
2.3 羧乙基殼聚糖衍生物與蒙脫石的不同配比對Cu2+去除率的影響
移取多個50 mL、30 mg/L、pH=6.0的Cu2+溶液放入錐形瓶中, 向其中投加3.0 g/L不同配比的羧乙基殼聚糖-蒙脫石復合吸附劑, 單獨蒙脫石、殼聚糖、羧乙基殼聚糖作對比, 恒溫35℃水浴40 min后取上清液, 測其吸光度。
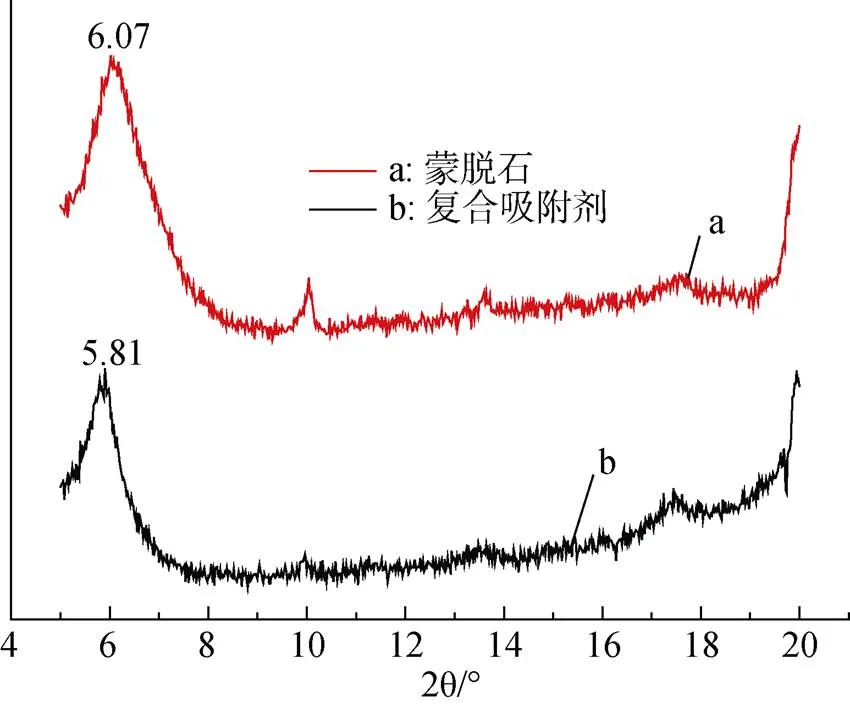
圖5 蒙脫石和蒙脫石羧乙基殼聚糖復合吸附劑的XRD圖
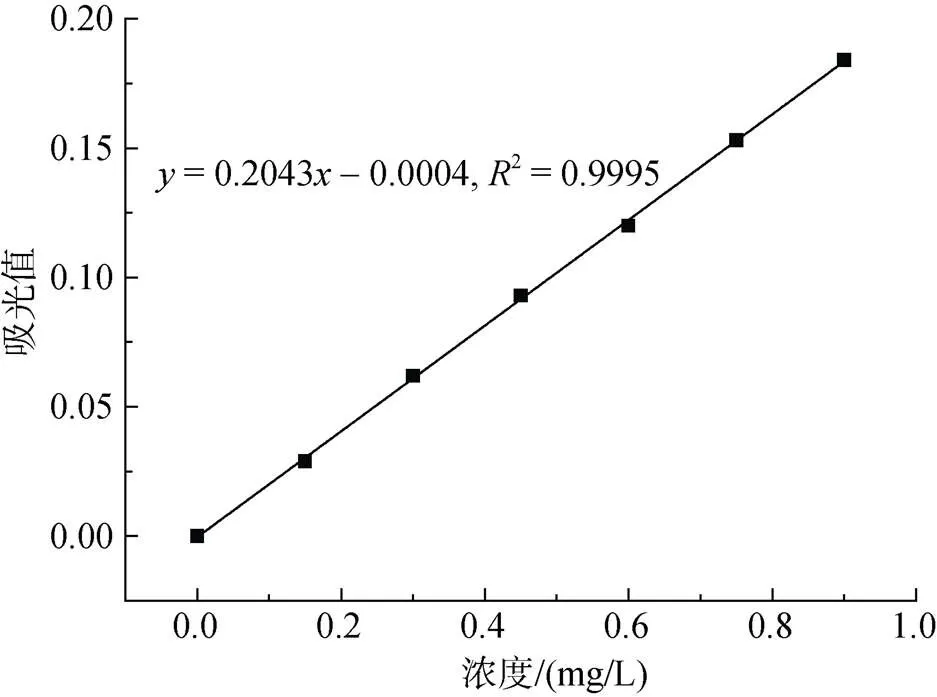
圖6 Cu2+標準曲線
由圖7實驗結果可知, 殼聚糖單獨使用時對Cu2+的去除率最低, 其次是蒙脫石和羧乙基殼聚糖, 不同配比復合吸附劑中, 當羧乙基殼聚糖與蒙脫石的比例是0.04時Cu2+的去除率最顯著, 計算得90.81%。
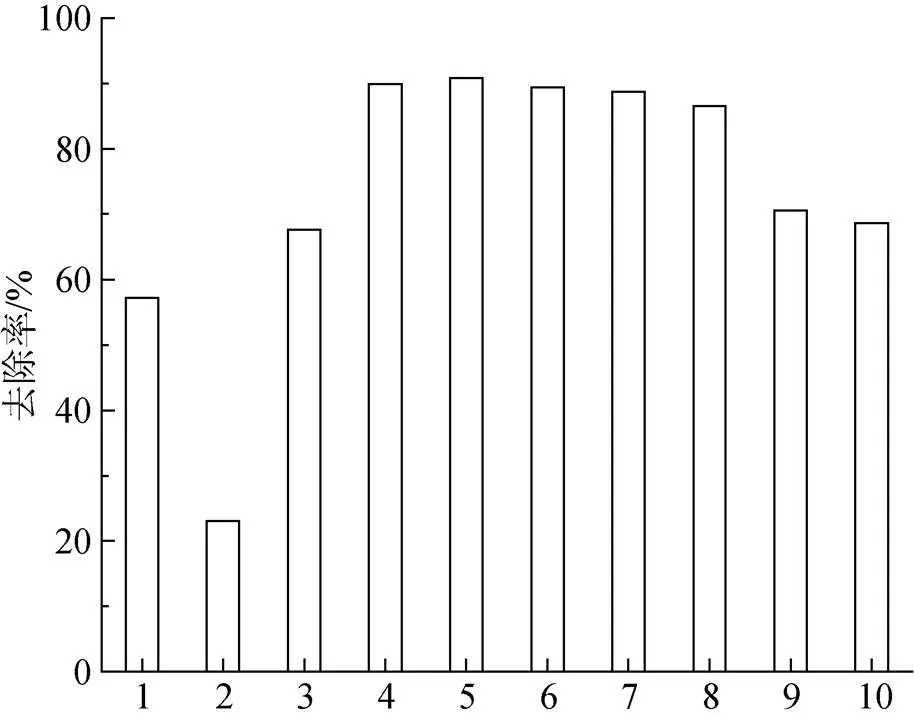
圖7 不同配比吸附劑對Cu2+吸附效果的影響
橫坐標1-3表示蒙脫石、殼聚糖、羧乙基殼聚糖; 4-10表示羧乙基殼聚糖與蒙脫石配比為0.02、0.04、0.06、0.08、0.10、0.50、1.00復合吸附劑
The abscissas 1-3 represent montmorillonite, chitosan and carbo-xye-thyl chitosan; 4-10 represent the composite adsorbent under the conditions of the carboxyethyl chitosan and montmori-llonite mass ratio of 0.02、0.04、0.06、0.08、0.10、0.50、1.00 respectively
配比增加后Cu2+去除率出現先增大后減小的現象可能是因為蒙脫石層間的陽離子交換容量≥羧乙基殼聚糖數量時, 去除率隨配比的增加而升高; 但是當蒙脫石的陽離子交換容量小于羧乙基殼聚糖數量之后去除率開始下降[13]。
2.4 吸附劑投加量對Cu2+吸附效果的影響
移取多個50 mL、30 mg/L、pH=6.0的Cu2+溶液放入錐形瓶中, 向其中投加1.0、1.6、2.2、3.0、4.0、5.0、6.0 g/L的配比0.04的復合吸附劑, 置于35℃水浴, 吸附40 min后取上清液, 測其吸光度。
根據圖8看出隨著投加量的增加, Cu2+去除率增加, 吸附劑在投加1.0 g/L~4.0 g/L范圍內, Cu2+去除率增長較為快速, 幾乎呈直線增長, 從63.13%增長到93.05%; 隨著吸附劑投加量越來越多, 溶液中Cu2+去除率基本維持穩定; 然而吸附容量當投加量越來越多它卻全程呈現降低的狀態。
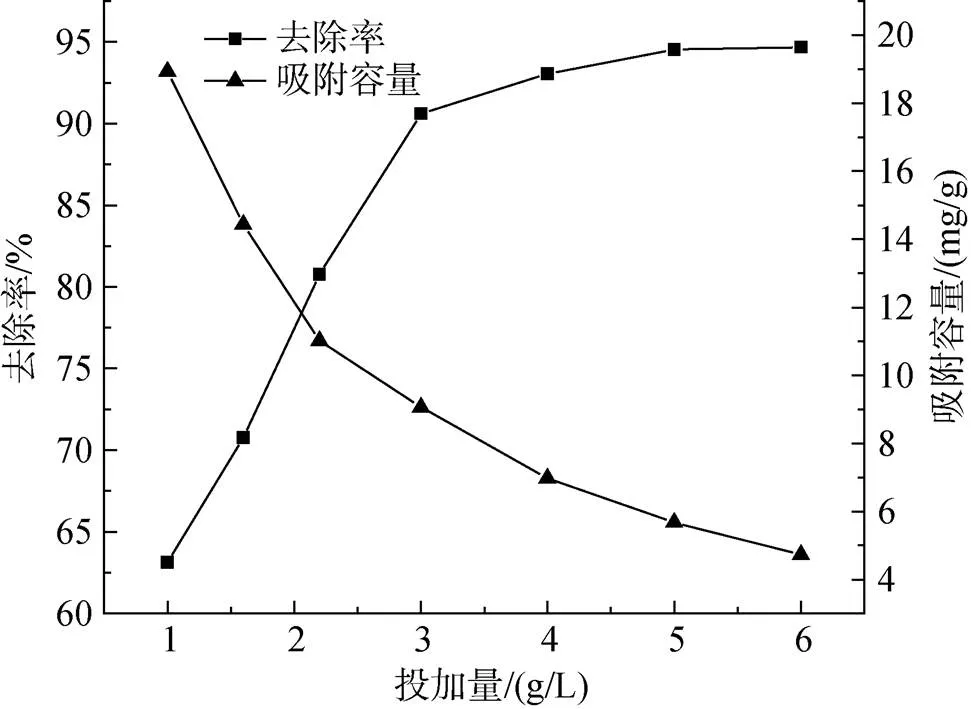
圖8 不同吸附劑投加量對Cu2+吸附效果的影響
隨著投加量的增加, 吸附劑可以供應的吸附點位也增加, 更有利于Cu2+的吸附, 去除率會有所提升。而當復合吸附劑的量達到某個限度之后, 即使投加量越來越多, 去除率卻基本不再改變, 而吸附容量卻一直下降, 這是因為溶液中大部分Cu2+被去除后, 復合吸附劑表明的吸附點位數不斷下降, 相關孔道也不斷被堵塞[12], 再加復合吸附劑時, 平均吸附Cu2+量降低。此外, 過量的復合吸附劑在溶液中也增加了分離出溶液中吸附劑的難度[14]。基于節省原料以及保持高去除率的觀念, 后續實驗中將羧乙基殼聚糖與蒙脫石復合吸附劑定為4.0 g/L。
2.5 溫度對Cu2+吸附效果的影響
移取多個50 mL、30 mg/L、pH=6.0的Cu2+溶液放入可加熱玻璃容器中, 向其中投加4.0 g/L配比為0.04的復合吸附劑, 分別置于25、30、35、40、45、50℃水浴, 吸附40 min后取上清液, 測其吸光度。
由圖9可知, 羧乙基殼聚糖與蒙脫石復合吸附劑當溫度在25℃~40℃時, Cu2+去除率增長較為明顯, 從91.71%增長到94.10%; 在此之后, 雖然溫度繼續越來越高, 但是Cu2+去除率增長緩慢, 為了節省資源, 蒙脫石負載羧乙基殼聚糖復合吸附劑的反應液控制在40℃。

圖9 不同溫度對Cu2+吸附效果的影響
2.6 吸附時間對Cu2+吸附效果的影響
移取多個50 mL、30 mg/L、pH=6.0的Cu2+溶液放入錐形瓶中, 向其中投加4.0 g/L配比為0.04的復合吸附劑置于40℃水浴, 在0、10、20、30、40、60、80、120 min后取上清液, 測其吸光度。
從圖10中可以看出在0~10 min范圍內, 隨著吸附時間的增長, 溶液中Cu2+的去除率增長速度很快, 在60 min以后, 隨著吸附時間的增長, Cu2+去除率基本不再變化, 后續實驗吸附時間選擇60 min。原因可能在于Cu2+只能在復合吸附劑的有限空間內被吸附, 主要與吸附點位數量及Cu2+質量濃度有關[15]。在初期, 吸附劑表面具有大量的吸附點位, 而且溶液中Cu2+的質量濃度較高, 吸附劑表面具有較高的推動力, 從而對Cu2+具有較高去除率; 在60 min以后溶液中的Cu2+質量濃度變為很小而且吸附劑表面已經吸附了大量的Cu2+, 導致Cu2+吸附速率下降[16]。
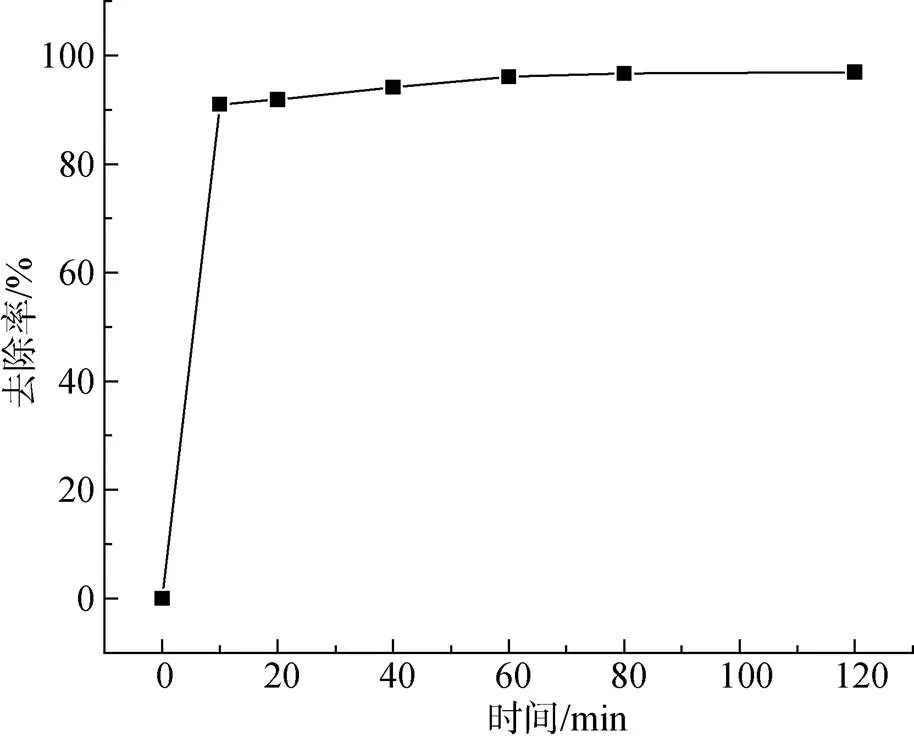
圖10 不同時間對Cu2+吸附效果的影響
2.7 pH對Cu2+吸附效果的影響
移取多個50 mL、30 mg/L的Cu2+溶液放入錐形瓶中, 調節pH在3.0、4.0、5.0、6.0、7.0、8.0、9.0, 向其中投加4.0 g/L配比為0.04的復合吸附劑置于40℃水浴加熱60 min后取上清液, 測其吸光度, 另設一組不添加吸附劑作為空白對照。
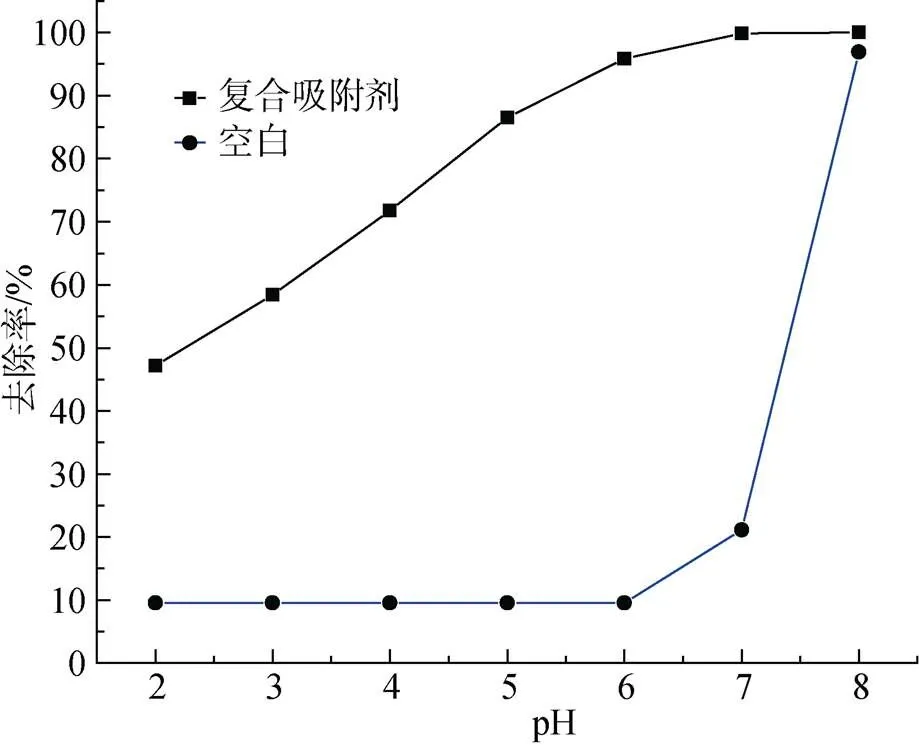
圖11 不同pH對Cu2+吸附效果的影響
由實驗結果可知, pH越來越高, 則Cu2+的去除率與之相應會越來越高, 最終接近100%。但從空白對照中可看出pH=7時, 開始生成沉淀, 當pH=8時去除率逼近100%, 說明溶液的OH–對Cu2+作用形成沉淀[17], 所以pH=6時比較適宜。
2.8 Cu2+濃度對Cu2+吸附效果的影響
移取多個50 mL、pH=6.0的Cu2+溶液(控制質量濃度在1、5、15、30、50、70、90、120、150 mg/L)放入可加熱玻璃容器中, 向其中投加4.0 g/L配比為0.04的復合吸附劑置于40℃水浴加熱60 min后取上清液, 測其吸光度。
由圖12中看出, 整體上隨著Cu2+濃度越來越大, Cu2+的去除率與其成反比例即明顯的越來越低, 在Cu2+質量濃度為1 mg/L~120 mg/L范圍內, 由100.00%降到50.28%; 與之相反的是吸附容量與Cu2+質量濃度成正比, 由0.25 mg/g增大到15.08 mg/g。
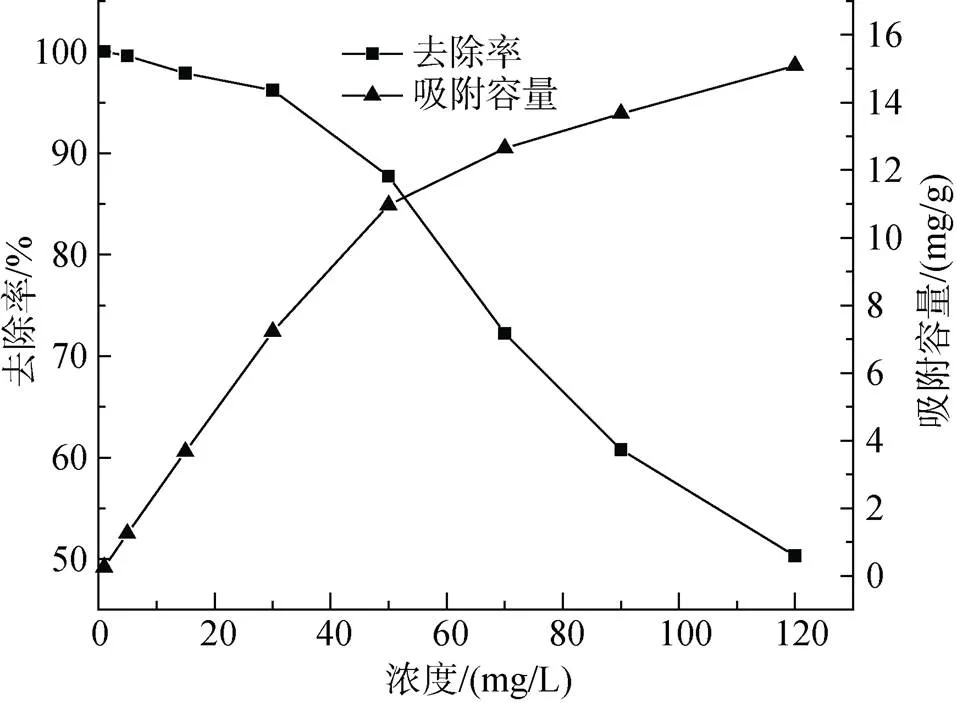
圖12 不同Cu2+濃度對Cu2+吸附效果的影響
在投加量一定的情況下, 當Cu2+質量濃度較低時, 吸附劑表面有足夠的吸附點位和離子交換容量使絕大部分Cu2+被吸附。在Cu2+質量濃度越來越高的同時, 溶液中Cu2+會逐漸增加直至過量, 但是已經飽和的吸附劑表面的吸附點位以及有限的離子交換容量已然無法接納過多的Cu2+[12]。越來越高的Cu2+質量濃度使得Cu2+與復合吸附劑表面碰撞的概率越來越大, 達到了使吸附容量增大的目的[18]。
根據采集黃驊和天津淡水養殖魚塘水體養殖一段時間后水體中實驗結果(表1), 處理后的水體中Cu2+質量濃度接均近于0, 符合《漁業水質標準》[19]規定, Cu≤0.01 mg/L的要求。
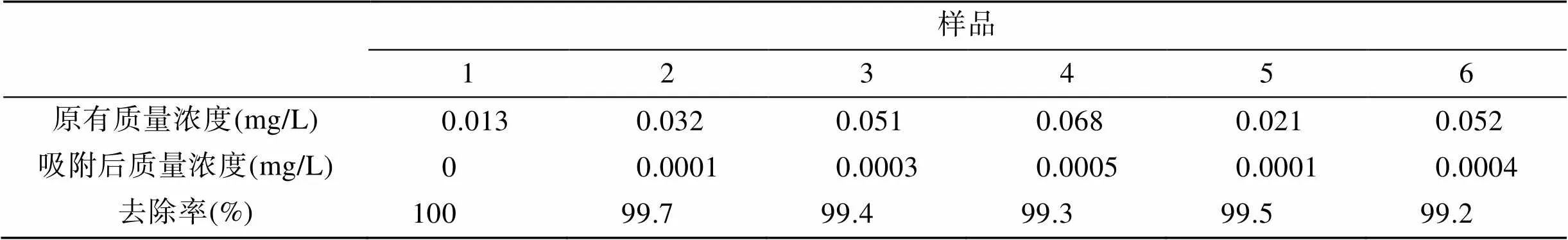
表1 淡水養殖魚塘水體中Cu2+質量濃度
2.9 不同濃度的NaCl對Cu2+吸附效果的影響
移取多個50 mL、pH=6.0的30 mg/L Cu2+溶液(NaCl質量濃度分別控制在0%、1%、2%、2.5%、3%、3.5%)放入可加熱玻璃容器中, 向其中投加4.0 g/L配比為0.04的復合吸附劑置于40℃水浴加熱60 min后取上清液, 測其吸光度。從圖13中可以看出, 吸附劑對 Cu2+的去除率隨NaCl初始質量濃度的增加而逐漸降低, Na+離子的存在與Cu2+形成競爭吸附的關系, 所以本類復合吸附劑在海水養殖中使用效果比在淡水養殖中差。
2.10 吸附劑吸附Cu2+熱力學實驗
移取多個50 mL、pH=6.0的Cu2+溶液(控制質量濃度在15、30、50、70、90、120 mg/L)放入錐形瓶中, 在30、40、50℃下向其中投加4.0 g/L配比為0.04的復合吸附劑水浴加熱60 min后, 測上清液吸光度。以平衡吸附量e為縱坐標、平衡濃度e為橫坐標, 得到不同溫度下復合吸附劑對Cu2+的吸附等溫線[12]。
目前常采用Langmiur和Freundlich兩種吸附等溫模型來描述固—液體系中的等溫吸附行為[12]。
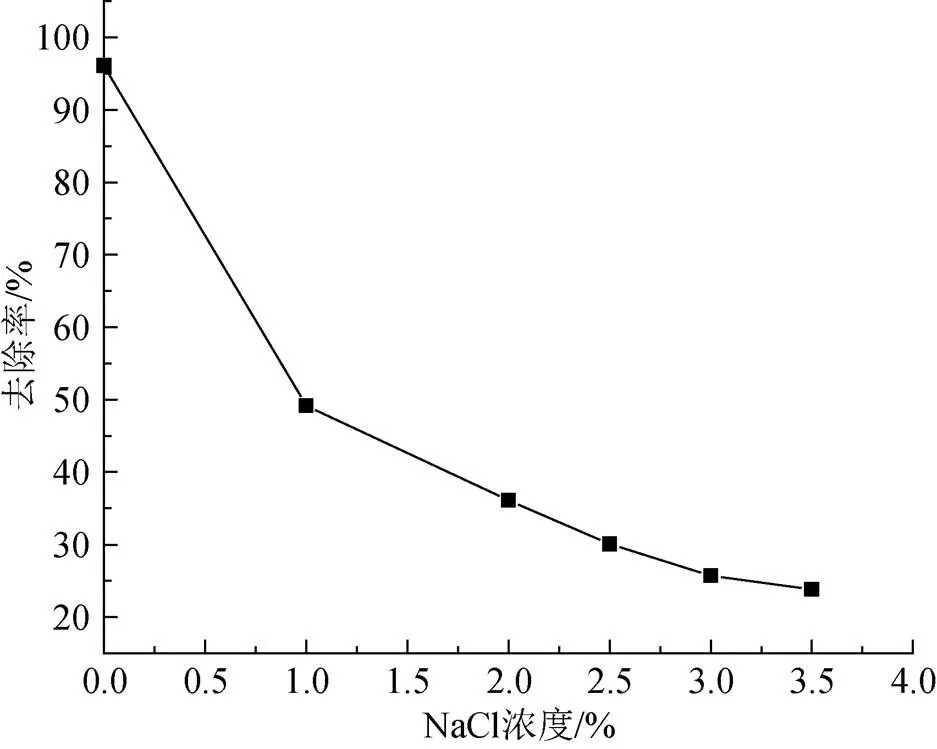
圖13 不同NaCl濃度對Cu2+吸附效果的影響
Langmuir方程由于它描述了吸附的基礎過程而被廣泛應用。表達式如下[20]:
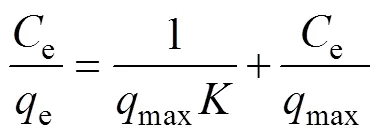
Freundlich方程適用于大多數多層非均相吸附。表達式如下[21]:
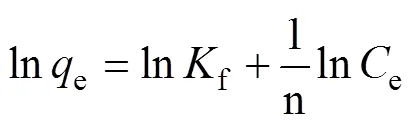
e代表反應結束時的Cu2+質量濃度(mg/L);e代表反應結束時的吸附容量(mg/g);max代表單位吸附劑能吸附Cu2+的最多量(mg/g); K、Kf和n為吸附常數。
圖14是各個溫度下Cu2+吸附等溫線, 當溫度越來越高, 吸附容量變大, 符合吸熱過程的特征。Langmuir、Freundlich方程的擬合曲線和相關數據見表2和表3。根據圖表得出結論: Langmuir方程更適合描述蒙脫石負載羧乙基殼聚糖對Cu2+的吸附過程, 且擬合得出的最大吸附容量與實驗實測的平衡容量更相接近, 其表現為單層吸附。
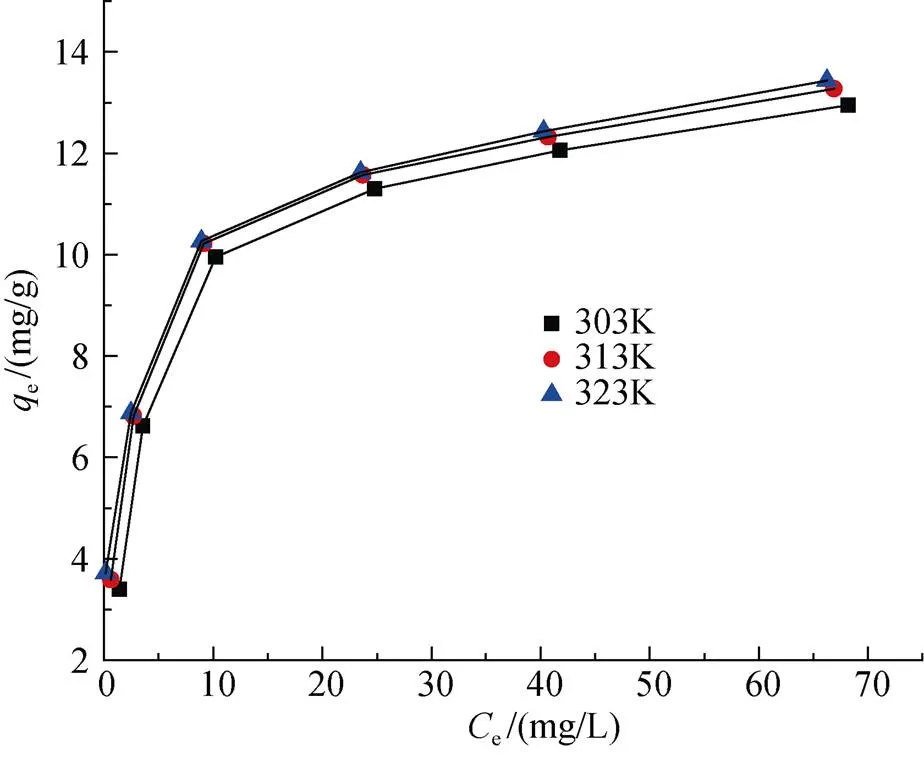
圖14 不同溫度下Cu2+吸附等溫線
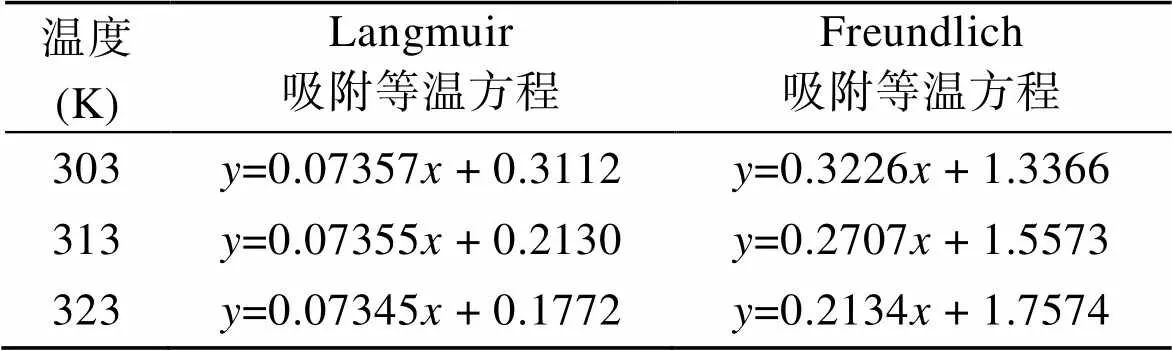
表2 等溫吸附擬合方程
由于本實驗的吸附等溫線更加符合Langmiur吸附等溫模型, 故熱力學參數 Δ、Δ和Δ采用以下公式進行計算[12, 22]:
Δ= –lnd(5)
Δ= Δ–Δ(6)
lnd= Δ–Δ(7)
通過以ln(ee)對e作圖, 由此擬合得到直線及直線方程(圖14), 將e延長至零, 可求得d, 從而根據式(5)可求得各溫度下對應的Δ值。再根據式(7), 通過以lnd對1/作圖(圖15), 由擬合得到的直線斜率和截距即可算出對應的Δ值和Δ值[12], 具體的計算結果如表3所示。
復合吸附劑對Cu2+的吸附過程反應焓變Δ= 33.35.61 kJ/mol>0, 說明該吸附反應過程為吸熱反應, Δ= 116.29 J/(mol·K)>0, 說明該吸附過程為熵增過程, 即吸附體系朝著混亂度增加的方向進行。吉布斯自由能Δ= –2.12 kJ/mol ~ –4.80 kJ/mol<0, 說明所制備的復合吸附劑對Cu2+的吸附過程是自發進行的, 且隨著溫度的升高, Δ的絕對值增大, 表明吸附過程中的推動力增大, 即升高溫度對吸附進行是有利的[12]。
2.11 吸附劑吸附Cu2+動力學實驗
移取多個50 mL、30 mg/L、pH=6.0的Cu2+溶液放入錐形瓶中, 在30、40、50℃下向其中投加4.0 g/L配比為0.04的復合吸附劑, 水浴加熱0、10、20、40、60、120 min后, 測上清液吸光度。
在各溫度下, 復合吸附劑對Cu2+的吸附速率在吸附初期都十分迅速, 此外, 通過對比不同溫度下的吸附動力學曲線可知, 升高溫度有利于吸附過程的進行。采用準一級動力學模型、準二級動力學模型來對圖17中的實驗數據進行線性擬合, 結果見表5和表6。
一級動力學表達式[23]:
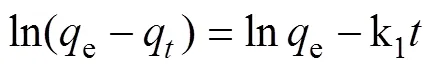
二級動力學表達式[24]:
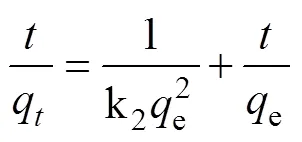
q代表時間內的總的吸附容量(mg/g);e代表反應結束時的總的吸附容量(mg/g); k1、k2為吸附速率常數。
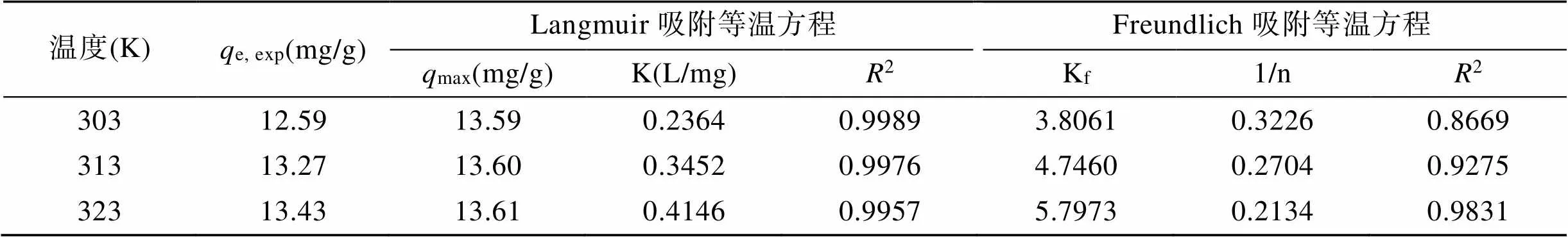
表3 等溫吸附方程參數
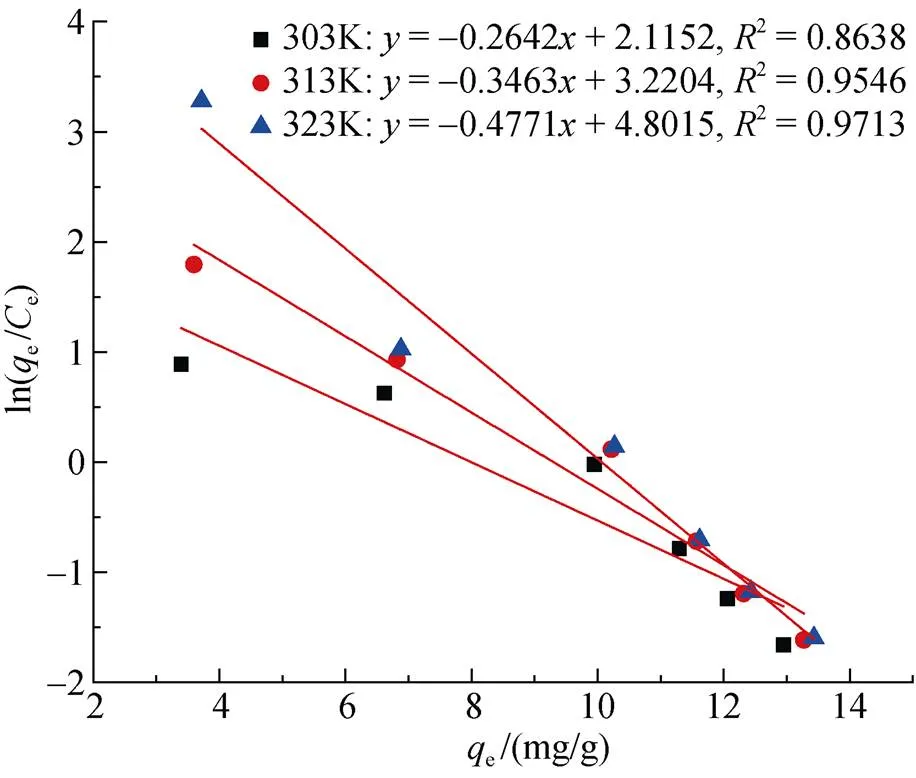
圖15 Kd求解直線圖
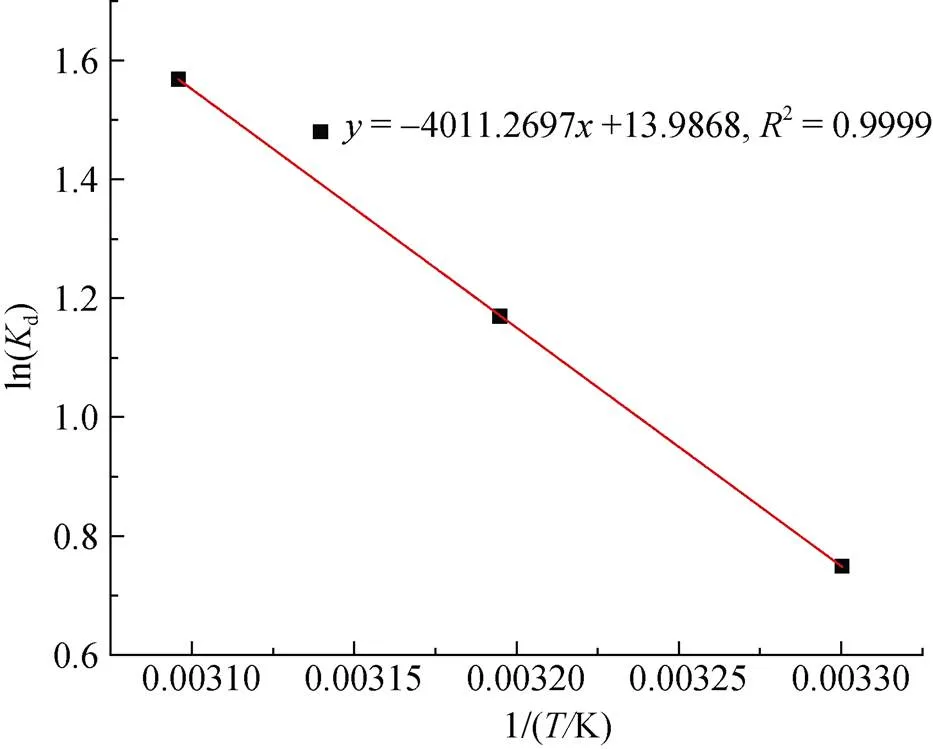
圖16 ΔH與ΔS求解擬合直線圖
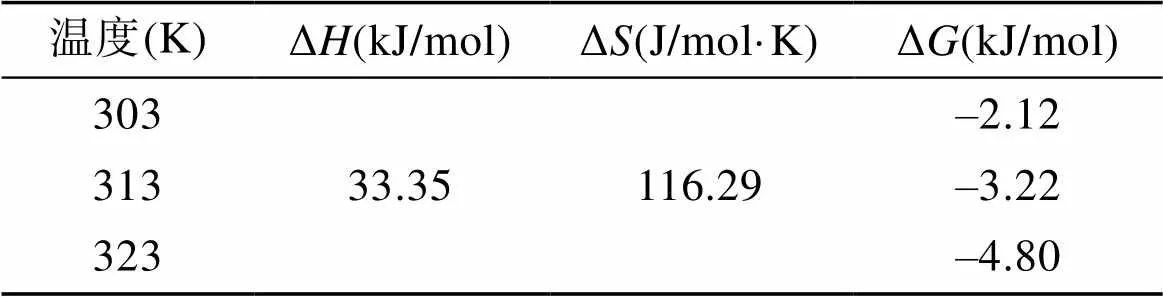
表4 不同溫度下熱力學參數
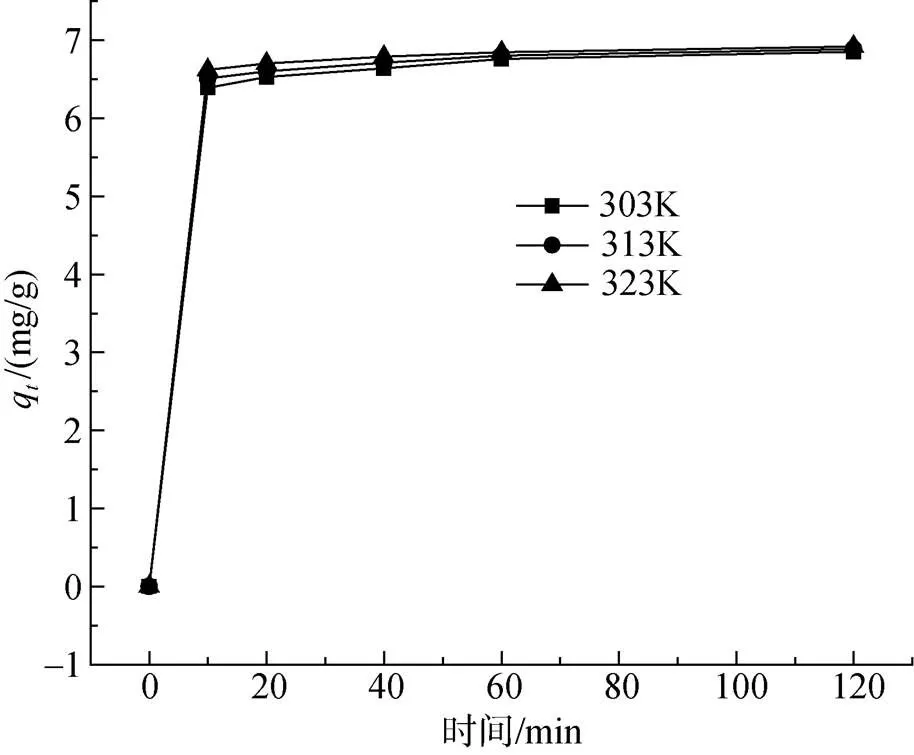
圖17 不同溫度下Cu2+吸附動力學曲線

表5 動力學方程

表6 動力學方程參數
根據表5和表6看出, 準二級動力學模型能更好地擬合復合吸附劑吸附Cu2+的動力學過程, 各溫度下的相關系數R更接近1, 且擬合得到的平衡吸附量e與實驗實測得到的平衡吸附量e, ex更接近, 由此可知, 復合吸附劑對Cu2+的吸附更加符合準二級動力學模型, 即該吸附過程為化學吸附過程[12, 25]。根據阿倫尼烏斯方程:
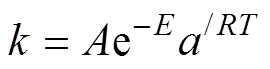
變形得到:
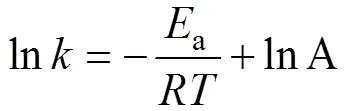
采用對吸附動力學過程擬合效果最好的準二級動力學模型反應速率常數k2, 對a進行計算。具體計算過程為: 以lnk2對1/作圖并進行擬合, 結果如圖17所示。
根據所擬合的直線斜率可求得反應活化能a= 16.75 kJ/mol, 一般情況下, 對于物理吸附反應, 其反應活化能一般小于4.2 kJ/mol; 對于化學吸附反應, 其反應活化能約為8.4 kJ/mol ~83.7 kJ/mol, 因此可據此來判斷吸附反應的類型[26]。這說明該吸附過程屬于化學吸附。
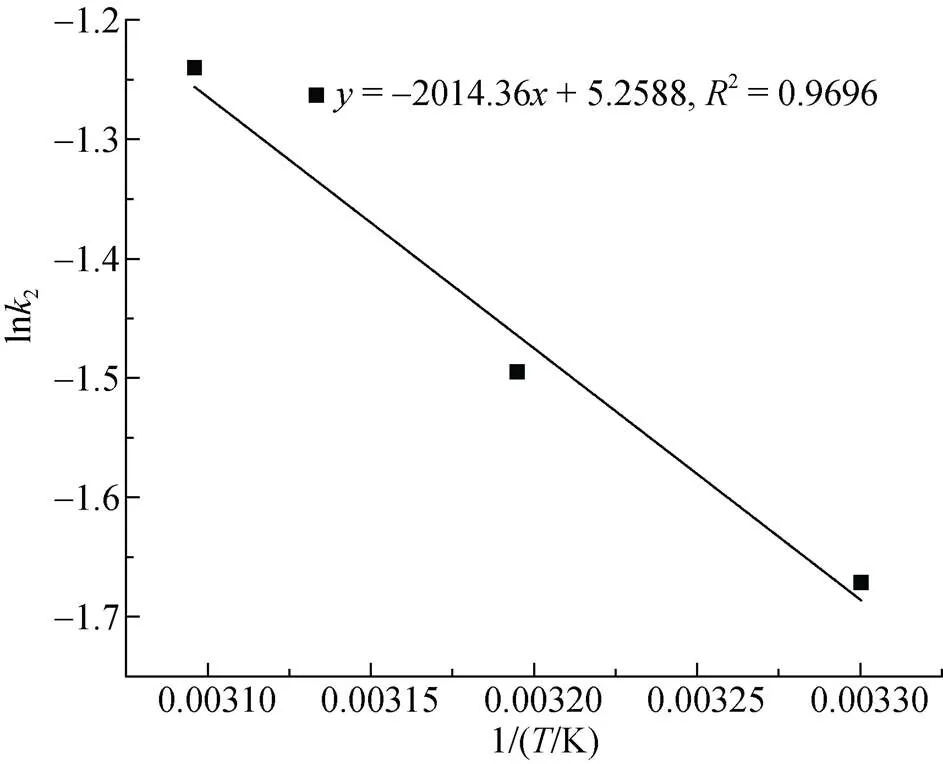
圖18 活化能(Ea)求解擬合直線圖
2.12 再生實驗
移取多個50 mL、30 mg/L、pH=6的Cu2+溶液放入錐形瓶中, 向其中投加4.0 g/L配比為0.04的復合吸附劑置于40℃水浴60 min后取上清液, 測其吸光度后, 向沉淀中分別加入0.10 mol/L的HCl或0.10 mol/L的NaOH溶液50 mL充分解吸后取沉淀, 烘干作為新的復合吸附劑重復以上步驟3次。測得復合吸附劑用HCl或NaOH洗滌后對Cu2+的吸附效果如圖19。

圖19 再生實驗結果
初次沒有經過解吸的吸附容量為6.72 mg/g, 經過0.10 mol/L的HCl解吸3次后的復合吸附劑再次進行吸附實驗時, 吸附容量只有4.3 mg/g, 而經過0.10 mol/L的NaOH溶液解吸3次后的復合吸附劑再次進行吸附實驗時, 吸附容量為5.48 mg/g, 高于經過HCl解吸后的吸附容量, 這就說明NaOH的再生能力優于HCl。
2.13 成本計算
通過計算得知, 復合吸附劑成本略高于蒙脫石而低于殼聚糖和羧乙基殼聚糖, 但吸附去除率遠高于其他三類單獨使用, 而且固-液分離速度快、脫水效果好。
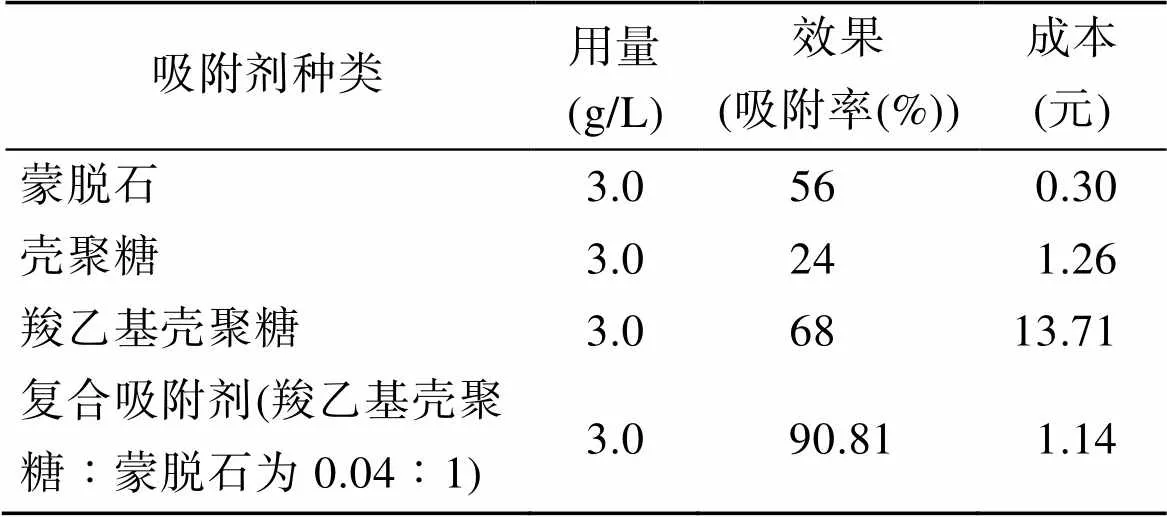
表7 吸附劑成本計算
注: 羧乙基殼聚糖按合成原料(丙烯酸、殼聚糖、氫氧化鈉)價格計算成本
3 結論
蒙脫石負載羧乙基殼聚糖復合吸附劑在對淡水養殖魚塘水體中Cu2+去除后可達到《漁業水質標準》規定, 并具有良好的再生能力; 復合吸附劑對Cu2+吸附過程為吸熱反應和單層化學吸附, 主要依靠離子交換反應去除溶液的Cu2+, 成本略高于蒙脫石而低于殼聚糖和羧乙基殼聚糖, 但吸附去除率遠高于其他3類單獨使用, 而且固-液分離速度快、脫水效果好。
[1] 李振, 陳玉林. 養殖水體自身污染的控制措施[J]. 中國水產, 2004, 7: 68- 69. Li Zhen, Chen Yulin. Control measures for aquaculture water pollution[J]. China Fisheries, 2004, 7: 68- 69.
[2] 宋力, 蔣桂芳, 蔣山泉, 等. 一種新型絮凝劑對養殖水體中銅的去除作用[J]. 山西農業科學, 2012, 40(7): 756-758. Song Li, Jiang Guifang, Jiang Shanquan, et al. Elimination effect of a new flocculant on copper in aquaculture water[J]. Journal of Shanxi Agricultural Sciences, 2012, 40(7): 756-758.
[3] 謝炎福, 祖恩普. 硫酸銅引起魚類中毒原因的分析及對策[J]. 水利漁業, 2005, 25(6): 98-99. Xie Yanfu, Zu Enpu. Analysis and countermeasure of causes of fish poisoning caused by copper sulfate[J]. Water fishery, 2005, 25(6): 98-99.
[4] 曾德芳, 程杰. 改性蒙脫石-殼聚糖絮凝劑處理造紙廢水[J]. 化工環保, 2009, 29(2): 144-146. Zeng Defang, Cheng Jie. Treatment of paper making waste water using m odified montmorillonite-chitosan flocculant[J]. Environmental Protection of Chemical Industry, 2009, 29(2): 144-146.
[5] 鄭慧. 重金屬廢水的處理技術現狀和發展趨勢[J]. 廣州化工, 2009, 36(10): 134-135. Zheng Hui. The actuality and trend of heavy metals wastewater treatment technology[J]. Guangzhou Che-mical Industry, 2009, 36(10): 134-135.
[6] Nalini Sankaranamakrishnan, Ajit Kumar Sharma, Rashmi Sanghi. Novel chitosan derivative for the removal of cadmium in the presence of cyanide from electroplating waste water[J]. Journal of Hazardous Materials, 2007, 148: 353-359.
[7] 趙春祿, 劉輝, 劉振儒. 殼聚糖的化學改性及吸附性能的研究[J]. 環境化學, 2005, 24(2): 209-212. Zhao Chunlu, Liu Hui, Liu Zhenru. A study on chemical modify of chitosan and its adsorbability[J]. Environ-mental Chemistry, 2005, 24(2): 209-212.
[8] 李利明. 聚羥基鐵-殼聚糖改性膨潤土的制備及其吸附性能研究[D]. 南寧: 廣西大學, 2012. Li Liming. Study on preparation and adsorption proper-ties of polyhydroxyl iron-chitosan modified bentonite[D]. Nanning: Guangxi University, 2012.
[9] Mara L P D, Ana F V M, Cybelle M F. Adsorptive removal of Cu (Ⅱ) from aqueous solution using non- crosslinked and crosslinked chitosan-coated bentonite beads [J]. Desalination, 2011, 275(1-3): 154-159.
[10] 楊蕊. 殼聚糖衍生物的制備及其在水處理中的應用[D]. 沈陽: 沈陽理工大學, 2013. Yang Rui. Preparation and application of chitosan deri-vatives in water treatment[D]. Shenyang: Shenyang Ligong University, 2013.
[11] 趙蓉. 膨潤土負載殼聚糖的制備及其對染料的吸附研究[D]. 南京: 南京林業大學, 2013. Zhao Rong. Preparation and characterisation of bentonite compound chitosan and its adsorption behaviour of organic dyes[D]. Nanjing: Nanjing Forestry University, 2013.
[12] 劉立山. 磁性殼聚糖/膨潤土復合吸附劑的制備及其吸附Cu2+的研究[D]. 長沙: 湖南大學, 2015. Liu Lishan. Study on synthesis of magnetic chitosan/ bentonite composite adsorbent and its application for Cu2+adsorption[D]. Changsha: Hunan University, 2015.
[13] 鄭重, 唐星華, 柯城, 等. 交聯殼聚糖的合成及其對重金屬離子吸附的研究進展[J]. 江西科學, 2008, 26(3): 421-425. Zheng Zhong, Tang Xinghua, Ke Cheng, et al. Cross- linked chitosan synthesis and heavy metal ion adsor-ption on progress[J]. Jiangxi Science, 2008, 26(3): 421- 425.
[14] 韓紅青, 朱岳. 膨潤土改性及其應用研究[J]. 無機鹽工業, 2011, 43(10): 5-8. Han Hongqing, Zhu Yue. Study on modification and application of bentonite[J]. Inorganic Chemicals Industry, 2011, 43(10): 5-8.
[15] 肖娟, 郭會明. 膨潤土改性及其應用進展[J]. 當代化工, 2009, 38(6): 626-628. Xiao Juan, Guo Huiming. Modification and application of bentonite[J]. Contemporary Chemical Industry, 2009, 38(6): 626-628.
[16] 施周, 劉立山, 楊秀貞, 等. 磁性殼聚糖/膨潤土復合吸附劑吸附Cu2+[J]. 環境工程學報, 2015, 9(12): 5677- 5682. Shi Zhou, Liu Lishan, Yang Xiuzhen, et al. Adsorption of Cu2+using magnetic chitosan/bentonite composite[J]. Chinese Journal of Environmental Engineering, 2015, 9(12): 5677-5682.
[17] Slaney A J, Bhamirdmarri R. Adsorption of pentachlorophenol (PCP) by activated carbon in fixed beds application of homogeneous surface diffusion model[J]. Water Science Technology, 1998, 38(7): 227-235.
[18] 張廷安, 豆志河. 用殼聚糖脫除廢水中的銅離子[J]. 東北大學學報(自然科學版), 2006, 27(2): 203-205. Zhang Tingan, Dou Zhihe. Removal of Cu2+in wastewater with chitosan[J]. Journal of Northeastern University (Natural Science), 2006, 27(2): 203-205.
[19] GB11607-89, 漁業水質標準[S]. GB11607-89, Fishery Water Quality Standards[S].
[20] Langmuir I. The adsorption of gases on plane surface of glass, mica and platinum[J]. Journal of the American Chemical Society, 1918, 40(9): 1361-1403.
[21] Freundlich H M F. Uber die adsorption in lusungen[J]. Journal of physical chemistry, 1906, 57: 385-470.
[22] Huang W Y, Chen J, He F, et al. Effective phosphate adsorption by Zr/Al-pillared montmorillonite: insight into equilibrium, kinetics and thermodynamics[J]. Applied Clay Science, 2014, 104: 252-260.
[23] Wu F C, Tseng R L, Juang R S. Kinetic modeling of liquid-phase adsorption of reactive dyes and metal ions on chitosan[J]. Water Research, 2001, 35(3): 613-618.
[24] Y S Ho. Review of second-order models for adsorption systems[J]. Hazard. Mater, 2006, 136: 681-689.
[25] 郭學益, 肖彩梅, 梁莎, 等. 改性柿子粉吸附劑對Cd2+的吸附性能[J]. 中南大學學報(自然科學版), 2012, 43(2): 412-417. Guo Xueyi, Xiao Caimei, Liang Sha, et al. Adsorption of Cd2+by chemically modified persimmon powder[J]. Journal of Central South University (Science and Tech-nology), 2012, 43(2): 412-417.
[26] Smith J M. Chemical engineering kinetics[M]. NewYork: Mc Graw Hill, 1981, 225-263.
Adsorption of Cu2+in aquaculture water using carboxyethyl chitosan (CEC)/montmorillonite adsorbent
LI Jian-ping, ZHOU Xin-yu, DAI Jing-wei, SHEN Qing-zhou
(Ocean College of Hebei Agricultural University, Qinhuangdao 066003, China)
A carboxyethyl chitosan (CEC)/montmorillonite composite adsorbent was synthesized with CEC and montmorillonite, and its surface structure was analyzed by Fourier transform infrared spectroscopy, scanning electron microscopy, and X-ray diffraction. The adsorption-affecting conditions of Cu2+treatment from the aqueous solution to the composite were investigated. The adsorption course of the adsorbents was investigated on the basis of the adsorption kinetics and thermodynamics. Finally, the effect of regeneration was investigated. Results showed that CEC was successfully coated onto montmorillonite. The adsorption efficiency of Cu2+reached 96.23% under the following conditions: CEC-to-montmorillonite mass ratio of 1︰25, pH of 6, temperature of 40℃, time of 60 min, adsorbent dosage of 4.0 g/L, and initial Cu2+concentration of 30 mg/L. The adsorption kinetics and isotherm of Cu2+on the composite followed the pseudo-second-order and Langmuir models, respectively. The thermodynamic and kinetic parameter studies indicated that adsorption was a spontaneous, endothermic, and chemical process. The regeneration effect of NaOH was better than that of HCl.
composite adsorbent; Cu2+; adsorption; mechanism; regeneration
Sept., 9, 2019
[Hebei Province Higher Education Science and Technology Research Funding Project, No. QN2018106]
X52
A
1000-3096(2020)02-0120-11
10.11759/hykx20190901001
2019-09-01;
2019-10-21
河北省高等學校科學技術研究資助項目(QN2018106)
李儉平(1982-), 女, 山東蘭陵人, 博士, 主要從事環境生態監測方面教研工作, 電話: 18712714196, E-mail: lijianping426@ 163.com
(本文編輯: 譚雪靜)

