杜比亞蟑螂共生真菌次生代謝產物及其生物活性
單體江,段志豪*,吳春銀,李志強,王 松,毛子翎**
(1. 華南農業大學林學與風景園林學院,廣東省森林植物種質創新與利用重點實驗室,廣州 510642;2. 廣東省生物資源應用研究所,廣州 510260)
杜比亞蟑螂Blapticadubia又名度比亞大蠊、度比亞蟑螂,屬蜚蠊目Blattaria、蜚蠊科Blattidae碧蠊屬Blaptica卵胎生昆蟲(Wuetal., 2013),主要分布于中美洲、南美洲,屬于衛生害蟲(Alameretal., 2014a; 2014b)。杜比亞蟑螂體內的蛋白質含量豐富,現多用于爬行動物和兩棲動物的活體飼料,為開發潛力較大的資源昆蟲之一 (Yietal., 2013;Tianetal., 2016)。杜比亞蟑螂產生的幾丁質、抗菌肽和殼聚糖等已用于生產醫藥保健品、化妝品等(章敏等,2012)。隨著昆蟲體內微生物研究方法的不斷改善,其體內大量的共生真菌不斷被人們所認知(戈惠明等,2009;Teeetal., 2015)。昆蟲體內微生物參與到昆蟲生活的許多方面,包括昆蟲的生理和進化,協助腸道消化食物,改善宿主營養,有利于種間種內通訊,抵御捕食者、病原菌以及寄生蟲的入侵等(Crottietal., 2012;Engeletal., 2013)。昆蟲共生真菌及其產生的次生代謝產物類型豐富、結構新穎、抗性較好,是目前國內外研究的重點(汪福源等,2017)。從棉蝗腸道菌Phomasp.中分離得到化合物epoxydon 6-methylsalicylateester,具有中等的免疫抑制活性和較強的除草活性(張應烙等,2010);從菜粉蝶腸道中分離得到的共生真菌Alternariasp.,發酵培養后得到7種對酪氨酸激酶具有不同程度抑制活性的次生代謝產物(郭玲芝等,2014)。
目前關于蜚蠊科共生真菌的研究報道較少,從德國小蠊Blattellagermanica腸道和糞便中分離出22株具有抗真菌活性和產鐵能力的菌株,表明腸道菌群對保護蟑螂免受真菌侵染和定植有重要作用(Zhangetal., 2018)。從美洲大蠊Periplanetaamericana體內分離出假絲酵母、曲霉和紅曲霉等23種真菌(Kassirietal., 2018),此外,美洲大蠊的甲醇提取物含有甾醇類和具有抗細菌活性的異黃酮類化合物(尹衛平等,2012)。然而尚未見杜比亞蟑螂共生真菌及其次生代謝產物的研究。杜比亞蟑螂體內是否存在共生真菌,共生真菌種類以及共生真菌次生代謝產物的生物活性等問題值得研究和探討。本論文以杜比亞蟑螂為研究對象,分離并鑒定其中的共生真菌,通過發酵培養提取共生真菌的次生代謝產物,并測定其抗菌和抗氧化活性,以期為杜比亞蟑螂及其共生真菌的綜合開發與利用提供重要的理論依據。
1 材料與方法
1.1 試驗材料
杜比亞蟑螂Blapticadubia于2016年11月30日購自青島連萬家杜比亞專賣店。
1.2 儀器與試劑
SW-CJ-2G型超凈工作臺(蘇州凈化設備有限公司);LRH系列生化培養箱(上海一恒科學儀器有限公司);ZF-2型三用紫外儀(上海安亭科學儀器廠);HQ45恒溫搖床(中國科學院武漢科學儀器廠);BCD-280W醫用冷藏箱(海爾生物醫療有限公司);旋轉蒸發儀OSB-2100(東京理化器械株式會社);DSX-280KB30手提式壓力蒸汽滅菌器(上海申安醫療器械廠);Exceed-C超純水機(成都唐氏康寧科技發展有限公司);JA2003N分析天平(上海精密科學儀器有限公司);DIS-2012R全溫振蕩搖床(上海世平實驗設備有限公司);LC-16高效液相色譜(日本島津);Thermo VarioskanTMLUX 多功能酶標儀(賽默飛世爾科技有限公司)。
乙酸乙酯、無水乙醇、二氯甲烷等均為分析純(天津富宇精細化工廠);分析純甲醇(天津富宇精細化工廠);色譜純甲醇(上海星可高純溶劑有限公司);升汞(廣逸化工有限公司);GF254薄層層析硅膠(青島海洋化工廠);羧甲基纖維素鈉(國藥集團化學試劑有限公司);噻唑藍(MTT)生物顯色劑(Amresco公司);硫酸鏈霉素(美國Sigma公司,99%)。
1.3 共生真菌的分離和純化
共生真菌的分離參照Shan等(2012)的方法。將活體杜比亞蟑螂用清水清洗20 min,晾干。先用75%乙醇處理30 s,再用0.2%氯化汞處理20 min,而后用無菌水沖洗3次,每次5 min,最后置于無菌濾紙上晾干。去除杜比亞蟑螂的翅、足和頭胸部,將蟑螂的腹部剖開后放置在PDA培養基平板中(含500 μg/mL的硫酸鏈霉素),在28℃恒溫培養箱內暗培養。待共生真菌長出后,從每個菌落的邊緣挑取少量菌絲接種到新的PDA培養基上,連續純化多次,直至菌落形態均勻一致為止。將分離純化得到的杜比亞蟑螂共生真菌依次編號為Bdf-1~Bdf-5。將純化好的共生真菌接種到PDA斜面上,4℃保存,備用。共生真菌分離頻率(CF)的計算公式如下:

1.4 共生真菌的鑒定
1.4.1共生真菌的形態學鑒定
將共生真菌菌株接種于PDA平板上,28℃恒溫培養5~10 d,觀察、記錄菌落形態并拍照,并在光學顯微鏡下觀察菌絲形態和產孢情況,記錄菌絲有無隔膜以及孢子的大小等。
1.4.2共生真菌的分子生物學鑒定
參照宋慧云等(2018)的方法對分離到的共生真菌進行鑒定。將純化后的菌株(在PDA平板上生長5 d)接種到PDB培養基中,于28℃ 150 rpm振蕩培養6~7 d,減壓抽濾后獲得其菌絲。用液氮將菌絲充分研磨至粉末狀,采用試劑盒法(上海生工DNA抽提取試劑盒)提取其DNA。使用真菌通用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAA GG-3′)擴增其ITS序列,PCR反應體系(50 μL):2×TaqPCR Master Mix(含染料)25 μL,ITS4(10 μmol/L)1 μL,ITS5(10 μmol/L)1 μL,DNA模板(10 ng/μL)2 μL,雙蒸水21 μL,混勻。擴增程序為:94℃預變性3 min;94℃變性40 s,56℃退火40 s,72℃延伸1 min 20 s,共30個循環;最后72℃延伸10 min,4℃保存。PCR產物送至生工生物工程(上海)股份有限公司進行測序。所得序列使用DNAMAN軟件進行互補拼接,將正向與反向引物互補序列兩端加上引物序列拼接成完整序列,所得的rDNA-ITS序列提交到GenBank數據庫,獲得其登錄號。
將擴增所得的rDNA-ITS序列在NCBI網站上(http://www.ncbi.nlm.nih.gov/)進行Blast,在GenBank數據庫中進行同源性檢索,下載與其相似性較高的序列及其近似屬的序列,通過MAFTT version 7處理后,使用MEGA 7.0.26軟件采用最大似然法構建系統發育樹,其中Bootstrap method中重復抽樣次數設置500,模式為General Time Reversible Model。
1.5 共生真菌次生代謝產物的制備
采用PDB培養基對分離鑒定后的共生真菌進行發酵培養,通過減壓抽濾分別得到菌絲和菌液。菌絲經乙酸乙酯冷浸提取3次,每次7 d,菌液直接采用乙酸乙酯萃取3次,分別將提取液和萃取液減壓濃縮,得到菌絲和菌液次生代謝產物,4℃保存備用。
1.6 抗細菌活性的測定
采用薄層層析(TLC)-噻唑藍(MTT)-生物自顯影法測定共生真菌次生代謝產物對不同供試細菌的抑制活性(歐陽錦逵等,2017)。供試細菌為大腸桿菌(Escherichiacoli,G-)、黃瓜角斑病菌(Pseudomonaslachrymans,G-)、番茄瘡痂病菌(Xanthomonasvesicatoria,G-)、枯草芽孢桿菌(Bacillussubtilis,G+)、青枯病菌(Ralstoniasolanacearum,G-)、根癌土壤桿菌(Agrobacteriumtumefaciens,G-)和溶血葡萄球菌(Staphylococcushaemolyticus,G+)。將提取物用丙酮溶解,在薄層層析板上用直徑0.5 mm的毛細管點樣,點樣量為5 μL。采用二氯甲烷和甲醇的混合溶液作為展開劑進行薄層層析,濃度為0.2 mg/mL硫酸鏈霉素作為陽性對照。向滅菌的LB半固體培養基中加入菌液(45 mL LB + 5 mL菌液),調其濃度約為108CFU/mL,振蕩均勻。用噴樣器將菌液均勻快速地噴灑到硅膠板上,待培養基冷卻凝固后,將硅膠板置于培養皿中于4℃冰箱中放置4 h,以利于抗菌成分的擴散;再將硅膠板置于28℃下保濕培養,12 h后取出硅膠板,均勻噴灑0.5 mg/mL MTT,靜待幾分鐘后觀察實驗結果。有抗菌活性成分處,供試細菌由于受到活性成分的抑制而出現抑菌斑;無抗菌活性成分處,供試細菌正常生長,噴灑MTT后顯藍紫色。通過抑菌斑的遷移率(即Rf值)來初步評價樣品中抗菌化合物的極性,根據抑菌斑的大小和多少來初步評價活性化合物的抑菌活性和數量。Rf值計算公式如下:

1.7 抗氧化活性的測定
采用多孔板-DPPH顯色法測定共生真菌次生代謝產物對DPPH的清除率,以IC50值來表示共生真菌次生代謝產物的抗氧化能力(Ouyangetal.,2018)。精密稱取DPPH 20.0 mg溶于100 mL無水乙醇中,振蕩搖勻,使其終濃度為0.2 mg/mL。陽性對照BHT和各提取物的初始濃度為10.0 mg/mL,而后用DMSO依次對半稀釋成濃度為5 mg/mL~0.0390625 mg/mL的溶液。向96微孔板中加入80 μL濃度為0.2 mg/mL DPPH無水乙醇溶液,而后加入20 μL系列濃度的待測樣品溶液或陽性對照溶液,震蕩搖勻。在37℃下水浴30 min,517 nm下測定吸光值。以20 μL DMSO溶液代替樣品溶液作為空白對照,每個處理3個重復,供試樣品對DPPH清除率的有效中濃度(IC50)計算公式如下:

所得數據采用Excel軟件進行作圖分析,供試樣品濃度取對數(X),清除率換算成機率值(Y),初步求得抗氧化活性的回歸方程(Y=aX+b)和IC50值。
1.8 共生真菌次生代謝產物的高效液相分析
為進一步探究杜比亞蟑螂共生真菌次生代謝產物的情況,本研究采用高效液相對其次生代謝產物進行分析。將發酵得到的5株共生真菌菌絲和菌液提取物各10 mg,用1 mL色譜甲醇溶解后,再用0.22 μm有機濾膜過濾,將濾液轉移到樣品瓶中,待測。使用甲醇-水梯度洗脫,其色譜條件為:0~2 min使用20%甲醇等度洗脫;2~20 min,甲醇濃度由20%線性遞增到100%;20~25 min,使用100%甲醇進行洗脫;25~30 min,使用20%甲醇對色譜柱進行平衡,紫外檢測器設置為254 nm單通道采樣。
2 結果與分析
2.1 共生真菌的分離和鑒定
從杜比亞蟑螂中總共分離得到13株共生真菌,通過菌落和顯微形態觀察,合并相同的菌株,最后得到5株形態各異的共生真菌,分別編號為Bdf-1~Bdf-5。其菌落和顯微形態如圖1所示。
光學顯微鏡下觀察發現,分離到的所有菌株菌絲均為有隔菌絲,在正常培養條件下均有孢子產生。杜比亞蟑螂共生真菌形態學描述見表1。菌株Bdf-2、Bdf-3和Bdf-5均有曲霉屬真菌典型的分生孢子頭產生,但菌落形態卻存在較大差異,因此采用分子生物學方法對篩選出的形態各異的共生真菌進行進一步的鑒定。

圖1 杜比亞蟑螂共生真菌菌落形態及其顯微結構Fig.1 The morphological characters of symbiotic fungi in Blaptica dubia

表1 杜比亞蟑螂共生真菌形態學描述
通過PCR擴增、測序后,將拼接完整的ITS序列提交至GenBank,獲得其登錄號,并構建系統發育樹(圖2)。結合菌落形態、顯微觀察以及構建的系統發育樹,杜比亞蟑螂共生真菌的最終鑒定結果如表2所示。5株共生真菌主要分布于青霉屬、曲霉屬和聚孢霉屬,其中曲霉屬的種類最多(3株),說明曲霉屬為優勢種群,其余兩屬各有1株。青霉屬雖然只有1株Bdf-1,但其分離頻率高達30.77%,僅次于曲霉屬的Bdf-3(46.15%)。曲霉屬和青霉屬真菌雖多為腐生菌,但也常常作為昆蟲的共生真菌被報道。中華劍角蝗腸道共生真菌草酸青霉Penicilliumoxalicum產生的次生代謝產物對人體多種癌細胞具有顯著的生長抑制作用(喻夢嵐等,2014;鄭燕麗等,2014)。
2.2 共生真菌的抗細菌活性
采用TLC-MTT-生物自顯影法測定了杜比亞蟑螂共生真菌菌液和菌絲提取物對不同供試細菌的抑制活性(表3)。結果表明,5種共生真菌菌液和菌絲提取物均表現出一定的抗菌活性,但同一提取物對不同供試細菌的抑制活性存在一定的差異。其中Bdf-1菌絲提取物對黃瓜角斑病菌未表現出抑制活性,而Bdf-3菌絲提取物對枯草芽孢桿菌未表現出抑制活性。所有菌株菌液提取物抑菌斑的Rf值范圍明顯大于菌絲提取物,說明菌液中含有更多的抗菌活性化合物。Rf值主要與化合物的極性有關,Rf值越小,化合物極性越大,Bdf-1、Bdf-3和Bdf-4菌液提取物Rf值在0.0~0.5之間均有分布,說明三株菌的菌液中具有抗菌活性的次生代謝產物其極性為中等偏大。Bdf-1和Bdf-3菌絲提取物Rf值主要分布在0.35~0.60之間,說明兩菌的菌絲中具有抗菌活性的物質主要為中等極性的次生代謝產物,而Bdf-4菌絲提取物Rf值主要分布在0.0~0.12之間,說明抗菌活性物質的極性偏大。Bdf-2和Bdf-5菌液提取物抑菌斑的Rf值范圍完全覆蓋菌絲提取物,說明菌液提取物中具有抑菌活性的次生代謝產物更為豐富。從抑菌斑的最大直徑來看,Bdf-4和Bdf-5菌液提取物對所有供試細菌的抑菌斑最大直徑均超過10 mm,而菌絲提取物要明顯弱于菌液,抑菌斑最大直徑一般在5~10 mm之間,其中Bdf-4菌絲提取物對黃瓜角斑病菌和大腸桿菌抑菌斑的最大直徑要大于10 mm。除黃瓜角斑病菌外,Bdf-2菌液提取物對其他供試細菌的抑菌斑的最大直徑也超過10 mm,且菌絲提取物弱于菌液提取物。Bdf-1和Bdf-3對不同供試細菌的抑制活性要弱于Bdf-2、Bdf-4和Bdf-5,但也表現一定的抗菌活性,抑菌斑的最大直徑多集中于5~10 mm之間。

表2 杜比亞蟑螂共生真菌鑒定結果
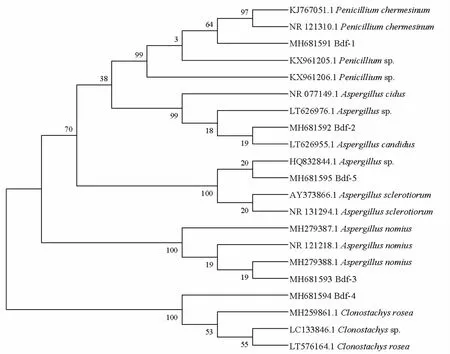
圖2 依據杜比亞蟑螂共生真菌rDNA-ITS序列構建的系統發育樹Fig.2 Phylogenetic tree of symbiotic fungi isolated from Blaptica dubia based on the rDNA-ITS sequence

綜上所述,菌株Bdf-2、Bdf-4和Bdf-5表現出較好的抗菌活性,且菌液提取物的抗菌活性要強于菌絲,說明杜比亞蟑螂共生真菌產生的活性次生代謝產物主要分泌到胞外,為極性偏大的化合物,這與抑菌斑的Rf值偏小的結果相一致。
2.3 共生真菌的抗氧化活性
采用DPPH法測定了5株杜比亞蟑螂共生真菌菌液和菌絲提取物的抗氧化活性(表4)。結果表明,Bdf-4和Bdf-5菌液和菌絲提取物在供試濃度下均未表現出任何抗氧化活性。Bdf-1,Bdf-2和Bdf-3的菌液提取物均表現出明顯的抗氧化活性,IC50值分別為0.26±0.01 mg/mL、2.20±0.99 mg/mL和0.75±0.16 mg/mL;而菌絲提取物的IC50值均大于5 mg/mL。說明Bdf-1,Bdf-2和Bdf-3中具有抗氧化活性的次生代謝產物主要分布于菌液中。

表4 杜比亞蟑螂共生真菌不同提取物對DPPH的清除力
注:“B”表示菌液提取物; “M”表示菌絲提取物。
Note: “B” was the crude extract from broth; “M” was the crude extract from mycelia.

圖3 杜比亞蟑螂共生真菌的菌絲和菌液不同提取物HPLC色譜圖Fig. 3 HPLC chromatograms for different crude extracts of symbiotic fungi isolated from Blaptica dubia
2.4 共生真菌次生代謝產物的高效液相分析
采用HPLC對分離得到的5株杜比亞蟑螂共生真菌菌絲和菌液提取物進行分析,其色譜圖如下所示(圖3)。HPLC分析結果表明,在波長為254 nm的檢測條件下,5株共生真菌都含有一定量的次生代謝產物,其中菌株Bdf-1、Bdf-3以及Bdf-5菌液次生代謝產物的數量要高于其菌絲,且主要差異均表現在化合物極性偏大的區域,即保留時間在20 min之前的區域,通過前面的研究發現,菌株Bdf-1和Bdf-3菌液提取物表現出較好的抗氧化活性,而Bdf-5菌液提取物表現出較好的抗菌活性,是否與這些成分有關還有待于進一步研究。此外,菌株Bdf-2和Bdf-4菌液中的化合物種類與菌絲差異不大,但其紫外吸收明顯弱于菌絲,說明次生代謝產物主要分布于菌絲中,而菌株Bdf-2和Bdf-4菌絲提取物的抗菌活性要弱于菌液,說明254 nm下含量較高的化合物其抗菌活性并不強。本實驗所得到的高效液相色譜圖,可以為杜比亞蟑螂共生真菌活性次生代謝產物的分離和純化提供參考。
3 結論與討論
本研究采用組織塊分離法從杜比亞蟑螂中分離鑒定出5株共生真菌,分屬于青霉屬、曲霉屬和聚孢霉屬,其中青霉屬和曲霉屬菌株為優勢菌株,可能與杜比亞蟑螂生活的環境有關。青霉屬和曲霉屬真菌作為常見的昆蟲和植物共生菌以及腐生菌,也能夠產生多種活性次生代謝產物,且生活環境不同,共生真菌所產生的次生代謝產物和生物活性也大不相同。從南海紅樹林中分離得到的鮮紅青霉,能夠產生對葡萄糖苷酶和乙酰膽堿酯酶具有不同程度抑制活性的化合物(Huangetal., 2011)。Aspergillusnomius是巴西堅果中黃曲霉毒素的重要生產者(Olsenetal., 2008)。從吉蘭泰鹽田沉積物中分離出Penicilliumcitrinum,并從該菌的發酵物中得到兩個桔霉素二聚體化合物,對DPPH自由基表現出一定的清除活性(Luetal., 2008)。本研究所采用的供試材料為人工飼養的杜比亞蟑螂,生活環境相對單一,且并不是所有的共生真菌均能在人工培養基上生長,所以分離到的共生真菌種類和數量偏少。本論文分別提取共生真菌菌絲與菌液的次生代謝產物,進而比較共生真菌胞內(菌絲)和胞外(菌液)次生代謝產物在抗細菌和抗氧化活性方面的差異。其中菌液提取物的抗細菌和抗氧化活性要強于其菌絲提取物,菌株Bdf-2、Bdf-4和Bdf-5菌液提取物表現出較強的抑菌活性,而Bdf-1,Bdf-2和Bdf-3的菌液提取物均表現出較好的抗氧化活性。其中Bdf-4鑒定為Clonostachyssp.,Roberti等(2008)發現從感染鐮刀菌的小麥冠中分離出的粉紅螺旋聚孢霉Clonostachysrosea,可以抑制谷物的種傳鐮刀菌病害。杜比亞蟑螂共生真菌次生代謝產物是否具有抗真菌、抗腫瘤和酶抑制活性還有待于進一步研究,此外,這些次生代謝產物對杜比亞蟑螂的抗病性和環境適應性等的影響也是接下來研究的重點。本研究為進一步分離杜比亞蟑螂共生真菌中的抗菌和抗氧化活性成分奠定了基礎,為杜比亞蟑螂及其共生真菌的綜合開發與利用提供了新的思路。

