404 Not Found
404 Not Found
電穿孔法轉染人乳腺癌細胞MCF-7的條件優化研究
閆東科,許鳳霞,呂平,李冬
(天津職業大學生物與環境工程學院,天津 300350)
乳腺癌是世界范圍內常見的一種女性癌癥。2017年全球統計數據表明,乳腺癌的發病率高達30%,排在首位,且乳腺癌的死亡率為14%,僅次于肺癌[1]。在我國,乳腺癌是導致女性癌癥患者死亡的首要原因[2]。隨著分子生物學的快速發展,尋找用于乳腺癌早期診斷和治療的分子靶標已成為當前乳腺癌研究的熱點。例如,針對人類表皮生長因子受體2(human epithelial growth factor receptor-2,HER-2)靶標的重組人源化單克隆抗體帕妥珠單抗[3](Pertuzumab,商品名Perjeta,帕捷特),已于2018年12月被我國國家食品藥品監督管理總局(CFDA)批準上市,用作HER-2陽性轉移性乳腺癌的靶向治療藥物。
而在癌癥治療分子靶標研究中,細胞轉染技術是研究特定基因表達調控的重要技術手段之一。其中,電穿孔法作為一種常用的細胞轉染技術,具有轉染效率高、轉染操作程序簡單、快捷、實驗重復性好、樣本處理量大、無殘留毒性以及適用范圍廣泛等優點,不僅可用于對干細胞、原代細胞、細胞系的轉染,而且可用于對類器官、受精卵(胚胎)、活體(離體)組織器官[4]、昆蟲[5]和藻類[6]以及植物種子[7]、花粉、原生質體等的轉染。電轉染是利用高于某一閾值的外加電脈沖刺激細胞膜,導致細胞膜磷脂雙分子層結構重排,形成瞬時性孔洞,從而使外源生物大分子通過孔洞導入細胞的過程。也有研究認為,電脈沖對生物大分子與細胞膜的結合起促進作用,生物大分子是通過細胞膜的內吞作用進入細胞的[8]。影響電轉染效率的因素眾多,不同細胞系最佳電轉染條件也不盡相同。本次實驗以目前常用的乳腺癌細胞模型人乳腺癌細胞系MCF-7為研究對象,研究電轉染時的電壓、電脈沖時長、電脈沖次數、質粒濃度和細胞傳代時間對其電轉染效率的影響。
1 材料與方法
1.1 實驗材料
1.1.1 質粒、菌株和細胞
pcDNA3.1(+)-EGFP質粒購自豐暉生物科技有限公司;大腸桿菌感受態菌株DH5α為本實驗室保存;人乳腺癌MCF-7細胞購自碧云天生物技術有限公司。
1.1.2 主要試劑
無血清培養基Opti-MEM(即電轉Buffer)和DMEM培養基均購自美國Gibco公司;胎牛血清購自美國HyClone公司;牛胰島素購自康朗生物科技(上海)有限公司;去內毒素質粒大提試劑盒購自德國Qiagen公司;胰蛋白酶購自美國Sigma公司;酵母提取物、胰蛋白胨和氯化鈉均購自美國Oxiod公司;氨芐青霉素購自天根生化科技(北京)有限公司。
1.1.3 主要儀器
電穿孔儀(NEPA21 Super Electroporator)及 2 mm電轉杯購自日本 NEPA GENE 公司;Nano Drop 2000超微量分光光度計、CO2培養箱和高速冷凍離心機均購自美國 Thermo Fisher Scientific公司;倒置熒光顯微鏡購自日本Olympus公司;細胞計數儀購自博大博聚科技(深圳)有限公司;恒溫細菌培養箱購自昕儀儀器儀表(上海)有限公司;恒溫細菌培養搖床購自圣科儀器設備(上海)有限公司。
1.2 實驗方法
1.2.1 轉染質粒的準備
利用Ca2+誘導轉化法將pcDNA3.1(+)-EGFP質粒導入DH5α感受態細胞,并將菌體涂布在LB平板(氨芐青霉素濃度為100 μg/mL)上,37 ℃恒溫細菌培養箱內培養過夜,挑取單克隆菌落至5 mL LB液體培養基(氨芐青霉素濃度為100 μg/mL)中,37 ℃恒溫細菌搖床中培養過夜,按照質粒大提試劑盒說明書提取擴增后的質粒。利用分光光度計測定質粒濃度,A260/A280為 1.8~1.9,測得質量濃度為 1.176 μg/μL。
1.2.2 細胞復蘇與培養
從液氮罐中取出裝有MCF-7細胞的凍存管,于37 ℃水中搖晃融化,加 4~5 mL DMEM 培養基混勻,1 000 r/min 離心 4 min,棄上清,加 1~2 mL 培養基重懸細胞,接種于 T25培養瓶中,加含 10% FBS、0.01 mg/mL牛胰島素的 DMEM 培養基 6~8 mL,于 37 ℃、飽和濕度、5% CO2培養箱中培養,每隔1 d換液 1次,每2~3 d按1∶4比例傳代1次。
1.2.3 MCF-7細胞的電轉染
融合度為80%~90%的MCF-7細胞在經0.25%胰蛋白酶(含0.01% EDTA)消化完全后,用電轉Buffer Opti-MEM重懸細胞2遍以除去消化終止液中的血清,而后用細胞計數儀計數。NEPA21電穿孔儀(2 mm電轉杯)懸浮電轉時,要求100 μL的電轉混合液中細胞數量不低于106個,質粒質量不少于10 μg。電轉染時,將裝有電轉混合液的電轉杯放入電轉杯腔,按下“Ω”鍵測定電阻值(應處于30~50 Ω),按下“start”鍵執行電轉程序,每組電轉程序重復3次。電轉完成后,細胞轉入預熱的培養皿中,置于CO2培養箱中培養,48 h后觀察EGFP表達情況,計算電轉染效率。
1.2.4 電轉染效率觀察
每組轉染的MCF-7細胞培養48 h后,經0.25%胰蛋白酶(含0.01% EDTA)消化收集,制成相同體積的細胞懸液,于熒光顯微鏡下固定1個視野計算出可見光下細胞數,然后轉換為熒光光源,計算出發綠色熒光的細胞數,按公式1計算轉染效率。

1.2.5 不同條件對細胞轉染效率的影響
分別在不同電壓(100 V、125 V、150 V、175 V、200 V)、不同電脈沖次數(1~4次)、不同電脈沖時長(2.5 ms、5.0 ms、7.5 ms)、不同質粒濃度(0.377 μg /μL、0.565 μg/μL、0.778 μg/μL、0.985 μg/μL、1.176 μg/μL)、不同細胞狀態(傳代后 0 h、24 h、48 h、72 h)條件下對MCF-7細胞進行電穿孔轉染,轉染48 h后,分別計算細胞的轉染效率。
1.2.6 統計學分析
利用SPSS 19.0軟件對轉染效率數值進行統計分析。相同條件下每組實驗重復3次,所有組間數據都以平均數±標準差表示,兩組間數據比較采用獨立樣本t檢驗,多組間數據比較采用單因素方差分析,P<0.05表示差異有顯著性意義。
2 結果與分析
2.1 電壓對轉染效率的影響
當電脈沖次數為2次,電脈沖時長為5 ms,質粒濃度為1.176 μg/μL,按照表1中的電壓值進行電轉實驗。由單因素方差分析可知,150 V電壓條件下獲得最大轉染效率為66.20%±2.48%;從圖1中可觀察出電壓自100 V增加至150 V時,轉染效率呈遞增趨勢,但當電壓升高至200 V時,由獨立樣本t檢驗分析可知,轉染效率顯著降低(P<0.05)。
當電壓自100 V增加至150 V時,細胞膜上形成的瞬時性孔洞不斷增多,MCF-7細胞獲取外源質粒DNA的量不斷增大,但當電壓升至175 V和200 V時,電脈沖對細胞的損傷程度較大,細胞死亡率上升,表現為轉染效率下降,從而使MCF-7細胞在150V時具有最大轉染效率為(66.20±2.48)%。

表1 不同電壓條件下人乳腺癌細胞MCF-7的電轉染率
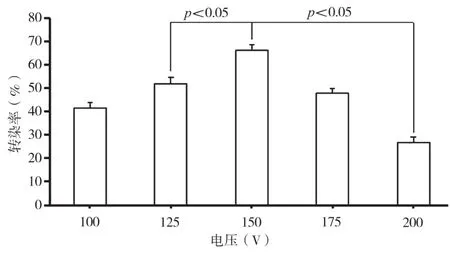
圖1 不同電壓條件對人乳腺癌細胞MCF-7電轉染效率的影響
2.2 質粒濃度對轉染效率的影響
當電脈沖次數為2次,電脈沖時長為5 ms,電壓值為150 V,按照表2中的質粒濃度進行電轉染實驗。由單因素方差分析可知,質粒濃度為1.176 μg/μL條件下獲得最大轉染效率為66.20%±2.48%;從圖2中可觀察出隨著質粒濃度的不斷提高(0.377~0.985 μg/μL),轉染效率相應提高,但當質粒濃度為1 μg/μL左右(0.985~1.176μg/μL)時,由獨立樣本t檢驗分析可知,質粒濃度的變化對細胞轉染效率的影響不顯著(P>0.05),提示電轉染時質粒濃度存在飽和性問題,1 μg/μL很可能是其閾濃度。

表2 不同質粒濃度條件下人乳腺癌細胞MCF-7的電轉染率
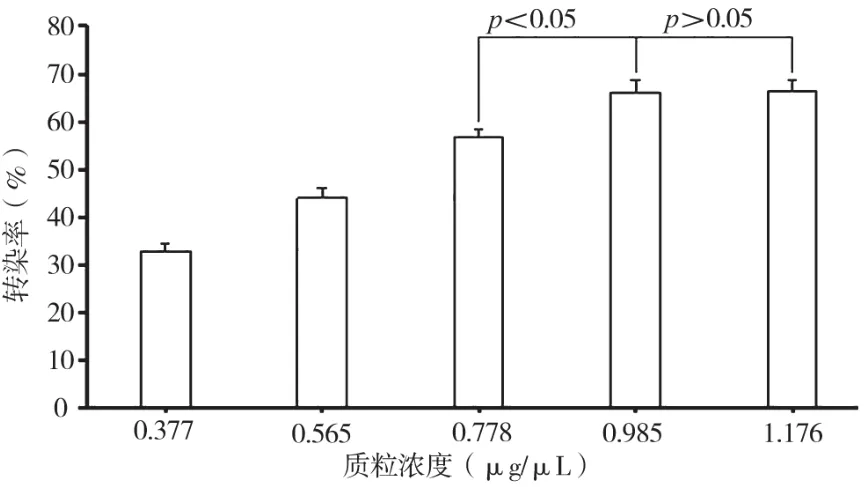
圖2 不同質粒濃度條件對人乳腺癌細胞MCF-7電轉染效率的影響
2.3 電脈沖次數對轉染效率的影響
當電脈沖時長為 5 ms,質粒濃度為 1.176 μg/μL,電壓值為150 V,按照表3中的電脈沖次數進行電轉實驗。由單因素方差分析可知,脈沖次數為2次時獲得最大轉染效率66.20%±2.48%;由圖3和獨立樣本t檢驗分析結果可知,脈沖次數為2時與1次及3次時的轉染效率差異均有顯著性意義(P<0.05)。

表3 不同脈沖次數條件下人乳腺癌細胞MCF-7的電轉染率
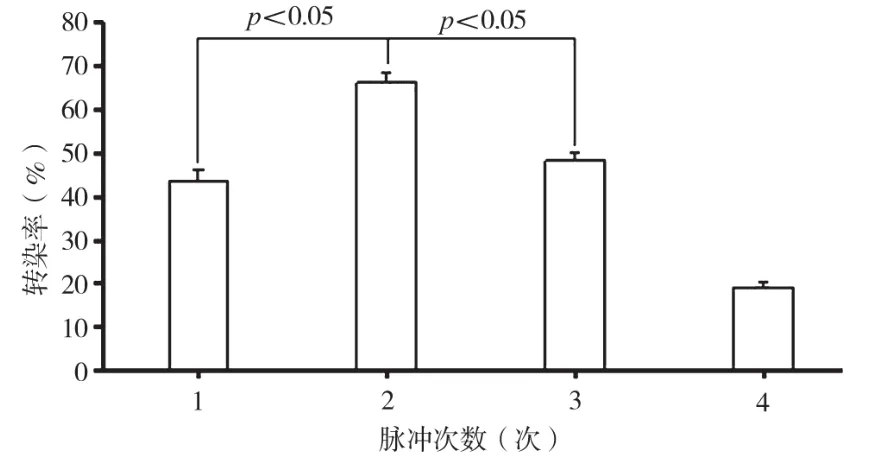
圖3 不同脈沖次數對人乳腺癌細胞MCF-7電轉染效率的影響
2.4 電脈沖時長對轉染效率的影響
當電脈沖次數為2,質粒濃度為1.176 μg/μL,電壓值為150 V,按照表4中的電脈沖時長進行電轉實驗。由單因素方差分析可知,脈沖時長為5 ms條件下獲得最大轉染效率66.20%±2.48%;由圖4和獨立樣本t檢驗分析結果可知,脈沖時長為5 ms時與2.5 ms及7.5 ms時的轉染效率差異均有顯著性意義(P<0.05)。
電脈沖時長過短或電脈沖次數過少,細胞膜上無法形成或形成的瞬時孔洞不足,導致轉染效率低下;電脈沖持續時間過長或電脈沖次數過多,電穿孔時產生熱量過多,細胞死亡率升高或后續培養時失去生物學功能。電脈沖時長為5 ms,脈沖數為2次時,電轉染MCF-7細胞可獲得最大轉染效率。

表4 不同脈沖時長下人乳腺癌細胞MCF-7的電轉染率

圖4 不同脈沖時長對人乳腺癌細胞MCF-7電轉染效率的影響
2.5 細胞狀態對轉染效率的影響
當電脈沖次數為2,脈沖時長為5 ms,質粒濃度為 1.176 μg/μL,電壓值為 150 V,按照表5中的細胞傳代后培養時間進行電轉實驗。由單因素方差分析可知,傳代時間為24 h條件下獲得最大轉染效率66.20%±2.48%;由圖5和獨立樣本t檢驗分析結果可知,傳代時間為24 h時與48 h及72 h時的轉染效率差異均有顯著性意義(P<0.05)。
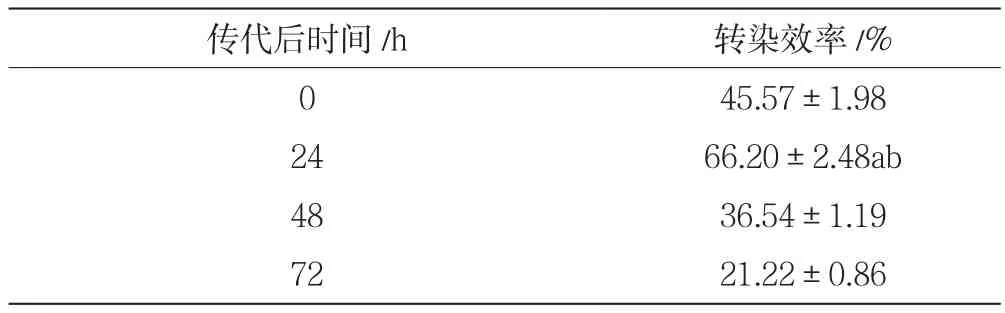
表5 不同細胞狀態下人乳腺癌細胞MCF-7的電轉染率

圖5 不同細胞狀態對人乳腺癌細胞MCF-7電轉染效率的影響
3 結論
本研究結果表明,在電壓150 V、質粒濃度1 μg/μL左右、脈沖數2次、脈沖時長5 ms、傳代時間 24 h時,電穿孔人乳腺癌細胞MCF-7可獲得最大轉染效率。本研究通過優化MCF-7細胞的電轉染條件,顯著提高了MCF-7細胞的轉染效率,為MCF-7細胞株的相關基礎研究和乳腺癌臨床靶向治療提供了實驗參數。
