原發(fā)腎上腺自然殺傷T 細胞淋巴瘤合并腎透明細胞癌1 例并文獻復習
魏雙,孫志芳
高密市人民醫(yī)院放療科,山東 高密2615000
原發(fā)性腎上腺惡性淋巴瘤(primary adrenal lymphoma,PAL)非常少見,僅占結外惡性淋巴瘤的3%[1],而其中原發(fā)腎上腺自然殺傷(natural killer,NK)T 細胞淋巴瘤更為罕見,國內在2003 年、國外在2007 年才首次報道此病[2-3]。同時性原發(fā)腎上腺NK T 細胞淋巴瘤合并腎透明細胞癌目前更是未見報道。本文報道1 例正在高密市人民醫(yī)院接受治療的同時性雙側腎上腺NK T 細胞淋巴瘤合并腎透明細胞癌病例,并進行相關文獻復習,以期提高臨床醫(yī)師對該病的認識程度。
1 病歷資料
患者男,59 歲,既往高血壓病史5 年,口服替米沙坦降壓治療;2 型糖尿病史4 年,口服瑞格列奈及二甲雙胍緩釋片降糖治療;無明確腫瘤家族史。半年前開始出現間斷性頭暈、惡心,偶有嘔吐癥狀,3 個月余前開始出現雙側腰腹部疼痛,伴有明顯乏力不適癥狀,夜間時有盜汗,食欲下降,近半年體重下降15 kg,余未訴明顯不適。患者于2020年3 月18 日就診于外院,血液檢查示低鈉低氯,皮質醇低,促腎上腺皮質激素明顯增高,考慮存在腎上腺皮質功能不全;乳酸脫氫酶(lactate dehydrogenase,LDH)319 U/L(增高);肝腎功能、尿常規(guī)、便常規(guī)、心電圖等均無明顯異常。下腹部動態(tài)增強計算機斷層掃描(CT):右腎下極見類圓形異常強化影,邊界較清楚,大小約29 mm×25 mm;雙側腎上腺見多發(fā)團片狀低密度影,邊界尚清,呈輕度強化;腹膜后未見明顯腫大的淋巴結影(圖1)。顱腦磁共振成像(MRI)、胸部及上腹部CT、骨發(fā)射型計算機斷層掃描(emission computed tomography,ECT)檢查均未見明顯異常。給予補充糖皮質激素、糾正電解質紊亂治療。待患者一般狀況改善后,于2020年3月23日在全麻下行腹腔鏡下腎癌根治性切除術(右側)+腹腔鏡下腎上腺切除術(右側)。術后病理:(右腎)腎透明細胞癌[范圍3.5 cm×2.5 cm,世界衛(wèi)生組織/國際泌尿病理協(xié)會(World Health Organization/International Association of Urological pathology,WHO/ISUP)核分級:Ⅱ~Ⅲ級],侵及局部腎被膜,未累及腎竇脂肪及輸尿管斷端,腎門血管斷端內未見癌栓;免疫組織化學:細胞角蛋白7(cytokeratin 7,CK7)(-),白細胞分化抗原10(leukocyte differentiation antigen 10,CD10)(+),CD117(-),波形蛋白(vimentin)(+/-),上皮鈣黏蛋白(E-cadherin)(+),碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ,CAⅨ)(+),配對盒基因-8(pairing box gene-8,Pax-8)(+),α-甲基酰基輔酶A 消旋酶(alpha-methylacyl-CoA racemase,AMACR)部分(+),轉錄因子結合IGHM 增強子3(transcription factor binding to IGHM enhancer 3,TFE3)(-),Ki-67(+,5%)。(右側腎上腺)非霍奇金淋巴瘤,伴大片壞死,結合形態(tài)學及免疫組織化學結果,考慮為NK T 細胞淋巴瘤,彌漫侵犯周圍組織,脈管內見瘤栓。免疫組織化學:CD56(+),T 細胞內抗原-1(T-cell intracellular antigen-1,TIA-1)(+),顆粒酶B(granzyme B)(+),CD3(+),CD20(-),CD10(-),廣譜細胞角蛋白(pan cytokeratin,CKpan)(-),Pax-8(-),突觸囊泡蛋白(synaptophysin,Syn)(-),嗜鉻顆粒蛋白A(chromogranin A,CgA)(-),CD31(+),Ki-67(+,60%),S100(-),愛潑斯坦巴爾病毒編碼核仁RNA(Epstein-Barr virus encoded small nuclear RNA,EBER)(原位雜交,+)。術后患者恢復尚可,未再有明顯B 癥狀出現,持續(xù)口服潑尼松(每日共10 mg)補充糖皮質激素,口服碳酸鈣、骨化三醇預防骨質疏松。術后未再服用降壓藥物,降糖藥物只口服瑞格列奈,血壓、血糖均在正常范圍內。患者于2020 年4 月20 日就診于高密市人民醫(yī)院放療科,血液檢查示低鈉低氯血癥,皮質醇在正常范圍內,促腎上腺皮質激素低,考慮口服激素治療有效。復查胸腹部CT:肝右葉見低密度腫物,截面約4.3 cm×2.8 cm,增強掃描輕度強化。右腎及腎上腺缺如,左側腎上腺區(qū)見低密度腫塊,截面約3.2 cm×2.4 cm,輕度強化(圖2)。行骨髓穿刺細胞學檢查,未發(fā)現明顯骨髓侵犯表現。考慮該患者疾病罕見且病情比較復雜,特邀請內分泌科、影像科、腎內科、腫瘤內科、血液科專家組織多學科診療(multidisciplinary team,MDT)討論患者病情,經充分討論考慮肝占位來源于腎癌轉移可能性大,查閱文獻得知,腎上腺淋巴瘤以雙側腎上腺同時受累多見[4]。結合患者病情,考慮左側腎上腺占位為原發(fā)NK T 細胞淋巴瘤可能性最大。故明確診斷:腎透明細胞癌術后肝轉移;雙側腎上腺NK T 細胞淋巴瘤;電解質紊亂;腎上腺皮質功能不全。根據最新相關治療指南,與家屬協(xié)商后,采用培門冬酶+奧沙利鉑+吉西他濱(P-Gemox)方案化療,肝臟轉移灶暫不予處理,密切觀察,若出現進展可考慮給予手術、介入、射頻消融等局部治療。患者已完成2個周期該方案化療,2020 年6 月4 日再次返院,復查CT 示左側腎上腺腫物及肝轉移灶較前明顯縮小(圖3),但在肝右葉再次出現新發(fā)轉移灶,與影像科醫(yī)師溝通后,根據肝轉移灶強化特點及疾病臨床特征仍考慮來源于腎癌轉移可能性大。
2 討論
2.1 病因
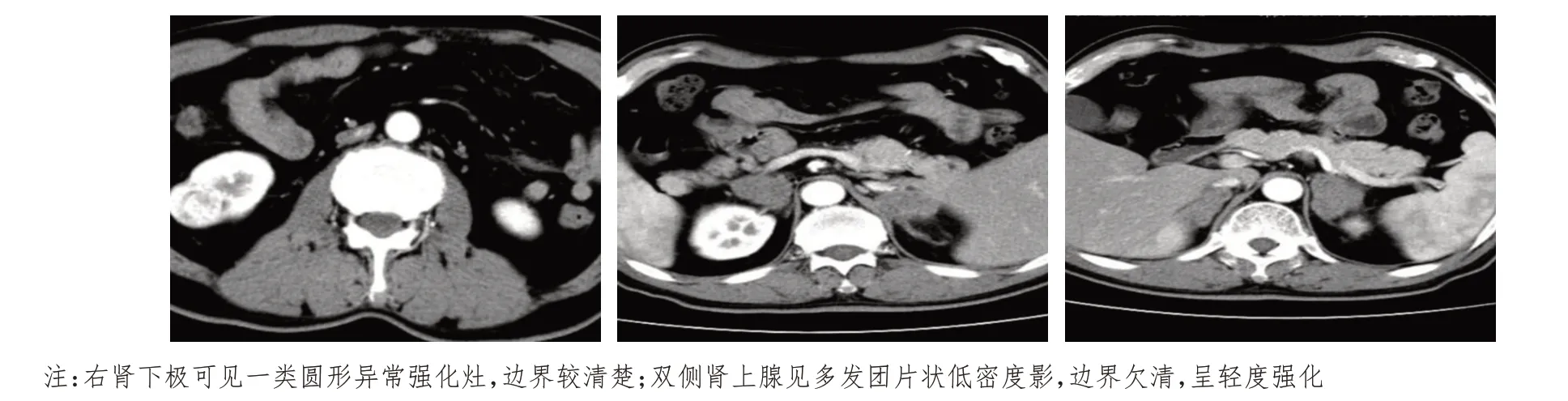
圖1 患者術前CT影像
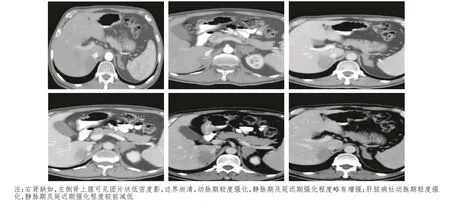
圖2 患者術后首次CT影像
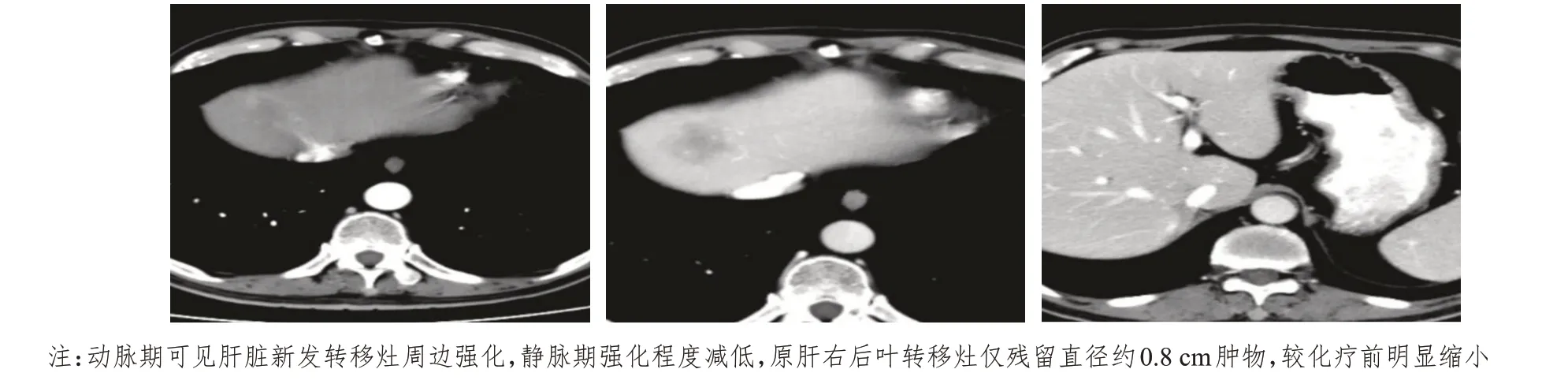
圖3 患者化療2個周期后CT影像
惡性淋巴瘤是起源于淋巴造血系統(tǒng)的惡性腫瘤,分為霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)。在中國NHL 發(fā)病率高于HL,在惡性腫瘤的發(fā)病率中居男性第9 位,女性第10 位。惡性淋巴瘤的發(fā)病原因至今仍不明確,可能與免疫功能失調、感染、家族易感性、化學因素、物理因素及生活方式等多種因素有關。鼻型結外NK T 細胞淋巴瘤起源于活化NK 細胞或更少見的細胞毒性T淋巴細胞,其發(fā)病與EB 病毒感染有明確的相關性。腎癌是原發(fā)于腎的惡性腫瘤,其中以腎透明細胞癌為最主要的病理類型,其病因也尚不明確,比較公認的危險因素為吸煙、肥胖、高血壓、高脂飲食及兩類家族遺傳學疾病[希佩爾-林道綜合征(von-Hippel-Lindau,VHL)和家族性腎乳頭狀癌]。
2.2 臨床表現和診斷
NK T細胞淋巴瘤好發(fā)于成人,男性多見,約2/3的病灶位于面部中線結構(鼻或鄂部),另1/3 位于鼻外,包括皮膚、胃腸道、睪丸和軟組織。臨床可出現淋巴瘤特有的B 癥狀:發(fā)熱、盜汗、體重減輕。本例患者既有盜汗癥狀又有明顯的體重下降,除全身癥狀外,主要表現為受累器官的表現。同時本例患者累及雙側腎上腺,除腰背部酸痛外,還出現腎上腺皮質功能不全的表現,低鈉低氯血癥,高血壓、高血糖病史多年,目前已停用降壓藥物,降糖藥物減量,均考慮為腎上腺皮質功能不全引起。腎上腺的受累在惡性腫瘤中比較常見,但腎上腺功能不全在惡性腫瘤的腎上腺受累中并不常見,因為少量的腎上腺功能儲備足以維持生命。既往研究報道,在127 例NHL 患者中,只有4 例患者有腎上腺功能不全[5],但積極處理腎上腺功能不全會改善生活質量[6]。因此在臨床工作中要重視對腎上腺功能的評估,特別是雙側腎上腺受累的患者,要及時改善患者的腎上腺功能。若患者以腎上腺皮質功能不全就診也要考慮到惡性腫瘤的可能性。該病的初始發(fā)現多依賴影像學檢查,周良平等[7]研究發(fā)現,CT 上腎上腺淋巴瘤呈浸潤性生長,多表現為腎上腺邊緣清楚的軟組織腫塊,形態(tài)可表現為圓形、橢圓形或不規(guī)則形。而對于其強化特點,臧歡歡等[8]研究發(fā)現,腎上腺淋巴瘤為乏血供或少血供腫瘤,CT 增強檢查動脈期僅輕度強化,隨著對比劑逐漸擴散,靜脈期可呈均勻的輕中度強化,延遲期持續(xù)強化。本例患者左側腎上腺占位強化特點與之較符合。病理及免疫組織化學結果仍是確診的金標準,結外NK T 細胞淋巴瘤以血管侵犯和血管破壞性浸潤為特征,CD3 的表達是NK T 細胞淋巴瘤區(qū)別于其他淋巴瘤的指標,CD56、細胞毒性分子、NK 細胞及T 細胞相關抗原,如CD4、CD8 等均可為陽性。因該病與EB 病毒感染有密切相關性,故幾乎所有腫瘤細胞均表現為EBER 陽性[9]。根據該患者腎上腺免疫組織化學結果,考慮符合該疾病的診斷。
腎透明細胞癌臨床上常表現為三聯(lián)征:血尿、腰痛及腹部腫塊,但隨著人們健康意識的提高,三聯(lián)征同時出現的患者已不多見。本例患者未出現血尿,也未觸及腹部腫塊。腎透明細胞癌的發(fā)現也依賴于影像學檢查,腹部B 超多作為首選檢查手段。B 超下腫物常呈邊界清晰的實性腫物,可檢出豐富的血流信號。對于增強CT 檢查,動脈期多表現為不均質強化,靜脈期及平衡期強化程度降低,低于周圍腎實質,即典型的“快進快出”式強化[10]。本病最終也要依靠病理診斷確診。本例患者肝臟轉移灶動脈期表現為點片狀不均勻強化,靜脈期及延遲期強化程度較前減低,考慮符合腎癌轉移影像學表現。但患者進行2 個周期化療后復查CT 示原肝轉移灶及左側腎上腺病灶均顯著縮小,根據臨床,更傾向于來源于腎上腺轉移,最終診斷需依賴病理學檢查,與家屬協(xié)商后暫不行病理學檢查。
2.3 治療和預后
NK T 細胞淋巴瘤根據原發(fā)部位的不同分為上呼吸消化道原發(fā)NK T 細胞淋巴瘤和非上呼吸消化道原發(fā)NK T 細胞淋巴瘤。原發(fā)于上呼吸消化道的NK T 細胞淋巴瘤早期應以局部擴大野的放療為主,有高危因素的患者可加用全身化療。而原發(fā)于非上呼吸消化道的NK T 細胞淋巴瘤應以全身化療為主,同時配合受累部位的局部放療(序貫或夾心放化療)。而既往研究證實,傳統(tǒng)長春新堿+環(huán)磷酰胺+表柔比星+潑尼松(CHOP)或CHOPlike 化療方案對該類疾病療效不佳,可能與腫瘤細胞高表達P-糖蛋白有關[11-12]。近年來有研究表明,以門冬酰胺酶為基礎的化療方案對該病療效優(yōu)于CHOP 方 案。Wang 等[13]采 用P-Gemox 化 療 方 案 聯(lián)合放療治療35 例早期結外NK T 細胞淋巴瘤患者,完全緩解(CR)率為80.0%,總有效率達94.3%,2 年無進展生存率為77.1%,生存率為82.9%。一項多中心研究同樣獲得類似的結果,CR 率為88.6%,總有效率為95.2%,3 年無進展生存率和生存率分別為72.8%、73.0%[14]。對于初治晚期或復發(fā)難治性患者,應以全身化療為主,但療效差,在化療獲得緩解后,應考慮自體造血干細胞移植的可行性。隨著對該病發(fā)病機制的研究及靶向治療、免疫治療的興起,NK T 細胞淋巴瘤在免疫治療、靶向治療方面也有了長足的發(fā)展。如:針對CD38、CD30、CD56、程序性死亡受體1(programmed cell death 1,PDCD1,也稱PD-1)/程序性死亡受體配體1(programmed cell death 1 ligand 1,PDCD1LG1,也 稱PD-L1)等的單克隆抗體;針對血小板源性生長因子、雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)信號通路的小分子抑制劑;EB病毒特異性細胞毒性T 細胞以及表觀遺傳學藥物、免疫抑制劑等。目前多采用國際淋巴瘤預后指數(international lymphoma prognosis index,IPI)評估淋巴瘤患者預后,但其對NK T 細胞淋巴瘤預后的預測不夠理想。目前多采用EB 病毒DNA 載量的自然殺傷淋巴瘤預后指數(prognostic index of natural killer lymphoma with EBV DNA,PINK-E)預后評分系統(tǒng)和NK T 細胞淋巴瘤列線圖模型對其進行風險分層。本例患者為非鼻型且EBV-DNA(+),屬于中危組,考慮預后欠佳。近年來有學者根據血清代謝組學,建立了包括丙氨酸、天冬氨酸、谷氨酸和琥珀酸在內的天冬酰胺酶相關代謝(asparaginase-associated metabolic,AsPm)評分,可有效預測患者對基于天冬酰胺酶的治療方案的反應[15]。隨著臨床試驗的不斷開展,相信NK T 細胞淋巴瘤患者的預后會越來越好。
局限性腎透明細胞癌是以手術為主要治療手段的疾病,根據疾病分期及患者情況,可選擇根治性腎切除術或保留腎單位的腎切除術。局部治療方法包括冷凍治療、射頻消融、高強度聚焦超聲等。有時為縮小腫瘤或減少出血,介入也是可選擇的手段之一。單純放療或化療對腎癌患者療效不佳,故不作為首選。而腎透明細胞癌的全身治療以分子靶向治療、免疫治療為主。近年來腎癌的分子靶向藥物逐漸應用于臨床,如索拉非尼、舒尼替尼、帕唑帕尼、貝伐珠單抗、依維莫司、卡博替尼等,均為腎癌患者的治療帶來福音。同樣的,隨著免疫治療的不斷發(fā)展,以納武單抗為代表的免疫治療藥物更是為腎癌患者帶來更多的治療選擇。對于早期局限性腎癌,腫瘤分期、WHO/ISUP核分級、病理類型均是預后的獨立影響因素,而有超過20%的局限性腎癌患者接受手術后會發(fā)生轉移[16]。Staehler 等[17]報道了88 例腎癌合并肝轉移患者,其中66 例行轉移性肝切除術,術后5 年的總生存率為62.2%,中位生存時間為142 個月;未行手術的患者5 年中位生存時間為27 個月。本例患者術前腎臟病灶局限,分期較早(T1期),但術后1 個月復查時即出現肝轉移,更說明了該病存在較強的腫瘤異質性及侵襲性。對于發(fā)生遠處轉移的患者,尤其是肝轉移,臨床上應根據患者的身體狀況選擇更加積極的治療措施,以延長患者的生存期。
原發(fā)腎上腺NK T 細胞淋巴瘤在臨床上屬于罕見病,臨床表現多樣,無特異性腫瘤標志物可作為疾病篩查指標,但病情發(fā)展快,預后差,在臨床工作中應提高對該疾病的認識,避免漏診、誤診。

