氣相色譜-質譜法測定綠茶中草甘膦和氨甲基膦酸殘留量
楊亞琴,馮書惠,胡永建,李圓圓,王會鋒,劉進璽,鐘紅艦
氣相色譜-質譜法測定綠茶中草甘膦和氨甲基膦酸殘留量
楊亞琴,馮書惠,胡永建,李圓圓,王會鋒,劉進璽,鐘紅艦*
河南省農業科學院農業質量標準與檢測技術研究所,農業農村部農產品質量安全風險評估實驗室(鄭州),河南 鄭州 450002
采用氣相色譜-質譜聯用建立了一種檢測綠茶中草甘膦及其代謝物氨甲基膦酸殘留量的測定方法。綠茶樣品用水提取,經二氯甲烷液液分配和陽離子交換/反相吸附復合固相萃取柱凈化,與三氟乙酸酐和七氟丁醇進行衍生化反應后,由氣相色譜-質譜聯用儀進行檢測。該方法草甘膦定量限為0.05?mg·kg-1,在2~100?ng·mL-1濃度范圍內呈現良好線性(R=0.999?3),氨甲基膦酸的定量限為0.02?mg·kg-1,在1~100?ng·mL-1濃度范圍內呈現良好線性(R=0.999?2)。綠茶樣品草甘膦添加濃度為0.25?mg·kg-1和0.50?mg·kg-1時,其平均回收率分別為90.8%和93.2%,相對標準偏差分別為4.93%和6.74%,氨甲基膦酸添加濃度為0.10?mg·kg-1和0.20?mg·kg-1時,其平均回收率分別為85.8%和95.4%,相對標準偏差分別為10.5%和5.16%。該方法凈化效果好,雜質干擾小,回收率高,可滿足綠茶中草甘膦及其代謝物氨甲基膦酸的殘留檢測要求。
氣相色譜-質譜法;草甘膦;氨甲基膦酸;綠茶
草甘膦(Glyphosate,PMG)作為一種廣譜、非選擇性、無殘留、苗后傳導性除草劑,因其價格低廉、除草性優良,被廣泛應用于農田、果園、茶園等。1996年以來,隨著大豆、玉米和油菜等抗草甘膦轉基因作物的問世和推廣應用,草甘膦的使用出現了迅猛增長[1]。雖然草甘膦毒性較低,但長期使用會影響土壤正常微生物的繁殖,是潛在的環境生態危險源。而且,草甘膦能夠在環境和生物體中富集,最終通過食物鏈進入人體,對身體健康造成危害[2]。中國是世界上茶葉種植面積和產量最大的國家,茶葉作為我國文化傳承的特色經濟作物,具有較高的社會價值和較廣的消費市場。近年來,有關茶葉中草甘膦及其代謝物氨甲基膦酸(Aminomethyl phosphonic acid,AMPA)殘留量超標的報道時有發生。我國食品安全國家標準GB 2763—2016中,明確規定了茶葉中草甘膦最大殘留限量為1?mg·kg-1[3]。
由于草甘膦和氨甲基膦酸均呈弱酸性,極性較強,易溶于水,難溶于有機溶劑,且揮發性低,難以氣化,缺少生色基團,對其殘留量分析的難度比較大。文獻報道的草甘膦常用檢測方法有分光光度法[4]、高效液相色譜法[5]、氣相色譜法[6]、離子色譜法[7]、氣相色譜-串聯質譜法[8]、高效液相色譜-串聯質譜法[9]、毛細管電泳法[10]、電化學分析法[11]等。國內對于茶葉樣品中草甘膦殘留量的檢測方法則多為高效液相色譜-串聯質譜法[9,12-15],主要采用柱前衍生使草甘膦及其代謝物氨甲基膦酸與氯甲酸-9-芴基甲酯(FMOC-Cl)反應形成熒光衍生物以增加極性被分析物的色譜保留。
氣相色譜-質譜聯用儀對草甘膦分析具有較大的優勢,草甘膦及其代謝物氨甲基膦酸通過與三氟乙酸酐-七氟丁醇等衍生試劑反應后,可生成易揮發物質用于氣相色譜分析。毛細管色譜柱良好的分離能力結合質譜的高靈敏度、強選擇性等特點,使得氣相色譜-質譜聯用法成為測定草甘膦殘留量的有效方法之一。我國于2009年發布了植物性產品中草甘膦殘留量測定的國家標準(GB/T 23750—2009)[16],然而氣相色譜-質譜法測定茶葉中草甘膦殘留量卻鮮有報道。本文針對茶葉樣品基質復雜的特點,擬采用純水提取綠茶中草甘膦及其代謝物氨甲基膦酸,經二氯甲烷液液分配和陽離子交換/反相吸附復合固相萃取柱凈化,三氟乙酸酐-七氟丁醇衍生化反應后,通過氣相色譜-質譜聯用儀進行定性定量分析。該方法操作便捷、雜質干擾小、回收率和靈敏度均可達到農藥殘留分析要求,易于在茶葉分析檢測實驗室中推廣應用。
1 材料與方法
1.1 儀器與試劑
Shimadzu GCMS-QP2010 Plus型氣相色譜-質譜聯用儀(日本島津公司);LabTech EG20A plus型微控數顯電熱板(北京萊伯泰科儀器股份有限公司);KQ-500DE型數控超聲波清洗器(昆山市超聲儀器有限公司);飛鴿GL-21B型高速冷凍離心機(上海安亭科學儀器廠);SK-1快速混勻器(金壇市白塔新寶儀器廠)。
草甘膦、氨甲基膦酸標準品,德國Dr. Ehrenstorfer公司;二氯甲烷:色譜純,上海麥克林生化科技有限公司;乙酸乙酯、甲醇:色譜純,德國默克股份兩合公司;三氟乙酸酐:分析純,北京百靈威科技有限公司(–20℃低溫儲存);七氟丁醇:分析純,上海麥克林生化科技有限公司(–20℃低溫儲存);濃鹽酸(12?mol·L-1),煙臺市雙雙化工有限公司;檸檬醛:分析純,阿法埃莎(中國)化學有限公司;試驗用水為Milli-Q超純水。
PCX固相萃取小柱(150?mg/3?mL)、HLB固相萃取小柱(150?mg/3?mL),河北津楊濾材有限公司;茶葉樣品均購于市場。
1.2 樣品前處理
提取:稱取2?g綠茶樣品,放入50?mL具塞塑料離心管中,加入20?mL水,渦旋混勻1?min,浸泡過夜,室溫下超聲提取10?min,5?000?r·min-1離心5?min,將上層清液轉移至另一離心管,加入50?μL濃鹽酸,混勻后加入5?mL二氯甲烷,渦旋2?min,5?000?r·min-1離心5?min,棄去下層二氯甲烷相,取上層清液待過柱。
凈化:PCX/HLB復合固相萃取小柱經3?mL甲醇、3?mL水活化后,緩慢加入5?mL上述提取液,收集流出液于50?mL燒杯中,再用3?mL水淋洗復合固相萃取小柱,合并流出液,于電熱板上50℃蒸干。準確加入1?mL酸化甲醇水溶液(160?mL水、2.7?mL濃鹽酸、40?mL甲醇混合液)于燒杯中,超聲復溶后,通過0.45?μm有機濾膜,收集該凈化提取液于小瓶中待衍生。
衍生化:取1.6?mL衍生試劑(三氟乙酸酐∶七氟丁醇=2∶1)于4?mL衍生小瓶,用移液器在衍生試劑液面下緩慢加入50?μL凈化提取液,加蓋混勻后立即放入冰水浴中冷卻,然后于90℃條件下衍生反應60?min,期間每隔15?min充分搖勻1次。
衍生反應結束后,取出衍生小瓶,用氮氣吹干,準確加入500?μL 0.2%檸檬醛乙酸乙酯溶液,加蓋超聲1?min,渦勻轉移至上機小瓶中待測定。
1.3 氣相色譜-質譜條件
色譜柱:DB-5MS(30?m×0.25?mm×0.25?μm);載氣:氦氣(純度≥99.999%),流速1.0?mL·min-1;升溫程序:80℃保持1.5?min,以30℃·min-1升至260℃保持2?min,再以30℃·min-1升至300℃保持2?min;進樣口溫度:200℃;進樣方式:無分流進樣;電離方式:EI,70?eV;進樣量:1?μL;接口溫度:270℃;離子源溫度:250℃;溶劑延遲:4?min;測定方式:選擇離子監測法(SIM)。草甘膦和氨甲基膦酸衍生化產物的質譜采集信息見表1。
以上機液濃度50?ng·mL-1為例,根據上述儀器條件,所得草甘膦和氨甲基膦酸標準溶液衍生化產物的監測離子總離子流色譜圖峰型對稱,保留時間適宜,相較于草甘膦,氨甲基膦酸衍生化產物的色譜峰強度明顯較高(圖1)。
2 結果與討論
2.1 前處理條件優化
草甘膦和氨甲基膦酸均為強極性化合物,通常采用純水進行提取[6,15-17]。由于綠茶樣品富含蛋白質、色素、氨基酸、多酚類等雜質,所得純水提取液成分復雜。為有效去除基質中雜質干擾,本文采用向純水提取液中加入鹽酸沉淀蛋白后,用二氯甲烷去除提取液中脂溶性雜質。對比文獻及標準方法中提及的CAX陽離子交換柱,選用PCX/HLB復合固相萃取小柱可更好地去除樣品中色素等雜質干擾,且直接收集凈化流出液可以有效避免常規方法[16]選用洗脫液進行淋洗時目標化合物隨雜質共同流出造成的回收率偏低。
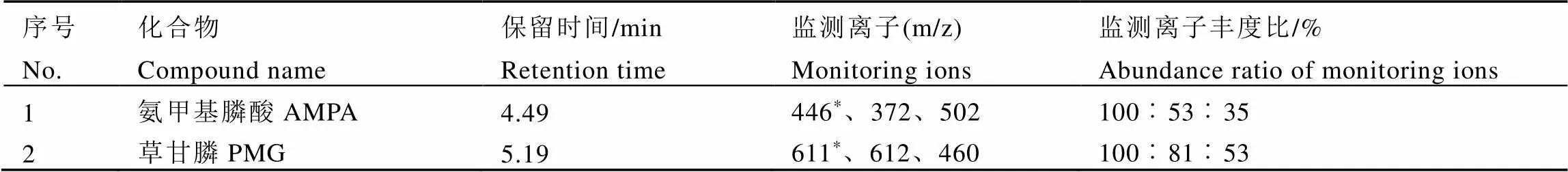
表1 草甘膦和氨甲基膦酸衍生化產物的保留時間及監測離子信息
注:*:定量離子
Note: *: quantitative ions
在衍生化反應條件方面,采用正交試驗對衍生過程中的3個因素,即因素A(三氟乙酸酐∶七氟丁醇)、因素B(衍生反應溫度)、因素C(衍生反應時間)進行優化(表2)。待衍生溶液為草甘膦和氨甲基膦酸的混合標準溶液,衍生后所對應草甘膦、氨甲基膦酸的上機液濃度分別為50?ng·mL-1、20?ng·mL-1。衍生條件正交試驗設計方案與試驗結果見表3。
以相同水平對應定量離子峰面積之和Ki的極差R來分別評價不同因素對草甘膦、氨甲基膦酸衍生反應的影響。結果顯示,根據極差R大小,各因素對草甘膦衍生反應的影響作用由大到小為A>C>B,最佳衍生條件為A3B3C2;各因素對氨甲基膦酸衍生反應的影響作用由大到小為A>B>C,最佳衍生條件為A3B2C3。綜合考慮草甘膦和氨甲基膦酸的衍生反應效果,本文最終選擇衍生條件A3B2C2,即三氟乙酸酐∶七氟丁醇=2∶1,反應溫度90℃,反應時間60?min為最佳衍生條件。
2.2 線性方程和檢出限
將草甘膦和氨甲基膦酸用空白綠茶基質液逐級稀釋配制成質量濃度為1.00、0.40、0.20、0.10、0.04、0.02、0.01?μg·mL-1的混合標準溶液,按照本文1.2章節進行衍生,所得衍生化產物上機液質量濃度分別為100、40、20、10、4、2、1?ng·mL-1。以上機液濃度為橫坐標(x,ng·mL-1),定量離子峰面積為縱坐標建立基質標準曲線(圖2)。結果表明,在2~100?ng·mL-1濃度范圍內,草甘膦衍生化產物呈良好線性,其線性方程=11.953-15.781,相關系數R=0.999?3;在1~100?ng·mL-1質量濃度范圍內,氨甲基膦酸衍生化產物呈良好線性,其線性方程=102.35+17.189,相關系數R=0.999?2。
采用向空白綠茶樣品中逐級降低加標液濃度的方法來確定檢出限(LOD)和定量限(LOQ)。以3倍信噪比(S/N=3)對應的目標物濃度作為檢出限,以10倍信噪比(S/N=10)對應的目標物濃度作為定量限,則氨甲基膦酸的方法檢出限為0.008?mg·kg-1,定量限為0.02?mg·kg-1;草甘膦的方法檢出限為0.02?mg·kg-1,定量限為0.05?mg·kg-1。
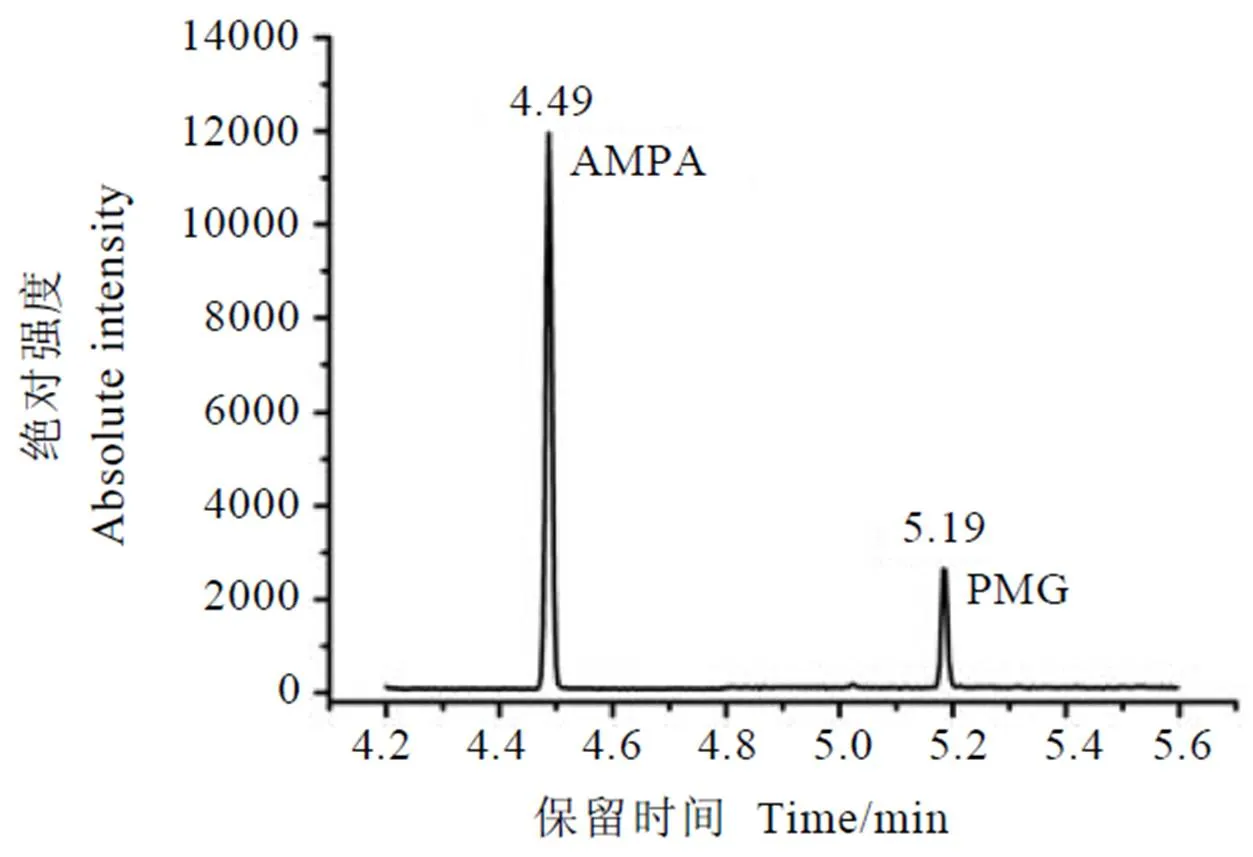
注:AMPA為氨甲基膦酸,PMG為草甘膦。下同
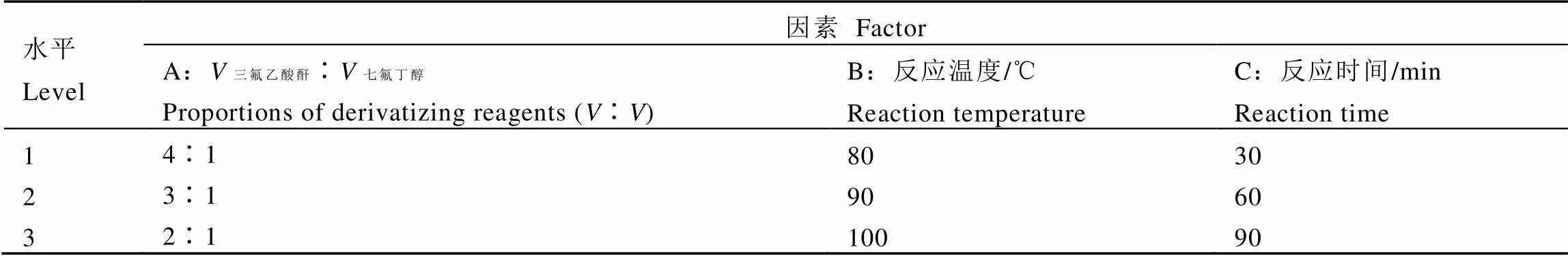
表2 衍生條件正交試驗因素水平表
注:Ki表示相同水平對應定量離子峰面積之和,其中i代表1、2、3等3個水平;R表示同一因素下不同水平Ki的極差
Note: Ki: the sum of corresponding quantitative ion peak areas at the same level (i=1, 2, 3). R: the difference between the maximum and minimum values of Kiat three different levels under each factor
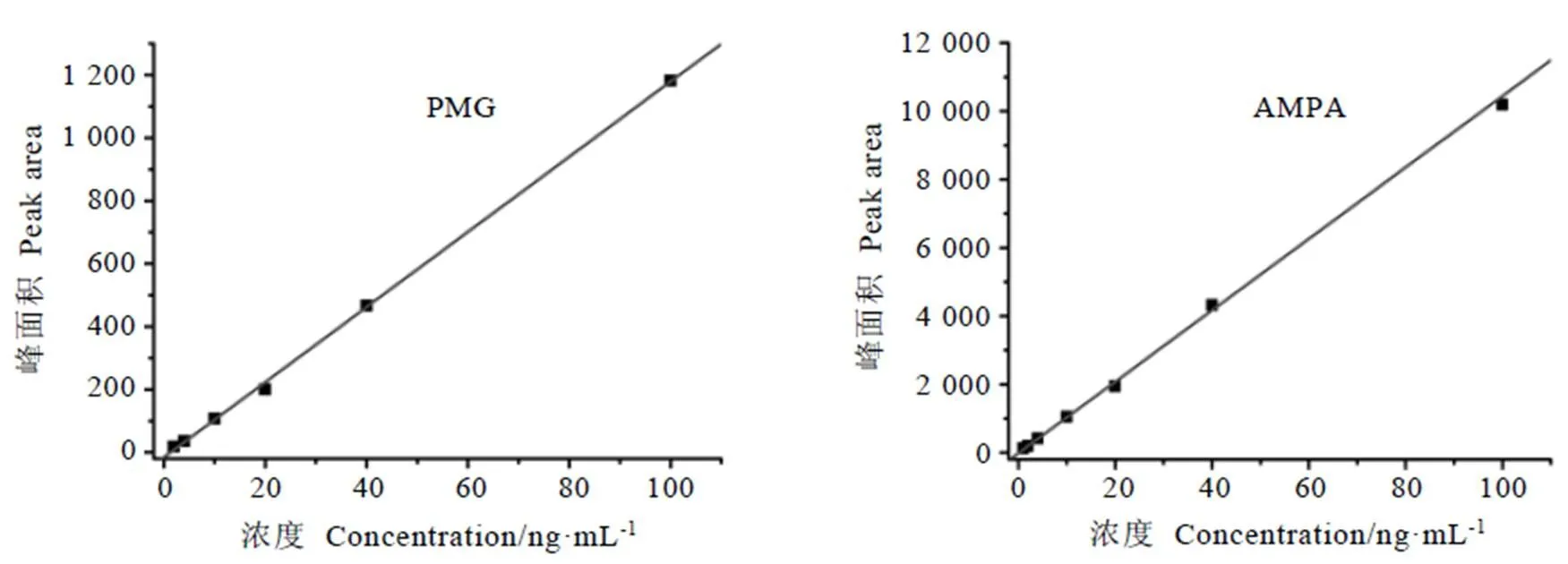
圖2 草甘膦和氨甲基膦酸衍生化產物的綠茶基質標準曲線
2.3 方法精密度與回收率
選取6個草甘膦、氨甲基膦酸添加濃度分別為1.00?mg·kg-1和0.40?mg·kg-1的空白綠茶加標樣品,按照1.2章節進行樣品前處理,所得草甘膦、氨甲基膦酸的上機液濃度分別為50?ng·mL-1和20?ng·mL-1。氣相色譜-質譜聯用儀測得6個綠茶添加樣品草甘膦衍生化產物的定量離子峰面積分別為454、430、482、508、480、456,其相對標準偏差RSD為5.83%;氨甲基膦酸衍生化產物的定量離子峰面積分別為1?818、1?979、1?802、1?949、1?904、1?885,其相對標準偏差RSD為3.71%,表明方法具有較好的精密度。
選取空白綠茶樣品,在方法線性范圍內對綠茶樣品進行添加回收試驗。草甘膦添加濃度分別為0.25?mg·kg-1和0.50?mg·kg-1,氨甲基膦酸添加濃度分別為0.10?mg·kg-1和0.20?mg·kg-1,其平均回收率范圍為85.8%~95.4%,相對標準偏差為4.93%~10.5%(表4),表明方法的準確度較好。圖3為空白綠茶樣品中添加濃度為0.25?mg·kg-1草甘膦和0.10?mg·kg-1氨甲基膦酸衍生化產物的監測離子色譜圖。

表4 草甘膦和氨甲基膦酸綠茶樣品中的回收率和相對標準偏差(n=4)

圖3 添加草甘膦(0.25?mg·kg-1)和氨甲基膦酸(0.10?mg·kg-1)綠茶樣品衍生化產物的監測離子色譜圖
2.4 實際樣品檢測
應用本文所建立的方法對市場購買的51個綠茶樣品進行測定。結果顯示,有16個樣品檢出草甘膦,其含量范圍在0.085~0.49?mg·kg-1;除草甘膦含量最高(0.49?mg·kg-1)的樣品同時檢出氨甲基膦酸(0.026?mg·kg-1)外,其余樣品均未檢出氨甲基膦酸。該樣品草甘膦及其代謝物氨甲基膦酸含量的測定結果總和以草甘膦計為0.53?mg·kg-1,小于國家規定草甘膦在茶葉中的最大殘留限量(1?mg·kg-1)。
3 結論
本文采用氣相色譜-質譜聯用儀建立了綠茶中草甘膦及其代謝物氨甲基膦酸的殘留測定方法,通過衍生反應使強極性的草甘膦和氨甲基膦酸生成能被氣相色譜柱分離測定的衍生化產物。試驗結果顯示,該方法雜質干擾小、重現性好、準確度高、檢出限低,可滿足綠茶中草甘膦及其代謝物氨甲基膦酸的殘留檢測要求。
[1] 陳世國, 強勝, 毛嬋娟. 草甘膦的作用機制和抗性研究進展[J]. 植物保護, 2017, 43(2): 17-24. Chen S G, Qiang S, Mao C J. Mechanism of action of glyphosate and research advances in glyphosate resistance [J]. Plant Protection, 2017, 43(2): 17-24.
[2] 周垂帆, 李瑩, 張曉勇, 等. 草甘膦毒性研究進展[J]. 生態環境學報, 2013, 22(10): 1737-1743. Zhou C F, Li Y, Zhang X Y, et al. Research advance in ecotoxicity of glyphosate [J]. Ecology and Environmental Sciences, 2013, 22(10): 1737-1743.
[3] 中華人民共和國國家衛生和計劃生育委員會. 食品安全國家標準食品中農藥最大殘留限量: GB 2763—2016[S]. 北京: 中國標準出版社, 2016.National Health and Family Planning Commission of PRC. National food safety standard—maximum residue limits for pesticides in food: GB 2763—2016 [S]. Beijing: Standards Press of China, 2016
[4] 李國鵬, 周彩榮, 石曉華, 等. 分光光度法測定草甘膦生產廢水中草甘膦和甘氨酸的含量[J]. 鄭州大學學報(理學版), 2012, 44(2): 81-84. Li G P, Zhou C R, Shi X H, et al. Determination of the Amount of glyphosate and glycine in the wastewater of glyphosate produced by spectrophotometry [J]. Journal of Zhengzhou University (Natural Science Edition), 2012, 44(2): 81-84.
[5] 王聰, 劉穎超, 龐民好, 等. 高效液相色譜柱后衍生法測定農田溝渠水中草甘膦殘留[J]. 植物保護, 2012, 38(5): 96-99. Wang C, Liu Y C, Pang M H, et al. Determination of glyphosate in the water of farmland ditch by high performance liquid chromatography-post column derivation [J]. Plant Protection, 2012, 38(5): 96-99.
[6] Zhang W D, Feng Y R, Ma L, et al. A method for determining glyphosate and its metabolite aminomethyl phosphonic acid by gas chromatography-flame photometric detection [J]. Journal of Chromatography A, 2019, 1589: 116-121.
[7] You J, Koropchak J A. Condensation nucleation light scattering detection with ion chromatography for direct determination of glyphosate and its metabolite in water [J]. Journal of Chromatography A, 2003, 989(2): 231-238.
[8] 羅彤, 付文雯, 郭盧云, 等. QuEChERS-氣相色譜-三重四級桿串聯質譜法測定茶葉中草甘膦和氨甲基膦酸殘留[J]. 食品研究與開發, 2018, 39(14): 153-158. Luo T, Fu W W, Guo L Y, et al. Determination of glyphosate and aminomethyl phosphonic acid residues in tea by quechers and gas chromatography-triple quadrupole mass spectrometry [J]. Food Research and Development, 2018, 39(14): 153-158.
[9] 諸力, 陳紅平, 周蘇娟, 等. 超高效液相色譜-串聯質譜法測定不同茶葉中草甘膦、氨甲基膦酸及草銨膦的殘留[J]. 分析化學, 2015, 43(2): 271-276. Zhu L, Chen H P, Zhou S J, et al. Determination of glyphosate,aminomethyl phosphonic acid and glufosinate in different teas by ultra performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2015, 43(2): 271-276.
[10] 曹麗偉, 梁絲柳, 譚小芳, 等. 毛細管電泳-激光誘導熒光法測定草甘膦、草胺膦及氨甲基膦酸[J]. 色譜, 2012, 30(12): 1295-1300. Cao L W, Liang S L, Tan X F, et al. Capillary electrophoresis analysis for glyphosate, glufosinate and aminomethylphosphonic acid with laser-induced fluorescence detection [J]. Chinese Journal of Chromatography, 2012, 30(12): 1295-1300.
[11] 張超, 李騰飛, 趙風年, 等. 分子印跡電化學傳感器的制備及其快速檢測飲水中草甘膦殘留的應用研究[J]. 分析測試學報, 2016, 35(12): 1542-1547. Zhang C, Li T F, Zhao F N, et al. Preparation of an electrochemical sensor based on molecularly imprinted polymer and its application in determination of glyphosate residues in water samples [J]. Journal of Instrumental Analysis, 2016, 35(12): 1542-1547.
[12] 吳曉剛, 陳孝權, 肖海軍, 等. 柱前衍生-超高效液相色譜-串聯質譜法同時檢測茶葉中草甘膦和草銨膦的殘留量[J]. 色譜, 2015, 33(10): 1090-1096. Wu X G, Chen X Q, Xiao H J, et al. Simultaneous determination of glyphosate and glufosinateammonium residues in tea by ultra performance liquid chromatography-tandem mass spectrometry coupled with pre-column derivatization [J]. Chinese Journal of Chromatography, 2015, 33(10): 1090-1096.
[13] 陳磊. HPLC-MS/MS同時檢測烏龍茶中草銨膦、草甘膦和氨甲基膦酸殘留[J]. 茶葉科學技術, 2014(1): 21-27. Chen L. Simultaneous detection of glufosinate, glyphosate and (aminomethyl) phosphonic acid in Oolong tea by HPLC-MS/MS [J]. Acta Tea Sinica, 2014(1): 21-27.
[14] 劉正才, 蔡春平, 林永輝, 等. 分散固相萃取/液相色譜-串聯質譜法測定茶葉中草甘膦及其代謝物氨甲基膦酸的殘留量[J]. 分析測試學報, 2015, 34(3): 335-340. Liu Z C, Cai C P, Lin Y H, et al. Determination of glyphosate and aminomethylphosphonic acid residues in tea by dispersive solid-phase extraction combined with high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Instrumental Analysis, 2015, 34(3): 335-340.
[15] 葉美君, 陸小磊, 劉相真, 等. 柱前衍生-超高效液相色譜-串聯質譜測定茶葉中草甘膦、草銨膦及主要代謝物氨甲基膦酸殘留[J]. 色譜, 2018, 36(9): 873-879. Ye M J, Lu X L, Liu X Z, et al. Determination of glyphosate, glufosinate, and main metabolite aminomethylphosphonic acid residues in dry tea using ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2018, 36(9): 873-879.
[16] 中華人民共和國國家質量監督檢驗檢疫總局. 植物性產品中草甘膦殘留量的測定氣相色譜-質譜法: GB/T 23750—2009[S]. 北京: 中國標準出版社, 2009.General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination of glyphosate residues in plant —GC-MS method: GB/T 23750—2009 [S]. Beijing: Standards Press of China, 2009.
[17] Lars C. Schrübbers, Mario Masís-Mora, Elizabeth Carazo Rojas, et al. Analysis of glyphosate and aminomethylphosphonic acid in leaves from Coffeaarabica using high performance liquid chromatography with quadrupole mass spectrometry detection [J]. Talanta, 2016, 146: 609-620.
Determination of Glyphosate and Aminomethyl Phosphonic Acid Residue in Green Tea by Gas Chromatography-Mass Spectrometry
YANG Yaqin, FENG Shuhui, HU Yongjian, LI Yuanyuan, WANG Huifeng,LIU Jinxi, ZHONG Hongjian*
Institute of Agricultural Quality Standards and Testing Technology, Henan Academy of Agricultural Sciences; Laboratory of Quality & Safety Risk Assessment for Agro-Products (Zhengzhou), Ministry of Agriculture and Rural Affairs, Zhengzhou 450002, China
An efficient method for the determination of glyphosate and its metabolite aminomethyl phosphonic acid (AMPA) in green tea was developed based on gas chromatography-mass spectrometry (GC-MS). Green tea samples were extracted with water, preliminary purified by dichloromethane and followed by purification with PCX and HLB combined solid phase extraction columns, derived with trifluoroacetic anhydride (TFAA) and 2,2,3,3,4,4,4-heptafluoro-1-butanol (HFB), then determined by GC-MS. For glyphosate, the limit of quantification (LOQ) was 0.05?mg·kg-1, showing good linearity with coefficientR=0.999?3 in the concentration range from 2-100?ng·mL-1. For AMPA, itsLOQ was 0.02?mg·kg-1, showing good linearity with coefficientR=0.999?2 in the concentration range from 1-100?ng·mL-1. At the spiked levels of 0.25?mg·kg-1and 0.50?mg·kg-1, the average recoveries of glyphosate in green tea were 90.8% and 93.2%, with relative standard deviation (RSD) of 4.93% and 6.74%. At the spiked levels of 0.10?mg·kg-1and 0.20?mg·kg-1, the average recoveries of AMPA in green tea were 85.8% and 95.4%, with RSD of 10.5% and 5.16%. The proper impurity purification, small impurity interference and high recovery rate made this method suitable for residue detection of glyphosate and its metabolite APMA in green tea.
chromatography-mass spectrometry, glyphosate, aminomethyl phosphonic acid, green tea
S571.1;S482
A
1000-369X(2020)01-125-08
2019-04-07
2019-08-07
河南省農業科學院科研發展專項資金項目(YNK201710609、YNK20177513)
楊亞琴,女,助理研究員,主要從事農產品質量安全檢測技術及風險評估研究。
80456811@163.com

