馬鈴薯根際與非根際土壤微生物群落結構及多樣性特征
葛應蘭,孫廷
南陽農業職業學院農業科學系,河南 南陽 473007
土壤微生物是土壤中元素循環、有機質分解、土壤礦化等地球化學循環過程中的重要參與者,也是土壤物質循環的主要驅動者,參與并維持農業土壤的健康和生產力(Leff et al.,2015;Carini et al.,2017;Lange et al.,2015)。土壤微生物的多樣性對土壤生態系統的功能、可持續性和完整性至關重要,近年來越來越多的研究表明,較高的微生物多樣性可以增強生態系統和微生物功能的穩定性(Lu et al.,2015;Deng et al.,2016)。根際土壤是直接受植物根系和分泌物影響的土壤區域,是土壤微生物與植物相互作用的重要場所(Lu et al.,2015)。根際土壤微生物與根系之間存在適應性協同進化關系,并形成植物-微生物之間的互惠關系(Wang et al.,2016;Bakker et al.,2015;Walters et al.,2018)。植物通過根系活動改變根際土壤的養分含量及其他土壤理化性質,改變根際微生物群落的組成,使得根際與非根際土微生物群落組成和多樣性上具有明顯的差異(Wang et al.,2016;Bakker et al.,2015)。根際微生物對植物生長具有重要的作用,促植物生長細菌(PGPR)通過自身代謝活動將土壤營養物質分解、轉化為植物可吸收利用的形態,促進植物生長,部分細菌分泌的激素等物質可提高植物的適應性(Walters et al.,2018)。根際土壤微生物的群落結構受植物影響,如植物種類、生長階段、健康狀況,另外,土壤理化性質對微生物群落也具有重要的影響,如土壤營養狀況、水分和pH、溫度(Lladó et al.,2018;Lu et al.,2015)。
馬鈴薯是中國農業生產中主栽作物之一,近年來,隨著栽培面積持續擴大,馬鈴薯種植的土壤問題日漸突出,緩解或消除馬鈴薯土壤貧瘠等問題障礙迫在眉睫(張立超等,2017;王麗紅等,2016)。已有研究表明,多年種植馬鈴薯后會對土壤微生物產生抑制作用,使土壤微生物總數、細菌數量減少,真菌數量增加(Uroz et al.,2016;Hou et al.,2015)。隨著種植年限的增加,細菌種類及數量不斷減少,特別是芽孢桿菌和放線菌等種類的改變,致使土壤微生物群落多樣性水平呈下降趨勢(孫夢媛等,2017)。因此,加深對土壤微生物群落結構、功能的了解,能夠闡明馬鈴薯種植后土壤微生物的影響機制。本研究利用Illumina-MiSeq高通量測序技術對馬鈴薯根際與非根際土壤中細菌的16S rDNA基因V3-V4區片段和真菌18S rDNA基因V4區片段進行了測序,研究馬鈴薯根際與非根際土壤微生物群落多樣性及其與土壤養分之間的關系,為研究馬鈴薯健康種植提供理論數據。
1 材料與方法
1.1 樣品采集
供試馬鈴薯為莊薯3號,種植面積為50 m ×50 m。于2018年馬鈴薯盛花期(4月中)采集根際土壤樣本,選擇3塊50 m ×50 m的重復樣地,每個樣地選5株長勢一致的馬鈴薯植株,采用抖根法(Lu et al.,2015)收集根際土壤,在根系周圍2—5 cm的位置采集非根際土,同一樣方內的土樣混合均勻作為一個混合樣,所有土壤樣品立即帶回實驗室,4 ℃冰箱保存。共采集15個根際樣品和15個非根際樣品。混勻的土樣一部分風干保存,測定土壤理化性質,另一部分新鮮土壤用于提取微生物總DNA進行高通量測序。
1.2 土壤理化性質
對于pH值、有機碳SOC、全氮TN的測定,分別借助于pH測量計、容重法及硝化法進行;通過電導儀測定電導率 EC,并通過其估算含鹽量;對于總磷和速效磷采用鉬銻抗比色法,速效氮采用光度計法(Zhalnina et al.,2018)。
1.3 土壤總DNA提取
利用 Fast DNA spin kit for soil試劑盒(MP BIO,Inc.,Irvine,CA,USA)進行 DNA提取,根據制造商提供的說明進行操作。洗脫后總 DNA體積為50 μL。利用1%的瓊脂糖凝膠泳提取總DNA(電泳條帶的單一性),同時用NanoDrop ND-1000微光分光光度計測定其濃度。
1.4 土壤微生物基因組DNA的提取
吸取1 mL根際土壤溶液至2 mL無菌離心管中,于4 ℃、10000 g離心30 s,棄上清,所得沉淀用于根際土壤微生物基因組DNA提取;對非根際土,用無菌藥匙取大約0.2 g土壤(濕重),加入2 mL無菌離心管中,用于提取基因組DNA。利用OMEGA試劑盒E.Z.N.ATM Mag-Bind Soil DNA Kit試劑盒(OMEGA)提取基因組DNA,利用1%瓊脂糖凝膠檢測 DNA的長度和完整性,利用NanoDrop檢測DNA的濃度和純度。
1.5 DNA擴增及測序
采用兩輪法對細菌16S rDNA V3-V4區進行擴增,第一輪擴增利用融合了barcode序列的通用引物進行,上游引物 341F:ccctacacgacgctcttccgatctg(barcode)cctacgggnggcwgcag,下游引物 805R:gactggagttcctt ggcacccgagaattccagactachvgggtatctaatcc;真菌 18S rDNA擴增,第一輪擴增利用融合了barcode 序列的通用引物進行,上下游引物序列:NS1:cctacacgacgctctt ccgatctn(barcode)gtagtcatatgcttgtctc,Fung:gactggagtt ccttggcacccgagaattccaattccccgttacccgt tg。反應體系30 μL,包含15 μL 2×Taq master Mix(Thermo),引物(10 μmol·L-1)各 1 μL,模板 DNA 20 ng。擴增條件:94 ℃3 min,94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,擴增 5個循環;94 ℃ 20 s,55℃ 20 s,72 ℃ 30 s,擴增20循環,72 ℃延伸5 min。第二輪擴增使用Illumina橋式PCR兼容引物,以第一輪的PCR產物為模板。反應體系同上。擴增條件:95 ℃ 30 s,95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,擴增5個循環,72 ℃延伸5 min。PCR產物經磁珠法回收并定量。將每個重復個體的 PCR產物等量混合,每份混合樣品包含相應的全部重復個體,將混合樣品送至生工(上海)生物工程有限公司,利用Illumina-MiSeq平臺進行高通量測序(Uroz et al.,2016;Hou et al.,2015)。
1.6 數據分析
測序原始數據去除引物接頭序列、去除各低質量堿基(Phred Quality Score=20)后進行拼接,舍棄長度短于200 bp的序列,去除非特異性擴增序列及嵌合體后,得到每個樣本的有效序列數據。以97%為劃定閾值,對16S和18S序列劃分操作分類單元(operational taxonomic unit,OTU)。根據樣本OTUs組成之間的weighted unifrac 距離矩陣,采用主成分分析(PCA)分析微生物群落之間的相似性;Pearson相關系數檢驗微生物多樣性與土壤養分之間的相關性;利用Canoco 4.5軟件對土壤養分和微生物群落多樣性指數進行冗余分析(Reundancy analysis,RDA)(Shi et al.,2016)。
2 結果分析
2.1 土壤養分
由表 1可知,馬鈴薯根際土壤 pH平均值為5.69,顯著低于非根際(P<0.05);差異性檢驗表明,根際土壤電導率、有機碳、全氮速效氮和速效磷均顯著高于非根際(P<0.05),而根際土壤全磷與非根際差異不顯著(P>0.05)。

表1 馬鈴薯根際與非根際土壤養分Table 1 Soil nutrients of potato in rhizosphere and non-rhizosphere soil
2.2 土壤微生物群落多樣性
由表2可知,馬鈴薯根際土壤細菌豐富度指數、Shannon-Wiener 指數、ACE、Chao 1指數均顯著高于非根際(P<0.05);而根際土壤細菌覆蓋度、均勻度和 Simpson指數與非根際差異不顯著(P>0.05)。由表3可知,馬鈴薯根際土壤真菌豐富度指數、Shannon-Wiener指數、ACE、Chao 1指數均顯著高于非根際(P<0.05);而根際土壤真菌覆蓋度、均勻度和Simpson指數與非根際差異不顯著(P>0.05)。
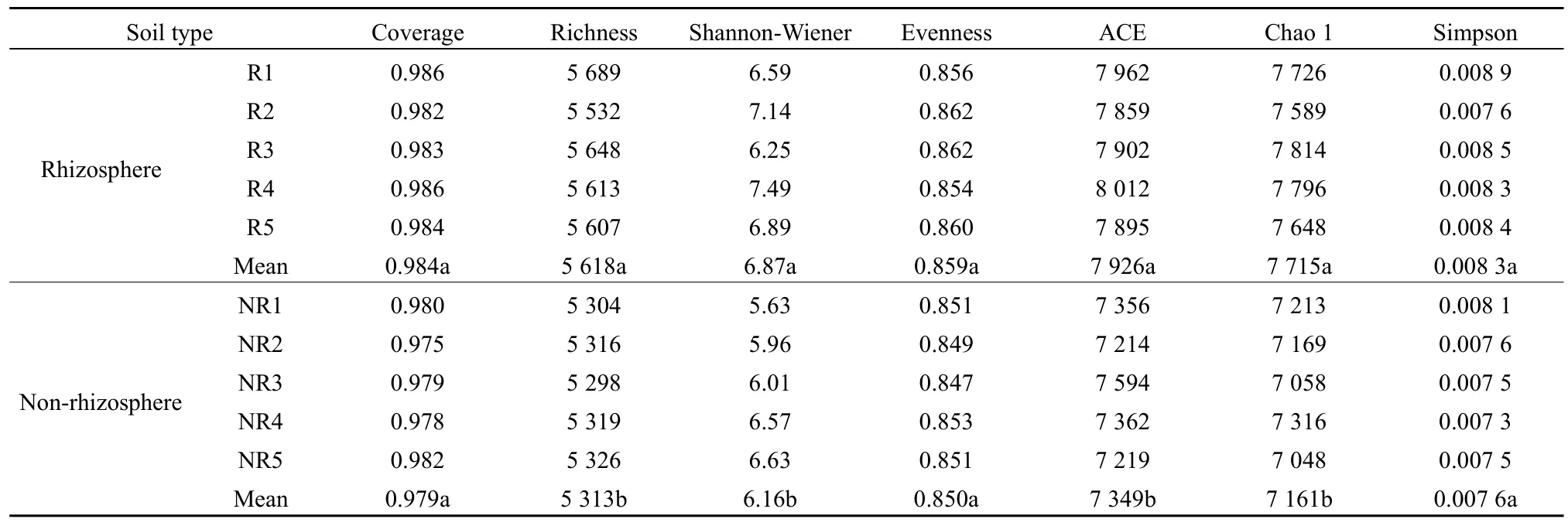
表2 馬鈴薯根際與非根際土壤細菌多樣性Table 2 Bacterial diversity in rhizosphere and non-rhizosphere soil
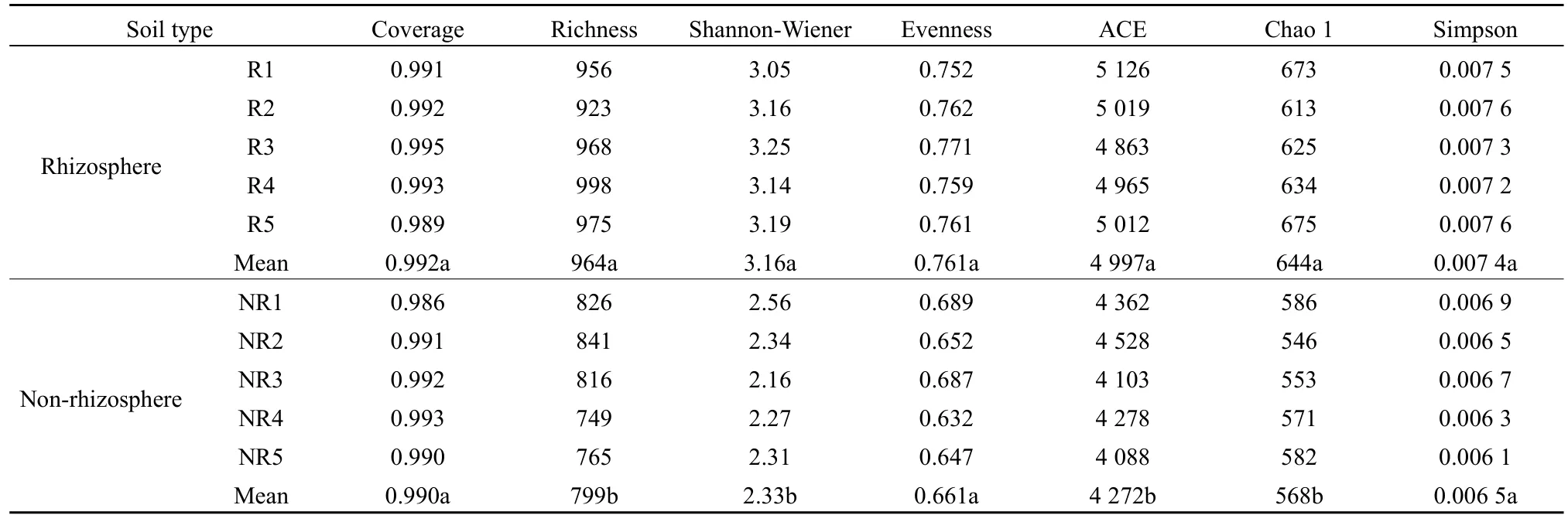
表3 馬鈴薯根際與非根際土壤真菌多樣性Table 3 Fungal diversity in rhizosphere and non-rhizosphere soil
2.3 土壤微生物群落組成
由圖1可知,馬鈴薯根際土壤細菌群落中,優勢類群主要是變形菌門Proteobacteria(35.98%)、酸桿菌門 Acidobacteria(27.03%)和芽單胞菌門Gemmatimonadetes(9.14%),還有浮霉菌門Planctomycetaceae(4.03%)、放線菌門Actinobacteria(3.02%)、擬桿菌門Bacteroidetes(1.56%)、后壁菌門 Firmicutes(3.89%)、綠彎菌門 Chloroflexi(6.18%)、疣微菌門 Verrucomicrobia(3.01%)。非根際土壤細菌群落中,優勢類群主要是變形菌門(46.02%)、酸桿菌門(23.17%)和芽單胞菌門(12.06%)。其中根際土壤細菌酸桿菌門相對豐度高于非根際,變形菌門相對豐度低于非根際。
馬鈴薯根際土壤真菌群落中,優勢類群主要是子囊菌門 Ascomycota(53.03%)和擔子菌門Basidiomycota(26.17%),還包括結合菌門Zygomycota(3.26%)、壺菌門 Chytridiomycota(0.58%)、新麗鞭毛菌門 Neocallimastigomycota(7.23%)、球囊菌門Glomeromycota(3.42%)、芽枝菌門 Blastocladiomycota(2.19%)。非根際土壤真菌群落中,優勢類群主要是子囊菌門(50.16%)和擔子菌門(30.18%)。主成分分析(PCA,圖2)表明:馬鈴薯根際土壤和非根際土壤比較,細菌群落、真菌群落都具有很好的相似性,并且根際和非根際的細菌群落、真菌群落都產生明顯的分離效應。

圖1 土壤細菌(A)和真菌(B)群落組成Fig. 1 Bacterial (A) and fungal (B) community composition in rhizosphere and non-rhizosphere soil
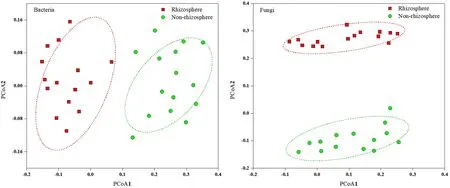
圖2 基于Weighted unifrac距離的土壤微生物群落的主坐標分析(PCoA)Fig. 2 Principal coordinate analysis (PCoA) of soil microbial communities based on Weighted unifrac distance
2.4 土壤養分與細菌群落結構的相關性
相關性分析表明(表 4),馬鈴薯土壤細菌和真菌Coverage、ACE與土壤養分均沒有顯著相關性(P>0.05);土壤pH與土壤細菌和真菌多樣性呈負相關,土壤電導率和全磷與土壤細菌和真菌多樣性均沒有顯著相關性(P>0.05)。
土壤有機碳與細菌 Richness、Shannon呈極顯著正相關(P<0.01),與細菌Chao 1和Simpson呈顯著正相關(P<0.05);土壤有機碳與真菌Shannon呈極顯著正相關(P<0.01),與真菌Richness、Chao 1和Simpson呈顯著正相關(P<0.05)。土壤全氮與細菌 Richness、Shannon呈極顯著正相關(P<0.01),與細菌Chao 1和Simpson呈顯著正相關(P<0.05);土壤全氮與真菌Shannon呈極顯正相關(P<0.01),與真菌 Richness、Chao 1 和 Simpson呈顯著的正相關(P<0.05)。土壤速效氮與Richness、Shannon、Evenness、Chao 1和Simpson呈顯著正相關(P<0.05),與真菌Shannon、Evenness、Chao 1和Simpson呈顯著正相關(P<0.05)。土壤速效磷與細菌Shannon、Chao 1和Simpson呈極顯著正相關(P<0.01),與 Evenness呈顯著正相關(P<0.05);土壤速效磷與真菌Shannon、Evenness、Chao 1和Simpson呈顯著正相關(P<0.05)。
2.5 土壤微生物群落與土壤養分的關系
馬鈴薯根際土壤細菌和真菌群落與土壤環境因子的冗余分析結果見表 5。蒙特卡羅置換檢驗結果顯示,第一典范軸P值為0.469(F=32.16),所有典范軸的P值為0.902,表明該排序模型的解釋變量(即土壤環境因子)與響應變量(即土壤細菌和真菌群落結構)的變化關系較為顯著。
由圖3可知,對于土壤細菌群落,RDA前兩個排序軸的特征值分別為0.6498和0.2147,分別解釋了64.98%和21.47%的細菌多樣性變化。所選的7個土壤環境因子共解釋了86%的總特征值,對馬鈴薯根際土壤細菌多樣性有顯著影響。其中對土壤細菌多樣性影響較大的有SOC和TN,而pH對土壤細菌多樣性影響為負。
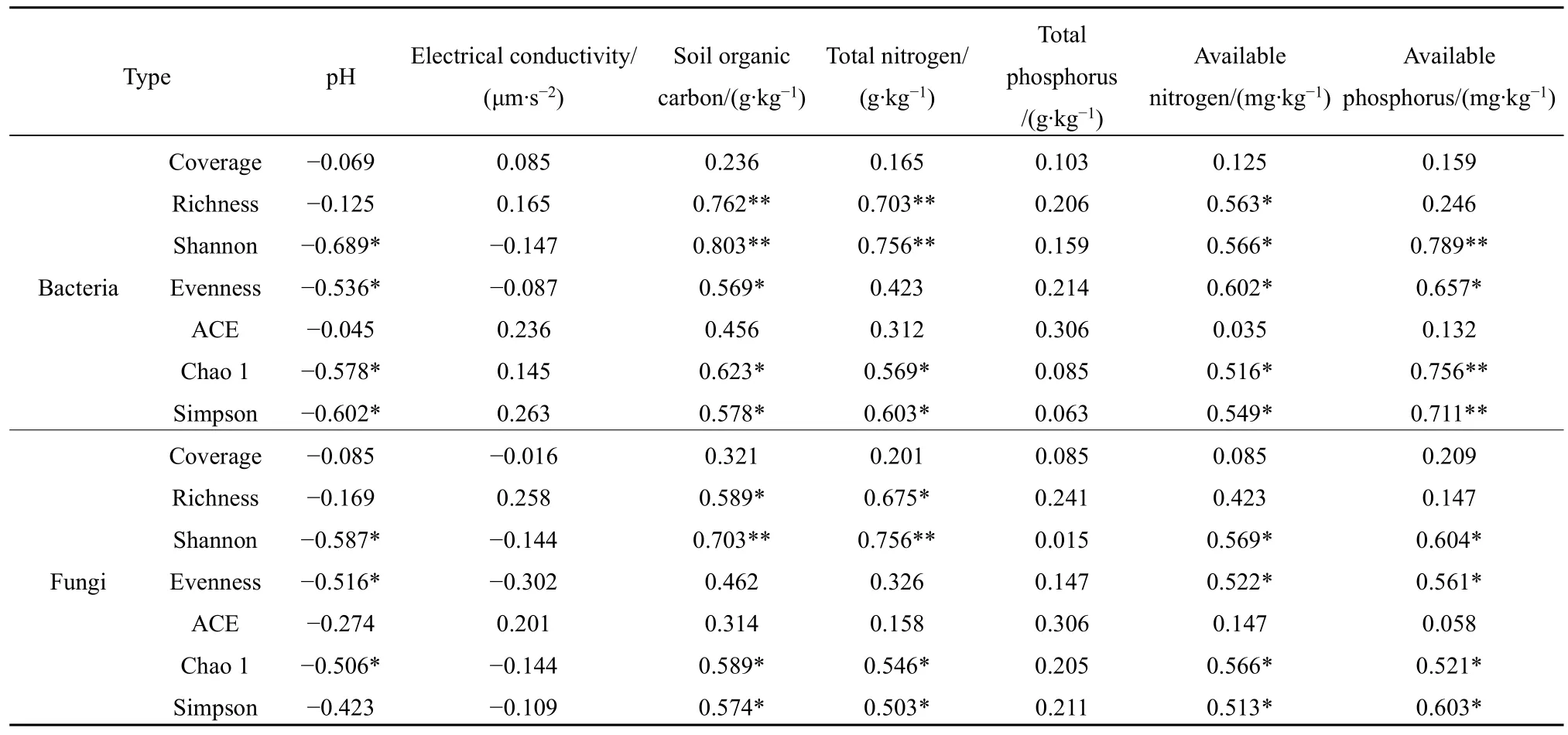
表4 土壤養分與土壤細菌和真菌多樣性相關性Table 4 Soil nutrients related to the diversity of soil bacteria and fungi
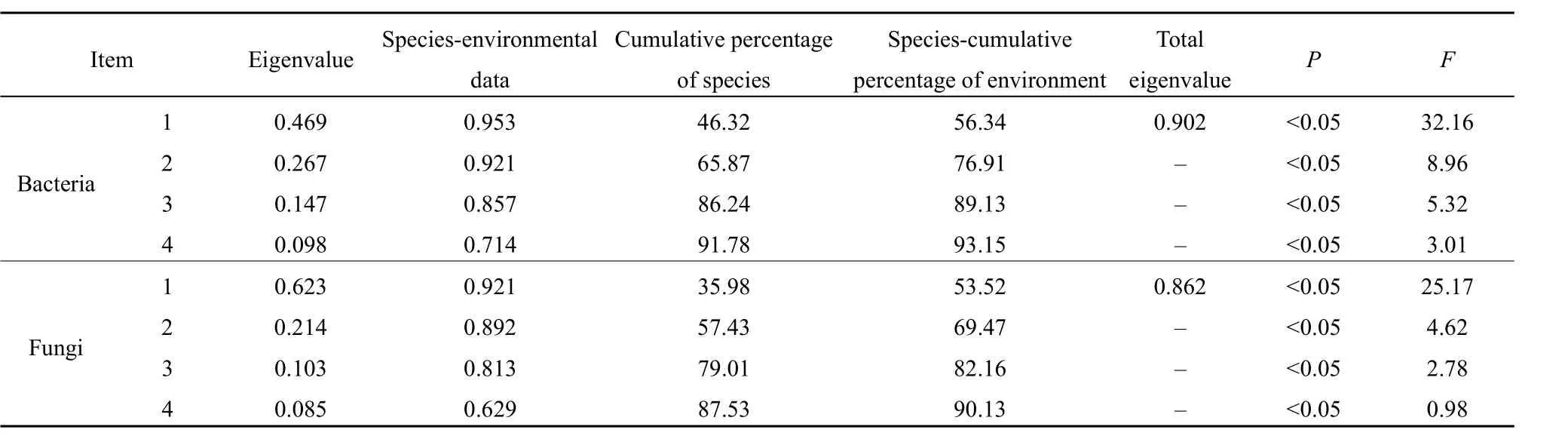
表5 冗余分析結果Table 5 Redundant analysis results
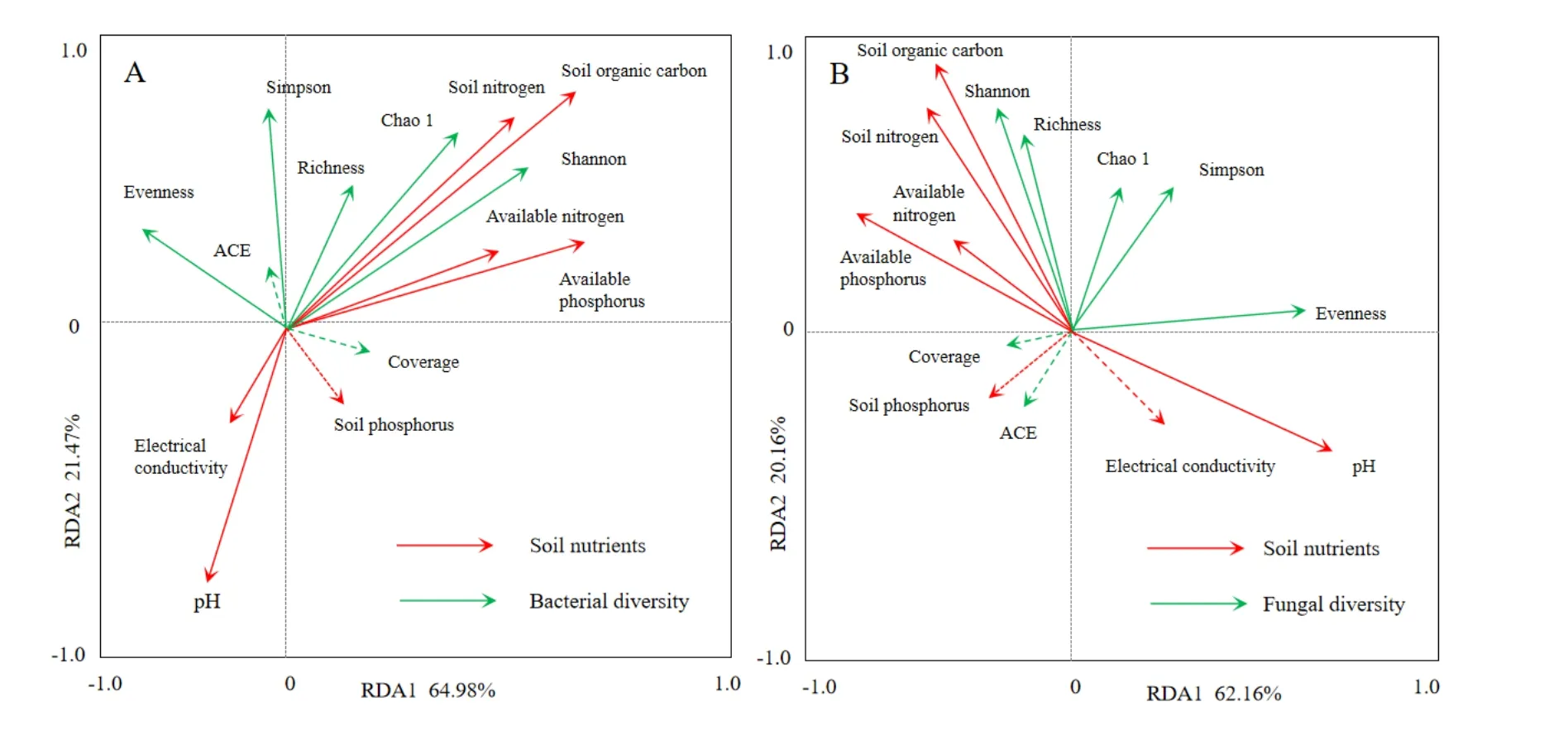
圖3 土壤細菌(A)和真菌(B)多樣性指數與環境因子的關系Fig. 3 Soil bacterial diversity index(A) and fungal diversity index (B) related to environmental factors
對于土壤真菌群落,RDA前兩個排序軸的特征值分別為0.6216和0.2016,分別解釋了62.16%和20.16%的真菌多樣性變化。所選的7個土壤環境因子共解釋了82%的總特征值,對馬鈴薯根際土壤真菌多樣性有顯著影響。其中對土壤真菌多樣性影響較大的有SOC和TN,而pH對土壤真菌多樣性影響為負。
3 討論
本研究中馬鈴薯非根際和根際土壤中細菌豐富度高,而真菌數量相對較少,這與土壤中微生物以細菌為主一致(Maarastawi et al.,2018;Whitman et al.,2017)。根際細菌多樣性高于非根際細菌,而根際真菌多樣性卻低于非根際土壤。根際土壤中營養物質高于非根際土壤,有利于細菌的繁殖故豐富度和多樣性較高。相關性分析也表明細菌多樣性和組成與SOC、TN呈正相關,與以往研究相一致(Liang et al.,2016;Deng et al.,2015);而土壤真菌多為病原菌,不利于植物生長,可能被植物根系主動過濾,導致根際真菌多樣性與非根際差異不顯著(Taschen et al.,2017)。根際細菌、真菌群落組成與非根際土壤存在明顯的差異,PCoA結果也表明非根際土壤與根際微生物群落分離明顯,非根際土壤群落之間,以及根際土壤群落之間各具有較高的相似性。
門水平上,馬鈴薯根際和非根際土壤細菌群落中,優勢類群主要是變形菌門、酸桿菌門和芽單胞菌門,還包括浮霉菌門、放線菌門、擬桿菌門、后壁菌門、綠彎菌門、疣微菌門,其中根際土壤細菌酸桿菌門相對豐度高于非根際,變形菌門相對豐度低于非根際。根際和非根際土壤真菌群落中,優勢類群主要是子囊菌門和擔子菌門,還包括結合菌門、壺菌門、新麗鞭毛菌門、球囊菌門、芽枝菌門。根際與非根際菌群的差異,一方面是因為根際土壤養分的含量高于非根際土,pH值低于非根際土,利于某些特定類群的增殖和豐度的提高(Taschen et al.,2017)。RDA結果表明,細菌和真菌群落結構與土壤SOC和TN呈正相關關系,而細菌和真菌群落結構與土壤pH呈負相關關系。總體上,根際土壤細菌群落多樣性高于非根際,主要是由于根際土壤pH的酸化導致土壤養分含量較高,土壤微生物多樣性較高(Li et al.,2016;Stewart et al.,2017;Zhang et al.,2015)。另一方面,是植物從自身代謝和健康出發,由根系主動選擇形成的,gamma變形菌包含許多促植物生長細菌(PGPR),如具有固氮作用的芽孢桿菌屬、固氮菌屬,在生產和釋放植物激素和土壤源植物病原菌(如真菌)的生物防治中有重要作用。alpha變形菌包含許多植物共生固氮菌,如Rhizobium、Rickettsia;delta變形菌的一些物種,如Desulfovibrio、Geobacter、Bdellovibrio等,對土壤硫循環具有重要作用,對植物生長有重要作用,因此在根際土壤中的豐富度明顯高于非根際土壤;alpha和delta變形菌的豐度升高是在根際土壤中變形菌門的豐度顯著高于非根際土的主要原因(Shen et al.,2015;Mellado-Vázquez et al.,2016)。
4 結論
馬鈴薯根際土壤pH顯著低于非根際,根際土壤養分、土壤細菌和真菌群落多樣性(豐富度指數、Shannon-Wiener指數、ACE、Chao 1指數)均顯著高于非根際(P<0.05),而根際土壤全磷與非根際差異不顯著(P>0.05),且根際優勢群落相對豐度較高。土壤微生物群落多樣性和組成在不同生境之間的差異與土壤理化性質密切相關,生境不同,根際微生物群落不同。研究發現馬鈴薯土壤根際和非根際細菌和真菌群落具有很好的相似性,并且根際和非根際細菌群落產生明顯的分離效應。土壤環境因子對馬鈴薯土壤細菌和真菌多樣性有顯著影響,其中對土壤細菌和真菌多樣性影響較大的有 SOC和TN,而pH對土壤細菌和真菌多樣性影響為負。由此可知,在馬鈴薯的種植過程中,土壤pH值對根際微生物群落多樣性起著重要的調節作用。

