基于網絡藥理學的黃連治療糖尿病的作用機制研究
邱楊 張菁
摘要:目的? 利用網絡藥理學手段研究黃連治療糖尿病的作用機制。方法? 從TCMSP數據庫獲取黃連的有效成分以及作用靶點,與GeneCards數據庫中糖尿病的作用靶點取交集獲取黃連治療糖尿病的預測靶點,利用Cytoscape軟件構建中藥化合物-靶點網絡及STRING數據庫構建PPI網絡,利用 DAVID在線工具進行GO功能分析及KEGG通路富集分析。結果? 黃連的活性成分有14個,關鍵有效成分有11個,治療糖尿病靶點137個。黃連主要活性成分作用的核心靶點為JUN、MAPK1、IL-6等靶基因,參與調控Insulin resistance,Regulation of lipolysis in adipocytes等多個信號通路。結論? 黃連能發揮多靶點、多通路的協同治療糖尿病作用。
關鍵詞:黃連;糖尿病;網絡藥理學
中圖分類號:R285? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? DOI:10.3969/j.issn.1006-1959.2020.01.021
文章編號:1006-1959(2020)01-0064-04
Study on the Mechanism of Coptis Chinensis in Treating Diabetes Based on Network Pharmacology
QIU Yang,ZHANG Jing
(Department of Pharmacy,Run Run Shaw Hospital,Zhejiang University School of Medicine,Hangzhou 310016,Zhejiang,China)
Abstract:Objective? To study the action mechanism of Coptis chinensis in treating diabetes by network pharmacology. Methods? Obtain the active ingredients and action targets of Coptis chinensis from the TCMSP database, intersect with the action targets of diabetes in the GeneCards database to obtain the predicted targets of Coptis chinensis for treatment of diabetes, use Cytoscape software to construct a Chinese medicine compound-target network and the STRING database to construct a PPI network Use DAVID online tool for GO function analysis and KEGG pathway enrichment analysis. Results? There were 14 active ingredients in Coptis chinensis, 11 key active ingredients, and 137 targets for treating diabetes. The core targets of the active components of Coptis chinensis are target genes such as JUN, MAPK1, and IL-6, which participate in the regulation of multiple signaling pathways such as Insulin resistance, Regulation of lipolysis in adipocytes.Conclusion? Coptis chinensis can play a multi-target and multi-path synergistic effect in the treatment of diabetes.
Key words:Coptis chinensis;Diabetes;Network pharmacology
糖尿病(diabetes)是因胰島素產生絕對不足或相對不足而導致的一種代謝性疾病[1]。隨著人口老齡化的進程,我國糖尿病患病率逐漸升高。截止2013年,我國18歲以上人群的糖尿病患病率已達10.4%[2]。糖尿病屬于中醫“消渴癥”范疇,《本草綱目》及《太平圣惠方》等經典古籍均記載了黃連有“止消渴”的功效[3]。近年來臨床研究發現,黃連不僅能促進胰島素分泌,降低血糖,還能改善2型糖尿病大鼠的腎臟損害[4,5],但目前對于黃連治療糖尿病的具體分子機制尚不明確。網絡藥理學是基于系統生物學的理論,對生物系統的網絡分析,選取特定信號節點進行多靶點藥物分子設計的新學科[6]。相對于傳統試驗藥理學方法,網絡藥理學具有全面、系統的特點,尤其適用于多種化學成分、多重靶點的傳統中藥作用機理的闡釋。本文擬通過網絡藥理學方法篩選黃連有效成分,明確其作用靶點,并進一步探索其治療糖尿病的作用機制。
1材料與方法
1.1軟件與數據庫? TCMSP數據庫(http://lsp.nwsuaf.edu.cn/tcmsp.php)[7]、GeneCards數據庫(https://www.genecards.org/)、STRING 數據庫(https://string-db.org/)、DAVID 數據庫(https://david.ncifcrf.gov/)、Cytoscape 3.5.1 軟件、R3.6.0軟件。
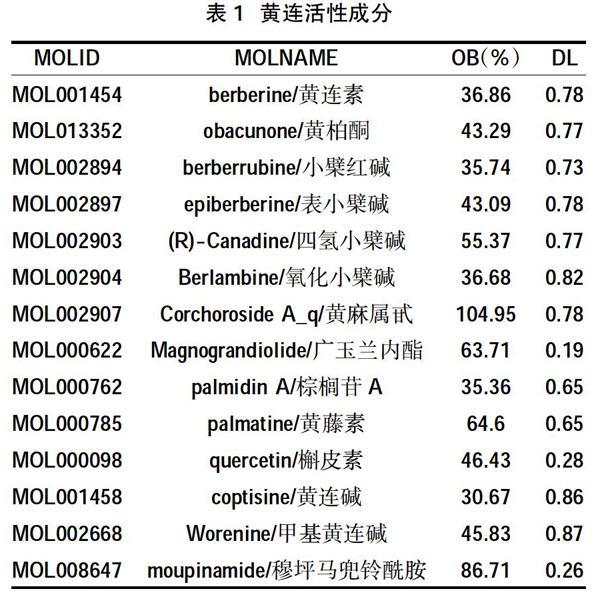
1.2黃連活性成分及其對應靶點的篩選? 從TCMSP數據庫獲取黃連有效成分以及作用靶點,依據口服生物利用度(Oral bioavailability,OB)和類藥性(Drug-likeness,DL)值(OB≥30%和 DL≥0.18)過濾篩選出符合條件的活性化合物及其對應靶點。
1.3黃連治療糖尿病的預測靶點選擇? 在 GeneCards數據庫中搜索糖尿病的相關靶點,將通過TCMSP數據庫獲取的黃連的作用靶點與從GeneCards 數據庫獲取的糖尿病靶點基因進行映射,獲取黃連治療糖尿病的預測靶點。
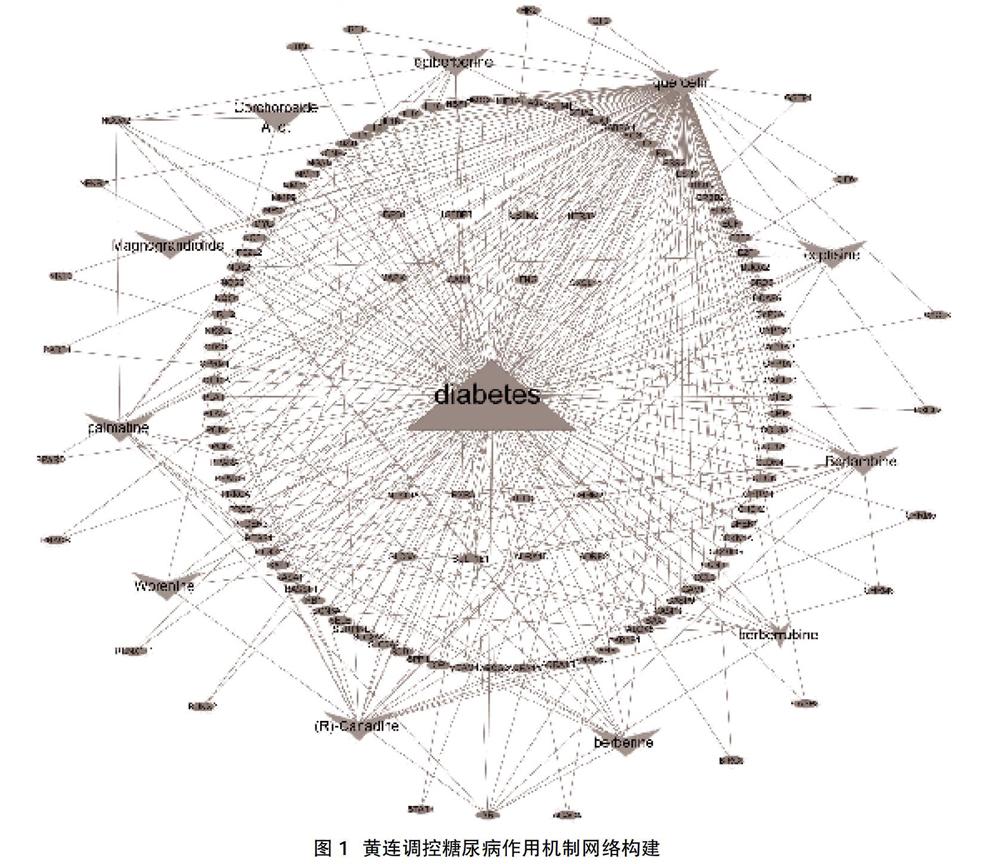
1.4黃連調控糖尿病作用機制網絡構建? Cytoscape3.5.1 是一種可視化軟件,能更直觀的分析藥物治療疾病的作用機制,其中節點(node)代表中藥所含藥物化學成分與潛在作用靶點,邊(edge)展現了中藥成分和其作用靶點之間的聯系。首先構建化合物-靶點網絡,再根據靶點連接情況篩選出黃連作用于糖尿病的關鍵化合物。
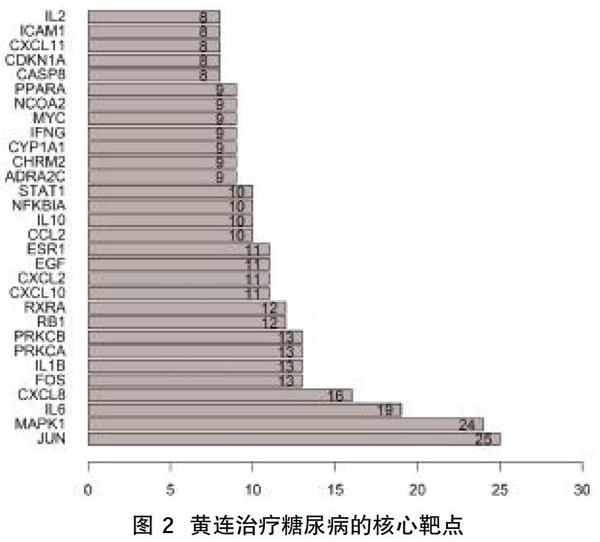
1.5 PPI網絡的構建及核心靶點篩選? STRING 數據庫可以用來分析蛋白質之間的相互作用[8],將黃連治療糖尿病的預測靶點導入STRING數據庫,限定研究物種為“Homo sapiens”,最低相互作用評分設置為最高置信度(“highest confidence<0.900>”),隱藏離散靶點,其余參數保持默認設置,得到黃連作用于糖尿病的PPI網絡。最后利用R腳本對STRING 數據庫中獲取的互作聯系進行計數排序,輸出連線數最多的30個靶點基因即核心靶點,繪制成圖。
1.6 GO功能分析和KEGG通路富集分析? DAVID數據庫為大規模基因或蛋白提供系統綜合的生物功能注釋信息,且能提供最顯著富集的生物學注釋[9]。將藥物-疾病交集基因導入DAVID6.8數據庫,輸入靶基因名稱列表,限定物種為“Homo Sapiens”,將靶基因名修正為官方名稱“official gene symbol”,設定閾值P<0.05,進行 GO生物過程富集分析和 KEGG 通路富集分析。
2結果
2.1活性成分篩選? 通過OB、DL值篩選共獲得黃連的14個活性成分,見表1。
2.2黃連調控糖尿病作用機制網絡構建? 共獲得137個共同靶點基因,利用Cytoscape 3.7.1軟件構建化合物-靶點相互作用網絡,發現該網絡共有149個節點(node),其中有效活性分子11個,共同靶點基因137個,疾病1個,348條邊(edge),見圖1。
2.3 PPI網絡的構建及核心靶點篩選? 將137個共同靶點輸入STRING 數據庫進行 PPI網絡分析,得到黃連治療糖尿病靶蛋白的PPI網絡,圖中發生蛋白互作的節點有137個,邊有317條,平均節點自由度為4.63,平均聚集系數為0.465。利用R腳本對STRING 數據庫中蛋白互作網絡進行節點連線計數并排序,獲得黃連治療糖尿病的核心靶點,見圖2。
2.4 GO富集分析? 在獲得上述共同靶點的基礎上,將靶點映射入DAVID數據庫進行GO富集分析,結果顯示,共同靶點的生物學過程主要集中在正向調控RNA聚合酶Ⅱ啟動子、細胞分裂、炎癥反應、凋亡過程、血壓控制、細胞外隙、細胞核、細胞質、細胞膜組成部分等方面;轉錄分子功能主要富集在轉錄因子活性、序列特異性DNA結合、血紅素結合、G蛋白耦聯乙酰膽堿受體活性、類固醇受體結合等方面, 見圖3。
2.5 KEGG分析? 將靶點映射入DAVID數據庫進行KEGG通路注釋分析,結果顯示與糖脂代謝直接相關的通路有Insulin resistance,Regulation of lipolysis in adipocytes,Adipocytokine signaling pathway,Type Ⅰ diabetes mellitus,TypeⅡ diabetes mellitus,Insulin signaling pathway。與心臟血管相關的通路有AGE-RAGE signaling pathway in diabetic complications,Fluid shear stress and atherosclerosis,HIF-1 signaling pathway,VEGF signaling pathway。與炎癥反應相關的通路有TNF signaling pathway,IL-17 signaling pathway,Toll-like receptor signaling pathway,Focal adhesion,Cytokine-cytokine receptor interaction,NF-kappa B signaling pathway,Chemokine signaling pathway。與增殖、凋亡相關的通路有Apoptosis,MAPK,p53 signaling pathway。輸出富集基因最多的20條通路見圖4。
3討論
中藥在治療糖尿病中積累了幾千年的理論和豐富的實踐經驗,在治療糖尿病及其慢性并發癥中發揮著重要的作用。本文通過網絡藥理學手段,對黃連控制糖脂代謝、保護心臟血管、抑制炎癥反應、抑制凋亡通路、促進增殖的多成分、多靶點、多通路的相互作用及調控網路進行了系統的挖掘和分析。
本研究發現黃連中作用于糖尿病的活性成分有14個,其中靶點數最多的活性成分為黃酮類的槲皮素,作用于56個糖尿病靶點。槲皮素能有效降低糖尿病肥胖大鼠血糖和膽固醇、調節血脂紊亂,促進糖尿病足傷口愈合,抑制促炎因子IL-6、TNF-α表達,促進抗炎因子IL-10表達,減少糖尿病難愈性傷口部位炎性反應過度的現象從而促進傷口愈合[10,11];還能作用于糖尿病大鼠晶狀體上皮細胞,抑制其凋亡,延緩糖尿病性白內障的發生發展[12]。其他活性成分如生物堿類的黃連素被報道可以通過過抑制ERK1/2、p38 MAPK信號通路起到抑制血管鈣化[13],保護心血管,改善脂質代謝,保護糖尿病性脂肪肝[14];且在體外高糖環境下,促進視網膜細胞增殖,保護糖尿病性視網膜損傷[15]。因此,黃連活性成分的作用靶點如IL-6、MAPK等均是糖尿病治療藥物的重要靶點,與本文預測的黃連作用的關鍵靶點結果相吻合。
另外,大量研究表明[16,17],糖尿病患者體內晚期糖基化終產物(AGEs)較正常人明顯升高,其與受體(RAGE)結合后促使ROS生成,誘導氧化應激,激活NF-kb,是糖尿病腎病的形成和進展中非常重要的一環,也是糖尿病創面難愈合的重要機制。在本研究中AGES-RAGE通路是黃連治療糖尿病中富集到最顯著的信號通路,該通路可能是黃連治療糖尿病的重要機制之一。
綜上所述,本研究通過網絡藥理學方法對黃連治療糖尿病的活性成分、作用靶點和作用機制進行了探索,發現黃連主要通過JUN、MAPK、IL-6等基因發揮作用。另外,黃連的多種活性成分相輔相成,通過控制糖脂代謝、保護心臟血管、抑制炎癥反應、抑制凋亡通路、促進增殖的多條通路發揮保護作用。不僅直接調控血糖,減少胰島素抵抗,還能降低血脂、保護心臟血管,改善糖尿病眼部以及足部損傷等并發癥,在糖尿病發生發展的多個環節中發揮保護作用。
參考文獻:
[1]Tao Z,Shi A,Zhao J.Epidemiological Perspectives of Diabetes[J].Cell Biochem Biophys,2015,73(1):181-185.
[2]中華醫學會糖尿病學分會.中國2型糖尿病防治指南(2017年版)[J].中華糖尿病雜志,2018,10(1):4-67.
[3]張桂仙,袁婭金,熊薇,等.中醫藥防治糖尿病認知功能障礙研究進展[J/OL].中國實驗方劑學雜志:1-9[2019-12-24].https://doi.org/10.13422/j.cnki.syfjx.20192339.
[4]鄧曉威,謝寧.黃連素治療2型糖尿病研究進展[J].中國中藥雜志,2014,39(8):1374-1378.
[5]司鳳霞,楊殿生,王柏欣.黃連素對2型糖尿病大鼠腎臟的保護作用[J].黑龍江醫藥科學,2005(4):10-12.
[6]Hopkins AL.Network pharmacology:the next paradigm in drug discovery[J].Nat Chem Biol,2008,4(11):682-690.
[7]汝錦龍.中藥系統藥理學數據庫和分析平臺的構建和應用[D].西北農林科技大學,2015.
[8]Von Mering C,Jensen LJ,Snel B,et al.STRING: known and predicted protein-protein associations, integrated and transferred across organisms[J].Nucleic Acids Res,2005,33(Database issue):D433-D437.
[9]Dennis GJ,Sherman BT,Hosack DA,et al.DAVID:Database for Annotation, Visualization, and Integrated Discovery[J].Genome Biol,2003,4(5):P3.
[10]郭艷芳,張皓,朱玲,等.槲皮素改善糖尿病肥胖大鼠糖脂代謝紊亂及總膽固醇的作用[J].解剖學研究,2018,40(6):505-509.
[11]付佳,黃瀟紅,黃靜娟,等.槲皮素對糖尿病傷口的促愈合作用及相關機制研究[J].廣東藥科大學學報,2019,35(3):395-401.
[12]劉鵑,康剛勁,康海軍,等.槲皮素對糖尿病大鼠晶狀體上皮細胞凋亡的影響[J].瀘州醫學院學報,2016,39(6):560-565.
[13]曾存良,張鑫鵬,胥雄飛,等.黃連素對糖尿病大鼠血管鈣化的影響及其機制研究[J].現代中西醫結合雜志,2019,28(8):799-805,849.
[14]張韞,趙宗江,李忻,等.黃連素對2型糖尿病大鼠脂肪肝的治療作用及機制研究[J].中日友好醫院學報,2018,32(1):23-27,封4.
[15]金軼平,朱皓皓.黃連素對高糖培養下大鼠視網膜Müller細胞增殖的影響[J].國際眼科雜志,2019,19(5):745-748.
[16]楊超茅,楊志新,馬曉玲.AGEs-RAGE信號通路在糖尿病腎病中的作用機制及中醫藥研究進展[J].中醫學報,2019,34(9):1864-1868.
[17]王雨,李杰輝.AGEs-RAGE信號通路與糖尿病難愈合創面[J].中國燒傷創傷雜志,2015,27(6):406-409.
收稿日期:2019-10-20;修回日期:2019-10-29
編輯/成森

