Z-沒藥甾酮對缺血性腦卒中大鼠氧化應激損傷的保護作用及分子機制
劉天龍,柳敏娜,王文軍,張一愷,封小娜,丁 一,文愛東
缺血性腦卒中又稱為腦梗死,是一種高發病率、高致殘率、高病死率和高復發率的腦血管疾病,對人類健康和生命安全造成嚴重威脅[1-4]。該病是因為大腦動脈血流短暫或持久性的閉塞導致腦供血不足或中斷,進而誘發一系列級聯反應,最終造成缺血區腦組織發生不可逆的損傷,引起神經功能缺損甚至死亡[5]。缺血性腦卒中病理機制十分復雜,其中氧化應激反應是其主要病理因素之一[6]。氧化應激由機體內產生的活性氧簇(ROS)介導,導致氧化與抗氧化失衡,從而引起組織、細胞的氧化損傷[7]。在缺血性腦卒中發生時,ROS的產生遠遠超過內源性抗氧化系統的清除能力,血管內皮細胞內大量的ROS使得細胞氧化呼吸鏈和氧化磷酸化的過程被破壞[8]。因此通過抑制腦缺血誘發的氧化應激反應,是治療腦卒中的有效途徑[9]。沒藥是臨床防治缺血性腦卒中的經典中藥,Z-沒藥甾酮(Z-Guggulsterone, Z-GS)是其主要藥效物質。前期研究表明,Z-GS可透過血腦屏障,發揮腦保護作用[10]。但是Z-GS對腦缺血后氧化應激的調控作用和機制并不明確。本研究以腦中動脈阻塞(MCAO)大鼠為模型,觀察Z-GS對缺血性腦卒中的保護作用,并探討其對氧化應激反應的調控及機制,為Z-GS開發成防治缺血性腦卒中的潛在藥物提供理論依據。
1 材料與方法
1.1實驗材料
1.1.1實驗動物:雄性SD大鼠(250~270 g)由空軍軍醫大學實驗動物中心提供,所有動物實驗遵循實驗動物倫理相關規定。飼養環境溫度為(22±2)℃,濕度為55%~75%,12 h循環光照,自由飲水和取食。適應性飼養7 d后開始實驗。
1.1.2試劑與儀器:Z-GS(Santa Cruz,美國),線栓(Doccol,美國),TTC試劑(Sigma-Aldrich,美國),TUNEL試劑盒(碧云天,上海),Nrf2和HO-1抗體(Abcam,英國),qRT-PCR試劑盒(TaKaRa,日本),超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)、丙二醛(MDA)和ROS試劑盒(建成,南京)。蛋白免疫印跡系統、PCR系統(Bio Rad,美國),光學顯微鏡、電子顯微鏡(Olympus,日本),低溫離心機(Eppendorf,德國)。
1.2實驗方法
1.2.1造模及給藥:大鼠行MCAO術模擬腦缺血。36只大鼠隨機分為假手術組、模型組、Z-GS組,每組12只。模型組及Z-GS組大鼠用5%異氟烷麻醉,仰臥位固定后,沿頸部正中線切開皮膚,鈍性分離右側頸總動脈、頸外動脈和頸內動脈。結扎頸總動脈和頸外動脈,夾閉頸內動脈。在頸外動脈插入線栓,進入頸內動脈,進線18~20 mm,固定線栓。2 h后拔出線栓。假手術組除不插入線栓外,其他操作同模型組。造模結束后,Z-GS組大鼠腹腔注射30 mg/kg的Z-GS(溶媒為DMSO,調整濃度使DMSO終濃度<5%),連續給藥7 d。假手術組及模型組給予相應的溶媒。
1.2.2神經功能評分:給藥結束后進行神經功能評分。評分標準采用Longa法評定:0分,無神經功能缺損癥狀;1分,懸尾時不能完全伸展左前肢;2分,向左側轉圈;3分,向左側傾倒;4分,不能自主行走;5分,死亡。
1.2.3腦梗死體積測定:神經功能評分結束后麻醉,迅速斷頭取腦,從腦前極與視交叉連線中點處,沿冠狀面從前向后按2 mm厚度切片,浸泡于1 %的TTC染液中,避光室溫孵育約20 min,隨后用4%多聚甲醛固定24 h。拍照后用Photoshop軟件測定梗死體積。梗死體積用百分率表示:梗死體積比=(對側正常腦組織體積-同側正常腦組織體積)/對側正常腦組織體積×100%。
1.2.4組織病理學染色:大鼠麻醉后,用生理鹽水和4%多聚甲醛灌注。隨后剝離腦組織浸入4%多聚甲醛繼續固定24 h以上,進行脫水、石蠟包埋和切片。按照常規方法進行HE染色。TUNEL染色用DAB法,切片脫蠟后根據說明書操作染色。
1.2.5氧化應激水平檢測:腦組織中氧化應激相關酶GSH-Px、SOD、CAT和MDA水平用相應的試劑盒根據說明書操作進行檢測。組織中ROS水平用熒光探針DCFH-DA進行檢測,根據說明書方法,組織制作細胞懸液后加入10 μmol/L的DCFH-DA 40 min后,用流式細胞儀檢測熒光強度,換算ROS百分比。
(3)執行進度:項目實施周期為四個季度,項目單位應于兩個季度末完成項目任務執行的50%,并于四個季度末完成所有項目。項目在執行過程中由于特殊原因需要終止、撤銷、變更的,須提前15天經區縣(自治縣)民政局同意后報中心審批,獲得同意變更書面回復后方可變更相關事項。
1.2.6免疫組化:切片脫蠟脫水后,0.3%甲醇-H2O2滅活內源性過氧化物酶,切片在枸櫞酸抗原修復液中修復后血清封閉。滴加一抗anti-Nrf2(1∶200)、anti-HO-1(1∶200)后4℃冰箱過夜。滴加二抗,室溫下孵育1 h。DAB顯色后滴加蘇木素復染細胞核。切片脫水透明封片固定。顯微鏡下隨機選區5個不同區域觀察拍照,平均光密度用Image-Pro Plus 6.0 軟件分析。
1.2.7蛋白免疫印跡檢測:提取腦組織總蛋白,用BCA法測定蛋白濃度。用8%的分離膠(SDS-PAGE)分離目標蛋白,隨后將蛋白轉移到硝酸纖維素膜上。用5%脫脂奶粉室溫封閉1 h,加入一抗在4℃孵育過夜,用相應的二抗室溫孵育1 h。ECL法顯色后用Quantity One系統曝光條帶。條帶灰度值用Image J軟件以β-actin為內參計算。所用目標一抗分別為:Nrf2(1∶1000)、HO-1(1∶1000)。
1.2.8qRT-PCR檢測:腦組織提取總RNA后,根據試劑盒操作說明,配制反轉錄體系合成cDNA。將合成的cDNA稀釋后,根據說明配制反應體系,反應條件為預變性:95℃ 10 min;循環反應:95℃ 10 s,60℃ 30 s;融解曲線:95℃ 15 s,60℃ 60 s,95℃ 15 s。用2-ΔΔCt法以GAPDH為內參計算目標基因的表達水平。
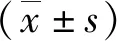
2 結果
2.1Z-GS對大鼠神經功能的影響 假手術組大鼠神經功能無明顯異常,而模型組大鼠神經功能受損嚴重,評分為(3.38±0.52)分,與假手術組比較差異有統計學意義(P<0.05),表明模型制備成功。Z-GS組大鼠神經功能恢復明顯,評分為(2.13±0.83)分,低于模型組(P<0.05)。
2.2Z-GS對大鼠腦梗死體積的影響 假手術組大鼠腦組織形態正常,模型組出現大面積腦梗死,梗死體積比為(43.50±5.63)%,與假手術組比較差異有統計學意義(P<0.05)。Z-GS組腦梗死體積比為(32.88±4.94)%,小于模型組,差異有統計學意義(P<0.05)。
圖1 3組大鼠腦組織病理學表現Z-GS為Z沒藥甾酮
2.4Z-GS對大鼠氧化應激的影響 模型組大鼠腦組織中抗氧化酶GSH-Px、SOD和CAT含量低于假手術組,Z-GS組高于模型組(P<0.05);模型組大鼠腦組織中MDA和ROS水平高于假手術組,Z-GS組低于模型組(P<0.05)。見表1。
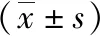
表1 3組大鼠腦組織氧化應激水平
注:Z-GS為Z沒藥甾酮;MDA為丙二醛,GSH-Px為谷胱甘肽過氧化物酶,SOD為超氧化物歧化酶,CAT過氧化氫酶,ROS為活性氧;與假手術組比較,aP<0.05;與模型組比較,cP<0.05
2.5Z-GS對大鼠腦組織Nrf2、HO-1 mRNA表達的影響 模型組大鼠腦組織Nrf2和HO-1 mRNA表達水平低于假手術組,Z-GS組高于模型組(P<0.05)。見圖2。

圖2 3組大鼠腦組織Nrf2和HO-1 mRNA表達水平
Z-GS為Z沒藥甾酮;與假手術組比較,aP<0.05;與模型組比較,cP<0.05
2.6Z-GS對大鼠腦組織Nrf2、HO-1蛋白表達的影響 模型組大鼠腦組織Nrf2和HO-1蛋白表達低于假手術組,Z-GS組高于模型組(P<0.05)。見圖3。對大鼠腦組織Nrf2和HO-1進行免疫組化染色驗證,結果與蛋白免疫印跡檢測結果一致。見圖4。

圖3 3組大鼠腦組織Nrf2和HO-1蛋白表達情況
Z-GS為Z沒藥甾酮

圖4 免疫組化染色檢測大鼠腦組織Nrf2和HO-1蛋白表達Z-GS為Z沒藥甾酮
3 討論
缺血性腦卒中是指由于腦動脈狹窄或堵塞,局部腦血流量減少或中斷,造成該動脈供應區域的腦組織缺血缺氧、供能減少,進而引起繼發性血管內皮損傷和自主神經功能障礙的一種病理狀態,嚴重影響患者生活質量[11-13]。溶栓是缺血性腦卒中的首選救治措施,但因其嚴格的治療窗口和較高的出血風險,溶栓效果受到很大限制[14-15]。而中藥因其公認的功效,在腦卒中的臨床治療中越來越受到國內外學者的重視[16]。
Z-GS是沒藥的活性成分之一。研究表明,Z-GS通過激活小鼠海馬和皮質區CREB-BDNF信號通路在小鼠體內產生抗抑郁和記憶損傷的作用[17-18]。Z-GS可通過抑制大鼠大腦組織和腦微血管內皮細胞中P-糖蛋白的活性和表達,發揮調控血腦屏障的作用[19]。筆者前期研究也發現,Z-GS腹腔給藥可通過抑制TLR4信號通路發揮抗炎腦保護作用[10]。本研究結果顯示,Z-GS給藥可顯著緩解腦梗死大鼠神經功能損傷和組織病理變化,表明了Z-GS潛在的抗腦卒中作用。
現代研究證實,氧化應激是缺血性腦卒中的主要病理機制之一。氧化應激是機體在遭受有害刺激,如腦缺血缺氧等,組織中ROS的產生和清除動態平衡被破壞,ROS的過度蓄積導致細胞氧化應激損傷[20]。正常生理狀況下,體內廣泛分布有GSH-Px、SOD和CAT等多種抗氧化酶,這些酶可對抗機體產生的自由基代謝產物[21]。缺血缺氧后,腦組織產生大量自由基,并通過多種途徑產生級聯反應加重腦損傷[22]。本研究結果顯示,大鼠制備MCAO模型后,腦組織中抗氧化酶GSH-Px、SOD和CAT水平下降,而MDA和ROS水平升高,表明模型組大鼠發生了氧化應激反應,Z-GS給藥后以上指標均被顯著逆轉,初步表明了Z-GS的抗氧化應激作用明顯。
Nrf2是調節氧化還原平衡的核心轉錄因子,在維持內皮細胞形態和保持血管功能完整性中發揮重要調控作用[23]。在生理狀態下,大部分Nrf2在細胞質中與其抑制性蛋白Keap1結合而處于失活狀態。當暴露于化學或組織特異性激酶等條件下,Nrf2與Keap1分離,從細胞漿轉移至細胞核內,與胞核內抗氧化劑反應元件ARE結合,從而調節Ⅱ相解毒或抗氧化酶基因的表達[24]。HO-1是Nrf2調控的重要基因之一,HO-1及酶解產物一起發揮抗氧化、抗凋亡等作用,是機體重要的內源性保護體系[25]。本課題組長期致力于心腦血管的保護研究,Nrf2/HO-1通路作為治療靶點已被多次證實[26-27]。本研究結果顯示,模型組大鼠腦組織Nrf2和HO-1蛋白表達低于假手術組,Z-GS組高于模型組。提示Z-GS抗氧化應激可能是通過促進Nrf2和HO-1的表達發揮作用。
綜上所述,Z-GS給藥可顯著緩解缺血性腦卒中大鼠神經功能損傷和氧化應激反應,其機制可能是通過激活Nrf2/HO-1通路,促進下游抗氧化因子表達。

