原發性/轉移性肝癌患者經肝動脈化療栓塞術或消融術后發生肝膿腫的病原菌分布及耐藥性分析
蔡妙甜,梁連春
首都醫科大學附屬北京佑安醫院 感染綜合科,北京 100069
經肝動脈化療栓塞術(TACE)及消融術已成為治療原發性肝癌、肝轉移癌等肝臟惡性腫瘤的主要手段,肝膿腫是術后常見嚴重并發癥之一,不僅影響肝癌治療效果,而且在治療不及時或方案不當時甚至可導致患者死亡。本文對本院肝癌TACE或消融術后肝膿腫患者的病原學資料進行了回顧性分析,旨在進一步了解此類患者的病原菌分布及耐藥情況,為臨床抗感染治療提供用藥參考。
1 資料與方法
1.1 研究對象 選取2011年1月-2018年12月北京佑安醫院收治的確診原發性或轉移性肝癌并行TACE或消融術且術后發生肝膿腫的患者,分為TACE組及消融組。對患者的肝膿液、血液培養分離菌株及藥敏試驗結果進行總結分析。本研究通過首都醫科大學附屬北京佑安醫院醫學倫理委員會審批,患者及家屬均簽署知情同意書。
1.2 TACE或消融術后肝膿腫診斷標準 (1)治療后4周內出現反復發熱,可伴畏寒、寒顫、右上腹部疼痛不適、黃疸等表現;(2)實驗室檢查提示外周血白細胞計數≥1.5×基礎值或<4×109/L,伴有中性粒細胞計數和(或)中性粒細胞比例、C反應蛋白、降鈣素原升高等;(3)B超顯示低回聲病灶,增強CT顯示病灶邊緣強化,病灶內可有分隔或氣腔形成;(4)肝膿液培養和(或)血培養陽性。
1.3 肝膿液、血液培養及菌種鑒定 按照《全國臨床檢驗操作規范(第4版)》要求采集肝膿液、血液標本。采用BD BACTEC FM200或BACTEC9120血培養系統(美國BD公司)、Phoenix100全自動細菌鑒定/藥敏分析系統(美國BD公司)進行細菌鑒定及藥敏分析。質控菌株肺炎克雷伯桿菌ATCC700603、大腸埃希菌ATCC25922、銅綠假單胞菌ATCC27853、金黃色葡萄球菌ATCC25923、糞腸球菌ATCC 29212均購自衛生部臨床檢驗中心。
1.4 污染菌判定 同一患者同種標本同時多瓶培養或多次培養出同一菌種按1株計算。肝膿液或血液培養檢出凝固酶陰性葡萄球菌、微球菌、芽孢桿菌、棒狀桿菌等時,如符合以下至少1項條件可判定為污染菌:(1)長時間培養后報陽,或連續多次多日培養,僅1次為上述菌種,或1次培養分離出≥2種上述菌種;(2)隨后多次培養證明為其他病原菌;(3)使用敏感抗生素治療無效。
1.5 統計學方法 應用SPSS22.0進行數據統計分析。計量資料以±s表示。計數資料采用株數及百分比表示,計數資料比較采用χ2檢驗。同一患者同種標本重復相同菌株按首次分離株結果進行分析。耐藥分析結果提示“中介”時均并入“耐藥”計算。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 共納入49例患者。TACE組15例,包括男10例,女5例,平均(61.1±2.5)歲。消融組34例,其中男31例,女3例,平均(56.2±1.7)歲。
2.2 TACE組病原菌分布 TACE組15例行肝膿液培養,14例陽性,陽性率93.3%;檢出單一菌5例,復數菌9例,復數菌檢出率64.3%;共分離25株病原菌,包括革蘭陰性菌15株,革蘭陽性菌9株,真菌1株。11例行血液培養,7例陽性,陽性率63.6%;檢出單一菌4例,復數菌3例,復數菌檢出率42.9%;分離10株病原菌,包括革蘭陰性菌4株,革蘭陽性菌5株,真菌1株。肝膿液、血液培養雙陽性率為63.6%(7/11),其中肝膿液與血液檢出菌完全或部分一致比例為85.7%(6/7)。 本組肝膿液及血液培養檢出革蘭陽性菌的患者比例分別為57.1%(8/14)及71.4%(5/7)。具體病原菌類型見表1。
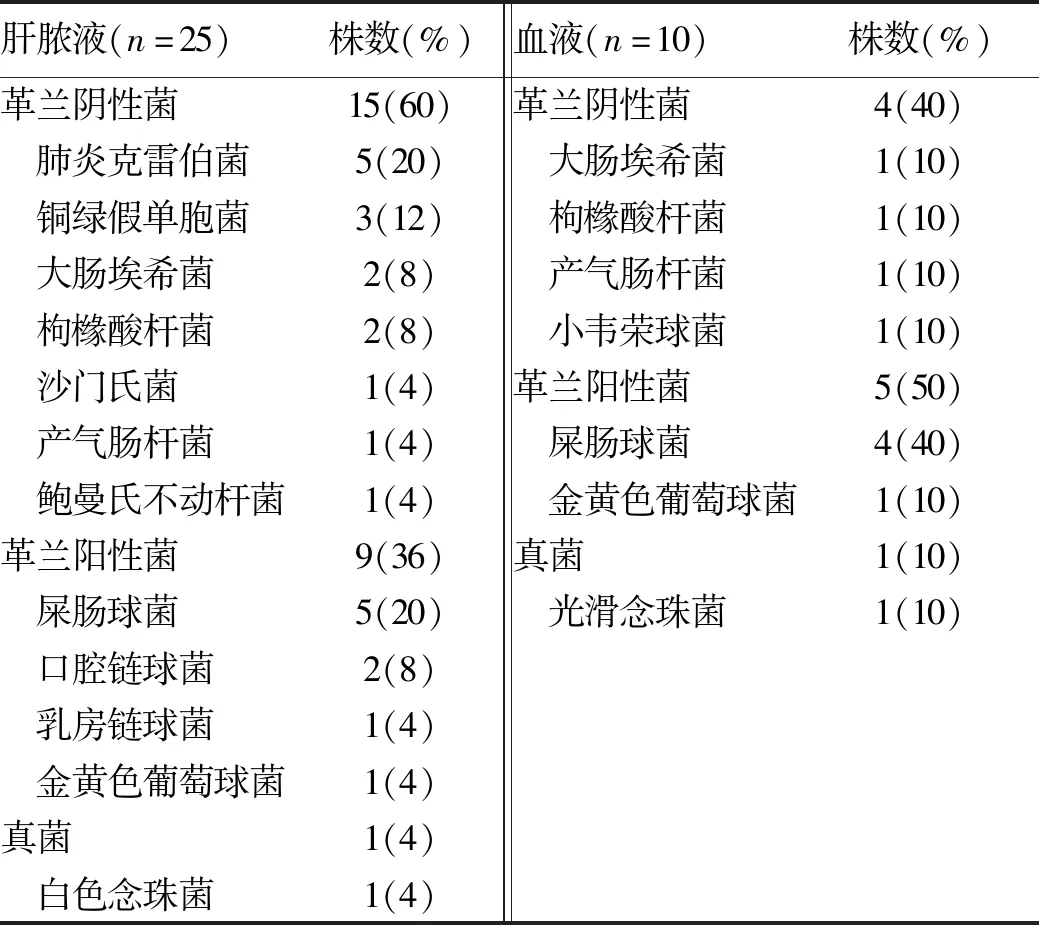
表1 TACE組肝膿液、血液培養病原菌分布
2.3 消融組病原菌分布 消融組32例行肝膿液培養,30例陽性,陽性率93.8%;檢出單一菌21例,復數菌9例,復數菌檢出率30.0%,與TACE組肝膿液培養復數菌檢出率(64.3%)比較,差異有統計學意義(χ2=4.642,P<0.05);分離43株病原菌,包括革蘭陰性菌28株,革蘭陽性菌14株,真菌1株。26例行血液培養,17例陽性,陽性率65.4%;檢出單一菌14例,復數菌3例,復數菌檢出率17.6%;分離21株病原菌,包括革蘭陰性菌10株,革蘭陽性菌11株。肝膿液培養、血液培養雙陽性率為58.3%(14/24),其中肝膿液與血液檢出菌完全或部分一致比例為92.9%(13/14)。本組肝膿液及血液培養檢出革蘭陽性菌的患者比例分別為43.3%(13/30)及58.8%(7/17)。具體病原菌分布見表2。
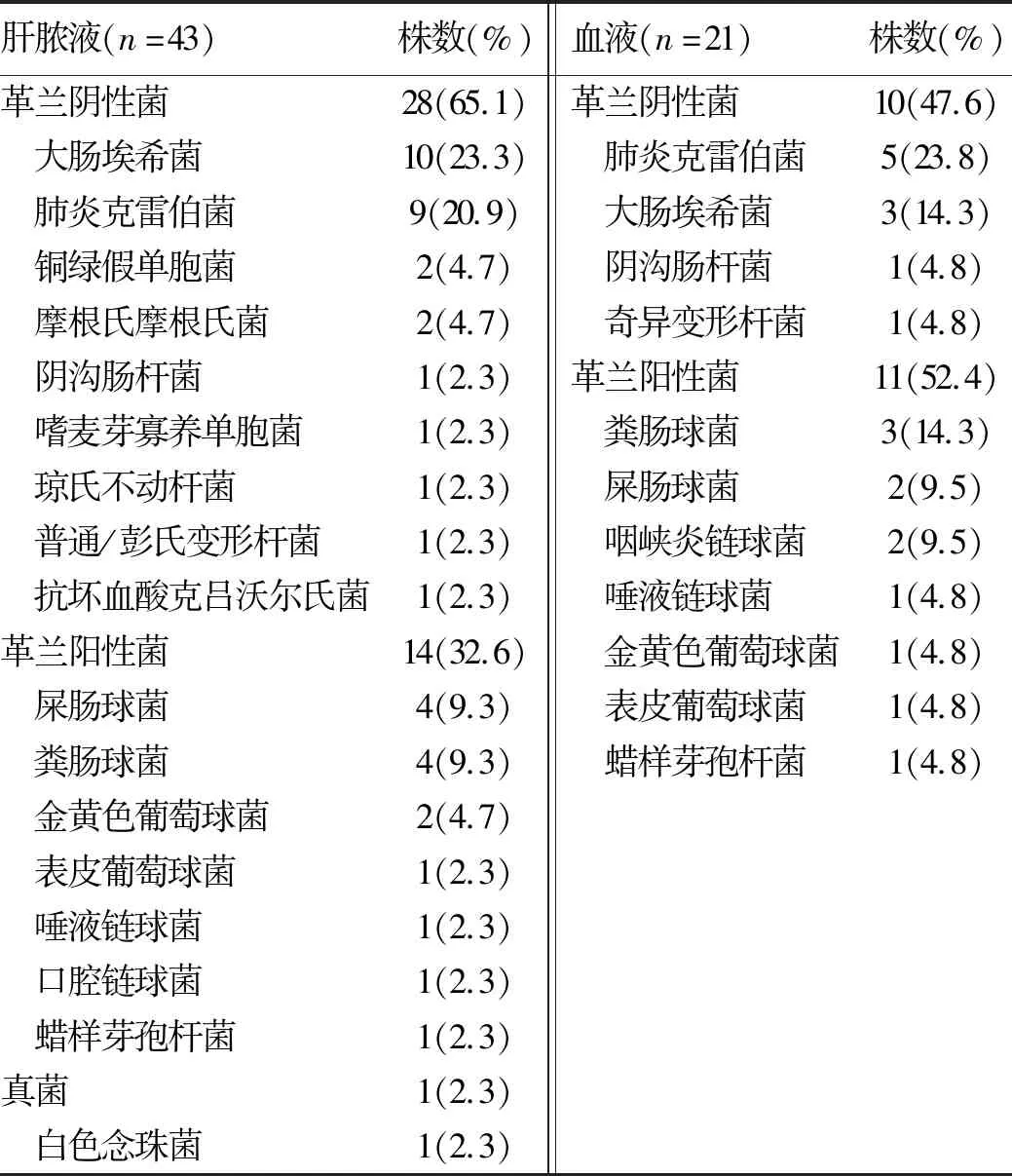
表2 消融組肝膿液及血液培養病原菌分布
2.4 49例患者主要革蘭陰性菌耐藥情況 49例患者肝膿液及血液共分離革蘭陰性菌主要為肺炎克雷伯菌(19株)、大腸埃希菌(16株)。肺炎克雷伯菌中檢出產超廣譜 β-內酰胺酶(Extended-Spectrum β-Lactamases, ESBLs)菌株5株(26.3%)、耐碳青霉烯類菌株2株(10.5%),對亞胺培南、美羅培南耐藥率分別為10.5%及5.3%;耐藥率較高的藥物包括:氨芐西林、氨芐西林/舒巴坦、頭孢唑林、哌拉西林、四環素等,耐藥率21.1%~100%;肺炎克雷伯菌對頭孢噻肟、頭孢他啶、環丙沙星、左氧氟沙星、慶大霉素、哌拉西林/他唑巴坦的耐藥率≤10.5%,未檢出阿米卡星耐藥菌株。大腸埃希菌中檢出產ESBLs菌株7株(43.8%),耐碳青霉烯類菌株2株(12.5%),對亞胺培南、美羅培南耐藥率均為12.5%;耐藥率較高的藥物包括:阿莫西林/克拉維酸、氨芐西林、氨芐西林/舒巴坦、哌拉西林、頭孢唑林、頭孢噻肟、頭孢他啶、環丙沙星、左氧氟沙星、四環素、復方新諾明等,耐藥率43.8%~62.5%;大腸埃希菌對哌拉西林/他唑巴坦的耐藥率為18.8%,未檢出阿米卡星耐藥菌株(圖1)。
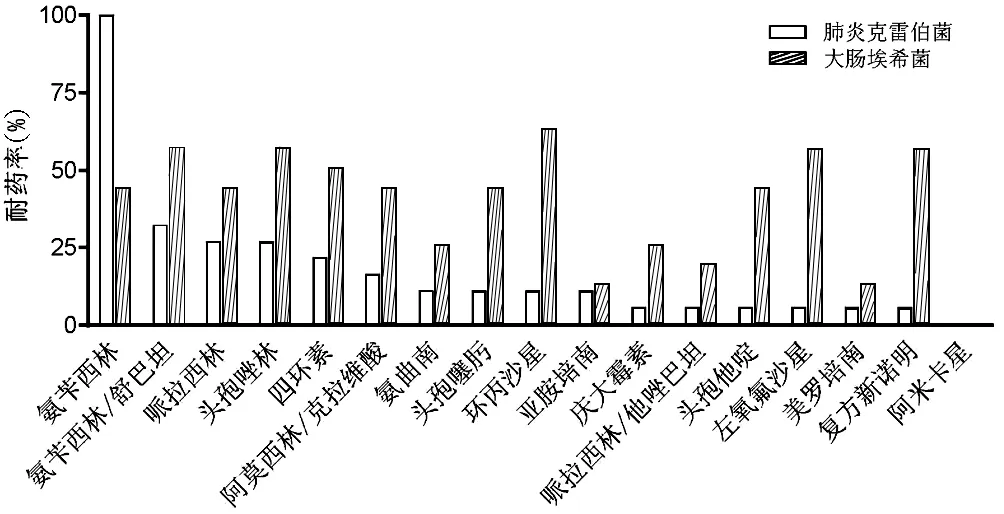
圖1 TACE組及消融組分離肺炎克雷伯菌、大腸埃希菌的耐藥率
2.5 49例患者主要革蘭陽性菌耐藥情況 49例患者肝膿液及血液共分離革蘭陽性菌主要為屎腸球菌(15株)、糞腸球菌(7株)等。屎腸球菌對紅霉素、環丙沙星、青霉素、氨芐西林、四環素的耐藥率均>50%,對高濃度慶大霉素、奎奴普丁/達福普汀耐藥率分別為46.7%及26.7%;檢出利奈唑胺及萬古霉素耐藥菌株各2株(13.3%);未檢出替考拉寧耐藥菌株。糞腸球菌對環丙沙星、青霉素、利奈唑胺耐藥率均為28.6%,未檢出萬古霉素及替考拉寧耐藥菌株,對其他被檢抗生素耐藥率均>50%(圖2)。
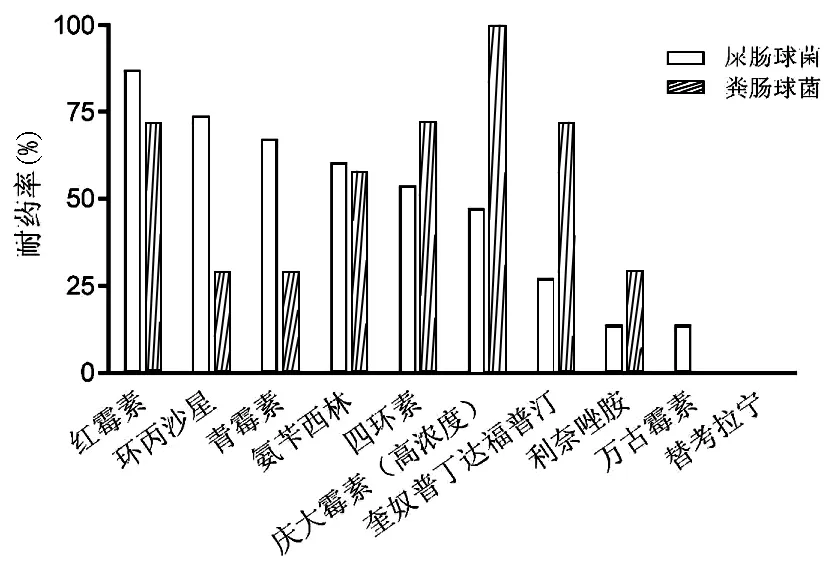
圖2 TACE組及消融組分離屎腸球菌、糞腸球菌的耐藥率
3 討論
肝膿腫是肝癌患者TACE或消融術后較為嚴重的并發癥之一,多在治療后8周內發生[1-2],主要臨床表現包括發熱、寒顫、腹痛等。一般認為發熱等癥狀持續2周以上者應高度懷疑肝膿腫,早期不易診斷,診治延誤或處理不當甚至可導致患者死亡。因此,明確肝癌TACE或消融術后肝膿腫病原菌分布及耐藥情況,對指導臨床早期抗感染治療具有重要意義。
早期認為革蘭陽性菌是導致此類肝膿腫形成的主要致病菌,因有研究[3]發現TACE術后肝膿腫肝膿液培養分離出革蘭陽性菌的患者比例高于分離出革蘭陰性菌的患者比例(93% vs 79%),另有數據[4]顯示此類肝膿腫患者肝膿液、血液培養所檢出病原菌中革蘭陽性菌達80%。近年來更多數據支持TACE術后肝膿腫致病菌以大腸埃希菌、克雷伯菌屬等革蘭陰性菌為主[1,5-7];這一病原學特點在消融術后肝膿腫患者中也得到了證實[6,8-9]。本研究中TACE組及消融組患者肝膿液中革蘭陰性菌檢出率≥60%,其中肺炎克雷伯菌、大腸埃希菌在2組中檢出率均較高。除上述革蘭陰性菌外,腸球菌也與TACE或消融術后肝膿腫的發生密切相關[3,8-9]。在介入、消融術后肝膿腫相關病原菌中,腸球菌檢出率明顯高于其他革蘭陽性菌[3,8,10-11],本研究結論與之一致,且發現屎腸球菌檢出率明顯高于糞腸球菌。
需指出的是,本研究中2組肝膿液培養以革蘭陰性菌總體檢出率更高,血液培養均為革蘭陽性菌總體檢出率更高。具體來看,TACE組血液培養中革蘭陰性菌尤其是肺炎克雷伯菌檢出減少明顯;消融組肝膿液及血液培養單一菌種檢出率仍以革蘭陰性菌占優勢,但兩類標本中檢出的革蘭陽性菌菌種數、菌株數較為接近,而革蘭陰性菌菌種數、菌株數間差異較大。造成2組血液培養與肝膿液培養之間檢出菌分布趨勢差異的確切原因尚無法說明,目前考慮可能與樣本量少、血液培養率、培養陽性率低等因素有關,或存在合并其他血流感染或菌血癥等。此外,TACE術后肝膿腫患者復數菌感染似比消融患者更多見。國外數據[1]顯示復數病原菌在TACE術后肝膿腫患者肝膿液及血液培養中檢出率≥60%。本研究中,TACE組肝膿液培養復數菌檢出率明顯高于消融組(64.3% vs 30.0%,P<0.05),制訂抗感染方案時應考慮上述病原學特點。
產生ESBLs是埃希菌屬、克雷伯菌屬等腸桿菌科細菌的主要耐藥機制。由于產ESBLs細菌常攜帶多種耐藥基因,所造成的多藥耐藥問題仍是臨床工作中的嚴峻挑戰。本研究中大腸埃希菌對所檢測青霉素類、喹諾酮類、頭孢菌素類藥物的耐藥率均>40%,耐藥結果與周宜慶等[12]報道類似,多藥耐藥現象嚴重,臨床中應嚴格參照藥敏試驗選用抗生素;對哌拉西林/他唑巴坦敏感性較好,耐藥率<20%;除阿米卡星外,對碳青霉烯類耐藥率最低,但數據高于國內平均水平[13]。肺炎克雷伯菌對碳青酶烯類、喹諾酮類、第三代頭孢菌素、含酶抑制劑復合制劑等多種抗菌藥物敏感性良好,臨床治療可供選擇較多。
埃希菌屬、克雷伯菌屬對碳青霉烯類耐藥性增加已成為不容忽視的問題,尤其是克雷伯菌屬。國內多中心數據[13]顯示2017年肺炎克雷伯菌對碳青霉烯類藥物平均耐藥率已超過20%,較2005年上升8倍。研究[14]發現耐碳青霉烯類肺炎克雷伯菌可同時攜帶多個耐藥基因,多藥耐藥機制與產ESBLs、碳青霉烯酶等有關,對青霉素類、含酶抑制劑復合制劑、氨曲南、頭孢菌素類、氨基糖苷類、喹諾酮類、碳青霉烯類等多種抗菌藥物表現出較高耐藥性,但對替加環素、多黏菌素敏感性較高,故臨床對于耐碳青霉烯類肺炎克雷伯菌可考慮替加環素、多黏菌素治療。
腸球菌是存在于人體腸道的條件致病菌,所致感染逐年增加,已成為我國醫院感染革蘭陽性菌中檢出率僅次于葡萄球菌的重要病原菌[13],其中屎腸球菌、糞腸球菌與感染性疾病關系最為密切[15]。研究[13,15]顯示,相比糞腸球菌,臨床標本中屎腸球菌檢出率更高,且對多種藥物表現出更強的耐藥性。本研究中,屎腸球菌對氨芐西林、環丙沙星、青霉素、紅霉素耐藥率均高于糞腸球菌。2017年CHINET數據[13]顯示,我國醫院檢出屎腸球菌及糞腸球菌對萬古霉素、利奈唑胺及替考拉寧的耐藥率分別為1.4%及0.1%、0.2%及1.2%、1.1%及0,本研究中屎腸球菌對萬古霉素及利奈唑胺耐藥率、糞腸球菌對利奈唑胺耐藥率明顯高于國內平均水平,這一方面說明耐藥率存在地域、醫院差異,另一方面說明本院對于相關藥物管理還需改進,臨床上治療腸球菌感染時,應根據耐藥特點和藥敏試驗結果合理選用抗菌藥物,減少因藥物不合理暴露導致耐藥菌株的產生。
目前多數研究在TACE、消融治療前后預防性應用抗生素[16-17],但效果仍存在爭議,且尚無預防性抗生素應用的標準方案。Geschwind等[18]發現相比單純靜脈途徑,靜脈聯合腸道預防應用抗生素能有效降低膽管手術后TACE患者肝膿腫的發生率,選擇針對膽系感染的抗生素也是加強預防效果的重要環節。動物實驗[19]證明Roux-en-Y膽管空腸吻合術后1周時肝內細菌濃度已明顯升高,2個月后僅下降約50%,且肝內分離到的大部分細菌類型與膽腸吻合口分離到的菌種一致。由此可見,腸道菌群移位、膽道內細菌定植、局部肝組織感染是一系列迅速且相對持續的過程,肝膿腫在TACE或消融術后2~90 d診斷[2-3,5,20]也間接說明了這一觀點,而預防性抗生素使用的療程較短,對于存在感染高風險因素的患者難以充分發揮預防作用。另外,考慮到TACE及消融術后肝膿腫總體發生率較低,大范圍使用預防性抗生素并不恰當。對于存在膽道手術史、糖尿病等高危因素的患者可給予廣譜抗生素以降低肝膿腫發生風險。
本研究主要不足在于:(1)樣本量小,數據受樣本量限制可能產生較大誤差,例如TACE組僅有7例血液培養陽性結果,但因考慮到血液培養是此類患者除肝膿液外主要病原學信息來源,臨床上有一定價值,為全面展示相關病原學信息,本文對血液培養結果進行了統計分析,供讀者參考。(2)對諸如性別、年齡等因素對病原菌分布及耐藥情況的影響未做考量。后續將針對上述不足作進一步研究及報道。
綜上所述,肝癌TACE或消融術后肝膿腫致病菌以肺炎克雷伯菌、大腸埃希菌等革蘭陰性桿菌及屎腸球菌、糞腸球菌等革蘭陽性球菌為主,建議加強標本培養及耐藥性監控,根據藥敏試驗合理選擇抗菌藥物,減少耐藥菌株產生。

