TRIM8在高糖高脂誘導的小鼠心肌細胞凋亡中的作用*
唐名揚, 宋志平, 侯娟妮, 馮 健, 馮 娟, 裴海峰△, 楊永健, △
(1 川北醫學院, 四川 南充 637000; 2西部戰區總醫院心內科, 四川 成都 610083)
目前,糖尿病已成為發達國家及發展中國家共同面對的巨大健康難題,根據國際糖尿病聯盟的統計,2017年全球糖尿病患者人數已達4.25億[1],其中2型糖尿病占所有糖尿病患者的90%,不僅如此,60%的2型糖尿病患者常常伴有血脂異常,主要表現為血中甘油三酯升高、低密度脂蛋白膽固醇正常或升高、高密度脂蛋白膽固醇降低和游離脂肪酸升高,其中以游離脂肪酸升高最為常見[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的主要心血管并發癥之一,2/3的2型糖尿病患者伴有心血管疾病危險因素或經歷過心血管事件,而血脂異常,特別是游離脂肪酸的增加被證實是導致這一現象的主要原因[2-3]。但目前DCM的防治效果并不理想,其龐大的患者人群和不斷攀升的發病率已成為嚴重的公共衛生問題。因此,有必要研究高糖尤其是合并高脂狀態下心肌易損性的機制與防范措施。
含三基序蛋白8(tripartite motif-containing protein 8,TRIM8)屬于TRIM蛋白家族成員,在固有免疫、炎癥反應及胰島素抵抗等多種病理過程中發揮著重要作用,例如它能夠介導非酒精性肝硬化[4]和高脂誘導的肥胖[5]等多種疾病的發生發展。除此之外,Chen等[6]報道TRIM8能夠通過介導炎癥反應和胰島素抵抗等途徑加重心肌肥厚。上述研究表明,TRIM8與心血管疾病在內的多種疾病的發病機制密切相關,但其在DCM中的作用尚無報道。因此,本研究在前期研究基礎上,在細胞水平采用高糖高脂(high glucose and high free acid, HGHF)培養基培養小鼠心肌細胞(mouse cardiomyocytes,MCMs)為模型,旨在研究糖尿病合并高脂的心肌細胞中TRIM8的作用及其相關機制,期望進一步揭示糖尿病心肌病的發生及發展機制。
材 料 和 方 法
1 細胞系及主要試劑
小鼠心肌細胞系購自豪地華拓生物科技有限公司,產品批號:HTX2799。DMEM培養基及胰蛋白酶購自HyClone;胎牛血清購Sigma;TRIzol和Lipofectamine 2000購自Invitrogen;反轉錄及PCR檢測試劑盒購自TaKaRa;qPCR 引物由成都擎科梓熙生物技術有限公司設計;二氫乙啶(dihydroethidium,DHE)超氧化物陰離子熒光探針購自凱基生物;annexin V-FITC/PI細胞凋亡檢測試劑盒購自BD;TRIM8-siRNA及scrambled siRNA (Scra-siRNA)購自銳博生物;抗α-actinin抗體購自Abcam;抗TRIM8抗體購自Santa Cruz;抗核因子E2相關因子2(nuclear factor E2-related factor 2, Nrf2)抗體購自CST;Nrf2抑制劑ML385購自Selleck。
2 實驗方法
2.1高糖高脂心肌細胞的培養 MCMs中加入含10%胎牛血清及1%雙抗的DMEM正常糖培養基(葡萄糖濃度為5.5 mmol/L),后置于5% CO2、37 ℃細胞培養箱中培養。選擇生長良好的對數生長期細胞,接種于6孔培養板中,給予高糖(葡萄糖濃度為33 mmol/L)及軟脂酸鈉(軟脂酸鈉濃度為300 μmol/L)培養基干預培養,并按分組進行實驗。
2.2免疫熒光染色鑒定小鼠心肌細胞 將MCMs制作成細胞爬片,待細胞生長至70%左右用PBS清洗3次;滴加50 μL破膜工作液,室溫孵育20 min后PBS清洗3次;3%牛血清白蛋白均勻覆蓋爬片,室溫封閉30 min后PBS清洗3次;加入I抗(抗α-actinin抗體,1∶100稀釋)4 ℃孵育過夜,PBS清洗3次;加入II抗(1∶500稀釋)37 ℃避光孵育60 min,PBS清洗3次;滴加DAPI復染核,避光孵育5 min,PBS清洗3次后晾干用抗熒光淬滅封片劑封片,置于熒光顯微鏡下觀察。
2.3流式細胞術檢測心肌細胞凋亡水平 用0.25%不含EDTA的胰酶消化收集各組細胞后,預冷PBS洗滌2次,binding buffer重懸細胞,加入 annexin V-FITC及PI各2.5 μL混勻細胞,檢測前5 min再加入binding buffer,流式細胞術檢測細胞凋亡率,FlowJo軟件分析數據。
2.4qPCR 檢測心肌細胞TRIM8、Nrf2、谷氨酸-半胱氨酸連接酶催化亞基(glutamate-cysteine ligase catalytic subunit, GCLC)、血紅素加氧酶(heme oxyge-nase-1, HO-1)和NAD(P)H:醌氧化還原酶1 [NAD(P)H:quinone oxidoreductase 1, NQO-1]的mRNA表達水平 采用TRIzol提取細胞的總RNA,再反轉錄為cDNA,qPCR擴增(引物序列見表1),GADPH為內參照,采用 2-ΔΔCt法計算目的基因的mRNA表達量。

表1 qPCR引物序列Table1. ThesequencesoftheprimersforqPCR
2.5Western blot檢測心肌細胞TRIM8及Nrf2的含量 取40 μg各組蛋白樣品,用SDS-PAGE分離,然后轉至PVDF膜上,于5%牛血清白蛋白中室溫封閉1 h;再用抗TRIM8抗體(1∶500)、抗Nrf2抗體(1∶1 000)和抗GAPDH抗體(1∶5 000)孵育,于4 ℃過夜;洗膜后再用 II 抗孵育(37 ℃,1 h),再次洗膜后發光并使用ImageJ軟件分析結果。目的蛋白相對表達量=目的蛋白灰度值/內參照蛋白灰度值。
2.6心肌細胞轉染 細胞培養以Lipofectamine 2000作為轉染試劑按50 nmol/L濃度進行TRIM8-siRNA轉染,每組設3個復孔,其中control組給予Lipofectamine 2000處理,TRIM8-siRNA組給予Lipofectamine 2000+TRIM8-siRNA處理,Scra-siRNA組給予Lipofectamine 2000+Scra-siRNA處理。轉染24 h后檢測細胞TRIM8 mRNA表達,48 h后檢測TRIM8蛋白表達以明確敲減效率。轉染48 h后給予33 mmol/L葡萄糖及300 μmol/L軟脂酸鈉繼續干預18 h并檢測MCMs的凋亡率、Nrf2表達水平及活性氧簇(reactive oxygen species,ROS)的水平。
2.7DHE染色實驗 將DHE熒光探針按5 μmol/L濃度用培養基稀釋后加入到各組細胞培養皿中,每組重復3孔,37 ℃避光孵育30 min,PBS清洗3次,采用激光共聚焦顯微鏡檢測DHE熒光水平并拍照。
2.8ML385配制 將ML385溶于100%DMSO中制備儲備溶液,接著用PBS稀釋成5% DMSO溶液再使用。
3 統計學處理
采用SPSS 16.0軟件進行統計分析。計量資料以均數±標準差(mean±SD)表示,兩組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析,進一步兩兩比較采用SNK-q檢驗。以P<0.05為差異有統計學意義。
結 果
1 高糖高脂增加MCMs的凋亡及ROS水平
用α-actinin免疫熒光鑒定小鼠心肌細胞,見圖1。經流式細胞術檢測MCMs的凋亡率,DHE染色法及流式細胞術檢測MCMs中ROS的含量,結果顯示在HGHF環境中,MCMs的凋亡率及ROS水平增加(P<0.05),見圖2、3。上述結果表明HGHF能增加MCMs的凋亡,氧化應激反應增強是HGHF致MCMs損傷的原因之一。

Figure 1. The identification of mouse cardiomyocytes. The scale bar=50 μm.
圖1 小鼠心肌細胞的鑒定
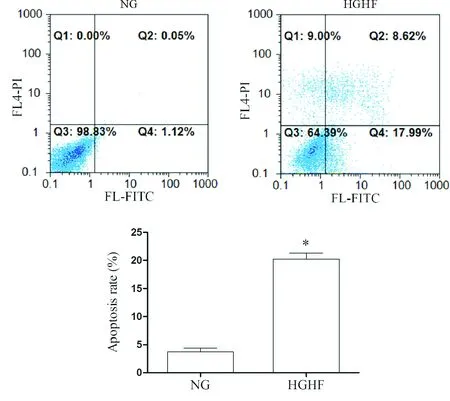
Figure 2. The effect of HGHF on the apoptosis of the MCMs 18 h after intervention was detected by flow cytometry. Mean±SD.n=6.*P<0.05vsNG group.
圖2 流式細胞術檢測各組細胞凋亡率
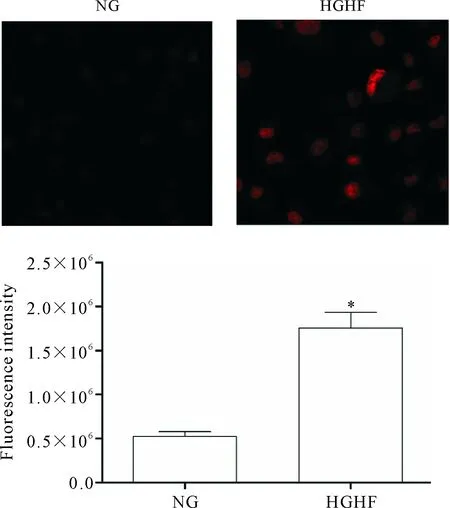
Figure 3. The effect of HGHF on the ROS production in the MCMs was detected by DHE staining (×400) and flow cytometry. Mean±SD.n=6.*P<0.05vsNG group.
圖3 流式細胞術檢測各組細胞ROS的生成
2 高糖高脂增加MCMs中TRIM8的表達水平
qPCR及Western blot檢測MCMs中TRIM8的表達水平,結果顯示在單獨HG及HF的作用下,MCMs中TRIM8的表達增加,HG合并HF可進一步增加TRIM8的表達,其表達量隨著干預時間的延長而增加(P<0.05),見圖4、5。

Figure 4. The expression of TRIM8 in the MCMs exposed to HGHF. A: the mRNA expression of TRIM8 was detected by qPCR; B: the results of Western blot for determining the protein expression of TRIM8. Mean±SD.n=6.*P<0.05vsNG group;#P<0.05vsHG group;△P<0.05vsHF group.
圖4 HGHF對各組細胞TRIM8 mRNA和蛋白表達的影響

Figure 5. The expression of TRIM8 in the MCMs exposed to HGHF for different time. A: the mRNA expression of TRIM8 was detected by qPCR; B: the results of Western blot for determining the protein expression of TRIM8. Mean±SD.n=6.*P<0.05vs0 h group;#P<0.05vs6 h group;△P<0.05vs12 h group.
圖5 HGHF對各組細胞TRIM8 mRNA和蛋白表達的影響
3 敲減TRIM8的表達減輕MCMs的凋亡并降低ROS水平
采用siRNA敲減MCMs中TRIM8的表達,通過qPCR及Western blot檢測對TRIM8的沉默效率,結果表明TRIM8 siRNA成功抑制了TRIM8在MCMs中的表達水平(P<0.05),見圖6。經流式細胞術檢測細胞凋亡率,DHE染色法及流式細胞術檢測MCMs中ROS的含量,結果表明TRIM8 siRNA/HGHF組MCMs的凋亡率及ROS水平明顯降低(P<0.05),見圖7。

Figure 6. The effects ofTRIM8expression knock-down on the expression of TRIM8 at mRNA and protein levels in the MCMs with or without HGHF exposure. A: the mRNA expression of TRIM8 in the MCMs after siRNA transfection for determining the knock-down efficiency; B and C: the effects ofTRIM8expression knock-down on the expression of TRIM8 at mRNA and protein levels in the MCMs exposed to HGHF. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsScra-siRNA group;△P<0.05vsScra-siRNA/PBS group;▲P<0.05vsScra-siRNA/HGHF group.
圖6 敲減TRIM8在MCMs中的效率驗證和對HGHF作用的影響
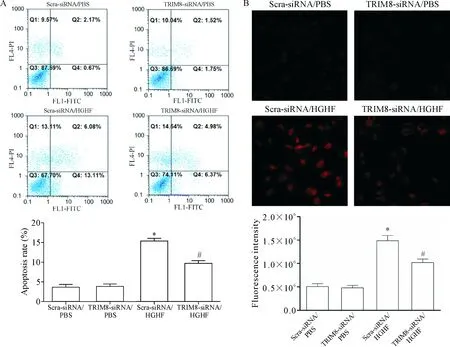
Figure 7. Knock-down ofTRIM8expression attenuated the apoptosis and ROS production in the MCMs exposed to HGHF. A: the results of flow cytometry for analyzing the apoptosis of the MCMs exposed to HGHF 18 h after intervention; B: the results of DHE staining (×400) and flow cytometry for analyzing the ROS production in MCMs. Mean±SD.n=6.*P<0.05vsScra-siRNA/PBS group;#P<0.05vsScra-siRNA/HGHF group.
圖7 敲減TRIM8表達減輕MCMs凋亡并降低ROS水平
4 高糖高脂減少MCMs中Nrf2的表達水平
Western blot檢測MCMs中Nrf2的蛋白表達水平,qPCR檢測Nrf2及其下游基因GCLC、HO-1和NQO-1的表達水平,結果表明在HGHF作用下,MCMs中的Nrf2及其下游基因GCLC、HO-1和NQO-1的表達降低(P<0.05),見圖8、9。
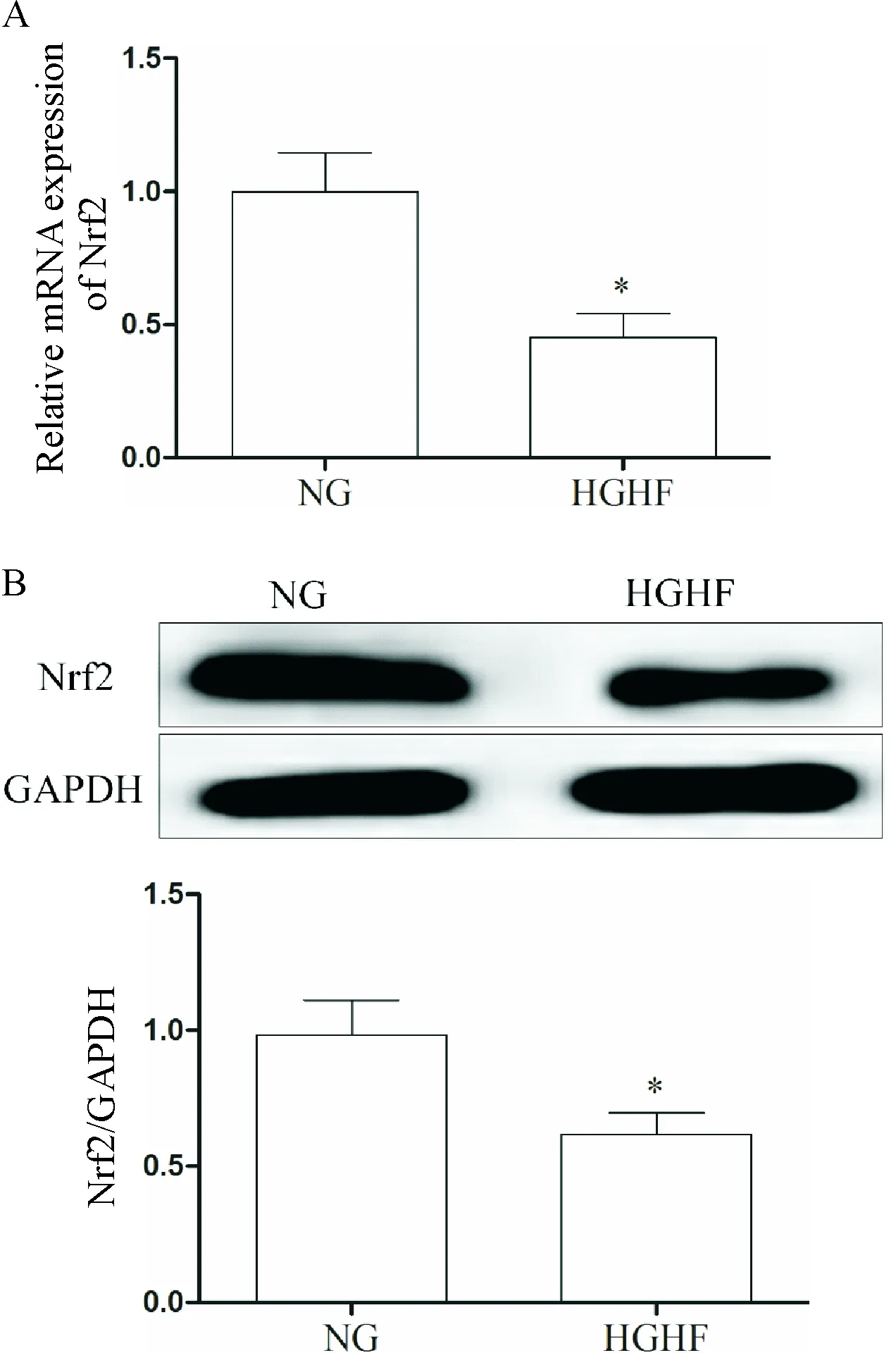
Figure 8. The effect of HGHF on the expression of Nrf2 in the MCMs. A: the mRNA expression detected by qPCR; B: the protein expression determined by Western blot. Mean±SD. n=6. *P<0.05 vs NG group.圖8 qPCR和Western blot檢測HGHF 對MCMs Nrf2蛋白表達的影響
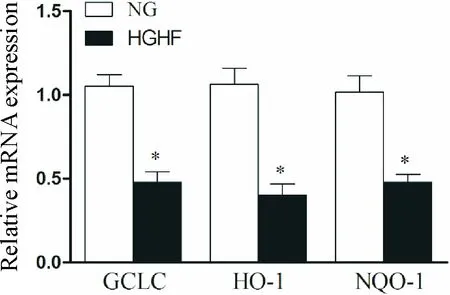
Figure 9. The effect of HGHF on the mRNA expression of the down-stream molecules of Nrf2 signalling pathway was detected by qPCR. Mean±SD.n=6.*P<0.05vsNG group.
圖9 qPCR檢測MCMs內Nrf2信號通路下游分子mRNA的表達
5 敲減TRIM8的表達增加MCMs中Nrf2的表達水平
敲減TRIM8的表達水平后,qPCR及Western blot檢測MCMs中Nrf2的表達水平,結果顯示TRIM8-siRNA/HGHF組的Nrf2表達水平升高(P<0.05),Nrf2下游基因GCLC、HO-1和NQO-1表達亦增加(P<0.05),表明TRIM8可影響Nrf2抗氧化通路及其下游基因GCLC、HO-1和NQO-1的表達,見圖10、11。
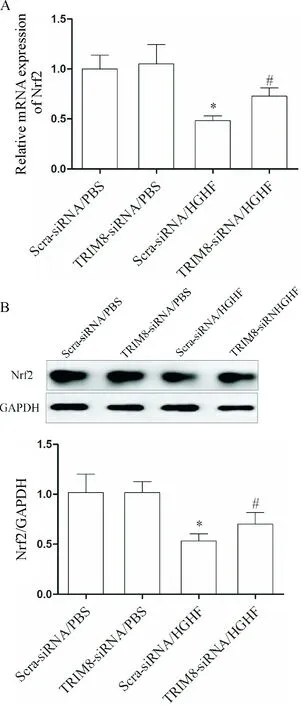
Figure 10. The efects ofTRIM8expression knock-down on the expression of Nrf2 at mRNA and protein levels in the MCMs with or without HGHF exposure. A: the mRNA expression was detected by qPCR; B: the protein expression determined by Western blot. Mean±SD.n=6.*P<0.05vsScra-siRNA/PBS groups;#P<0.05vsScra-siRNA/HGHF group.
圖10 敲減TRIM8對Nrf2在MCMs中表達和對HGHF作用的影響

Figure 11. The effects ofTRIM8expression knock-down on the mRNA expression of the down-stream molecules of Nrf2 signalling pathway in the MCMs with or without HGHF exposure were detected by qPCR. Mean±SD.n=6.*P<0.05vsScra-siRNA/PBS group;#P<0.05vsScra-siRNA/HGHF group.
圖11 敲減TRIM8表達對MCMs在HGHF條件下Nrf2信號通路下游分子mRNA表達的影響
6 Nrf2抑制劑ML385部分逆轉敲減TRIM8減輕MCMs損傷的作用
在敲減TRIM8表達的同時予以Nrf2特異性抑制劑ML385干預MCMs,qPCR結果顯示,在HGHF作用下,同樣轉染TRIM8-siRNA的細胞,用Nrf2特異性抑制劑ML385(4 μmol/L)干預18 h后,MCMs中的抗氧化分子Nrf2、GCLC、HO-1及NQO-1的表達減少(P<0.05),見圖12。流式細胞術及DHE檢測結果顯示,MCMs中的ROS及細胞凋亡水平增加(P<0.05),見圖13。這些結果表明 TRIM8通過抑制Nrf2的表達激活氧化應激反應,促進高糖高脂誘導的MCMs凋亡。

Figure 12. The effects of Nrf2 specific inhibitor ML385 andTRIM8expression knock-down on the mRNA expression of the down-stream molecules of Nrf2 signalling pathway in the MCMs with HGHF exposure detected by qPCR. Ts: TRIM8-siRNA. Mean±SD.n=6.*P<0.05vsHGHF/DMSO group;#P<0.05vsHGHF+Ts/DMSO group.
圖12 Nrf2特異性抑制劑ML385和敲減TRIM8表達對MCMs在HGHF條件下Nrf2信號通路下游分子mRNA表達的影響
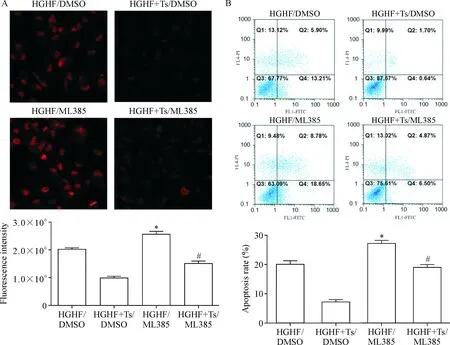
Figure 13. The effects of Nrf2 specific inhibitor ML385 andTRIM8expression knock-down on the ROS production and apoptosis of MCMs with HGHF exposure. A: DHE staining (×400) and flow cytometry for evaluating the ROS production; B: flow cytometry was used for analyzing the cell apoptosis. Mean±SD.n=6. Ts: TRIM8-siRNA.*P<0.05vsHGHF/DMSO group;#P<0.05vsHGHF+Ts/DMSO group.
圖13 Nrf2特異性抑制劑ML385和敲減TRIM8表達對MCMs在HGHF條件下ROS生成和細胞凋亡的影響
討 論
DCM是一種獨立于高血壓和冠心病的特異性心肌病,與糖尿病患者心力衰竭的高發生率和死亡率密切相關,且嚴重影響患者的生活質量。現有研究表明,DCM可能與糖脂代謝異常[7]、炎癥反應[8]和氧化應激[9]等多種因素相關,有學者認為氧化應激可能在DCM發生發展中起到關鍵性作用[10],在糖尿病合并高脂血癥患者中,高糖、高游離脂肪酸將導致心肌細胞內線粒體過氧化產物的堆積,從而導致細胞內ROS的增加,ROS的異常增加可以通過誘導心肌細胞凋亡,最終出現DCM的心臟功能及結構異常。在本研究中,我們采用HGHF培養MCMs來模擬糖尿病合并高脂環境,并檢測心肌細胞凋亡率及ROS水平,結果顯示在高糖合并高脂環境中,心肌細胞凋亡率及ROS水平增加,這與文獻報道一致[11-12]。
近年來,有研究發現,TRIM8能夠與多種底物相互作用,調節先天免疫、病毒反應和炎癥等病理過程[13-15]。Yan等[4]發現,TRIM8能夠通過激活脂代謝、胰島素抵抗和炎癥反應等途徑介導肝硬化的發生發展;而在心血管方面,Chen等[6]發現,TRIM8能夠通過激活心肌細胞的代謝異常、胰島素抵抗及炎癥等途徑加重心肌肥厚及心肌纖維化,以上研究證明TRIM8可能在DCM的發病過程中起作用,但目前暫無相關報道。在本研究中,用HG和HF分別干預MCMs后,TRIM8的表達明顯升高,而在HG合并HF的作用下,TRIM8的表達水平進一步升高,其表達量隨著干預時間的延長而增加,為了進一步探索TRIM8在DCM中的作用,我們給予心肌細胞特異性siRNA 來降低MCMs的TRIM8水平,結果顯示,降低TRIM8的表達能夠減輕MCMs的凋亡及 ROS 的生成。
既往有文獻報道,Nrf2所介導的抗氧化應激反應通路是細胞內最主要的抵御氧化應激產生的細胞毒性作用的途徑,當激活Nrf2后, 將啟動其下游GCLC、HO-1和NQO-1基因的轉錄及高效表達, 從而減輕ROS的產生,保護機體免受氧化應激的損傷[16-19]。在本研究中,我們觀察到HGHF干預后,MCMs中抗氧化分子Nrf2及其下游基因GCLC、HO-1和NQO-1的表達降低。既往研究發現,在病理情況下,TRIM8能夠通過Nrf2相關信號通路調節組織內氧化應激水平[20],所以我們推測TRIM8介導高糖高脂誘導心肌細胞凋亡的作用可能是通過調節Nrf2抗氧化通路產生的。本實驗發現降低TRIM8的表達能夠增加MCMs中Nrf2及其下游基因GCLC、HO-1和NQO-1的表達,為了進一步明確此機制,我們給予Nrf2特異性抑制劑ML385抑制Nrf2的表達,結果顯示ML385可降低細胞內Nrf2及其下游基因GCLC、HO-1和NQO-1的表達,升高ROS的含量,逆轉了敲減TRIM8表達減輕HGHF誘導MCMs凋亡的作用。上述結果表明TRIM8能夠通過抑制Nrf2通路的表達激活氧化應激反應增加高糖高脂誘導的心肌細胞凋亡。有文獻報道,TRIM8是TNF-α和IL-1β介導的NF-κB活性的關鍵調控分子[4, 6, 20],在DCM中,體內高血糖與蛋白質產生非酶糖化反應生成糖基化終產物,糖基化終產物修飾的蛋白質和脂質與心肌細胞表面的受體結合,使NF-κB表達增加,從而激活炎癥途徑,導致抗氧化分子減少以及大量的ROS產生,進而誘導細胞凋亡[21-22]。綜合之前的報道,我們推測在高糖高脂環境中,TRIM8可能通過激活NF-κB炎癥通路導致Nrf2抗氧化分子減少,從而使心肌細胞氧化應激水平增加,最終引起心肌細胞凋亡,故仍需在下一步實驗中明確TRIM8影響細胞內Nrf2通路及其氧化應激的具體機制。
綜上所述,TRIM8通過抑制Nrf2通路的表達激活氧化應激反應增加高糖高脂誘導的心肌細胞凋亡。這為糖尿病患者心血管方面的防護提供了新的理論基礎,有利于開發新的干預靶點和治療措施。

