通腑清營湯對(duì)膿毒癥急性肺損傷大鼠Fas及腫瘤壞死因子-α水平的影響
陳乾 任瀟瀟 韓丹 施榮 沈曉紅 熊旭東
摘要:目的??觀察通腑清營湯對(duì)膿毒癥急性肺損傷大鼠Fas和腫瘤壞死因子(TNF)-α水平的影響,探討其治療膿毒癥急性肺損傷的作用機(jī)制。方法??清潔級(jí)健康成年雄性SD大鼠隨機(jī)分為模型組、中藥組和地塞米松組,每組再分4個(gè)亞組(12、24、48、72 h時(shí)間點(diǎn))觀察,每組6只,共72只。各給藥組給予相應(yīng)藥液灌胃,模型組給予生理鹽水灌胃,每日1次,連續(xù)3 d。末次給藥2 h后采用盲腸結(jié)扎穿孔術(shù)制作膿毒癥急性肺損傷模型,分別于術(shù)后12、24、48、72 h處死大鼠,觀察大鼠一般情況;取大鼠肺組織稱重,測定大鼠肺組織濕/干重比值(W/D),HE染色觀察肺組織病理變化,TUNEL法檢測肺組織細(xì)胞凋亡指數(shù)(AI),Western blot檢測肺組織Fas蛋白表達(dá)量;采集肺泡灌洗液標(biāo)本,ELISA檢測TNF-α含量。結(jié)果??中藥組、地塞米松組術(shù)后大多時(shí)間點(diǎn)W/D值和AI均低于模型組(P<0.05,P<0.01),中藥組與地塞米松組比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05);中藥組和地塞米松組肺泡灌洗液TNF-α含量在術(shù)后不同時(shí)間點(diǎn)均較模型組顯著降低(P<0.01),中藥組肺泡灌洗液TNF-α含量術(shù)后各時(shí)間點(diǎn)較地塞米松組明顯增加(P<0.01);中藥組和地塞米松組肺組織Fas蛋白表達(dá)在術(shù)后48、72 h較模型組明顯降低(P<0.05),地塞米松組Fas蛋白表達(dá)術(shù)后48 h低于中藥組(P<0.05)。結(jié)論??通腑清營湯具有減輕膿毒癥急性肺損傷大鼠炎癥反應(yīng)及抗凋亡的作用,其機(jī)制與下調(diào)模型大鼠肺組織Fas蛋白的表達(dá)、抑制TNF-α炎癥介質(zhì)的水平相關(guān)。
關(guān)鍵詞:通腑清營湯;膿毒癥;急性肺損傷;Fas蛋白;腫瘤壞死因子-α;大鼠
中圖分類號(hào):R285.5 ???文獻(xiàn)標(biāo)識(shí)碼:A ???文章編號(hào):1005-5304(2019)12-0040-05
DOI:10.3969/j.issn.1005-5304.2019.12.010 ?開放科學(xué)(資源服務(wù))標(biāo)識(shí)碼(OSID):
Effects of Tongfu Qingying?Decoction on Fas and TNF-α in Rats with Acute Lung Injury Induced by Sepsis
CHEN Qian, REN?Xiaoxiao, HAN Dan, SHI Rong, SHEN?Xiaohong,?XIONG?Xudong
Shuguang Hospital Affiliated to Shanghai University of TCM, Shanghai 200021, China
Abstract: Objective?To observe the effects?of Tongfu Qingying Decoction?on Fas protein and TNF-α?in rats with acute lung injury induced by sepsis; To discuss the mechanism of Tongfu Qingying Decoction in treating acute lung?injury by sepsis. Methods?Clean healthy adult male SD rats were randomly divided into model group,?TCM group and dexamethasone group, each group was divided into four subgroups (12?h, 24?h, 48?h and 72?h), with?6 cases in each group,?a total of 72 rats. Each administration group was given relevant medicine for gavage, and model group was given saline for gavage, once a day for 3 d. Acute lung injury model of sepsis was prepared by cecal ligation and perforation after 2 h of last administration. Rats were sacrificed at 12, 24, 48, 72?h after operation and the general condition of rats were observed. Rat lung tissue was taken and weighed to determine the wet/dry weight ratio (W/D) of lung tissue. HE staining was used to observe the pathological changes of lung tissue. TUNEL method was used to detect the apoptosis index (AI) of lung tissue. The amount of Fas protein expression in lung tissue?was detected by Western blot. The alveolar lavage fluid samples were collected and the TNF-α content was detected by ELISA.
Results?Compare with the model group, W/D values and AI of TCM group and dexamethasone group were lower at most postoperative time points (P<0.05, P<0.01), but there was no statistical significance in W/D values and AI between TCM group and dexamethasone group (P>0.05).?The content of TNF-α in alveolar lavage fluid in TCM group and dexamethasone group was significantly lower than that in the model group at different postoperative time points (P<0.01).?The content of TNF-α in alveolar lavage fluid in TCM group was higher than that in the dexamethasone group at each postoperative time point (P<0.01).?The expression of Fas protein in lung tissues of TCM group and dexamethasone group?was lower than that of the model group at 48?h and 72?h after operation (P<0.05), and the expression of Fas protein in dexamethasone group was lower than that of TCM group at 48h after operation (P<0.05). Conclusion?Tongfu Qingying Decoction?has the effects of alleviating the inflammatory reaction and anti-apoptosis in rats with acute lung injury induced by sepsis. The mechanism is related to down-regulating the expression of Fas protein in the lung tissue of rats and inhibiting the expression of TNF-α inflammatory mediators.
Keywords:?Tongfu Qingying Decoction; sepsis; acute lung injury; Fas protein; TNF-α; rats
膿毒癥是由于機(jī)體對(duì)炎癥反應(yīng)失調(diào)而引發(fā)危及生命的器官功能障礙疾病[1],其中肺組織是膿毒癥最易累及的靶器官,其超高的炎癥反應(yīng)被視為主要病理生理改變[2]。研究顯示,過強(qiáng)炎癥反應(yīng)可誘導(dǎo)細(xì)胞凋亡,并通過Fas/Fas-L凋亡途徑介導(dǎo)膿毒癥導(dǎo)致急性肺損傷[3]。因此,針對(duì)細(xì)胞凋亡途徑對(duì)膿毒癥進(jìn)行研究是近年來新的熱點(diǎn)。由于膿毒癥急性肺損傷病機(jī)為營熱腑實(shí),故本實(shí)驗(yàn)通過盲腸結(jié)扎穿孔術(shù)法建立膿毒癥急性肺損傷大鼠模型,運(yùn)用自擬方通腑清營湯干預(yù),觀察其對(duì)模型大鼠Fas及腫瘤壞死因子(TNF)-α水平的影響,為進(jìn)一步闡明通腑清營湯治療膿毒癥急性肺損傷的作用機(jī)制提供依據(jù)。
1 ?材料與方法
1.1 ?動(dòng)物
清潔級(jí)雄性SD大鼠,72只,體質(zhì)量(180±20)g,上海中醫(yī)藥大學(xué)動(dòng)物實(shí)驗(yàn)中心提供,動(dòng)物質(zhì)量合格證號(hào)2008001666079,動(dòng)物生產(chǎn)許可證號(hào)SYXK(滬)2014-0008。飼養(yǎng)于溫度20~22 ℃、相對(duì)濕度45%~55%環(huán)境,正常光照,自由攝食飲水。
1.2 ?藥物及制備
通腑清營湯[桃仁10 g,大黃(后下)10 g,芒硝(沖)10 g,玄參15 g,赤芍15 g,當(dāng)歸15 g,金銀花15 g,連翹15 g,麥冬10 g],飲片由上海中醫(yī)藥大學(xué)附屬曙光醫(yī)院中藥房提供并煎制。除芒硝外用10倍體積蒸餾水浸泡30 min,之后7味中藥先煎煮10 min后加入大黃,再煎煮10 min,熄火留取藥液。重新加6倍體積的蒸餾水進(jìn)行第2次煎煮直至沸騰,再用小火煎煮20 min,熄火留取藥液。將2次藥液混合,紗布過濾藥渣后加入芒硝,充分?jǐn)嚢柚敝镣耆芙猓捎盟≌舭l(fā)方法將藥液濃縮為1 g原藥材/mL藥液,并分裝于無菌塑料瓶中,置于4 ℃冰箱保存?zhèn)溆谩5厝姿闪姿徕c注射液,山西省芮城科龍獸藥有限公司,批號(hào)20160501;戊巴比妥鈉,上海威奧生物科技有限公司,批號(hào)20160120。
1.3 ?主要試劑與儀器
TNF-α酶聯(lián)免疫檢測試劑盒(英國Abcam公司,批號(hào)2017006),兔抗大鼠Fas多克隆抗體(英國Abcam公司,批號(hào)2017003),β-actin多克隆抗體(上海威奧生物科技有限公司,批號(hào)2017002),DAB顯色試劑盒(武漢博士德生物試劑公司,批號(hào)2017002),原位細(xì)胞凋亡試劑盒和DAB顯色試劑盒(武漢博士德生物試劑公司,MK1020,批號(hào)2017004)。全自動(dòng)多功能酶標(biāo)儀(美國Bio-Rad公司),空氣搖床培養(yǎng)箱(Barloworld scientific公司,型號(hào)stuarts150),Thermo Fresco17離心機(jī)(美國Thermo公司),電子分析水平(賽多利斯公司,型號(hào)BSA2245-cw),電熱恒溫干燥箱(天津市賽得利斯實(shí)驗(yàn)分析儀器制造廠,型號(hào)202-00A),電泳儀(北京市六一儀器廠,型號(hào)DYY-50),小型Trans-Blot轉(zhuǎn)印槽(美國Bio-Rad公司),Mini-PROTEAN3電泳槽(美國Bio-Rad公司),包埋機(jī)(德國徠卡,型號(hào)Leica EG1160),切片機(jī)(德國徠卡,型號(hào)Leica RM2035),自動(dòng)脫水機(jī)(德國徠卡,型號(hào)Leica ASP300),葉拓101數(shù)顯鼓風(fēng)干燥機(jī),顯微鏡(日本OLYMPUS,型號(hào)BX43)。
1.4 ?造模
參照文獻(xiàn)[4]方法,采用大鼠盲腸結(jié)扎穿孔術(shù)復(fù)制膿毒癥模型。造模前12 h禁食不禁飲水,造模時(shí)2%戊巴比妥鈉(1 mL/kg)腹腔注射麻醉并固定,備皮消毒,于腹正中切開1.5 cm切口,找到盲腸并于其根部結(jié)扎,用18號(hào)針于結(jié)扎處遠(yuǎn)端貫穿3次后放回腹腔,縫合切口。縫合后,為補(bǔ)充手術(shù)中丟失的體液,生理鹽水(30 mL/kg)皮下注射。術(shù)后自由攝食飲水。
1.5 ?分組及給藥
按隨機(jī)數(shù)字表將實(shí)驗(yàn)大鼠分為模型組、中藥組和地塞米松組,每組再分4個(gè)亞組(12、24、48、72 h時(shí)間點(diǎn))觀察,每組6只,共72只。模型組大鼠給予生理鹽水灌胃(10 mL/kg),每日1次,連續(xù)3 d;中藥組大鼠給藥劑量按人和動(dòng)物間體表面積折算等效劑量[5],灌胃量為9.9 g/kg,給藥體積1 mL/100 g,每日1次,連續(xù)3 d;地塞米松組大鼠腹腔注射地塞米松(5 mg/kg)[6],每日1次,連續(xù)3 d。
1.6 ?標(biāo)本采集
各組分別于術(shù)后12、24、48、72 h處死大鼠,并收集肺泡灌洗液和肺組織標(biāo)本。
1.7 ?檢測指標(biāo)
觀察大鼠術(shù)后大體情況,包括外觀形態(tài)、精神狀態(tài)、活動(dòng)情況、呼吸狀態(tài)等;用濾紙吸取右肺上葉肺組織表面滲液和血跡,稱取濕重,置于60 ℃烤箱內(nèi)連續(xù)烘烤72 h后達(dá)恒重,再次稱重獲得干重,計(jì)算肺組織濕重/干重比值(W/D),右肺中葉組織標(biāo)本用4%多聚甲醛固定,并脫水、包埋,隨后肺組織HE染色,光鏡觀察肺組織病理形態(tài),DAB顯色后蘇木素復(fù)染,觀察肺組織凋亡指數(shù)(AI)。各時(shí)間點(diǎn)收集肺泡灌洗液,將灌洗液1200 r/min離心10 min,留取上清液,-20 ℃凍存,ELISA檢測肺泡灌洗液中TNF-α含量。各時(shí)間點(diǎn)取肺組織,冰浴條件勻漿,4 ℃、1200 r/min離心10 min,取上清液-70 ℃冰箱保存,Western blot檢測肺組織Fas蛋白表達(dá)。
1.8 ?統(tǒng)計(jì)學(xué)方法
采用SPSS17.0統(tǒng)計(jì)軟件進(jìn)行分析。實(shí)驗(yàn)數(shù)據(jù)以x(—)±s表示,多組間比較采用方差分析。P<0.05表示差異有統(tǒng)計(jì)學(xué)意義。
2 ?結(jié)果
2.1 ?一般狀況
模型組大鼠術(shù)后呈蜷縮狀、精神萎靡,毛發(fā)豎立,腹部膨隆,呼吸急促,活動(dòng)量減少,大便不通,隨著時(shí)間延長,模型組大鼠情況逐漸加重;中藥組及地塞米松組大鼠外觀形態(tài)、精神狀態(tài)、活動(dòng)量等表現(xiàn)術(shù)后不同時(shí)間點(diǎn)均較模型組改善,但組間比較無明顯差異。開胸后模型組大鼠肺組織色澤黯紅、有瘀點(diǎn)和瘀斑,隨著時(shí)間的延長,模型組大鼠肺組織大體情況逐漸嚴(yán)重;中藥組和地塞米松組大鼠肺組織大體表現(xiàn)術(shù)后不同時(shí)間點(diǎn)均較模型組改善,但組間無明顯差異。
2.2 ?肺組織病理變化
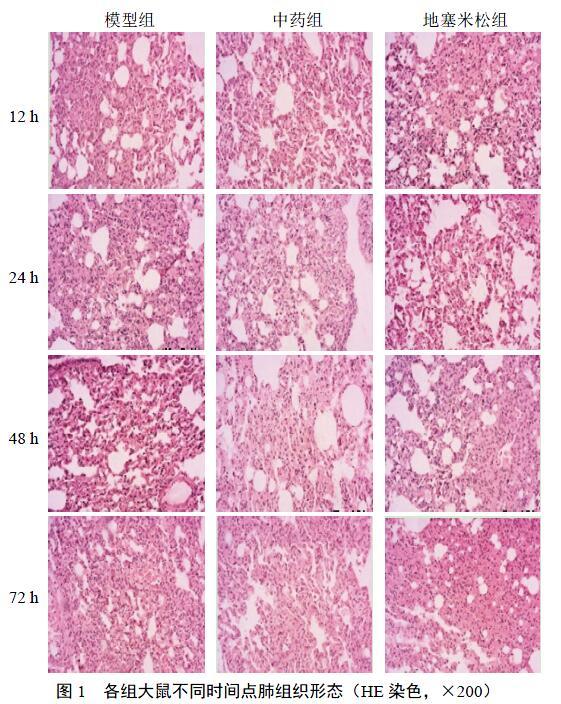
模型組大鼠隨著術(shù)后時(shí)間延長,肺泡腔逐漸縮小,并伴有大量炎性細(xì)胞浸潤及出血,肺間質(zhì)水腫和肺實(shí)變明顯;中藥組、地塞米松組較模型組大鼠肺組織損傷范圍較小,部分肺泡腔內(nèi)有少量炎性細(xì)胞浸潤和少量出血,肺間質(zhì)水腫和肺實(shí)變較輕,但2組肺組織病理變化無明顯差異。見圖1。
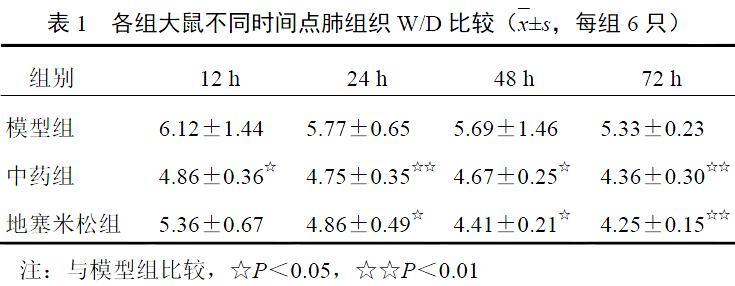
2.3 ?通腑清營湯對(duì)模型大鼠肺組織濕重/干重比值的影響
中藥組大鼠肺組織W/D在術(shù)后不同時(shí)間點(diǎn)均低于模型組(P<0.05,P<0.01);地塞米松組大鼠肺組織W/D術(shù)后除12 h時(shí)間點(diǎn)外均低于模型組(P<0.05,P<0.01);2組組間比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。結(jié)果見表1。
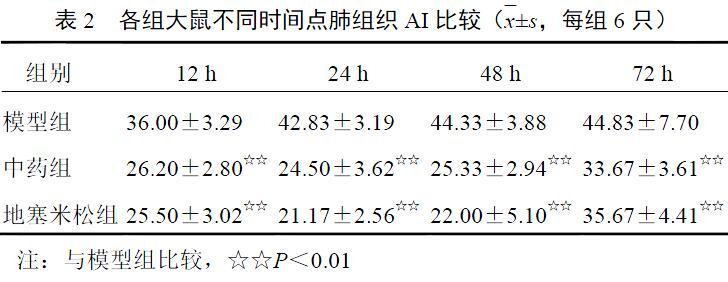
2.4 ?通腑清營湯對(duì)模型大鼠肺組織凋亡指數(shù)的影響
中藥組和地塞米松組大鼠肺組織AI在術(shù)后不同時(shí)間點(diǎn)均低于模型組(P<0.01),2組組間比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。結(jié)果見表2。2.5 ?通腑清營湯對(duì)模型大鼠肺泡灌洗液腫瘤壞死因子-α含量的影響
隨著術(shù)后時(shí)間延長,模型組、中藥組及地塞米松組大鼠肺泡灌洗液TNF-α含量呈上升趨勢(shì),但中藥組和地塞米松組大鼠肺泡灌洗液TNF-α含量在術(shù)后各時(shí)間點(diǎn)均顯著低于模型組,差異有統(tǒng)計(jì)學(xué)意義(P<0.01);地塞米松組大鼠肺泡灌洗液TNF-α含量在術(shù)后各時(shí)間點(diǎn)均低于中藥組,差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。結(jié)果見表3。
2.6 ?通腑清營湯對(duì)模型大鼠肺組織Fas蛋白表達(dá)的影響
隨著術(shù)后時(shí)間的延長,模型組、中藥組和地塞米松組大鼠肺組織Fas蛋白表達(dá)均呈逐漸上升趨勢(shì),但中藥組和地塞米松組大鼠肺組織Fas蛋白表達(dá)術(shù)后48、72 h顯著低于模型組(P<0.05,P<0.01);地塞米松組大鼠肺組織Fas蛋白表達(dá)術(shù)后48 h顯著低于中藥組(P<0.05)。結(jié)果見表4、圖2。
3 ?討論
膿毒癥臨床表現(xiàn)屬中醫(yī)溫病范疇。通過對(duì)膿毒癥急性肺損傷患者長期臨床觀察發(fā)現(xiàn),膿毒癥急性肺損傷的演變過程與衛(wèi)氣營血的傳變過程大致類似,炎癥風(fēng)暴相當(dāng)于溫?zé)岵≈袣夥肿C、營分證[7]。膿毒癥急性肺損傷時(shí),由于營熱毒邪侵襲,肺宣發(fā)肅降失常,故而可見到膿毒癥急性肺損傷患者氣喘表現(xiàn)明顯,因肺輸布津氣失常,全身氣血津液來源匱乏,同時(shí)營熱更加耗竭陰液,更易導(dǎo)致腸中津液損耗,從而導(dǎo)致腸內(nèi)腑氣不通,燥屎內(nèi)結(jié),致使?fàn)I熱無外出之路,加重患者病情。因此,膿毒癥急性肺損傷主要病機(jī)為營熱腑實(shí)。本實(shí)驗(yàn)以清營熱活血通腑為治療大法,自擬通腑清營湯干預(yù)膿毒癥急性肺損傷大鼠,通過清熱通腑兼滋陰活血,以期祛除營分熱邪。通腑清營湯具有通腑瀉熱、養(yǎng)陰活血功效。方中大黃、芒硝、桃仁為君藥,三者合用共奏清熱、通腑、活血化瘀之功;玄參、赤芍、當(dāng)歸、麥冬四者為臣藥,具有養(yǎng)陰活血潤腸之功;佐用金銀花、連翹,清熱解毒、疏散風(fēng)熱,清輕透邪,使?fàn)I分熱邪有外達(dá)之機(jī),促其透出氣分而解。全方瀉熱不忘通腑,清營不忘養(yǎng)營陰。
膿毒癥急性肺損傷發(fā)病機(jī)制復(fù)雜,近年來,免疫炎癥反應(yīng)一直是膿毒癥研究中的熱點(diǎn),TNF-α是典型的促炎癥細(xì)胞因子,其中TNF-α是炎癥因子中釋放最早的炎性介質(zhì),通過活化NF-κB信號(hào)通路刺激下游的IL-6、IL-8等炎癥因子的合成和釋放[8],可觸發(fā)和啟動(dòng)炎癥反應(yīng),通過阻斷TNF-α的表達(dá),能特異性地減輕肺組織的損傷[9]。本研究顯示,隨著術(shù)后時(shí)間的延長,模型組大鼠肺組織W/D、肺泡灌洗液TNF-α水平呈逐漸上升趨勢(shì),提示膿毒癥急性肺損傷時(shí),促炎介質(zhì)TNF-α參與肺內(nèi)組織損傷。通過給予中藥和地塞米松干預(yù),W/D及肺泡灌洗液TNF-α水平在術(shù)后各時(shí)間點(diǎn)均較模型組降低,地塞米松組TNF-α水平較中藥組低,提示通腑清營湯雖然抗炎效應(yīng)不及地塞米松,但減輕肺組織損傷的療效與地塞米松相當(dāng)。
隨著研究的進(jìn)展,研究者們發(fā)現(xiàn)細(xì)胞凋亡也參與膿毒癥急性肺損傷炎癥反應(yīng)的過程[10]。細(xì)胞凋亡區(qū)別于細(xì)胞壞死,是為了維持機(jī)體內(nèi)環(huán)境穩(wěn)定,在一系列凋亡基因的調(diào)控下發(fā)生的主動(dòng)、有序的死亡過程[11]。目前與凋亡相關(guān)的信號(hào)通路有死亡受體介導(dǎo)的外源性凋亡通路、線粒體介導(dǎo)的內(nèi)源性凋亡通路和內(nèi)質(zhì)網(wǎng)應(yīng)激介導(dǎo)的內(nèi)源性凋亡通路3條,其中以Fas/Fas-L為途徑的死亡受體信號(hào)轉(zhuǎn)導(dǎo)是細(xì)胞凋亡的主要通路[12-13]。有研究者用盲腸結(jié)扎穿孔術(shù)建立膿毒癥急性肺損傷小鼠模型,發(fā)現(xiàn)Fas/Fas-L凋亡途徑介導(dǎo)的細(xì)胞凋亡在膿毒癥急性肺損傷的發(fā)生發(fā)展過程中發(fā)揮了重要作用[14]。膿毒癥急性肺損傷發(fā)生后,TNF-α大量釋放,促使肺泡上皮細(xì)胞的死亡受體Fas大量表達(dá),激活Fas/Fas-L凋亡途徑,誘導(dǎo)細(xì)胞凋亡[15]。本研究發(fā)現(xiàn),隨著術(shù)后時(shí)間延長,模型組大鼠AI及Fas蛋白水平呈逐漸上升趨勢(shì),通過給藥干預(yù),中藥組和地塞米松組大鼠肺組織AI和Fas蛋白水平降低,但二者無明顯差異。提示通腑清營湯可通過下調(diào)肺組織Fas蛋白的表達(dá),抑制肺內(nèi)TNF-α炎癥介質(zhì)的水平,發(fā)揮抗凋亡的作用,其作用與地塞米松相似。
綜上所述,本研究表明通腑清營湯除可減輕肺組織損傷和抗炎外,其抗細(xì)胞凋亡作用可能是減輕膿毒癥肺損傷的另一個(gè)途徑,其機(jī)制尚待進(jìn)一步深入研究。
參考文獻(xiàn):
[1] DELLINGER R P, LEVY M M, RHODES A, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock,2012[J]. Intensive Care Med,2013,39(2):165-228.
[2] RHODES A, EVAN L E, ALHAZZANI W, et al. Surviving sepsis campaign:international guidelines for management of sepsis and septic shock:2016[J]. Intensive Care Med,2017,43(3):304-377.
[3] HENSON P M. Possible roles for apoptosis and apoptotic cell recognition in inflammation and fibrosis[J]. Am J Respir Cell Mol Biol,2003,29(3 Suppl):S70-S76.
[4] MATSUDA N, YAMAMOTO S, TAKANO K, et al. Silencing of Fas-associated death domain protects mice from septic lung inflammation and apoptosis[J]. Am J Respir Crit Care Med,2009, 179(9):806-815.
[5] 徐叔云,卞如濂,陳修.藥理實(shí)驗(yàn)方法學(xué)[M].北京:人民衛(wèi)生出版社, 2002:202-204.
[6] 王俏,朱虹,周龍女,等.熱休克蛋白70在膿毒癥急性肺損傷大鼠中的表達(dá)及藥物干預(yù)的研究[J].上海醫(yī)學(xué),2010,33(10):934-937.
[7] 李志軍,李銀平.從“衛(wèi)氣營血”辨證到“三證三法”看膿毒癥的診治思辨[J].中華危重病急救醫(yī)學(xué),2019,31(2):135-138.
[8] 唐甜,譚利平.炎癥反應(yīng)在膿毒癥ARDS發(fā)病機(jī)制中的作用[J].重慶醫(yī)學(xué),2017,46(15):2146-2149.
[9] JESMIN S, YAMAGUCHI N, ZAEDI S, et al. Time-dependent expression of endothelin-1 in lungs and the effects of TNF-α?blocking peptide on acute lung injury in an endo toxemic rat model[J]. Biomed Res,2011,32(1):9-17.
[10] WESCHE D E, LOMAS-NEIRA J L, PERL M. Leukocyte apoptosis and its significance in sepsis and shock[J]. J Leukoc Biol,2005,?78(2):325-337.
[11] VEMEULEN K, VAN BOCKSTANCLE D R, BERNEMAN Z N. Apoptosis mechanisms and relevance in cancer[J]. Ann Hematol,2005,84(10):627-639.
[12] MARRIOTT H M, HELLEWELL P G, CROSS S S, et al. Decreased alveolar macrophage apoptosis is associated with increased pulmonary inflammation in a murine model of pneumococcal pneumonia[J]. J Immunol,2006,177(9):6480-6488.
[13] 趙美玲,季宇彬,畢明剛.細(xì)胞凋亡的死亡受體途徑[J].黑龍江醫(yī)藥, 2013,26(2):196-199.
[14] PERL M, CHUNG C S, PERL U, et al. Fas-induced pulmonary apoptosis and inflammation during indierct acute injury[J]. Am J Respir Crit Care Med,2007,176(6):591-601.
[15] PERL M, CHUNG C S, LOMAS-NEIRA J, et al. Silencing of Fas, but not caspase-8, in lung epithelial cells ameliorates pulmonary apoptosis, inflammation, and neutrophil influx after hemorrhagic shock and sepsis[J]. Am J Pathol,2005,167(6):1545-1559.
(收稿日期:2019-04-22)
(修回日期:2019-06-13;編輯:華強(qiáng))

