急性腦梗死前后循環發病相關因素對比分析
牛寶豐 劉艷婷
1 天津市環湖醫院神經內科 300350;2 天津市人民醫院神經內科
不同腦血管病危險因素可能對不同腦血流區域損害的嚴重程度存在差異,繼而導致急性腦梗死(Acute cerebral infarction,ACI)發病部位傾向性有所差異。目前對比分析ACI前后循環供血區發病相關因素作用強度差異的研究較少,且尚無一致結論。本研究旨在對比分析前后循環供血區ACI發病相關因素作用強度差異。
1 對象與方法
1.1 研究對象 回顧性連續選取2018年1—12月天津市人民醫院神經內科收治MRI診斷為ACI患者889例。排除同時累及前后循環供血區ACI及大面積ACI患者。本研究納入的889例ACI患者中,男575例(64.7%),女314例(35.3%),年齡30~94歲。
1.2 資料收集 人口統計學資料:性別、年齡;化驗結果:血漿黏度值(PV)、紅細胞沉降率(ESR)、紅細胞壓積(Hct)、紅細胞剛性指數(HGX)、纖維蛋白原(FIB)、D-二聚體、紅細胞計數(RBC)、血紅蛋白含量(Hb)、平均紅細胞體積(MCV)、C 反應蛋白(CRP)、同型半胱氨酸(Hcy)、促甲狀腺激素(TSH)、游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺素(FT4)、糖化血紅蛋白(HbAlc)、尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL);基礎疾病:高血壓、糖尿病、房顫;影像資料:頸動脈狹窄、Willis環變異。以頸動脈彩超判斷頸動脈狹窄[1],狹窄包含慢性進展性閉塞。依據MRA判斷Willis環變異[2],A型:一側大腦前動脈A1段不顯影;P型:一側胚胎型大腦后動脈;O型:所有其他類型Willis環變異;N型:Willis環正常(圖1)。

A B C D
圖1 MRA判斷Willis環變異
A:A型 B:P型 C:O型 D:N型

2 結果
2.1 前后循環ACI組間比較單因素分析 見表1。對兩組資料進行單因素分析結果顯示,兩組間ESR、FIB、D-二聚體、CRP、TSH、FT3、FT4、BUN、糖尿病、房顫、頸動脈狹窄、Willis環變異的差異有統計學意義(P<0.05)。

表1 前后循環ACI組間比較[M(P25,P75)]
2.2 腦梗死部位的獨立相關因素分析(1)見表2。將兩組間化驗結果差異有統計學意義的變量(ESR、FIB、D-二聚體、CRP、TSH、FT3、FT4、BUN)納入多因素Logistic回歸結果顯示,FT3(OR=1.460)、FT4(OR=0.908)與梗死部位存在獨立相關性;進一步將年齡、性別納入回歸方程后,FT3(OR=1.499)、FT4(OR=0.905)與梗死部位依然存在獨立相關性。

表2 腦梗死部位獨立相關因素Logistic回歸分析(1)
2.3 腦梗死部位的獨立相關因素分析(2)見表3。將年齡、性別、FT3、FT4、糖尿病、房顫、頸動脈狹窄、Willis環變異納入多因素Logistic回歸結果顯示,糖尿病(OR=2.167)、房顫(OR=9.421)、頸動脈狹窄(OR=7.801)、Willis環變異(OR=0.127)亦與梗死部位存在獨立相關性。
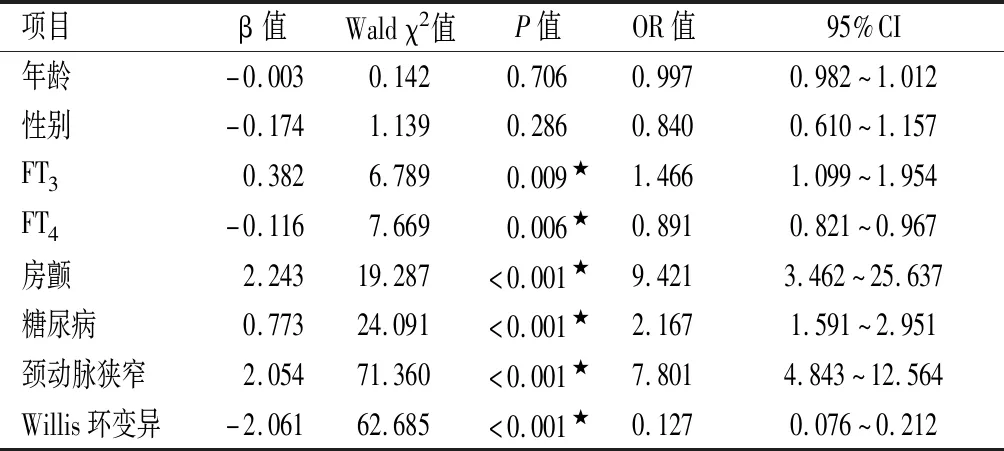
表3 腦梗死部位獨立相關因素Logistic回歸分析(2)
綜上所述,FT3降低、糖尿病、房顫、頸動脈狹窄與前循環供血區ACI相關性更強;FT4降低、Willis環變異與后循環供血區ACI相關性更強。
3 討論
本研究結果顯示,相較于后循環ACI,前循環ACI對FT3降低作用更強,且與糖尿病、房顫、頸動脈狹窄的獨立相關性更強;反之,相較于前循環ACI,后循環ACI對FT4降低作用更強,且與Willis環變異的獨立相關性更強。
既往研究[3]顯示,ACI急性期FT3、FT4可呈不同程度降低,FT3、FT4降低程度與ACI病情嚴重程度正相關。文獻描述[4],疾病狀態下組織脫碘酶受抑,T4向T3轉化障礙,FT3降低,伴或不伴FT4降低,稱為正常甲狀腺病態綜合征,意義為使機體處于較低代謝率,因而在ACI與FT3、FT4降低的因果關系上,后者很可能為繼發性。迄今尚無關于不同部位ACI對FT3、FT4水平降低程度的對比研究,而本研究顯示,相較于后循環ACI,前循環ACI對FT3降低作用更強;反之,相較于前循環ACI,后循環ACI對FT4降低作用更強。推測可能的機制為,前后循環ACI對下丘腦機能、組織對FT3及FT4的攝取、組織中脫碘酶受抑等環節影響程度存在差異[5],但具體機制尚待進一步研究。
本研究顯示,房顫、頸動脈狹窄使ACI更傾向于前循環供血區發病。機制為頸動脈在其載體動脈開口處內徑遠大于椎動脈,心源性栓子更易進入前循環,而頸動脈本身為前循環供血動脈。關于罹患糖尿病對ACI發病部位傾向性的影響,迄今觀點尚存爭議:Megherbi等[6]研究顯示,糖尿病患者前循環供血區ACI發病概率增加程度甚于后循環供血區;Subramanian 等[7]研究顯示,糖尿病對前后循環供血區ACI發病概率影響無顯著差異;而Kim等[8]研究顯示,糖尿病患者后循環供血區ACI發病概率增加程度甚于前循環供血區。本研究結論與Megherbi等[6]報道一致,推測機制為,相較于前循環,后循環動脈系統交感神經分布相對較少,交感神經可在血壓急驟變化時維持血管張力,糖尿病自主神經病變可損害前循環自主神經系統,加速血管損傷進程,但具體機制尚待進一步研究。
Willis環在腦血流動力學變化時起最重要代償作用,其變異為ACI的危險因素。MRA對流速異常或湍流顯影差,判斷管腔狹窄敏感性過高,健康人前后交通動脈間無血流通過導致MRA不顯影,Willis環完整者ACI發病時可對不同血管間壓力代償性調整,前后交通動脈此時可在MRA顯影,因而ACI患者MRA可顯示Willis環具有臨床意義的變異。既往研究多從Willis環局部入手探討其形態異常與ACI部位的關系:Hoksbergen等[9]研究顯示,前循環ACI患者Willis環變異率遠高于健康對照組,A型Willis環變異可使前循環ACI風險增高;Chuang等[10]研究顯示,P型Willis環變異是后循環ACI的獨立危險因素;Lochner等[11]研究亦顯示,P型Willis環變異與后循環ACI存在密切關系。但迄今,Willis環變異作為整體而言,對前后循環供血區ACI發病作用強度差異尚未見報道。本研究結果顯示,相較于前循環供血區,Willis環變異與后循環供血區ACI相關性更強。推測可能機制為,前循環系統可通過眼動脈、腦膜中動脈與頸外動脈系統形成吻合,前循環軟腦膜動脈間亦存在廣泛吻合,此解剖特征有利于側支循環的建立;而后循環對完整Willis環的依賴性更強。但鑒于本研究的局限性,尚需DSA評價Willis環變異基礎上,更大樣本的多中心研究證實。
本研究尚存不足:MRA僅可顯影內徑>1mm的血管,而前后交通動脈內徑>0.5mm時即可提供有效代償[9],MRA可致判斷Willis環變異的敏感性過高;本研究排除了大面積ACI及同時累及前后循環供血區的ACI,降低了樣本對ACI人群的代表性;作為回顧性研究,盡管連續性選取研究對象,但病源來自同一醫院限制了本研究結論的外推性。

