PK-15細胞生物學特性鑒定
柴 華,劉鑫瑩,李建華
(哈藥集團生物疫苗有限公司,哈爾濱 150000)
豬腎上皮細胞(PK-15)來源于豬腎,源自成年豬腎細胞PK-2a,體外貼壁生長,可連續傳代培養。該細胞對豬細小病毒、豬圓環病毒、豬瘟病毒等多種病毒敏感,在疫苗生產中被廣泛應用[1-6]。本研究對PK-15 細胞的基本生物學特性進行研究,旨在開展PK-15 細胞及多種疫苗的研究提供理論依據。
1 材料和方法
1.1 試驗材料
試驗用PK-15 細胞購自中國獸醫藥品檢查所,DMEM 購自美國gibco,新生牛血清購自美國CLARK,0.25%胰蛋白酶購自美國gibco,秋水仙素購自美國sigma。試驗儀器為CO2培養箱(美國ThermoFisher,參數設置為37 ℃,5% CO2),相差倒置顯微鏡(日本OLYMPUS)。
1.2 試驗方法
1.2.1 細胞復蘇
自液氮罐取出一支凍存PK-15細胞,于37 ℃水浴鍋中解凍,離心后棄掉上清,用培養基重懸后接種至細胞瓶中,置于培養箱培養,逐日觀察細胞生長狀態,待細胞生達到90%匯合度時進行消化傳代。
1.2.2 細胞傳代
從培養箱中取出細胞,加入0.25%的胰酶消化液,將方瓶置于37 ℃培養箱中,待觀察到個體清晰、細胞之間界限分明時,搖晃細胞從瓶壁上脫落時,培養基終止膜酶消化作用,吹打至形成單細胞懸液,按密度進行傳代培養。
1.2.3 鑒定
細胞形態:用倒置顯微鏡進行觀察。生長曲線:將PK-15 細胞按密度為4.0×105cells ·mL-1接種至T25細胞瓶中,每隔24 h進行細胞計數,繪制細胞增殖曲線。無菌檢驗:按現行《中國獸藥典》附錄進行檢驗。支原體檢驗:按現行《中國獸藥典》附錄進行檢驗。外源病毒檢測:取待檢細胞,反復凍融3 次,接種Vero 細胞、MDBK 細胞和ST細胞。細胞單層樣品經甲醇定后,用適宜的熒光抗體進行染色,檢查每一組細胞單層是否存在牛病毒性腹瀉病毒、豬細小病毒和豬瘟病毒外源病毒的熒光。當陽性對照出現特異熒光,正常細胞無熒光時,如果被檢樣品出現外源性病毒特異性熒光,判為存在相應病毒污染而樣品不合格。胞核學檢查:取PK-15細胞,加入含0.1μg·mL-1秋水仙素的培養液作用2~4 h,離心棄去培養液。用Eargle's等滲鹽水清洗,離心棄去液體,加入含1%酚紅的低滲液(1 L水加入1 mol·L-1NaHCO34滴),37 ℃作用30 min。加入醋酸∕甲醛固定液,與細胞反應25 min。在加熱板上加熱至60 ℃,滴加1 mol·L-1鹽酸作用10 min。用姬姆薩染色液染色后油鏡下觀察,取50個處于有絲分裂中期的細胞進行檢查,對染色體計數,觀察染色體組型。細胞致瘤性檢驗:用裸鼠20 只,隨機分成3 組。第1 組10 只裸鼠,各皮下接種107個PK-15 細胞;第2 組5 只裸鼠,各經皮下接種107個人宮頸癌細胞(HeLa)作為陽性對照;第3組5只裸鼠,各經皮下接種107個人胚肺成纖維細胞(MRC-5)作為陰性對照。接種后逐日觀察有無結節或腫瘤形成,21 d剖檢第1組裸鼠5只;剩余5只裸鼠,繼續觀察,12周后全部剖檢。陽性和陰性對照組觀察21 d 全部剖檢,剖檢后觀察淋巴結和器官有無結節形成。
2 試驗結果
2.1 細胞形態
PK-15 細胞置顯微鏡下觀察如圖1,細胞為不規則多邊形,輪廓清晰,細胞形態較好。
2.2 生長曲線
PK-15 細胞生長曲線成S 型,如圖2,細胞生長經歷了潛伏期、增殖期和停滯期。其中,細胞在48~120 h 增殖較快,細胞培養72 h 細胞密度約為43.0×105cells·mL-1。
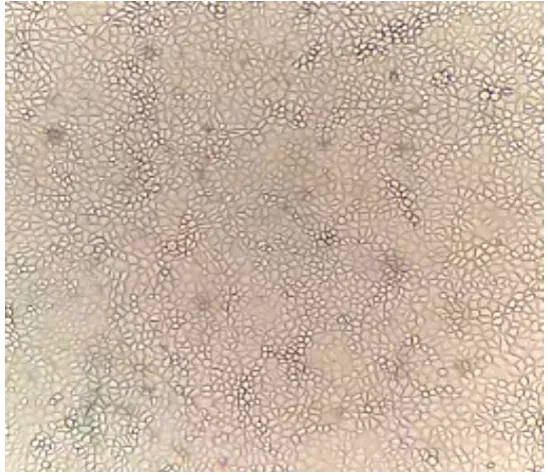
圖1 PK-15細胞
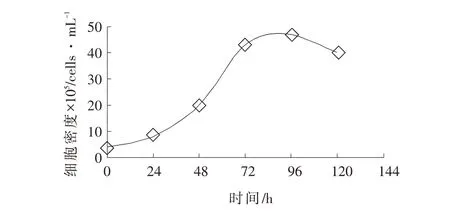
圖2 細胞增殖曲線
2.3 無菌檢驗結果
按現行《中國獸藥典》附錄進行檢驗,PK-15細胞檢驗結果為陰性。
2.4 支原體檢驗結果
按現行《中國獸藥典》附錄進行檢驗,PK-15細胞檢驗結果為支原體陰性。
2.5 外源病毒檢測結果
按現行《中國獸藥典》附錄進行PK-15 細胞檢測,熒光抗體檢測結果為陰性,結果如圖3~5。
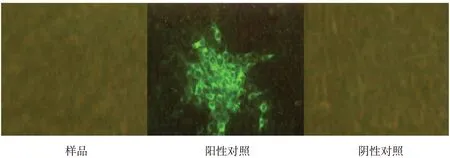
圖3 BVDV熒光抗體檢測結果
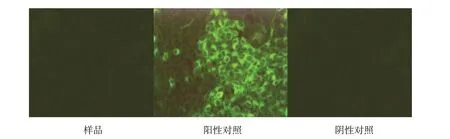
圖4 CSFV熒光抗體檢測結果
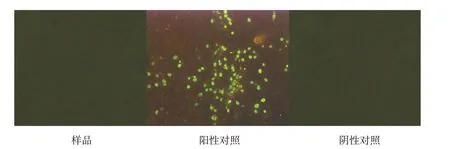
圖5 PPV熒光抗體檢測結果
2.6 細胞致瘤性檢驗
將PK-15 細胞頸部皮下接種裸鼠,21 d 及12周剖檢裸鼠,裸鼠各個淋巴結和器官均無結節形成,陽性對照組出現明顯腫瘤,陰性對照組裸鼠均無結節形成,PK-15細胞無致瘤性。
2.7 胞核學檢查
細胞染色體標本經姬姆薩染色,對有絲分裂中期的細胞進行檢查,染色體數為19×2,染色體形態見圖6。
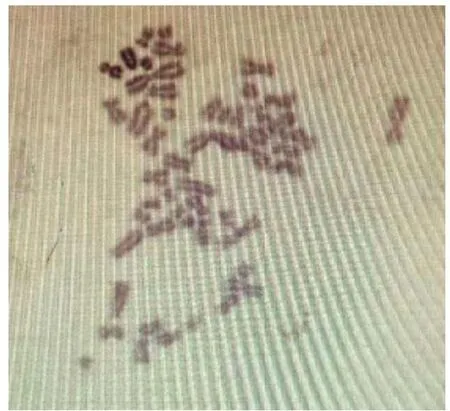
圖6 PK-15細胞染色體
3 結 論
本研究對PK-15 細胞進行生長動力學鑒定、無菌檢驗、支原體檢驗、核型分析及致瘤性檢驗,結果表明,PK-15細胞為純凈細胞株。PK-15細胞培養過程中能保持相對穩定的遺傳特性,為疫苗的生產打下了基礎。同時,豬圓環病毒、豬細小病毒等病毒能夠在PK-15 細胞系中穩定、高效價的增殖,為豬細圓環病毒疫苗及豬細小病毒滅活疫苗的研究及開發提供基礎理論依據。

