利用剩余活性污泥合成聚羥基脂肪酸酯的研究進展
孟棟,李枘枘,劉玉玲,樊祥宇,黃兆松,古鵬飛,李強
綜 述
李強 濟南大學生物科學與技術學院副院長,教授、博士生導師,中國微生物學會終身會員,山東微生物學會理事,長期從事資源與環境微生物學相關研究。先后主持承擔國家自然科學基金項目3項、省部級項目4項。在、、等主流學術刊物發表科研論文30余篇,其中SCI收錄20余篇。作為第一完成人獲授權國家發明專利5項,獲中國商業聯合會科技進步二等獎1項、山東省高校優秀科研成果二等獎1項。

利用剩余活性污泥合成聚羥基脂肪酸酯的研究進展
孟棟,李枘枘,劉玉玲,樊祥宇,黃兆松,古鵬飛,李強
濟南大學 生物科學與技術學院,山東 濟南 250022
利用單一微生物發酵是現階段獲得聚羥基脂肪酸酯 (PHA) 的主要方式,但過高的生產成本限制了其大規模應用。近年來利用活性污泥菌群混合培養合成PHA被廣泛研究。將剩余污泥處理與PHA合成相結合,不僅可以省去純培養所必需的滅菌環節,同時可以實現剩余污泥的資源化利用。剩余污泥的水解酸化、菌群富集馴化及PHA合成受環境因素影響,深入的生物合成機制研究有助于混合培養合成PHA的推廣應用。文中主要介紹利用剩余污泥合成PHA的可行性、影響剩余污泥水解酸化的因素、污泥菌群富集馴化合成PHA及其機制等方面的研究進展。
聚羥基脂肪酸酯,活性污泥,揮發性脂肪酸,微生物混合培養
隨著“白色污染”帶來的問題愈發嚴重,尋找石油基塑料的替代產品迫在眉睫。聚羥基脂肪酸酯 (PHA) 可在自然條件下被微生物完全降解,具有與石油基塑料產品相似的物理化學性質,使其成為一種潛在的替代產品,可廣泛應用于工業、農業、建筑、制藥及生物醫學等領域[1-2]。利用單一微生物發酵是現階段獲得PHA的主要方式。雖然產量較高,但昂貴的發酵底物及發酵過程需保持無菌條件使其生產成本至少是傳統塑料的3倍以上[3]。因此尋找低成本的生產方式成為PHA研究領域的重點方向。利用活性污泥微生物混合培養發酵合成PHA無需保持無菌條件,且污泥本身經水解酸化可以產生廉價碳源,有望解決合成PHA成本較高的問題。
1 利用剩余污泥合成PHA的可行性
活性污泥法是目前應用最廣泛的污水生物處理技術,缺點是產生大量的剩余活性污泥亟待處理。根據《“十三五”全國城鎮污水處理及再生利用設施建設規劃》[4](以下簡稱“《規劃》”) 數據顯示,截止2015年底我國污水處理能力達2.17億m3/d,約產生污泥13萬t/d,而污泥無害化處置規模僅為3.74萬t/d。因此《規劃》中特別強調,“十三五”期間國家“鼓勵采用能源化、資源化技術手段,盡可能回收利用污泥中的能源和資源”。
Wallen等[5]首次報道活性污泥中的微生物可以積累PHA,揭開了利用剩余活性污泥這種廢棄物資源合成PHA的序幕。2014年Van等[6]在上撰文指出了未來的污水處理廠利用剩余活性污泥菌群合成PHA的重要意義。Pittmann等[7]通過論證在德國或歐洲其他國家的污水處理廠進行PHA生產的可行性,認為全歐洲的污水處理廠可以生產出全球目前生物聚合物產量1.15倍的產品,因此利用污水處理活性污泥規模化生產PHA的潛力巨大。
Valentino等[8]提出可以將利用活性污泥生產PHA與污水處理過程結合,產PHA的同時可以減少活性污泥的產量,這一過程主要是通過將有機固體轉化為揮發性脂肪酸 (VFAs) 來實現,而VFAs可以作為PHA的合成原料。在經濟上切實可行的利用剩余污泥菌群混合培養發酵合成PHA主要包括3個過程:1) 底物準備階段:含大分子有機物的廢水或剩余污泥經水解酸化生成VFAs;2) 產PHA菌群富集階段:通過馴化污泥將具有合成PHA能力的菌群富集;3) PHA合成階段:經馴化富集的污泥菌群利用VFAs合成PHA[9]。
2 剩余污泥水解酸化的影響因素
剩余污泥厭氧水解酸化生成的VFAs主要是由6個或者更少的碳原子組成的短鏈脂肪酸,該反應一般在序批式反應器 (SBR) 中進行。研究表明以下若干因素會對生成VFAs的濃度及組成有較大影響。
2.1 溫度對水解酸化的影響
溫度對厭氧消化底物中組分的物化特性有重要影響,同時還影響微生物的生長速率與代謝,從而使反應器中的種群動態發生變化[10]。Yuan等[11]研究表明在24.6 ℃條件下VFAs最高產量為 2 154 mg/L,而在嗜冷范圍14 ℃和4 ℃條件下VFAs產量分別為1 449 mg/L和782 mg/L,但在這3種不同溫度下產生的VFAs的組成并沒有顯著的變化。Liu等[12]發現,在最佳pH下總VFAs的積累在嗜熱 (55 ℃) 條件下最高,是嗜溫 (35 ℃) 條件下的2倍,是嗜高溫 (70 ℃) 條件下VFAs積累量的1.12倍。另外,Hao等[13]的研究也證明了55 ℃條件下VFAs產量高,厭氧發酵VFAs的積累量是嗜溫條件的10倍。通過以上研究表明,55 ℃左右的嗜熱條件是水解酸化的最適溫度。
2.2 pH對水解酸化的影響
由于大多數的產酸微生物在強酸 (pH<3) 和強堿 (pH>12) 環境下不能生存,因此控制反應器中的pH對于VFAs的生產非常重要[14]。在酸性和堿性環境下,產酸微生物均能夠進行厭氧發酵產酸。在堿性條件下,污泥中胞外聚合物帶電基團的電離會促進污泥水解,并導致胞外聚合物之間的強排斥,從而使碳水化合物和蛋白質釋放到環境中。同時堿性條件還能夠防止生成的VFAs消耗形成甲烷[15]。Liu等[12]研究了不同pH條件對VFAs生產的影響,發現在pH 12條件下,最大VFAs濃度為2 930 mg/L;在pH 10條件下,VFAs最大濃度為6 128 mg/L;在pH 8條件下,VFAs最大濃度為5 463 mg/L。堿性環境下的VFAs濃度均高于未調節pH的VFAs濃度。Cheah等[16]利用城市垃圾發酵產酸時,在酸性條件 (pH 6) 下發酵3.5 d后,VFAs濃度是最初體系中濃度的2倍。同樣是利用城市垃圾產酸,Moretto等[17]在實驗過程中監測發酵體系的pH變化,發現pH隨發酵時間降低,尤其在初始條件為堿性時變化顯著,在低于pH 4.5時水解過程及產酸菌生長嚴重受到抑制,最終導致有機物溶解及VFA積累下降。另外,pH還會影響VFAs的類型,Cokgor等[18]的研究顯示在pH 5.5時乙酸產生的百分比約為70%,而在pH 6.5時乙酸所占比例降低為35%左右。因此,在生產特定類型的VFAs組成時,需要確定最佳pH。
2.3 有機負荷率對水解酸化的影響
有機負荷率 (OLR) 可以反映體系中微生物處理有機物的能力,在水解酸化的過程中有機物被微生物分解成VFAs。Lim等[19]發現食品垃圾中隨著OLR從5 g/(L·d)增加到13 g/(L·d),厭氧產生的VFAs濃度從 (13.0–14.0) g/L增加到(28.9–30.0) g/L;而當OLR超過13 g/(L·d)時,反應器變得不穩定。此外,增加OLR會改變VFA的組分。Tang等[20]研究了食品垃圾乳酸發酵的結果,當OLR從14 g/(L·d)增加到22 g/(L·d)時,乙酸濃度從2.1 g/L增加到5.5 g/L,丙酸和丁酸則幾乎沒有變化;當OLR從14 g/(L·d)增加到18 g/(L·d)時,乳酸濃度從29 g/L上升至37.6 g/L;OLR從18 g/(L·d)增加到 22 g/(L·d)時,乳酸產量急劇下降至22 g/L。Wijekoon等[21]在厭氧產酸發酵工藝中,將OLR從5 g/(L·d)提高到12 g/(L·d)時發現VFA的主要組分從乙酸變成正丁酸。因此,優化OLR參數不僅可以提高酸的產量還可以獲取不同種類的VFA。
2.4 停留時間對污泥水解酸化的影響
停留時間包括固體停留時間 (SRT) 與水力停留時間 (HRT),使用剩余污泥來生產VFAs時,SRT等于HRT[22]。Feng等[23]在pH 10條件下,SRT從4 d延長至12 d,VFAs濃度增加了43.6%;而SRT增加至16 d時,VFAs濃度下降,可能是由于產甲烷菌消耗了部分生成的VFAs。所以在一定的范圍內增加SRT可以提高VFAs的產量。SRT對于VFAs組分中乙酸和丙酸的影響較大,SRT從4 d增加到16 d,乙酸的比例從32.0%增加到42.4%,而丙酸則從23.6%下降到14.3%,丁酸與戊酸保持相對穩定。Yuan等[24]的研究中,隨著SRT延長至10 d,VFAs產量增加了46%,但是乙酸所占比例從第5天的66%下降至第10天的49%,丙酸的比例保持穩定,維持在17%左右。適當調整停留時間,提高水解酸化過程中VFAs的產量,可以為菌群富集和PHA合成階段積累充足的養分。
3 污泥菌群的富集馴化及PHA合成
3.1 污泥菌群的富集馴化模式
菌群富集馴化的目的是為了富集PHA合成菌,以獲得較高的PHA產量。活性污泥合成PHA的工藝中,較多采用好氧瞬時補料工藝 (豐盈-饑餓模式)。該工藝使微生物在豐盈和饑餓狀態下反復交替。在豐盈狀態下,菌群可以將過量碳源轉化成PHA儲存在體內;而在饑餓狀態時,這些物質可以被利用供微生物的生長和代謝。通過這種選擇性壓力,每個周期都會淘汰掉部分無法合成PHA的菌株,從而實現對PHA合成菌群的富集。清華大學王慧教授課題組采用該模式馴化活性污泥,得到具有較高PHA合成能力的菌群S-150,并通過將剩余污泥的厭氧發酵控制在水解酸化階段大量合成VFAs。然后以S-150為菌種分別利用剩余污泥水解酸化液及模擬污泥水解液合成PHA,PHA含量最高可達細胞干重的62.43%[25]。除此之外,活性污泥菌群的馴化還可采用厭氧-好氧工藝,該過程中微生物在厭氧階段處于休眠期,主要是微生物對碳源進行攝取在體內儲存PHA,隨后的好氧階段通入空氣時,此時體系碳源不足以供菌群生長代謝,而PHA合成菌可以利用儲存的PHA繼續生長。Liu等[26]報道使用該工藝不僅可以對廢水進行生物除磷,對PHA合成菌群的富集也具有一定效果,實現了污水處理和合成PHA的雙重效果。Bengtsson等[27]利用該模式處理廢水時,通過菌群結構分析,發現了大量的聚磷菌 (PAOs) 和聚糖菌 (GAOs),這兩種菌群是典型的PHA合成優勢菌群。除此之外還可以將不同的合成工藝整合來富集PHA合成菌群,比如將利用微生物產H2和PHA合成相結合。Suriyamongkol等[28]研究發現H2可以作為合成VFAs的中間體,而VFAs可以被微生物利用產PHA,將兩個工藝相結合不僅可以獲取H2能源,而且有利于富集PHA合成菌群。
3.2 影響菌群富集的因素
在菌群富集的過程中,基質、pH、溫度、SRT等條件參數都會影響最終的富集效果和微生物群落結構。Janarthanan等[29]提出不同基質投放會影響污泥中PHA菌群的馴化效果。Beccari等[30]在研究中發現在富集PHA合成菌群時,當使用復雜的富含VFAs的原料時,如橄欖油廢水,更有利于PHA菌群的富集。Oliveira等[31]通過研究發現,在低有機負荷體系中,通過添加奶酪乳清促進PHA菌群的富集。除此之外在富集階段,優先考慮改善PHA合成菌群的生長條件,投加之前需對原料進行預處理。Korkakaki等[32]對城市垃圾過濾液稀釋后再進行投放,較未處理組的富集效果顯著提升。另外還可以通過控制溫度與pH的方法為混合菌群創造良好的生長環境。Zhang等[33]在以有毒污染物苯酚為原料合成PHA的過程中,考察了不同溫度對微生物富集的影響,發現低溫可以抑制PHA合成菌群的生長,菌群的豐富度也降低。在此之前的研究中表明在pH<7時,菌群生長變緩,Fleit等[34]發現這種抑制作用可能與低pH下底物中的未解離酸 (如乙酸) 有關。這些酸可以擴散到細菌的細胞內造成質子負荷,從而導致菌體代謝生長變慢。Oehmen等[35]研究pH對富集階段菌群結構的影響時,通過對比發現富集體系控制在pH為8時,富集菌群的生物量是未控制pH體系的兩倍,最終前者體系中PHA的積累率也明顯提升。控制SRT對活性污泥合成PHA的體系至關重要,SRT參數作為一種選擇性壓力可以表征富集過程中微生物世代交替時間,適當調控SRT可以保持富集體系中微生物的活性[36]。Albuquerque等[37]利用水解酸化后的廢水對PHA合成菌群進行富集,通過調整不同的SRT進行對比實驗,最終發現在SRT設為10 d時,富集效果最佳,菌群代謝旺盛,PHA的合成比例高達74.6%。
3.3 影響PHA積累的因素
富集之后的PHA合成菌群具有相似的代謝特征,根據生長環境的變化,菌群會利用碳源合成PHA[38]。雖然具備這種特征,在PHA積累過程中還應該控制微生物的生長環境,如通過控制補料模式、溶解氧、碳源種類、氮磷比、pH、溫度等參數,來滿足微生物合成代謝的需求。目前報道的補料方式主要有兩種:間歇批次補料模式和連續補料模式。在PHA生產中間歇批次補料模式應用最廣泛。Serafim等[39]采用間歇批次補料模式,將乙酸分3次加入反應器,最后合成的PHA含量高達78.5%。與間歇批次補料模式相比,連續補料不會中斷反應,可以防止微生物在中斷過程中消耗體內儲存的PHA,但是該過程對碳源的利用率較低。Albuquerque等[40]通過實驗驗證,同等條件下在連續補料模式中微生物對碳源的攝取速率和代謝活力比間歇批次補料更具有優勢,最終PHA的產量高出5%。
氧氣供給是混合菌群利用活性污泥合成PHA的關鍵因素。Wang等[41]通過改變氧氣的供應證明PHA的合成與硝化反應密切相關,通過調節溶解氧 (DO),不僅可以促進氮的去除,而且不影響現有菌群的PHA最大存儲速率,為活性污泥生產PHA工藝生產條件的控制提供了依據。鄭裕東 等[42]在厭氧-好氧模式下研究PHA合成時,發現污泥中大多數微生物利用碳源合成聚磷酯和糖原等物質,PHA實際占的比重較低,而對通氧量進行控制可以促進微生物積累PHA。
合成PHA的種類與所使用的底物的組成直接相關,脂肪酸、葡萄糖、蔗糖和果糖通過代謝產生不同的羥基烷酸單體,并用于PHA的生物合成。選擇不同碳源,菌群積累PHA的能力也有所不同。哈爾濱工業大學陳志強等[43]以VFAs作為碳源,開發了一種利用污泥菌群合成PHA的連續供料模式,PHA最高積累量可達菌體干重的70.4%。廈門大學王遠鵬等[44]選用乙酸 (和丙酸)為碳源,利用二沉池活性污泥在序批式反應器中發酵合成PHBV,積累率可達到74%。Rodriguez等[45]對近些年利用不同廢棄物合成PHA報道作了統計,發現混合菌群利用的廢棄底物來源廣泛,并且合成PHAs的種類豐富,具有巨大的應用潛力。Palmeiro等[46]報道在中試規模下活性污泥中PHA的含量占污泥有機質成分的66%,活性污泥不僅可以作為菌種來源,同時也可以作為合成底物,富含可供微生物生長繁殖的營養物質,目前報道利用活性污泥合成PHA的產率接近純菌發酵的產率。Ribeiro等[47]在利用粗甘油合成PHA的過程中,發現底物基質里中鏈和長鏈的脂肪酸比例越高,合成的中鏈和長鏈聚合物的摩爾含量越大。
在PHA合成階段,適當控制pH可以促進微生物的代謝積累。Villano等[48]在研究控制pH對PHA積累影響時發現當pH 7.5–9.0時更有利于PHA積累,并且通過pH改變可以控制PHAs的合成種類。相反如果不控制pH,甚至會導致PHA的水解,Zheng等[49]研究發現在厭氧堿性 (pH 10) 發酵條件下,通過熒光原位雜交 (FISH)等技術研究菌群結構,發現有大量的假單胞菌屬和產堿桿菌屬富集,這兩種菌可以分泌胞外蛋白酶和解聚酶,將PHA水解成單體 (3-羥基丁酸、3-羥基戊酸),之后產酸菌可以利用這些單體合成短鏈脂肪酸。不同基質中N/P含量有所差異,研究表明高濃度的氮磷會影響微生物的代謝生長,Korkakaki等[32]通過曝氣使垃圾滲濾液中的磷酸鹽沉淀,低濃度的磷酸鹽不會造成微生物的生長抑制,提高了PHA積累率。Schmidt等[50]研究發現氮的消耗會導致PHB產量下降,而3-羥基戊酸酯的積累和氮的消耗保持在同一水平,因此在生產體系中要補充氮元素以獲得較高的PHA產率。
4 PHA的生物合成機制
雖然混合培養合成PHA的研究已經取得令人矚目的成果,但是與單一菌種發酵相比還有不小差距。有效縮短馴化富集時間,提高PHA在污泥中的含量成為擺在污泥資源化利用面前的難題,而深入的PHA合成機制研究有助于解決這一問題。
4.1 PHA代謝相關基因
已知的PHA代謝相關的酶和調控蛋白及它們的編碼基因見表1,按照所執行的功能,可分別歸類為PHA合成、PHA降解和PHA代謝調控[51-52]。
其中PHA合酶 (PHA synthase,PhaC) 是PHA生物合成過程中最關鍵的酶,由(或)編碼。它能夠以羥基脂肪酸 (HA) 的CoA硫酯為底物,催化HA脫去CoA聚合形成PHA。根據合成PHA的類型、合酶結構中亞基的種類以及對底物的特異性,PHA合酶可分為4種類型 (Ⅰ?Ⅳ合酶)。Ⅰ類和Ⅱ類合酶由一個亞基組成 (PhaC),其分子量大約為60 kDa,Ⅲ類合酶由PhaC亞基 (分子量40–53 kDa) 和PhaE亞基 (分子量20–40 kDa)組成,Ⅳ類合酶由PhaC亞基 (分子量約41 kDa)和PhaR亞基 (分子量約22 kDa) 組成。四類PHA合酶都可以行使催化功能,盡管組分及結構具有一定差異,但均以二聚體形式進行催化。Ⅰ類和Ⅱ類合酶以兩個PhaC亞基形成同二聚體,而Ⅲ類和Ⅳ類合酶分別由兩個不同亞基形成異二聚體進行催化。在合成過程中,Ⅰ類、Ⅲ類和Ⅳ類PHA合酶可以利用丙酸鹽、丁酸鹽、戊酸鹽、己酸鹽等合成短鏈聚合物 (scl-PHA),而Ⅱ型PHA合酶可以利用烷烴等作為前體合成中鏈聚合物 (mcl-PHA)。此外,丙二酰輔酶A酰基轉移蛋白轉酰酶(由編碼) 及3-酮酰輔酶A還原酶(由fabG編碼) 等與PHA合成途徑相耦聯的酶也參與了PHA合成。
PHA憑借生物可降解特性受到了科學界廣泛關注,在降解的過程中PHA解聚酶 (Depolymerase,PhaZ) 起到了關鍵作用,它可以將PHA分解成小分子量的寡聚體[53]。PhaZ酶位于PHA顆粒上,它可以水解含有脂肪族和芳香族單體的PHA,該酶由一條多肽鏈構成 (分子量37–60 kDa),包括N-端催化結構域、C-端催化結構域和兩位點的結合區[54]。Jendrossek等[55]研究發現微生物可以通過在胞外或者胞內分泌解聚酶來降解不同環境中的PHA,然后利用分解后的小分子物質作為碳源供細胞生長繁殖。在PHA降解的過程中,解聚酶的催化效率取決于環境因素以及PHA的種類。Huisman等[56]研究發現在厭氧條件下微生物對PHA的降解時間可長達數月,而在高鹽的海水中則需要一年。Kunioka等[57]在研究PHA的單體構造時發現,當引入4HB單體時,PHA的降解速度顯著提高,最終的降解對比結果是P (3HB-co- 4HB)>P (3HB)>P (3HB-co-3HV)。
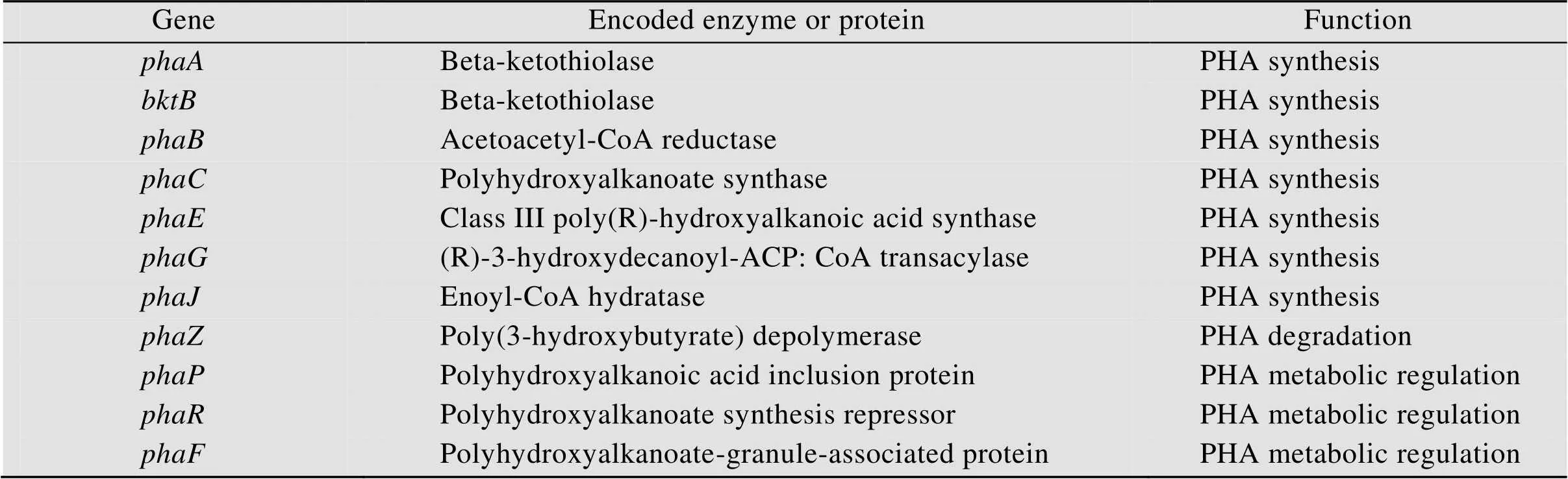
表1 PHA代謝相關的酶和蛋白及其編碼基因
PHA是以包涵體的形式儲存在微生物體內,其表面覆蓋蛋白質層,這些蛋白質被稱為PHA顆粒結合蛋白 (GAPs),在PHA代謝中起調控作用,其中phasin蛋白占絕大多數。Phasin蛋白是不均勻的小尺寸蛋白質群,具有兩親性 (可保護疏水性聚合物),它雖然缺乏一定的催化功能,但是在PHA顆粒構造和代謝過程中起到關鍵調控作用[58]。近些年,大量phasin蛋白被發現并證實了其功能。科學家在青枯菌中發現了大量的PhaP家族蛋白,這些多肽與PHA的疏水端緊密結合,可以分散PHA顆粒,防止與其他蛋白質特異性結合[59]。Kuchta等[60]通過構建突變菌株發現PhaP基因缺失雖然不會對PHA合成產生影響,但是會顯著影響PHA的成粒,最終突變菌株體內會形成一個大顆粒的PHA。Prieto等[61]在假單胞菌中發現了PhaF蛋白,證實了該蛋白有兩個結構域:N-末端和C-末端,其中N-末端與PHA結合,而C-末端則非特異性與DNA結合。PhaF蛋白不僅可以增強PHA在細胞內的穩定性,而且對PHA在細胞內的定位起關鍵作用,它可以將DNA與PHA顆粒連接,確保兩者在細胞分裂時分配均勻[62]。
4.2 微生物中PHA的合成途徑
微生物中已知的PHA合成途徑主要分為3種:1) 聚羥基丁酸 (Polyhydroxybutyrate,簡稱PHB)的葡萄糖合成途徑;2) 脂肪酸β-氧化途徑;3) 脂肪酸從頭合成途徑[63]。微生物以VFAs 為碳源合成PHA時,以H16合成聚羥基丁酸戊酸共聚酯 (Poly (3-hydroxybutyrate-co-3- hydroxyvalerate),簡稱PHBV) 為例,主要的合成途徑包括:1) 乙酸主要經乙酰輔酶A合成酶 (由編碼) 或乙酸激酶 (由編碼) 催化生成乙酰輔酶A,β-酮基硫解酶 (由編碼) 催化2個乙酰輔酶A縮合成乙酰乙酰CoA,乙酰乙酰CoA由NADPH依賴的乙酰乙酰CoA還原酶 (由編碼) 還原生成3HBCoA,然后在PhaC的催化下參與合成PHA;2) 丙酸經丙酰輔酶A合成酶 (由編碼) 催化生成丙酰輔酶A,β-酮基硫解酶 (由編碼) 再催化1分子的乙酰CoA和1分子丙酰CoA縮合而成的β-酮戊酰CoA,β-酮戊酰CoA在PhaB的催化下生成3-羥基戊酰CoA,然后在PhaC的催化下參與合成PHA;3) 丁酸經β-氧化過程的酶催化生成丁烯酰CoA,再經(R)-烯脂酰CoA水合酶 (由編碼) 催化生成(R)-3-羥基丁酰CoA用于PHA的合成。此外,(R)-3-羥基脂酰-ACP:CoA酰基轉移酶 (由編碼) 催化脂肪酸從頭合成途徑的中間產物 (R)-3-羥基脂酰-酰基載體蛋白轉化成相應的CoA的衍生物,用于PHA的合成。合成的PHA可以被解聚酶 (由編碼) 作用后,被微生物重新利用。活性污泥菌群中可能的VFAs消耗及PHA代謝途徑見圖1。
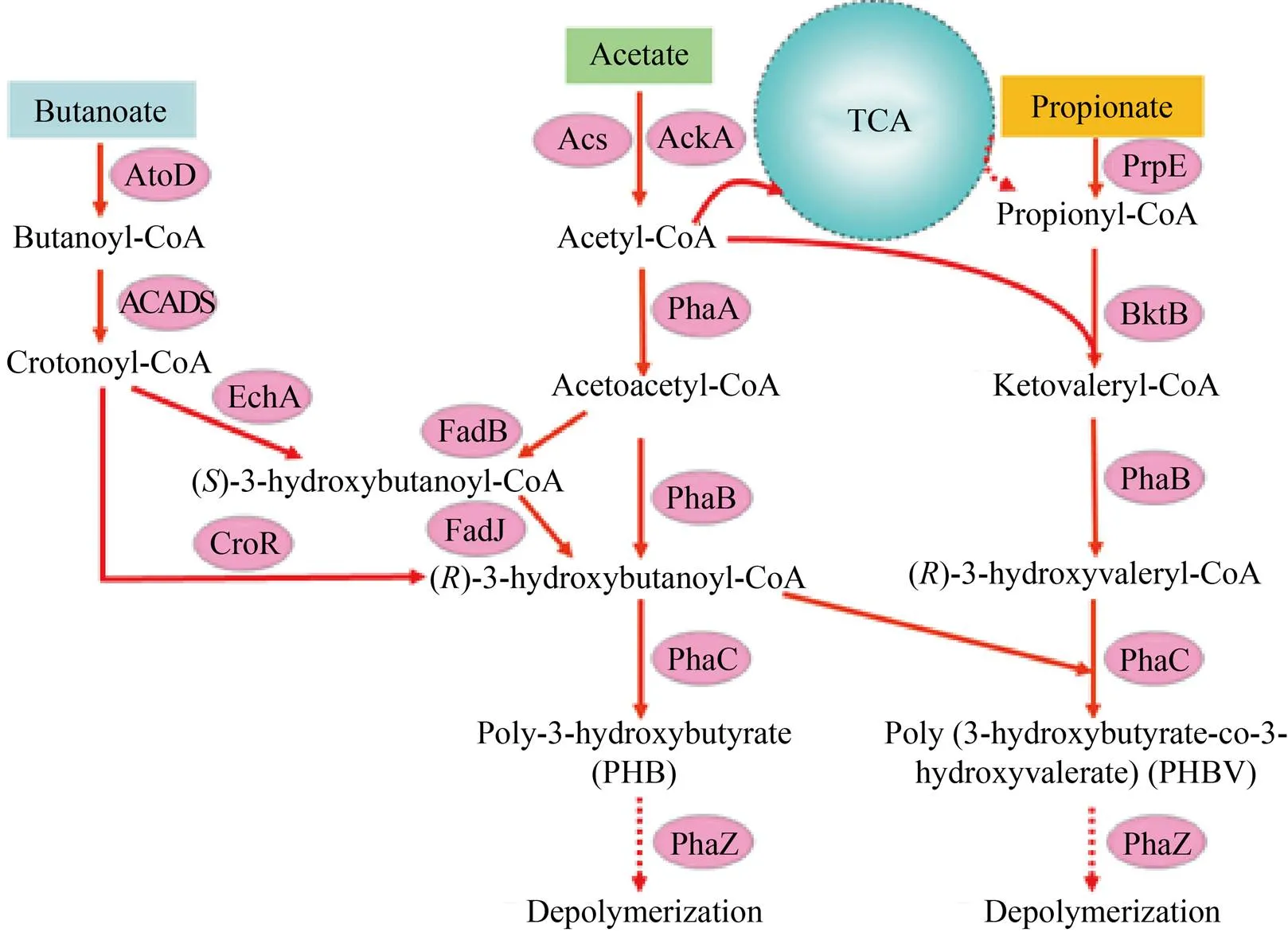
圖1 活性污泥菌群中可能的VFAs消耗及PHA代謝途徑
4.3 混合培養PHA合成菌群研究
變性梯度凝膠電泳 (DGGE)、末端限制性片段長度多態性分析 (T-RFLP) 等技術曾廣泛應用于分析混合培養PHA合成菌群的結構[64-65]。隨著價格的大幅度降低,高通量測序逐漸成為目前菌群研究的主要技術手段。Wang等[66]利用16S rDNA高通量測序,分析了強化生物除磷工藝中污泥菌群結構,并利用宏基因組高通量測序從中拼接出一株名為GAO-HK菌株的接近完整的基因組草圖,并挖掘出菌株降解嗎啉過程中通過乙醛酸循環利用VFAs合成PHA的代謝途徑。Oshiki等[67]通過對多種活性污泥的菌群結構進行解析,發現具有合成PHA潛力的微生物在污泥菌群所占比例為11%–18%。
Wang等[68]以處理[Cl–]高達24 000 mg/L以上的環氧丙烷 (Propylene epoxide,簡稱 PO) 皂化廢水的活性污泥菌群為研究對象,采用豐盛-饑餓模式向PO皂化廢水中定期添加乙酸,馴化PO皂化廢水活性污泥菌群合成PHA,最終獲得占污泥干重23.67%的PHBV,同時污泥馴化及合成PHA過程中COD明顯降低,證明PO皂化廢水污泥菌群經馴化可利用含VFAs廢水合成PHA。利用 16S rDNA高通量測序,檢測了馴化前后污泥菌群的變化情況,推測芽孢桿菌、不動桿菌、短波單胞菌及假單胞菌等為污泥中可能合成PHA的微生物。
越來越多的優勢菌株被篩選和鑒定,在基因水平上證明了活性污泥來源的微生物具有較強的PHA合成潛力。Janarthanan等[29]通過對污泥樣品中的菌群進行基因測序,分析了PHA合成菌群的多樣性和豐富度以及MMCs (Mixed microbial cultures,微生物混合培養) 的動態變化,評估出該條件中PHA合成的潛力。因此利用高通量測序技術研究污泥中PHA菌群的結構能夠更好地使PHA生產工藝和廢水的處理相結合。
5 展望
隨著高通量測序技術的不斷發展,未來有關混合培養合成PHA研究領域的重點方向將是從生物多樣性出發深入研究合成PHA菌群的特征及相關代謝途徑等[52]。另外,借鑒陳國強等開發的藍水生物技術的研究經驗[69],從馴化富集的污泥中篩選PHA合成優勢菌株,并在開放條件下利用污泥水解酸化產生的VFAs為碳源合成PHA,也可能會成為混合培養合成PHA研究的一個主要方向。
[1] Reddy CSK, Ghai R, Rashmi, et al. Polyhydroxyalkanoates: an overview. Bioresour Technol, 2003, 87(2): 137–146.
[2] Ivanov V, Stabnikov V, Ahmed Z, et al. Production and applications of crude polyhydroxyalkanoate- containing bioplastic from the organic fraction of municipal solid waste. Int J Environ Sci Technol, 2015, 12(2): 725–738.
[3] Sudesh K, Bhubalan K, Chuah JA, et al. Synthesis of polyhydroxyalkanoate from palm oil and some new applications. Appl Microbiol Biotechnol, 2011, 89(5): 1373–1386.
[4] 國家發展改革委網站. 《“十三五”全國城鎮污水處理及再生利用設施建設規劃》[EB/OL]. (2016-12-31). http://www.ndrc.gov.cn/zcfb/zcfbtz/201701/t20170122_836015.html.
[5] Morgan-Sagastume F, Hjort M, Cirne D, et al. Integrated production of polyhydroxyalkanoates (PHAs) with municipal wastewater and sludge treatment at pilot scale. Bioresour Technol, 2015, 181: 78–89.
[6] van Loosdrecht MCM, Brdjanovic D. Anticipating the next century of wastewater treatment. Science, 2014, 344(6191): 1452–1453.
[7] Pittmann T, Steinmetz H. Potential for polyhydroxyalkanoate production on German or European municipal waste water treatment plants. Bioresour Technol, 2016, 214: 9–15.
[8] Valentino F, Morgan-Sagastume F, Fraraccio S, et al. Sludge minimization in municipal wastewater treatment by polyhydroxyalkanoate (PHA) production. Environ Sci Pollut Res, 2015, 22(10): 7281–7294.
[9] Morgan-Sagastume F, Heimersson S, Laera G, et al. Techno-environmental assessment of integrating polyhydroxyalkanoate (PHA) production with services of municipal wastewater treatment. J Cleaner Prod, 2016, 137: 1368–1381.
[10] Appels L, Baeyens J, Degrève J, et al. Principles and potential of the anaerobic digestion of waste- activated sludge. Prog Energy Combust Sci, 2008, 34(6): 755–781.
[11] Yuan Q, Sparling R, Oleszkiewicz JA. VFA generation from waste activated sludge: Effect of temperature and mixing. Chemosphere, 2011, 82(4): 603–607.
[12] Liu XG, Dong B, Dai XH. Hydrolysis and acidification of dewatered sludge under mesophilic, thermophilic and extreme thermophilic conditions: Effect of pH. Bioresour Technol, 2013, 148: 461–466.
[13] Hao JX, Wang H. Volatile fatty acids productions by mesophilic and thermophilic sludge fermentation: Biological responses to fermentation temperature. Bioresour Technol, 2015, 175: 367–373.
[14] Liu H, Wang J, Liu XL, et al. Acidogenic fermentation of proteinaceous sewage sludge: Effect of pH. Water Res, 2012, 46(3): 799–807.
[15] Zhang P, Chen YG, Zhou Q. Waste activated sludge hydrolysis and short-chain fatty acids accumulation under mesophilic and thermophilic conditions: Effect of pH. Water Res, 2009, 43(15): 3735–3742.
[16] Cheah YK, Vidal-Antich C, Dosta J, et al. Volatile fatty acid production from mesophilic acidogenic fermentation of organic fraction of municipal solid waste and food waste under acidic and alkaline pH. Environ Sci Pollut Res, 2019: 1–14, doi: 10.1007/s11356-019-05394-6.
[17] Moretto G, Valentino F, Pavan P, et al. Optimization of urban waste fermentation for volatile fatty acids production. Waste Manage, 2019, 98: 21–29.
[18] Cokgor EU, Oktay S, Tas DO, et al. Influence of pH and temperature on soluble substrate generation with primary sludge fermentation. Bioresour Technol, 2009, 100(1): 380–386.
[19] Lim SJ, Kim BJ, Jeong CM, et al. Anaerobic organic acid production of food waste in once-a-day feeding and drawing-off bioreactor. Bioresour Technol, 2008, 99(16): 7866–7874.
[20] Tang JL, Wang XC, Hu YS, et al. Lactic acid fermentation from food waste with indigenous microbiota: Effects of pH, temperature and high OLR. Waste Manage, 2016, 52: 278–285.
[21] Wijekoon KC, Visvanathan C, Abeynayaka A. Effect of organic loading rate on VFA production, organic matter removal and microbial activity of a two-stage thermophilic anaerobic membrane bioreactor. Bioresour Technol, 2011, 102(9): 5353–5360.
[22] Lee WS, Chua ASM, Yeoh HK, et al. A review of the production and applications of waste-derived volatile fatty acids. Chem Eng J, 2014, 235: 83–99.
[23] Feng L, Wang H, Chen YG, et al. Effect of solids retention time and temperature on waste activated sludge hydrolysis and short-chain fatty acids accumulation under alkaline conditions in continuous-flow reactors. Bioresour Technol, 2009, 100(1): 44–49.
[24] Yuan Q, Sparling R, Oleszkiewicz JA. Waste activated sludge fermentation: Effect of solids retention time and biomass concentration. Water Res, 2009, 43(20): 5180–5186.
[25] Jia QQ, Xiong HL, Wang H, et al. Production of polyhydroxyalkanoates (PHA) by bacterial consortium from excess sludge fermentation liquid at laboratory and pilot scales. Bioresour Technol, 2014, 171: 159–167.
[26] Liu ZG, Wang YP, He N, et al. Optimization of polyhydroxybutyrate (PHB) production by excess activated sludge and microbial community analysis. J Hazard Mater, 2011, 185(1): 8–16.
[27] Bengtsson S. The utilization of glycogen accumulating organisms for mixed culture production of polyhydroxyalkanoates. Biotechnol Bioeng, 2010, 104(4): 698–708.
[28] Suriyamongkol P, Weselake R, Narine S, et al. Biotechnological approaches for the production of polyhydroxyalkanoates in microorganisms and plants- A review. Biotechnol Adv, 25(2): 148–175.
[29] Janarthanan OM, Laycock B, Montano-Herrera L, et al. Fluxes in PHA-storing microbial communities during enrichment and biopolymer accumulation processes. New Biotechnol, 2015, 33(1): 61–72.
[30] Beccari M, Bertin L, Dionisi D, et al. Exploiting olive oil mill effluents as a renewable resource for production of biodegradable polymers through a combined anaerobic-aerobic process. J Chem Technol Biotechnol, 2009, 84(6): 901–908.
[31] Oliveira CSS, Silva CE, Carvalho G, et al. Strategies for efficiently selecting PHA producing mixed microbial cultures using complex feedstocks: Feast and famine regime and uncoupled carbon and nitrogen availabilities. New Biotechnol, 2016, 37: 69–79.
[32] Korkakaki E, Mulders M, Veeken A, et al. PHA production from the organic fraction of municipal solid waste (OFMSW): Overcoming the inhibitory matrix. Water Res, 2016, 96: 74–83.
[33] Zhang Y, Wusiman A, Liu X, et al. Polyhydroxyalkanoates (PHA) production from phenol in an acclimated consortium: Batch study and impacts of operational conditions. J Biotechnol, 2018, 267: 36–44.
[34] Fleit E. Intracellular pH regulation in biological excess phosphorus removal systems. Water Res, 1995, 29(7): 1787–1792.
[35] Oehmen A, Pinto F V, Silva V, et al. The impact of pH control on the volumetric productivity of mixed culture PHA production from fermented molasses. Eng Life Sci, 2014, 14(2): 143–152.
[36] Deng Y. Process stability of polyhydroxyalkanoates production using acidogic waste water[D]. Harbin: Harbin Institute of Technology, 2012 (in Chinese). 鄧毅. 廢水產酸合成聚羥基烷酸酯工藝穩定運行研究[D]. 哈爾濱: 哈爾濱工業大學, 2012.
[37] Albuquerque MGE, Torres CAV, Reis MAM. Polyhydroxyalkanoate (PHA) production by a mixed microbial culture using sugar molasses: Effect of the influent substrate concentration on culture selection. Water Res, 2010, 44(11): 3419–3433.
[38] Guo ZR. Research on new progress of PHA production using activated sludge based on dynamic pulse discharge-aerobic dynamic feeding mode[D]. Harbin: Harbin Institute of Technology, 2016 (in Chinese). 郭子瑞. 基于動態間歇排水瞬時補料的活性污泥合成PHA新工藝研究[D]. 哈爾濱: 哈爾濱工業大學, 2016.
[39] Serafim LS, Lemos PC, Oliveira R, et al. Optimization of polyhydroxybutyrate production by mixed cultures submitted to aerobic dynamic feeding conditions. Biotechnol Bioeng, 2004, 87(2): 145–160.
[40] Albuquerque MGE, Martino V, Pollet E, et al. Mixed culture polyhydroxyalkanoate (PHA) production from volatile fatty acid (VFA)-rich streams: Effect of substrate composition and feeding regime on PHA productivity, composition and properties. J Biotechnol, 2011, 151(1): 66–76.
[41] Wang XF, Bengtsson S, Oehmen A, et al. Application of dissolved oxygen (DO) level control for polyhydroxyalkanoate (PHA) accumulation with concurrent nitrification in surplus municipal activated sludge. New Biotechnol, 2019, 50: 37–43.
[42] Zheng YD, Zhong QH, Ma WS, et al. Biosynthesis of PHA from anaerobic-aerobic activated sludge process. Res Environ Sci, 2001, 14(2): 41–44 (in Chinese). 鄭裕東, 鐘青華, 馬文石, 等. 厭氧-好氧馴化活性污泥生物合成PHA的研究. 環境科學研究, 2001, 14(2): 41–44.
[43] Chen ZQ, Huang L, Wen QX, et al. Efficient polyhydroxyalkanoate (PHA) accumulation by a new continuous feeding mode in three-stage mixed microbial culture (MMC) PHA production process. J Biotechnol, 2015, 209: 68–75.
[44] Wang YP, Cai JY, Lan JH, et al. Biosynthesis of poly(hydroxybutyrate-hydroxyvalerate) from the acclimated activated sludge and microbial characterization in this process. Bioresour Technol, 2013, 148: 61–69.
[45] Rodriguez-Perez S, Serrano A, Pantión AA, et al. Challenges of scaling-up PHA production from waste streams. A review. J Environ Manage, 2018, 205: 215–230.
[46] Palmeiro-Sánchez T, Fra-Vázquez A, Rey-Martínez N, et al. Transient concentrations of NaCl affect the PHA accumulation in mixed microbial culture. J Hazard Mater, 2016, 306: 332–339.
[47] Ribeiro PLL, Silva GDS, Druzian JI. Evaluation of the effects of crude glycerol on the production and properties of novel polyhydroxyalkanoate copolymers containing high 11-hydroxyoctadecanoate byIPT 029 andIPT 429. Polym Adv Technol, 2016, 27(4): 542–549.
[48] Villano M, Beccari M, Dionisi D, et al. Effect of pH on the production of bacterial polyhydroxyalkanoates by mixed cultures enriched under periodic feeding. Process Biochem, 2010, 45(5): 714–723.
[49] Zheng X, Su YL, Li X, et al. Pyrosequencing reveals the key microorganisms involved in sludge alkaline fermentation for efficient short-chain fatty acids production. Environ Sci Technol, 2013, 47(9): 4262–4268.
[50] Schmidt M, Ienczak JL, Quines LK, et al. Poly(3-hydroxybutyrate--3-hydroxyvalerate) production in a system with external cell recycle and limited nitrogen feeding during the production phase. Biochem Eng J, 2016, 112: 130–135.
[51] Chen GQ, Jiang XR. Engineering bacteria for enhanced polyhydroxyalkanoates (PHA) biosynthesis. Synth Syst Biotechnol, 2017, 2(3): 192–197.
[52] Wang Q. Biosynthesis, biodegradation and molecular evolution of polyhydroxyalkanonates in[D]. Ji’nan: Shandong University, 2009 (in Chinese). 王倩. 聚羥基脂肪酸酯在大腸桿菌中的合成、降解以及分子改造[D]. 濟南: 山東大學, 2009.
[53] Jendrossek D, Schirmer A, Schlegel HG. Biodegradation of polyhydroxyalkanoic acids. Appl Microbiol Biotechnol, 1996, 46(5/6): 451–463.
[54] Alvarez HM, Pucci OH, Steinbuchel A. Lipid storage compounds in marine bacteria. Appl Microbiol Biotechnol, 1997, 47(2): 132–139.
[55] Jendrossek D. Peculiarities of PHA granules preparation and PHA depolymerase activity determination. Appl Microbiol Biotechnol, 2007, 74(6): 1186–1196.
[56] Huisman GW, Wonink E, Meima R, et al. Metabolism of Poly(3-hydroxyalkanoates) (PHAs) by pseudomonas oleovorans. Identification and sequences of genes and function of the encoded proteins in the synthesis and degradation of PHA. J Biol Chem, 1991, 266(4): 2191–2198.
[57] Doi Y, Kanesawa Y, Kunioka M, et al. Biodegradation of microbial copolyesters: poly(3-hydroxybutyrate-co-3-hydroxyvalerate) and poly(3-hydroxybutyrate-co-4-hydroxybutyrate). Macromolecules, 1990, 23(1): 26–31.
[58] P?tterM, Steinbüchel A. Poly (3-hydroxybutyrate) granule-associated proteins: impacts on poly (3-hydroxybutyrate) synthesis and degradation. Biomacromolecules, 2005, 6(2): 552–560.
[59] Cho M, Brigham CJ, Sinskey AJ, et al. Purification of polyhydroxybutyrate synthase from its native organism,: implications for the initiation and elongation of polymer formation in vivo. Biochemistry, 2012, 51(11): 2276–2288.
[60] Kuchta K, Chi LF, Fuchs H, et al. Studies on the influence of phasins on accumulation and degradation of PHB and nanostructure of PHB granules inH16. Biomacromolecules, 2007, 8(2): 657–662.
[61] Moldes C, García P, García JL, et al.immobilization of fusion proteins on bioplastics by the novel tag BioF. Appl Environ Microbiol, 2004, 70(6): 3205–3212.
[62] Maestro B, Galán B, Alfonso C, et al. A new family of intrinsically disordered proteins: structural characterization of the major Phasin PhaF fromKT2440. PLoS ONE, 2013, 8(2): e56904.
[63] Wang Q, Xia YZ, Chen Q, et al. Incremental truncation of PHA synthases results in altered product specificity. Enzyme Microb Technol, 2012, 50(6/7): 293–297.
[64] Ciesielski S, Pokoj T, Klimiuk E. Molecular insight into activated sludge producing polyhydroxyalkanoates under aerobic–anaerobic conditions. J Ind Microbiol Biotechnol, 2008, 35(8): 805–814.
[65] Yang C, Zhang W, Liu RH, et al. Analysis of polyhydroxyalkanoate (PHA) synthase gene and PHA-producing bacteria in activated sludge that produces PHA containing 3-hydroxydodecanoate. FEMS Microbiol Lett, 2013, 346(1): 56–64.
[66] Wang DB, Zeng GM, Chen YG, et al. Effect of polyhydroxyalkanoates on dark fermentative hydrogen production from waste activated sludge. Water Res, 2015, 73: 311–322.
[67] Oshiki M, Onuki M, Satoh H, et al. Microbial community composition of polyhydroxyalkanoate- accumulating organisms in full-scale wastewater treatment plants operated in fully aerobic mode. Microbes Environ, 2013, 28(1): 96–104.
[68] Wang YW, Zhu Y, Gu PF, et al. Biosynthesis of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) by bacterial community from propylene oxide saponification wastewater residual sludge. Int J Biol Macromol, 2017, 98: 34–38.
[69] Yin J, Che XM, Chen GQ. Progress on polyhydroxyalkanoates (PHA). Chin J Biotech, 2016, 32(6): 726–737 (in Chinese).尹進, 車雪梅, 陳國強. 聚羥基脂肪酸酯的研究進展. 生物工程學報, 2016, 32(6): 726–737.
Advances in synthesis of polyhydroxyalkanoates by using residual activated sludge
Dong Meng, Ruirui Li, Yuling Liu, Xiangyu Fan, Zhaosong Huang, Pengfei Gu, and Qiang Li
,’,’250022,,
Pure microbial fermentation is the primary means of polyhydroxyalkanoates (PHA) production at present, but high cost limits its large-scale application. In recent years, the synthesis of PHA by mixed microbial culture of activated sludge has been extensively studied. Combining the residual sludge treatment with PHA synthesis not only eliminates the sterilization process necessary for pure culture, but also utilizes residual sludge as resource. The hydrolysis and acidification of the residual sludge, the enrichment and acclimation of the consortium and the PHA synthesis are affected by environmental factors. The intensive biosynthesis mechanism study is helpful for the application of mixed culture to synthesize PHA. This paper introduces the feasibility of using residual sludge to synthesize PHA, the factors affecting the hydrolysis and acidification of residual sludge, the accumulation and domestication of PHA by sludge microbial consortium and its mechanism.
polyhydroxyalkanoates, activated sludge, volatile fatty acids, mixed microbial culture
July9, 2019;
August 26, 2019
National Natural Science Foundation of China (Nos.31870105, 31741007).
Qiang Li. Tel: +86-531-82767364; Fax: +86-531-89736818; E-mail: chm_liq@ujn.edu.cn
國家自然科學基金 (Nos.31870105, 31741007) 資助。
2019-09-09
http://kns.cnki.net/kcms/detail/11.1998.Q.20190906.1035.001.html
孟棟, 李枘枘, 劉玉玲, 等. 利用剩余活性污泥合成聚羥基脂肪酸酯的研究進展. 生物工程學報, 2019, 35(11): 2165–2176.
Meng D, Li RR, Liu YL, et al. Advances in synthesis of polyhydroxyalkanoates by using residual activated sludge. Chin J Biotech, 2019, 35(11): 2165–2176.
(本文責編 郝麗芳)

