高血壓人群原發性醛固酮增多癥患者代謝改變的性別特異性研究
榮利偉,駱秦,王夢卉,張德蓮,努爾比亞·阿不都塞拉木,陶維俊,李南方*
原發性醛固酮增多癥(primary aldosteronism,PA)以腎上腺皮質醛固酮生成過多為特征,占高血壓患者的4.6%~16.6%,在難治性高血壓中更高[1-2]。長期醛固酮過多與心肌梗死、心房顫動、卒中和慢性腎臟疾病風險的增高密切相關[3-5]。與原發性高血壓病(EH)患者相比,PA患者常伴發更多的心血管并發癥,醛固酮對心血管的危害可能獨立于高血壓的作用之外[3,6-7]。除了對血壓、血管內容積的影響外,PA還可能使機體代謝發生改變[8],發生氧化應激,從而導致靶器官損害[9-10]。多項研究報道PA與糖代謝紊亂和代謝綜合征(metabolic syndrome,MS)的發生密切相關。醛固酮過多引起的低血鉀癥可以影響胰島素的分泌,導致糖代謝紊亂[5,11-12]。醛固酮過多本身也可影響胰島素的分泌,促使胰島素抵抗的發生[13-14]。研究顯示,與EH患者相比,PA患者中糖尿病和MS的患病率明顯增高[5,15-16]。然而一項大型的橫斷面研究報道,PA和EH之間糖代謝和脂代謝紊亂的發生情況沒有差異[17]。因此代謝紊亂在PA和EH中是否存在差異尚不明確。這些PA患者中代謝紊亂改變研究結果的差異,可能與不同性別PA患者代謝改變存在差異有關,但目前關于不同性別對PA患者代謝影響的研究較少。肥胖個體醛固酮生成過多是其心血管疾病和代謝紊亂發生的重要原因之一[18],研究顯示醛固酮在肥胖男性中與微血管胰島素敏感性和代謝改變無關[19],僅在女性中與肥胖、體質指數(BMI)及血壓直接相關[20]。此外通過鹽皮質激素受體拮抗劑(MRA)阻滯醛固酮作用女性(雌性)比男性(雄性)更有效[21-22]。據此本研究的目的是分析不同性別PA患者的代謝改變,為醛固酮的作用機制和PA的診治提供新的證據。
本文要點:
原發性醛固酮增多癥(PA)與糖代謝紊亂和代謝綜合征的發生密切相關。與原發性高血壓病(EH)患者相比,PA患者常伴發更多的心血管并發癥。本研究主要結果為:(1)進行年齡匹配后,男性PA患者血壓水平明顯高于EH患者,女性血壓水平無明顯差異;(2)肥胖女性中,PA患者糖代謝異常的比例明顯高于EH患者,而男性未發現此種差異。提示:PA患者存在嚴重靶器官損害,在男性中主要由于高血壓,在女性中除高血壓外還可能與較重的代謝紊亂有關,PA患者代謝改變可能存在性別特異性。
1 對象與方法
1.1 研究對象 選入2009—2010年就診于新疆維吾爾自治區人民醫院高血壓診療中心并診斷為高血壓的患者1 058例。納入標準:(1)已服用2種或2種以上降壓藥物,血壓仍不能降至140/90 mm Hg(1 mm Hg=0.133 kPa)以下;(2)自發性低鉀血癥;(3)腎上腺意外瘤、早發高血壓及腦卒中等心腦血管疾病,以及有腎上腺疾病家族史等疑似PA。排除標準:(1)高血壓嚴重無法控制;(2)肝、腎功能不全,嚴重心血管并發癥(心肌梗死、心絞痛、卒中或心臟衰竭);(3)甲狀腺功能異常;(4)疑似庫欣綜合征、嗜鉻細胞瘤、腎實質性高血壓、腎血管性高血壓等繼發性高血壓。
1.2 研究方法
1.2.1 一般資料統計 患者基本信息,包括姓名、性別、年齡、身高、體質量、腹圍、血壓、用藥情況、高血壓、糖尿病史等。
1.2.2 一般生化檢測 血、尿標本留取:患者普通飲食,未補鉀時先要求受試者準確留取24 h尿,隔夜空腹12 h后8:00~10:00采集血樣。入選者分別采集外周靜脈血于乙二胺四乙酸(EDTA)抗凝管中,進行肝功能(丙氨酸氨基轉移酶、天冬氨酸氨基轉移酶、膽紅素、清蛋白等)、腎功能(血尿素氮、肌酐、尿酸、尿蛋白等)、血糖、血脂、電解質等檢測。血、尿電解質測定采用離子選擇電極法(日本日立公司7600-010全自動生化分析儀,電極參比液購自Beckman Coulter,美國)進行檢測,血、尿鉀批間變異(coefficient of variation,CV)<2%,血、尿鈉批間CV<1%,血脂測定采用酶法,血糖測定采用葡萄糖氧化酶法。
1.2.3 特殊生化指標檢測 血醛固酮(plasma aldosterone concentration,PAC)、血腎素活性(plasma renin activity,PRA)測定準備:要求患者檢測前停用血管緊張素轉換酶抑制劑、血管緊張素受體拮抗劑、二氫吡啶類鈣拮抗劑和β-受體阻滯劑至少4周,停用利尿劑和鹽皮質激素拮抗劑至少6周。如果有必要,降壓藥可替換為緩釋維拉帕米或α-腎上腺素受體拮抗劑(多沙唑嗪或特拉唑嗪)或兩者的結合以減少對PAC、PRA和醛固酮腎素比(ARR)測量的干擾。患者普通飲食,低血鉀患者采用口服補鉀的方法將血鉀調整至3.5~4.5 mmol/L再抽坐位血。于當地時間9:00抽取坐位靜脈血(空腹,保持坐位15 min以上),測定醛固酮和腎素活性,計算ARR。ARR按照以下公式計算:ARR(ng/dl∶ ng·ml-1·h-1)=PAC(ng/dl)/PRA(ng·ml-1·h-1)。鹽水試驗:試驗前須空腹、保持坐位15 min以上,當地時間9:00開始.在4 h內靜脈滴注0.9%氯化鈉溶液2 000 ml(500 ml/h,滴速恒定),在整個過程中需要密切監測血壓和心率變化。在靜脈滴注前和靜脈滴注后分別測定PAC及PRA。PAC和PRA的檢測均采用放射免疫法,試劑盒分別購自Beckman Coulter(美國)和北京北方生物研究所(中國)。PAC參考范圍為3.81~31.3 ng/dl(坐位狀態),PRA參考范圍為0.20~1.90 ng·ml-1·h-1(坐位狀態),PAC試劑盒批間CV是9.8%,批內CV是4.5%:PRA試劑盒批間CV<15%,批內CV<10%。
1.3 相關診斷標準
1.3.1 PA的篩查與診斷 嚴格按照美國內分泌學會的PA診斷治療專家共識[23],PA陽性的篩檢試驗 是 基 于 ARR>20 和 /或 PAC>10 ng/dl。 對 PA 的診斷依據生理鹽水輸注試驗(saline infusion test,SIT)的結果判定。受試者SIT后PAC>10 ng/dl被認為是 確 診 PA,PAC 5~10 ng/dl認 為 是 不 確定 PA,PAC<5 ng/dl或 ARR<20可以排除 PA。2次 PAC水平均值<5 ng/dl者,同時排除其他繼發性高血壓作為EH組。兩次PAC水平均值>5 ng/dl而<10 ng/dl的為不確定PA。最終127例患者被確診為PA,259例患者為不確定PA,672例患者被確診為EH。對確診PA患者和EH患者按性別、年齡(±1歲)標準以1∶3的比例進行匹配,最后124例PA患者和372例EH患者完成匹配。
1.3.2 MS的診斷 參考2009年多機構聯合聲明(Joint Interim Statement,JIS)對 MS的診斷標準[24],具備以下3項或3項以上者為MS:(1)腹圍升高:男性腹圍≥90 cm、女性≥80 cm;(2)高三酰甘油:空腹≥1.7 mmol/L和/或進行降三酰甘油藥物治療者;(3)低高密度脂蛋白膽固醇(HDL-C):空腹血HDL-C男性<1.0 mmol/L、女性<1.3 mmol/L和/或進行低HDL-C藥物治療者;(4)血壓升高:收縮壓≥130 mm Hg和/或舒張壓>85 mm Hg和/或已確診為高血壓降壓治療者;(5)高血糖:空腹血糖(FPG)≥5.6 mmol/L和/或餐后2 h血糖(2 hPG)>7.8 mmol/L或已確診為糖尿病并治療者。由于本研究中腹圍數據不很精確,因此同時參考中華醫學會糖尿病分會對超重或肥胖(BMI≥25 kg/m2為超重或肥胖)及MS的定義[25],分別以腹圍和BMI兩個標準分別研究MS的患病情況,記作WCMS和BMIMS。
1.4 統計學方法 采用SPSS 22.0統計軟件進行統計分析。正態分布計量資料以(x ±s)表示,兩組間比較采用獨立樣本t檢驗,三組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗;計數資料以百分率表示,比較采用χ2檢驗或Fisher's確切概率法;在分別控制年齡、血壓、血肌酐、尿酸后,采用多元線性回歸分析不同性別超重或肥胖患者血糖的影響因素。以P<0.05為差異有統計學意義,計數資料三組間兩兩比較,需調整檢驗水準為0.017。
2 結果
2.1 基線情況 按照排除納入標準,總共1 058例患者進入了PA的篩檢流程并完善了相關的檢查項目,如:坐位醛固酮及PRA、鹽水負荷試驗、血糖、血脂、血壓等。該人群男667例(63.0%),平均年齡為(45.5±9.0)歲,醛固酮為(14.8±8.2)ng/dl,PA 的檢出率為12.0%(127/1 058),糖尿病檢出率為13.5%(143/1 058)。三組患者年齡、收縮壓、舒張壓、血糖、糖尿病患者占比、總膽固醇、血鉀、坐位醛固酮、坐位腎素、ARR比較,差異有統計學意義(P<0.05),性別、腹圍、BMI、三酰甘油、HDL-C、WCMS、BMIMS、肌酐、尿酸比較,差異無統計學意義(P>0.05,見表1)。
2.2 PA患者與性別、年齡相匹配的EH患者一般情況的比較 在性別、年齡匹配的患者中,總體患者,PA組收縮壓、坐位醛固酮、ARR明顯高于EH組,總膽固醇、血鉀、坐位腎素水平明顯低于EH組,差異有統計學意義(P<0.05);男性患者,PA收縮壓、舒張壓、坐位醛固酮、ARR明顯高于EH組,血鉀、坐位腎素水平明顯低于EH組,差異有統計學意義(P<0.05);女性患者,PA組總膽固醇、血鉀、坐位腎素水平明顯低于EH組,坐位醛固酮、ARR明顯高于EH組,差異有統計學意義(P<0.05,見表2)。
2.3 不同性別PA和EH患者代謝相關指標檢出率的比較 男性PA和EH患者之間、女性PA和EH患者之間,肥胖、血脂異常、血糖異常、MS的檢出率比較,差異無統計學意義(P>0.05,見表3)。但在超重或肥胖患者中,女性PA患者高血糖癥的檢出率明顯高于EH組(P<0.05),而男性患者中MS和代謝相關指標的檢出率在PA和EH間差異無統計學意義(P>0.05,見表4)。
2.4 不同性別超重或肥胖患者血糖的影響因素的多元線性回歸分析 以不同性別超重或肥胖患者的血糖為因變量,以年齡、收縮壓、舒張壓、三酰甘油、肌酐、尿酸、鹽水后醛固酮為自變量,進行多元線性回歸分析,結果顯示:年齡、三酰甘油是男性超重或肥胖患者血糖的影響因素(P<0.05);年齡、三酰甘油、鹽水后醛固酮是女性超重或肥胖患者血糖的影響因素(P<0.05,見表5)。
3 討論
本研究結果顯示,與EH患者相比,男性PA患者血壓水平較高,女性血壓水平未見明顯差異。MS和代謝相關參數異常的檢出率在不同性別PA和EH患者之間整體上未見明顯差異,而在肥胖女性PA患者中高血糖癥的檢出率明顯高于EH患者,男性患者中MS和代謝相關指標異常檢出率在PA和EH間均未見明顯差異。在肥胖女性個體中,鹽水后醛固酮與血糖獨立相關。
本研究在性別、年齡相匹配的PA和EH患者間未發現糖脂代謝指標的差異,與本研究結果相似,MATROZOVA等[17]分析了大量的PA和EH患者后,發現與EH患者相比,PA患者糖脂代謝異常比例不高,認為PA中MS患病率較EH患者高的可能性不大。同樣SOMLóOVá等[26]回顧性分析了100例PA患者,其中50例特發性醛固酮增多癥、50例醛固酮腺瘤,和90例年齡、病程相匹配的EH患者做對照,結果顯示MS患病率在PA和EH之間相似。之前許多研究報道PA與糖代謝紊亂、MS密切相關[5,12-13]。醛固酮過多引起低血鉀癥,通過影響胰島素的分泌,導致糖代謝異常[12-13]。甚至醛固酮過多本身也可影響胰島素的分泌,促使胰島素抵抗的發生[13-14]。德國的一項研究顯示與年齡、性別、血壓相匹配的對照組相比,PA患者中MS的患病率明顯增高,其中糖尿病患病率的升高是主要的貢獻因素[5]。上述研究的差異可能由于代謝紊亂在PA和EH間發生機制不同有關,不同性別、不同亞型[26]的PA其各代謝紊亂的情況可能不相同,而多數研究沒有考慮這些因素。本研究發現與EH患者相比,雖然PA患者的年齡偏大、血壓偏高,但其血脂水平卻較低,目前PA和EH代謝紊亂的機制還不十分清楚。
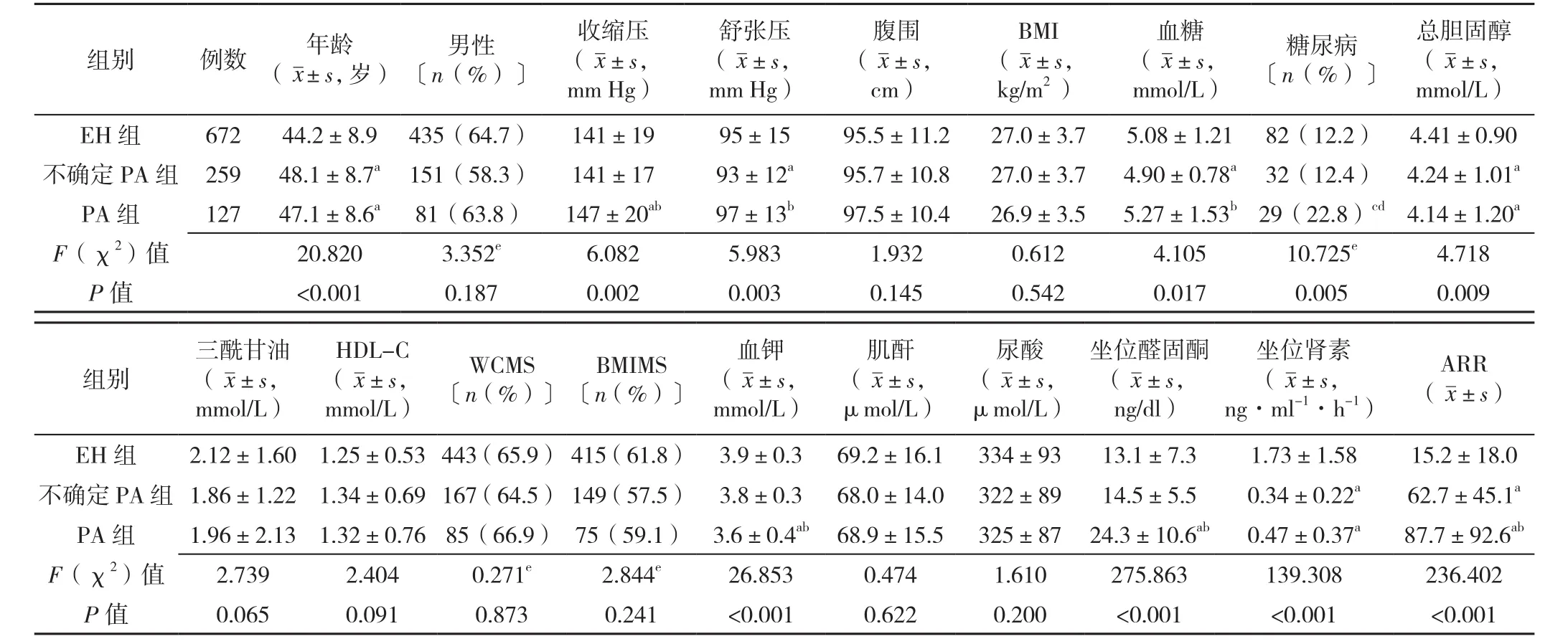
表1 三組患者的基線情況比較Table 1 Comparison of baseline characteristics among three groups
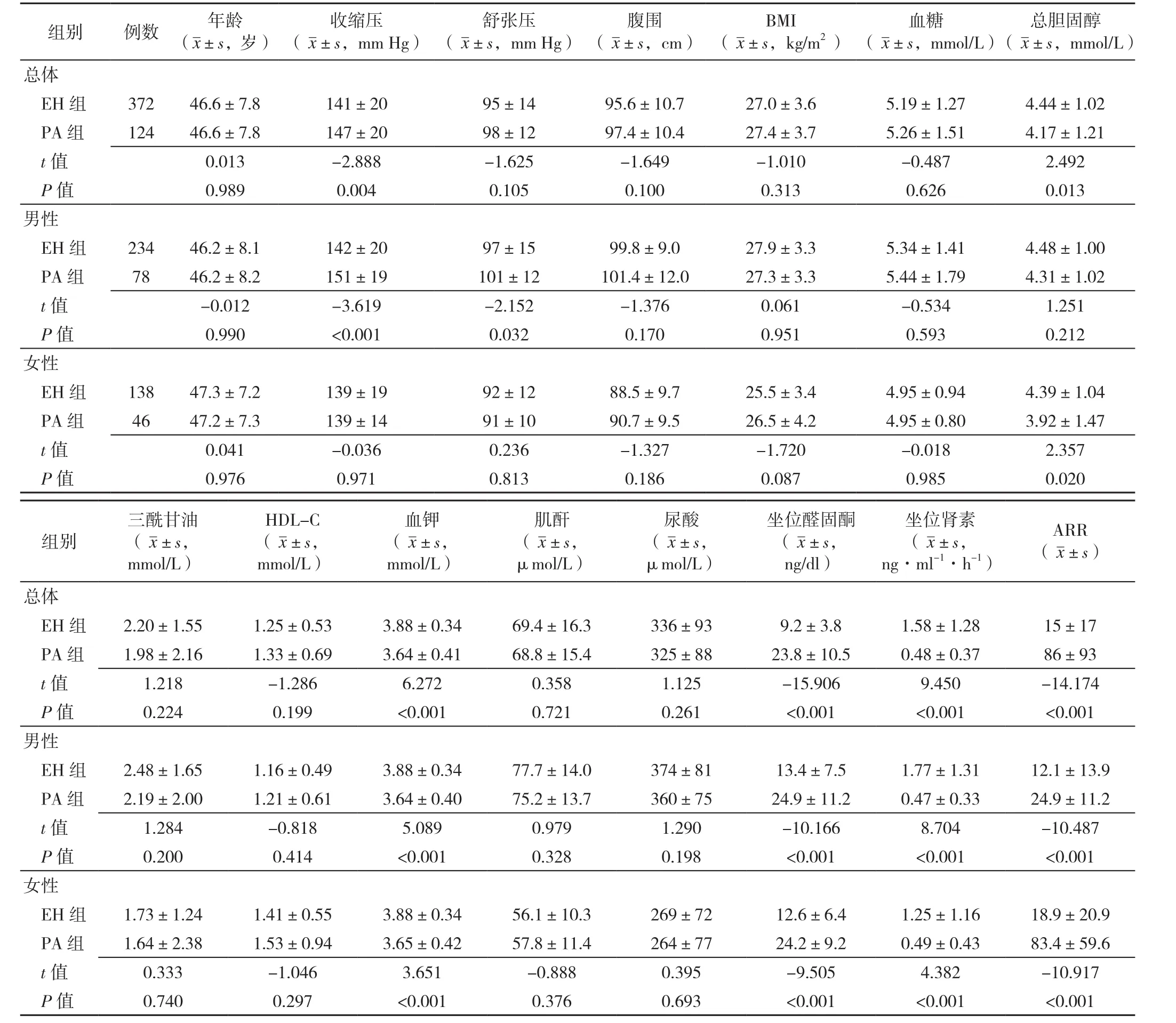
表2 PA患者與性別和年齡相匹配的EH患者一般情況的比較Table 2 Comparison of general conditions of PA patients and EH patients matched for age and sex
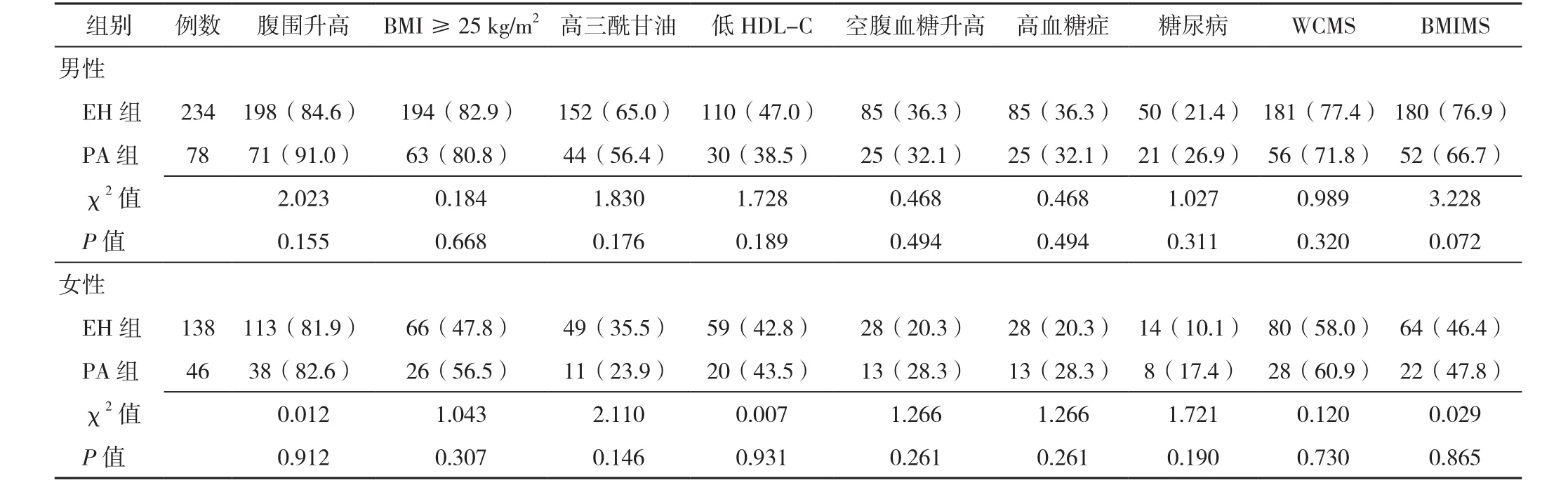
表3 不同性別PA和EH患者代謝相關指標檢出率的比較〔n(%)〕Table 3 Comparison of detection rates of metabolic related parameters in PA patients and EH patients with different genders
本研究僅在肥胖女性中發現PA患者高血糖癥的患病率明顯高于EH,而男性患者中未發現這種差異。對于不同性別PA患者對代謝影響的研究目前還較少,肥胖個體醛固酮生成過多是心血管疾病和代謝紊亂的重要因素之一[18],而肥胖個體醛固酮過多僅在女性個體中與內臟肥胖和BMI及血壓直接相關[20],而且通過鹽皮質激素受體拮抗劑阻滯醛固酮的作用女性比男性更有效[21-22]。研究顯示在肥胖的男性患者中未發現醛固酮和微血管胰島素敏感的關系[19]。在這項研究中分析了25例非肥胖和53例腹型肥胖的男性個體,結果顯示腹型肥胖參與者和非肥胖的參與者之間醛固酮水平和鈉鹽分泌沒有差異,也未發現醛固酮與胰島素介導的肌肉微血管恢復受損(impaired insulin-mediated muscle microvascular recruitment,IMMR)、胰島素敏感性之間的相關性,醛固酮的絕對水平不能解釋肥胖與非肥胖個體間微血管、胰島素敏感性和血壓之間的差異。SHAMISS等[27]發現未經治療的PA患者胰島素的敏感性明顯高于EH患者。研究報道PA患者經鹽皮質激素受體拮抗劑或腎上腺切除術治療后,胰島素敏感性恢復正常[28-29],然而沒有發現PA患者在長期藥物或手術治療后,其糖耐量受損得到改善[30]。PA和EH的糖代謝異常是否有共同的作用機制尚不清楚。醛固酮合酶基因變異(CYP11B2,參與醛固酮合成的主要酶)和高血糖之間的相關性已在EH患者中發現[31],醛固酮水平和胰島素抵抗的相關性也已經在正常血壓和高血壓的人群中觀察到[32-33]。醛固酮的基因組生物學作用是通過與核受體家族成員和MR相互作用而介導的。MR與胰島素受體基因啟動子中的糖皮質激素反應元件的直接作用,導致胰島素受體下調[34]。關于人體脂肪組織中MR的存在以及醛固酮作為調節脂肪組織功能和介導脂肪組織中胰島素抵抗作用的可能角色尚不清楚。同樣我們發現在肥胖女性個體中,鹽水后醛固酮與高血糖癥獨立相關,而未發現血鉀和醛固酮與高血糖癥的相關性。不同性別非肥胖個體中及所有個體整體分析,均未發現血鉀、醛固酮或鹽水后醛固酮與高血糖癥的相關性。研究表明肥胖個體脂肪源性瘦素增加,可能是脂肪介導醛固酮水平升高的關鍵環節。肥胖個體內源性瘦素增加或外源性補充瘦素會增加醛固酮合酶(CYP11B2)的表達和醛固酮的生成,瘦素缺乏或阻滯瘦素信號會降低醛固酮水平[35]。在腎臟皮質細胞,瘦素依賴的CYP11B2的表達及其介導的鈣依賴通道機制是肥胖個體醛固酮升高的原動力而非脂肪體積[35],瘦素導致肥胖個體高血壓的機制是:女性通過瘦素激活醛固酮鹽皮質激素軸[22],男性通過瘦素介導的交感系統激活[36]。肥胖可以通過瘦素誘導內皮細胞功能紊亂和刺激心肌膠原沉積[35],肥胖小鼠MRA可以消除MR介導心血管疾病的損害[37-39]。在肥胖個體,雄性可以通過內皮源性超極 化(endothelium-derived hyperpolarization,EDH) 抑制內皮細胞功能紊亂[40],但肥胖可以損傷女性中這種內皮細胞源性超極化(EDH),內皮細胞MR敲除可以消除肥胖個體內皮細胞功能紊亂的發生,但雄性中沒有觀察到這種作用[40-41]。研究顯示,機體內皮細胞的一氧化氮(NO)合成減少,會增加氧化物質的氧化應激,影響內皮細胞功能[42],進而產生胰島素抵抗[43]。肥胖女性個體EDH缺乏,因此內皮細胞功能發生紊亂,造成胰島素抵抗,使機體的代謝發生紊亂,而在男性中不存在這種風險。PA患者代謝改變的性別特異性還可能和機體性激素的改變有關,最近有研究發現PA患者中性激素水平與對照組相比有明顯差異[44],研究納入了85例PA患者、46例EH患者和76例正常個體作為對照,結果血清硫酸脫氫表雄酮(DHEA-S)在女性PA患者中較低,PA亞型中只有女性醛固酮腺瘤患者的DHEA-S水平較低。脫氫表雄酮(DHEA)及其硫酸鹽衍生物硫酸脫氫表雄酮(DHEA-S)是靈長類動物腎上腺產生的,兩者受到促腎上腺皮質激素(ACTH)的刺激,并由網狀帶分泌,其與機體代謝密切相關[45]。在本研究中年齡匹配的男性PA患者血壓水平明顯高于EH患者,而女性中糖代謝異常的比例明顯高于EH患者,與上述文獻觀點相符。目前PA患者代謝紊亂的情況還不十分清楚,PA分型、瘦素、性激素等都與糖脂代謝密切相關。PA患者嚴重靶器官損害,在男性中主要由于高血壓,而女性中除高血壓外還可能與較重的代謝紊亂有關,PA患者代謝改變可能存在性別特異性。

表4 不同性別超重或肥胖PA和EH患者代謝相關指標檢出率的比較〔n(%)〕Table 4 Comparison of detection rates of metabolic related parameters in overweight or obese PA patients and EH patients with different genders
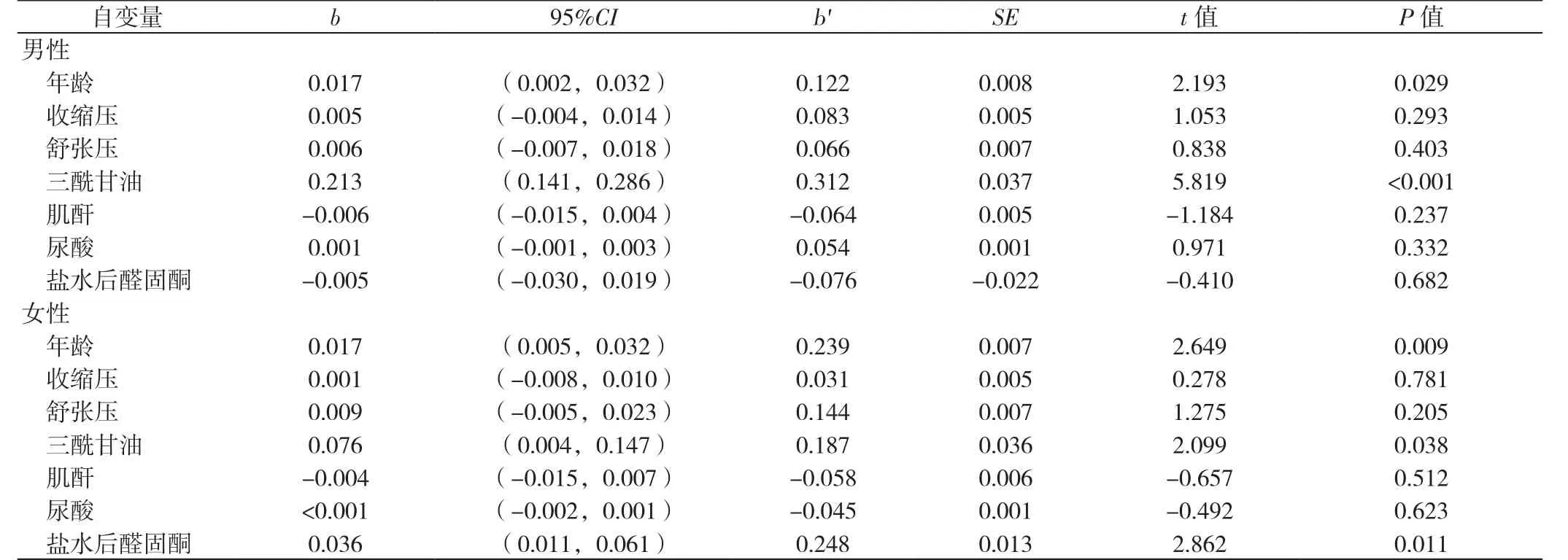
表5 不同性別超重或肥胖患者血糖的影響因素的多元線性回歸分析Table 5 Multivariate linear regression analysis of factors affecting blood glucose in overweight or obese patients
總之,研究發現,僅在肥胖女性PA患者中糖代謝異常的比例明顯高于年齡匹配的EH患者,而男性未發現這種差異。在超重或肥胖的女性個體中,只有鹽水后醛固酮與高血糖癥獨立相關,未發現血鉀、血醛固酮與高血糖癥的相關性。但在我們的研究中,PA患者按性別和是否肥胖分組后各亞組樣本量相對較小,同時由于胰島素、瘦素、性激素、PA分型等相關數據缺乏,我們沒有對不同性別中糖脂代謝紊亂差異的可能原因進行深入分析。同時用BMI≥25 kg/m2標準定義女性超重或肥胖可能造成女性糖代謝異常比例相對較高,對于PA中不同性別代謝改變的情況仍需要進一步的體內外研究進行驗證。
作者貢獻:駱秦、李南方進行文章構思和設計、數據收集、統計分析,對文章進行批判性審查和修訂;榮利偉進行文章撰寫、設計、數據整理、統計分析及結果解釋;王夢卉進行資料收集,參與數據初步統計分析和文章撰寫;張德蓮進行資料收集,并參與文章結果的解釋;努爾比亞·阿不都塞拉木、陶維俊參與數據收集、數據初步整理及統計分析。
本文無利益沖突。

