響應面優化紅毛藻多糖提取工藝及抗光氧化活性
張一非,陳艷紅,2,3,4,伍 菱,2,3,4,姜澤東,2,3,4,黃高凌,2,3,4,朱艷冰,2,3,4,倪 輝,2,3,4,李清彪,2,3,4
( 1.集美大學 食品與生物工程學院,福建 廈門 361021; 2.福建省食品微生物與酶工程重點實驗室,福建 廈門 361021; 3.廈門南方海洋研究中心經濟海藻資源化利用重點實驗室,福建 廈門 361021; 4.廈門市食品生物工程技術研究中心,福建 廈門 361021 )
紅毛藻(Bangiafusco-purpurea)又稱紅毛菜、紅發菜等,屬紅藻門、紅毛菜綱、紅毛菜目[1],是我國東南沿海海域獨有的珍貴經濟海藻,福建省莆田市南日島海域是其主要產地之一。相關研究表明,紅毛藻具有祛陰去火[2]和預防動脈粥狀硬化[3]、心腦血管疾病[4]等食藥用功效,深受東南沿海地區人們的喜愛。研究表明,紅毛藻中總糖含量占27%[5-6]。孫惠潔[7]研究發現,紅毛藻多糖能夠清除DPPH自由基,表明其具有體外抗氧化活性。宋田源等[8]研究表明,紅毛藻多糖具有抑制血管緊張素轉換酶活性,具有潛在的降血壓功效。余剛等[9]研究表明,紅毛藻多糖能夠誘導小鼠巨噬細胞RAW264.7活化,釋放一氧化氮和腫瘤壞死因子,具有潛在的免疫誘導活性。這些有益的生物活性使紅毛藻多糖在生物醫藥、特殊膳食食品、功能性食品等領域具有的良好的應用價值和開發前景。
目前,多糖的分離一般采用沉淀法,利用大多數多糖在有機溶劑中的溶解度小的原理,向提取液中加入陽離子表面活性劑如乙醇或季胺鹽類等,使水溶性多糖沉淀析出,但其特異性不高[7]。劉艷芳等[10]通過酶法輔助對毛頭鬼傘(Coprinuscomatus)子實體粗多糖提取工藝進行改良,使其提取率得到顯著提高;劉啟順等[11]篩選出纖維素酶、果膠酶和蛋白酶3種酶高效提取小球藻(Chorella)藻渣多糖,并采用正交試驗對條件進行優化,使提取率得到顯著提高。目前,關于紅毛藻多糖提取工藝的研究鮮有報道。孫惠潔等[7]用物理方法(超聲輔助提取法)優化了提取工藝,使紅毛藻粗多糖提取率相比熱水浸提法提高了38.39%。纖維素和果膠是細胞壁的主要成分,也是阻礙紅毛藻細胞間質和胞內大分子物質溶出的主要因素,利用纖維素酶、果膠酶水解細胞壁可降低這種阻礙作用[12]。據此,本研究利用纖維素酶、果膠酶輔助提取紅毛藻多糖,在考察不同酶和各工藝參數對多糖提取率影響的基礎上,采用響應面法優化酶法輔助提取紅毛藻多糖的工藝,為其規模化工業生產提供科學依據。此外,基于前期研究發現,紅毛藻多糖具有潛在的抗氧化活性[7],在本研究中進一步利用人皮膚成纖維細胞抗光氧化模型分析其抗紫外損傷活性,為紅毛藻多糖在抗紫外損傷生物醫學敷料和護膚品領域的開發應用提供理論依據。
1 材料與方法
1.1 材料
新鮮紅毛藻采集于福建莆田市南日島海域;纖維素酶(來源于黑曲霉)(上海阿拉丁生化科技股份有限公司),果膠酶(來源于黑曲霉),100X青鏈雙抗溶液(美國Sigma-Aldrich公司),人皮膚成纖維細胞(上海素爾生物科技有限公司),胎牛血清(FBS)(中國睿鉑賽生物科技公司),高糖DMEM培養基(美國Hyclone公司);無水乙醇等試劑均為國產分析純。
1.2 儀器設備
振蕩培養箱(ZQZY-CF,上海知楚儀器有限公司),高速萬能粉碎機(FW80,天津市泰斯特儀器有限公司),pH酸度計(FE20/EL20,梅特勒—托利多儀器(上海)有限公司),Free Zone 6 plus真空冷凍干燥機(美國Labconco公司),BioTek Cytation-5細胞成像多功能檢測系統(美國伯騰儀器有限公司)。
1.3 試驗設計
1.3.1 酶法輔助提取紅毛藻多糖
紅毛藻經水洗凈、烘干、打粉、過篩后得紅毛藻粉末。按料液比1∶20(m/V)將紅毛藻藻粉與水混勻[13],加入纖維素酶(或果膠酶)(纖維素酶:2.00 U/mL;果膠酶:0.22 U/mL),于45 ℃水浴鍋中酶解90 min。酶解液經熱水(100 ℃)抽提2.0 h,冷卻到室溫,4000 r/min離心20 min棄藻渣。加入3倍體積乙醇攪拌,靜置過夜,4000 r/min離心20 min,收集沉淀產物透析,冷凍干燥得紅毛藻多糖。
1.3.2 單因素試驗
固定條件:酶活性為纖維素酶,2.00 U/mL(或果膠酶,0.22 U/mL)[14];酶解溫度50 ℃(果膠酶為45 ℃);酶解時間2.0 h(果膠酶為1.2 h);酶解pH為8.0(果膠酶為8.0)。改變單一因素,考察酶解pH、纖維素(果膠酶)酶活性、酶解時間、酶解溫度對紅毛藻多糖提取率的影響,試驗結果取3次重復的平均值。按下式計算提取率:
提取率/%=m1/m×100%
式中,m1為紅毛藻多糖粉末質量(g),m為紅毛藻粉末質量(g)。
1.3.3 響應面試驗設計
根據Box-Behnken中心組合試驗設計原理,基于單因素試驗結果,選取三因素三水平試驗表1~2,利用Design-Expert 8.0.5軟件進行工藝條件優化,試驗結果取3次重復的平均值。
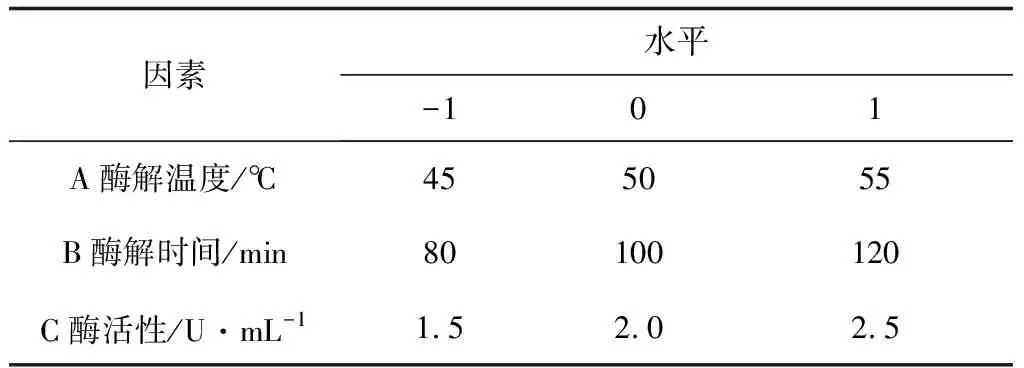
表1 Box-Behnken試驗因素和水平(纖維素酶)

表2 Box-Behnken試驗因素和水平(果膠酶)
1.4 紅毛藻多糖的抗光氧化損傷活性分析
1.4.1 細胞培養
人皮膚成纖維細胞采用含10%胎牛血清、100 U/mL青霉素及100 μg/mL鏈霉素的高糖DMEM培養基,于37 ℃、5%CO2的細胞培養箱中培養[9]。
試驗組:不同質量濃度(0、1、10、20、100、200 μg/mL)的紅毛藻多糖;空白組:生長培養基。
試驗組1與空白組1不經紫外線輻照,用于多糖對細胞活力影響的分析。
試驗組2與空白組2經過紫外線輻照20 min,輻照強度16.20 J/cm2,用于抗光氧化活性分析。
對照組:生長培養基培養,不經紫外線照射。
1.4.2 紅毛藻多糖對細胞活力影響及抗光氧化損傷活性分析
通過噻唑藍法[15]測定紅毛藻多糖對人皮膚成纖維細胞活力的影響。將處于對數生長時期的人皮膚成纖維細胞以3×104個/mL的密度接種于96孔細胞培養板,待細胞貼壁后,用不同質量濃度的多糖樣品溶液(0~200 μg/mL)孵育2.0 h,除去上清液后,每孔加入終含量為5%的噻唑藍—磷酸鹽緩沖溶液50 μL,繼續孵育30 min,移去上清液后,加入100 μL的二甲基亞砜,振蕩20 min,于Cytation-5細胞成像多功能檢測系統測量570 nm處吸光值(OD570)。按下式計算細胞活力。
式中,V為細胞活力,A為試驗組OD570,B為空白組OD570,C為對照組OD570。
2 結果與分析
2.1 各因素對紅毛藻多糖提取率的影響
2.1.1 pH的影響
酶解pH對紅毛藻多糖提取率的影響見圖1。pH為6.0~9.0時,隨著pH的升高,纖維素酶輔助提取紅毛藻多糖的提取率呈現下降的趨勢,在pH為10.0時略有提高;果膠酶處理的紅毛藻多糖提取率隨pH的增大無顯著變化,在pH為6.0時,提取率高于其他試驗組且二者提取率接近。綜上,將pH=6.0選為固定因素。
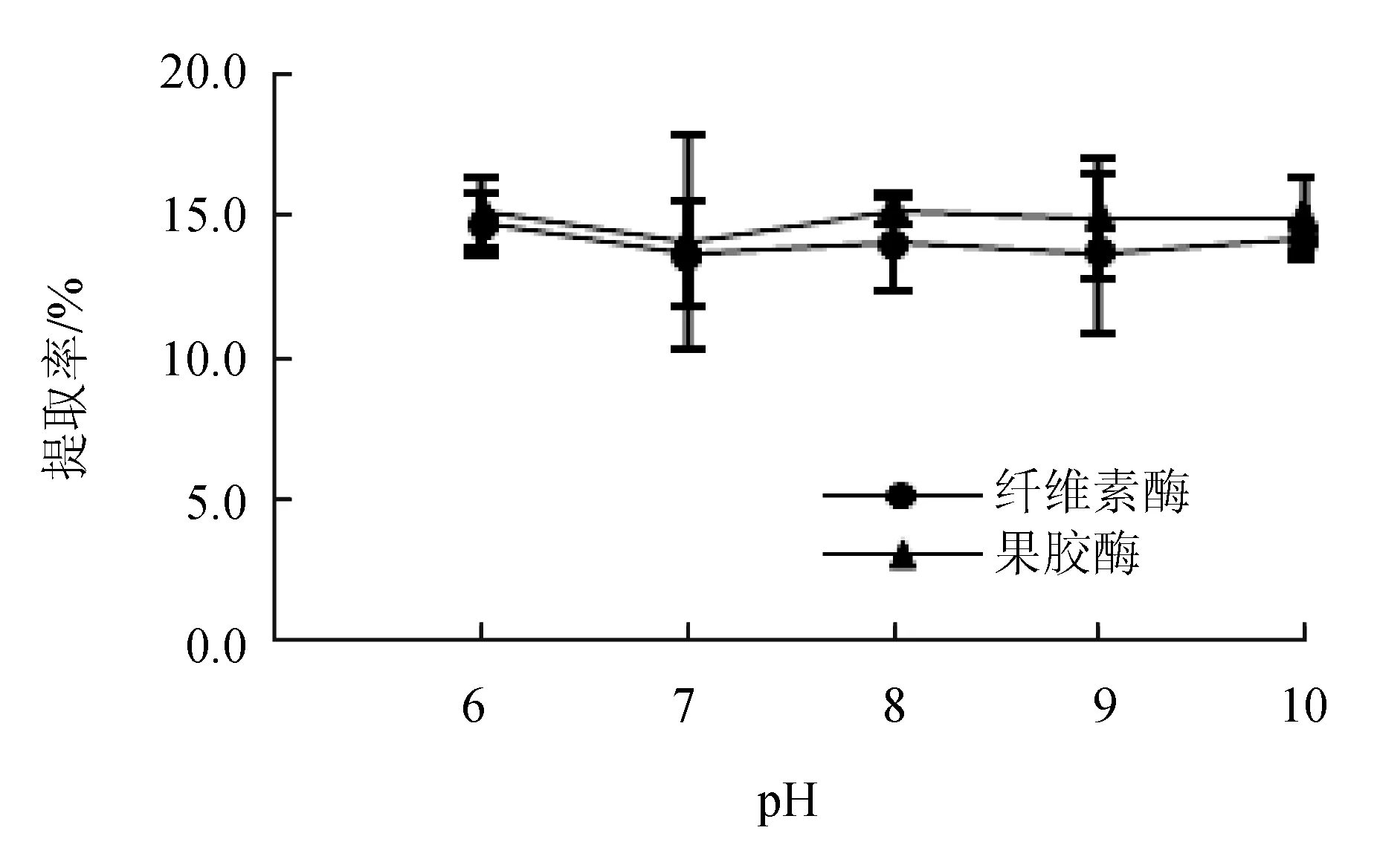
圖1 pH對紅毛藻多糖提取率的影響
2.1.2 酶活性的影響
纖維素酶和果膠酶的酶活性對紅毛藻多糖提取率的影響見圖2。纖維素酶活性在0~2.50 U/mL時,隨酶活性增大,提取率升高,在酶活性達到2.50 U/mL時,提取率最高可達11.45%,活性超過2.50 U/mL時,提取率下降(圖2a);果膠酶處理曲線趨勢與纖維素酶相似,果膠酶活性在0.165 U/mL時的提取率最高,達到10.35%(圖2b)。這是由于纖維素和果膠作為細胞壁的主要成分,在該反應體系中兩種酶分別水解紅毛藻細胞壁中的纖維素和果膠,僅使細胞壁被水解,而酶的活性升高可以使酶與藻粉的接觸更充分,提升水解效率,由于底物與酶結合的位點有限[16],當酶活性過高時,底物質量濃度不夠則會造成酶的浪費,故最佳的纖維素酶活性為2.50 U/mL,果膠酶活性為0.165 U/mL,且果膠酶催化效率高于纖維素酶。
2.1.3 酶解時間的影響
酶解時間對紅毛藻多糖提取率的影響見圖3。隨著酶解時間的增加,提取率均呈現先升后降的趨勢,而纖維素酶最佳酶解時間為100 min,果膠酶的最佳酶解時間為80 min。這是由于隨著酶解時間延長細胞壁的纖維素或果膠成分逐漸被水解,多糖逐漸溶出,但由于纖維素酶和果膠酶也可水解紅毛藻多糖中的糖苷鍵,導致分解作用加劇,提取率在接下來的一段時間內稍有下降[17]。
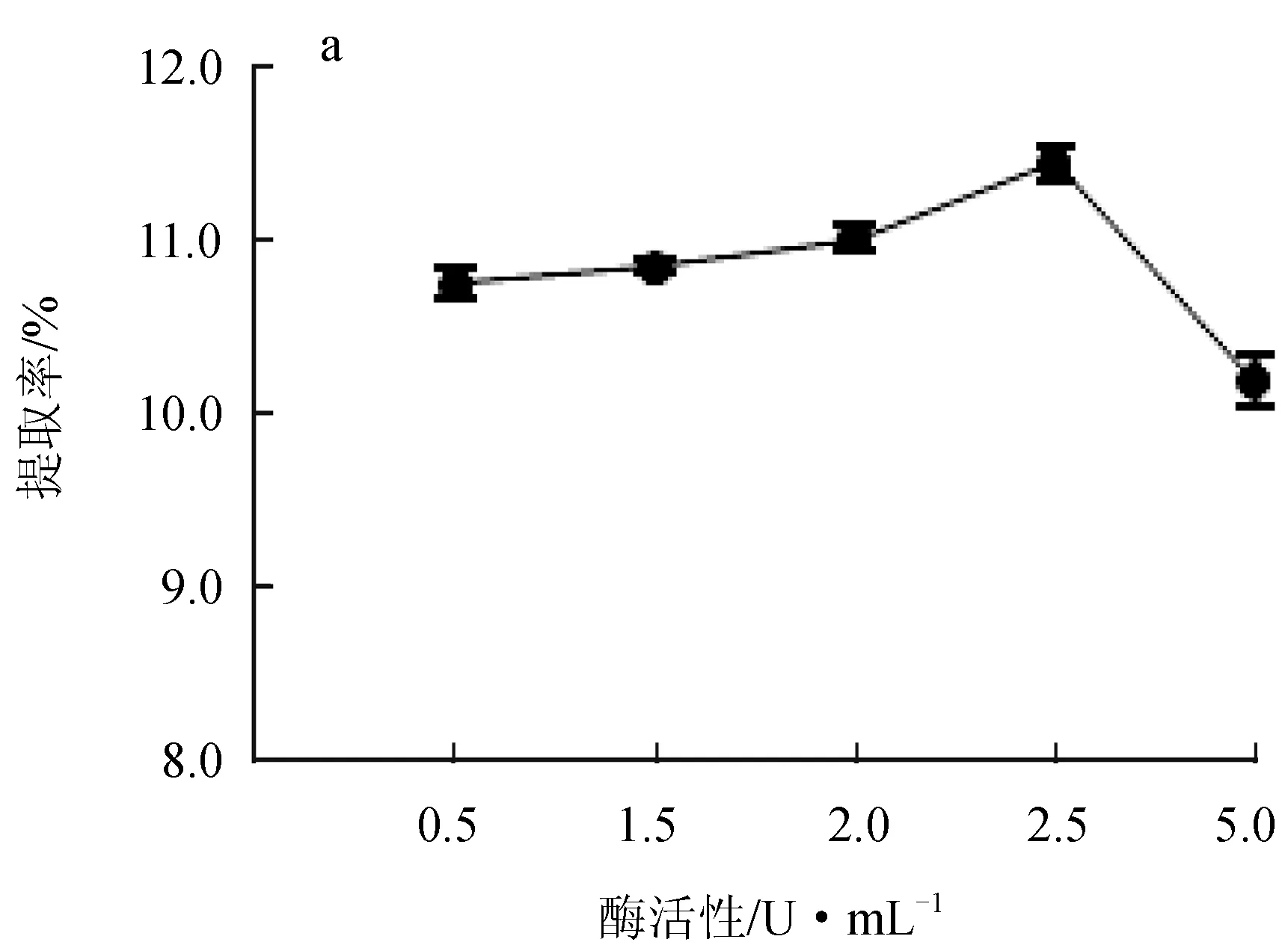
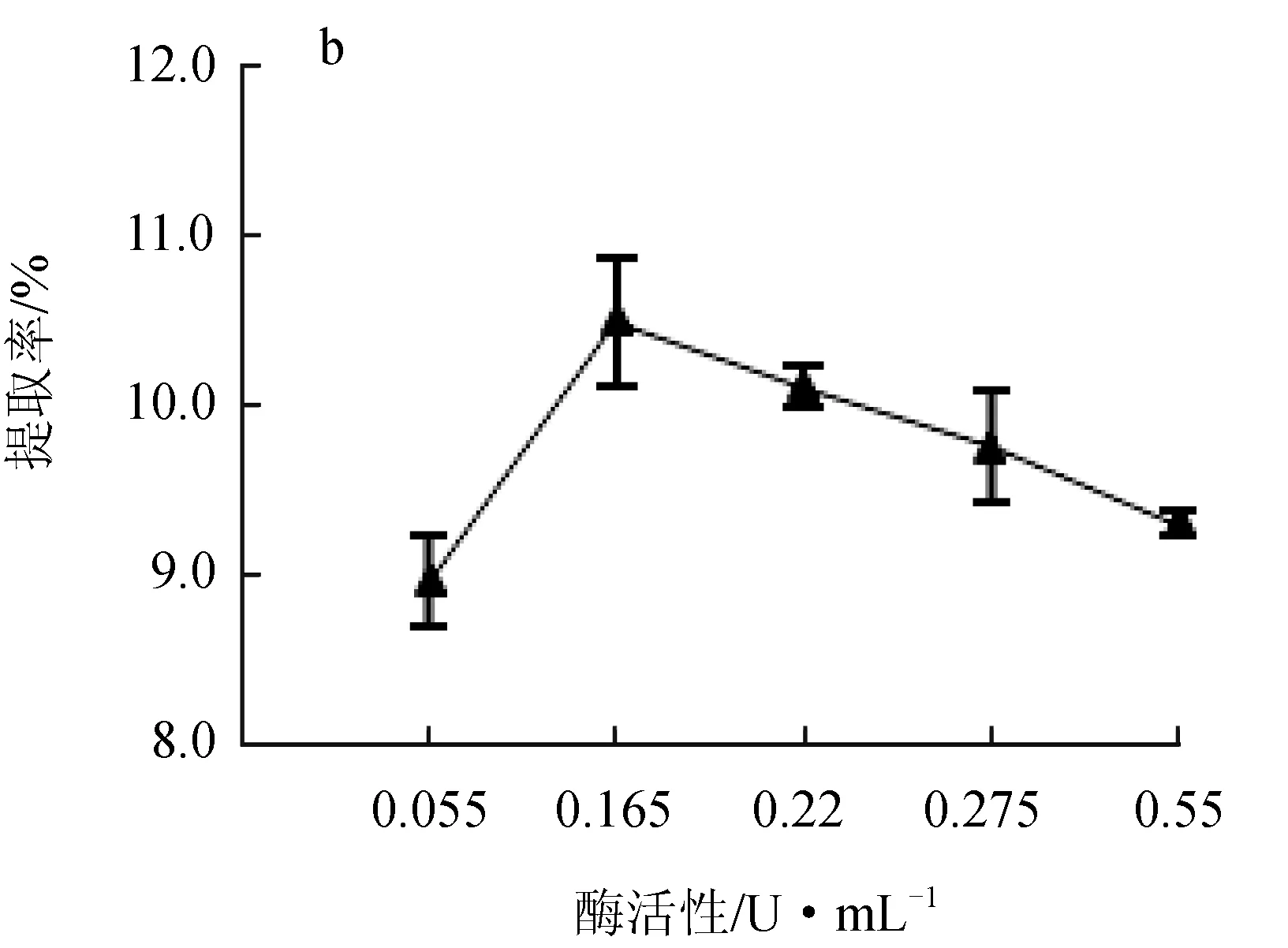
圖2 纖維素酶活性(a)和果膠酶活性(b)對紅毛藻多糖提取率的影響
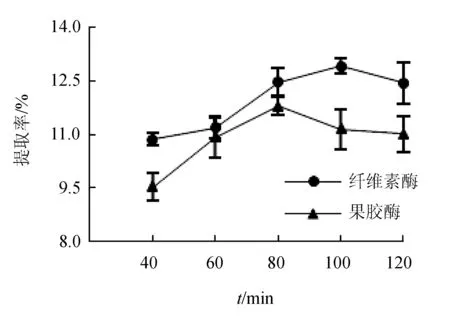
圖3 酶解時間對紅毛藻多糖提取率的影響
2.1.4 酶解溫度的影響
酶解溫度對紅毛藻多糖提取率的影響見圖4。結果表明,隨著酶解溫度的升高,提取率逐漸上升后突然下降,這是由于纖維素酶和果膠酶都存在一個最適溫度即酶活性最高時的溫度,在此溫度下酶的催化效率最高,當溫度較高時酶的穩定性降低,導致了酶活性下降,作用效率下降[16]。纖維素酶的適宜溫度為45~65 ℃,果膠酶的適宜溫度為20~70 ℃,以50 ℃效果最好,這與文獻[18]利用果膠酶酶解果汁得到的優化結果一致。
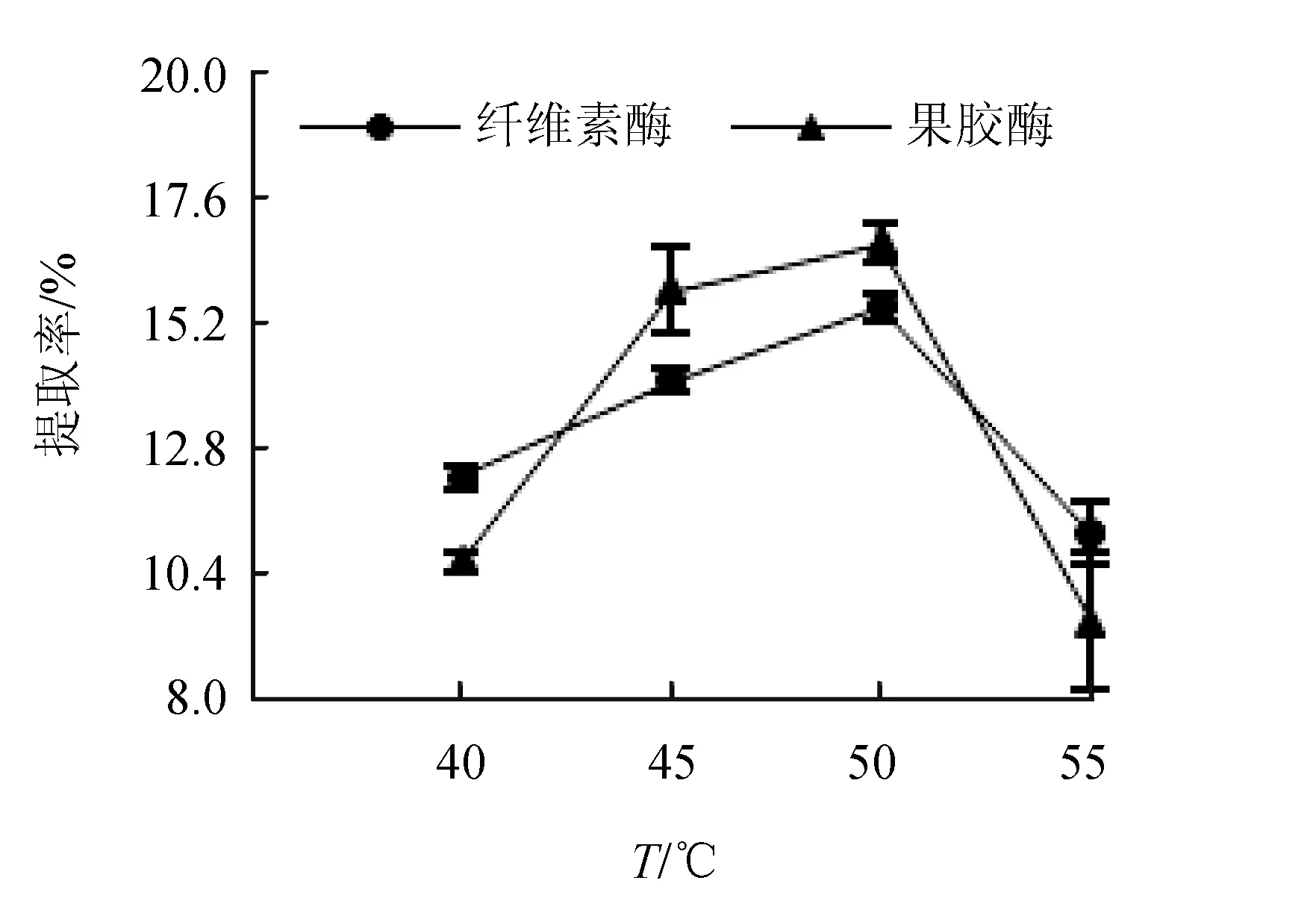
圖4 酶解溫度對紅毛藻多糖提取率的影響
2.2 響應面試驗結果
2.2.1 中心組合試驗結果
考慮pH對紅毛藻多糖水解的影響,故通過單因素試驗選取pH=6.0作為固定因素,根據Box-Benhnken中心組合試驗設計原理[19-21],選取的主要因素有酶解溫度、酶解時間和酶活性,設計三因素三水平響應面分析試驗,試驗點共17個,其中分析因子12個,以及用于估計誤差的零點5個[22]。以紅毛藻多糖提取率作為響應值,進行酶輔助提取紅毛藻多糖的工藝條件優化,試驗方案及紅毛藻多糖提取率見表3、4。
2.2.2 模型方差分析結果
根據表1、2的因素水平選取,參考表3、4結果,利用Design-Expert 8.0.5軟件分析,結果見表5、6。由表5、6可見,兩種酶試驗所選模型均極顯著(P<0.01),且果膠酶模型的純誤差不顯著,纖維素酶模型的純誤差顯著(失擬項P纖維素酶=0.0403,失擬項P果膠酶= 0.9262),纖維素酶模型擬合結果不理想。纖維素酶試驗中一次項中酶解時間(B)對紅毛藻多糖提取率影響最大;二次項中3個因素對紅毛藻多糖提取率影響皆極顯著(P<0.01);交互項中兩兩無顯著影響,擬合效果不理想。果膠酶試驗一次項中酶解溫度(A)對紅毛藻多糖提取率影響較大,達顯著水平(P<0.05);二次項中酶解溫度(A)、酶解時間(B)和酶活性(C)對紅毛藻多糖提取率影響均極顯著(P<0.01);交互項AC之間具有顯著影響(P<0.05)。由此可知,響應值受各因素的影響并非線性關系,其影響程度為酶解溫度>酶解時間>酶活性。采用Design-Expert 8.0.5軟件對表5、6的數據進行分析,得如下回歸方程:
Y纖維素酶=16.97+0.076A-0.55B+0.21C-0.51AB+0.38AC-0.11BC-4.65A2-4.84B2-3.68C2
Y果膠酶=16.72+0.37A-0.08B-0.067C+0.088AB-0.50AC+0.022BC-4.99A2-3.65B2-4.55C2
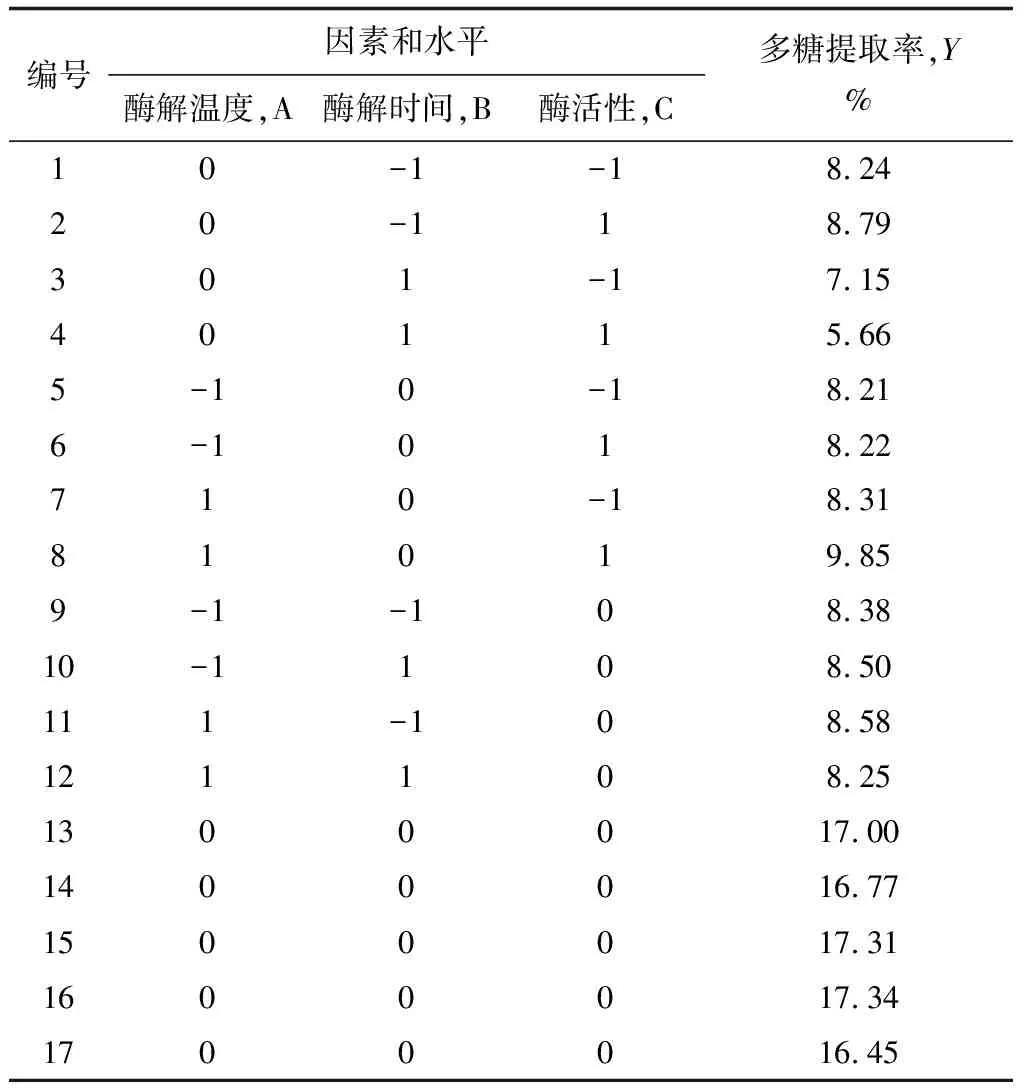
表3 纖維素酶Box-Behnken試驗設計及結果
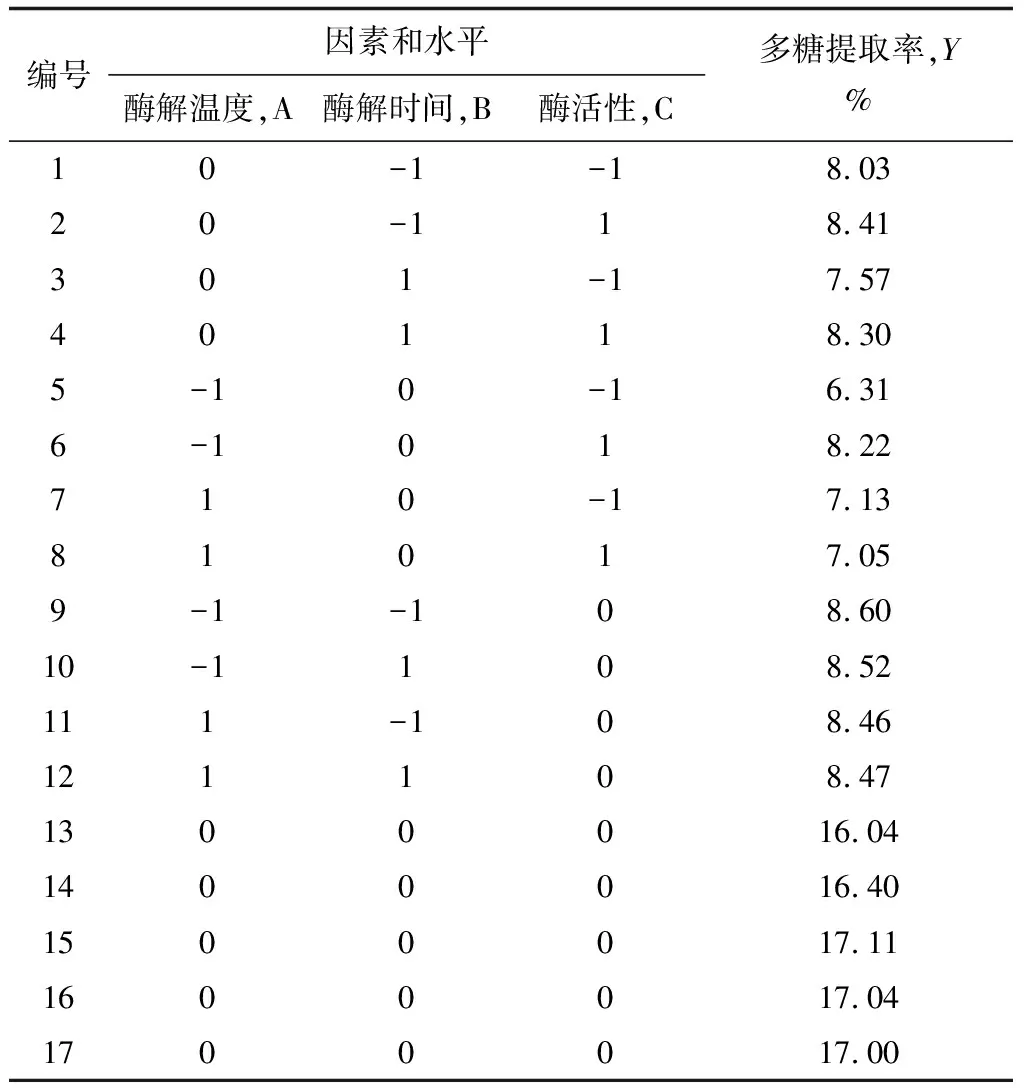
表4 果膠酶Box-Behnken試驗設計及結果
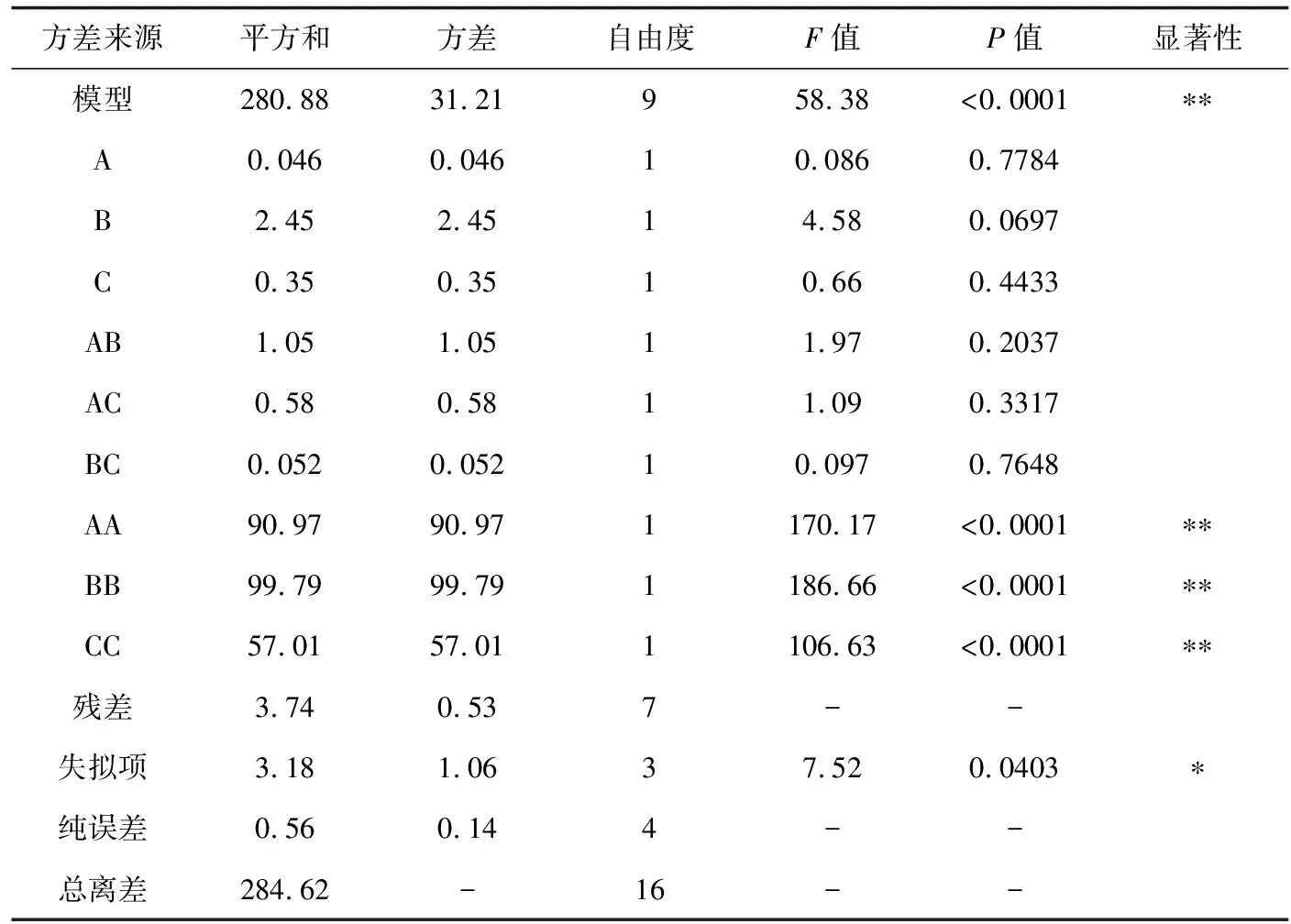
表5 纖維素酶回歸模型方差分析
注:*顯著影響(P<0.05);**極顯著影響(P<0.01).下同.
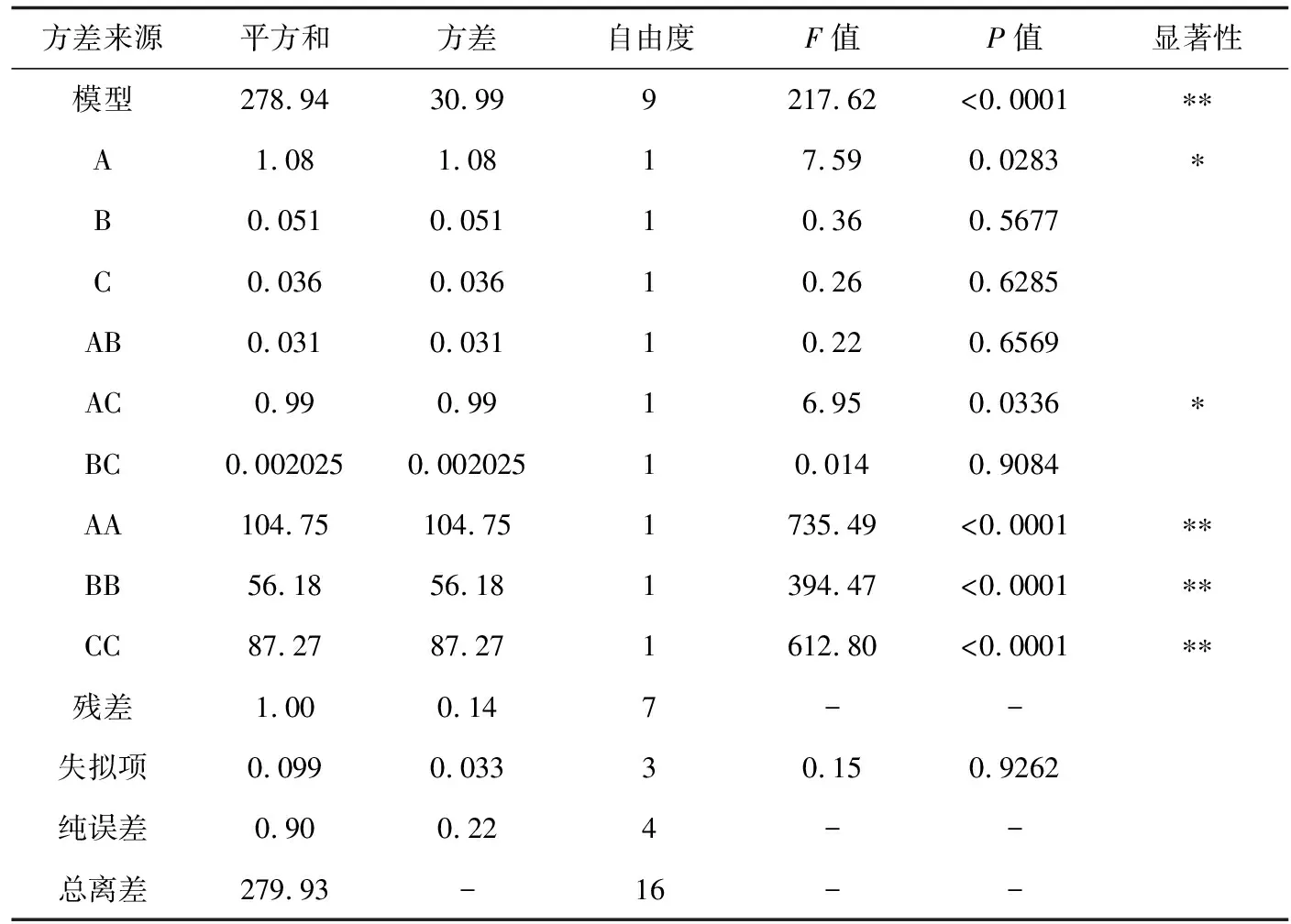
表6 果膠酶回歸模型方差分析
2.2.3 響應面法優化結果
響應曲面三維圖可以直觀地反映各因素對響應值的影響程度和因素間的交互作用強弱。等高線的形狀反映出交互作用影響效應的強弱與大小[24]。
纖維素酶輔助提取多糖的響應面優化結果見圖5,其優化效果不明顯,三因素之間的兩兩交互作用弱,故纖維素酶對紅毛藻多糖提取的作用效果較差,以上結果與表5回歸方程方差分析結果一致。
由圖6等高線可見,當固定其中一個因素,提取率都會隨另一因素的增大而增大,但增大到一個峰值后又開始緩慢下降[25]。固定酶活性為0.22 U/mL時,酶解溫度(A)和酶解時間的(B)交互作用對紅毛藻多糖提取率的影響與上文描述一致。響應面發生了彎曲,表明果膠酶活性(C)與酶解時間(B)對紅毛藻多糖的影響不是簡單的線性關系。比較圖6a、c,發現酶解溫度(A)與酶活性(C)的交互作用對多糖提取率的影響顯著。由3D等高線圖(圖6d)可見,酶解時間(B)對紅毛藻多糖提取率的影響大于酶活性(C)的影響,兩個因素的交互作用不顯著。以上結果與表5回歸方程方差分析結果一致。
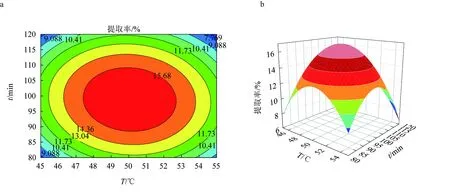
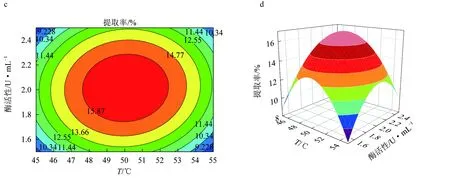

圖5 纖維素酶輔助提取紅毛藻多糖的響應面優化結果a.纖維素酶酶解溫度和時間對提取率影響的響應曲面圖; b.纖維素酶酶解溫度和時間對提取率影響的等高線圖; c.纖維素酶酶解溫度和酶活性對提取率影響的響應曲面圖; d.纖維素酶酶解溫度和酶活性對提取率影響的等高線圖; e.纖維素酶酶解時間和酶活性對提取率影響的響應曲面圖; f.纖維素酶酶解時間和酶活性對提取率影響的等高線圖.
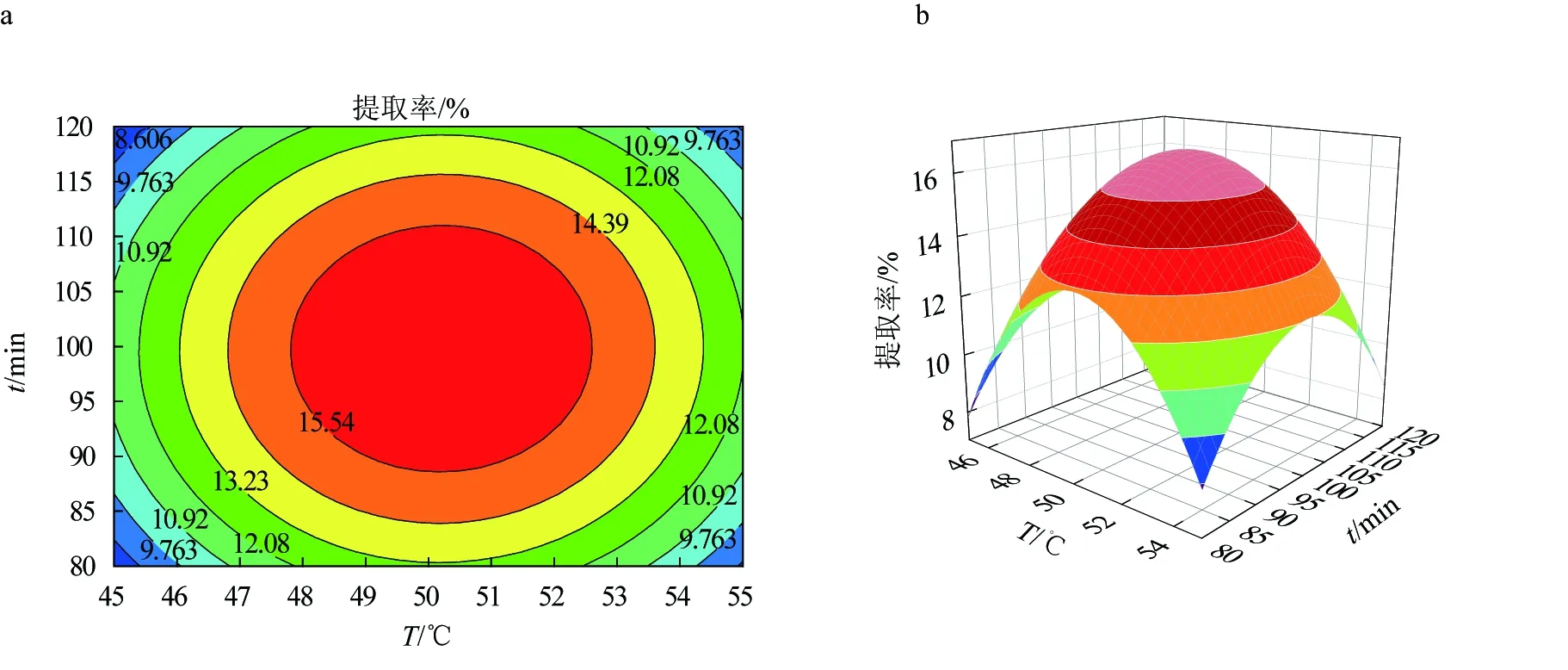
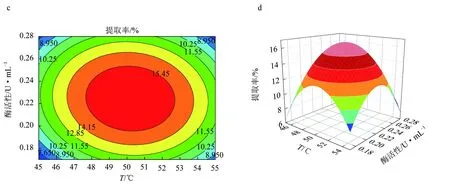
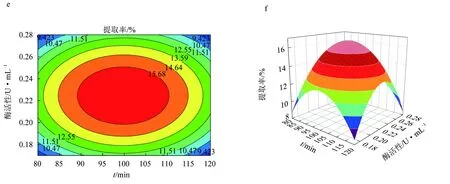
圖6 果膠酶輔助提取紅毛藻多糖的響應面優化結果a.果膠酶酶解溫度和時間對提取率影響的響應曲面圖; b.果膠酶酶解溫度和時間對提取率影響的等高線圖; c.果膠酶酶解溫度和酶活性對提取率影響的響應曲面圖; d.果膠酶酶解溫度和酶活性對提取率影響的等高線圖; e.果膠酶酶解時間和酶活性對提取率影響的響應曲面圖; f.果膠酶酶解時間和酶活性對提取率影響的等高線圖.
2.2.4 模型驗證試驗
用Design-Expert 8.0.5軟件分析得出的最佳工藝為:選用果膠酶,酶活性0.22 U/mL、酶解時間99.78 min、酶解溫度50.19 ℃。該條件下紅毛藻多糖的最高提取率為16.72%。根據實際操作調整酶解時間為100 min,酶解溫度為50 ℃,酶活性為0.22 U/mL,與中心組合試驗的零點試驗條件一致,得紅毛藻多糖提取率為(16.60±0.13)%,與預測值的相對誤差較小,表明回歸模型與試驗結果擬合程度高,回歸方程能真實地反映酶解時間、酶解溫度、酶活性對提取率的影響,該模型有可行性。
2.2.5 紅毛藻多糖毒性及抗氧化活性
以未照射紫外線并且未添加紅毛藻多糖的細胞活力為100%,在測試多糖質量濃度為1~100 μg/mL時,隨著多糖質量濃度的升高,細胞活力無顯著變化,表明多糖質量濃度為1~100 μg/mL時,對人皮膚成纖維細胞無顯著毒性作用,當多糖質量濃度達到200 μg/mL時,對人皮膚成纖維細胞活力產生抑制作用(圖7a)。參考文獻[26]試驗方法,16.20 J/cm2輻射20 min后人皮膚成纖維細胞活力為56.26%,接近50%。隨著多糖質量濃度的升高,細胞活力逐漸上升,當多糖質量濃度為10~20 μg/mL時,細胞活力可恢復至96.53%~98.49%,表明紅毛藻多糖具有抵抗人皮膚細胞光氧化紫外線損傷的能力,且多糖質量濃度為10~20 μg/mL時效果最佳(圖7b)。
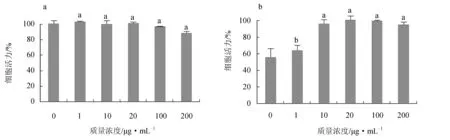
圖7 不同質量濃度的紅毛藻多糖對細胞毒性的影響(a)和對細胞抗光氧化活力的影響(b)不同字母表示差異顯著(P<0.05).
3 討 論
3.1 紅毛藻多糖的提取工藝研究
近年來,隨著海藻多糖優良的理化性質(如凝膠、乳化、保濕)和有益生物活性的逐漸發掘,海藻多糖被廣泛應用于食品、生物醫藥和化妝品等領域,因此對多糖的高效提取工藝的研究與開發越來越受到關注。海藻多糖的提取通常采用機械粉碎藻體,對得到的藻粉中的多糖類物質進行熱水抽提,繼而通過利用多糖在有機溶劑中的溶解度小的原理,向抽提液中加入乙醇或季胺鹽類等使多糖沉淀析出[7]。為提高多糖提取率,Rodriguez-Jasso等[27]利用微波提取法自褐藻中提取硫酸酯化多糖,與原始方法相比提取率提高了31.01%。孫惠潔[7]利用超聲波輔助提取法提取紅毛藻多糖的提取率為9.69%,比用熱水提取紅毛藻多糖的提取率高38.39%。周峙苗[28]利用纖維素酶輔助提取羊棲菜(Sargassumfusiforme)多糖,是熱水浸提工藝的粗多糖得率的2.2倍,使其提取效率顯著提高。纖維素和果膠是海藻細胞壁的主要成分,也是海藻細胞間質和胞內大分子物質溶出的主要屏障。因此,本研究分別利用纖維素酶和果膠酶輔助提取紅毛藻多糖,經正交法考察各工藝參數以及響應面法優化紅毛藻多糖的酶解工藝,由于纖維素酶提取效果不理想,選出果膠酶進行輔助提取,模擬得到最佳提取工藝為pH 6.0、酶活性0.22 U/mL、酶解時間100 min、酶解溫度50 ℃,試驗結果與熱水浸提法相比提升了64.04%,與孫惠潔[7]利用物理方法輔助提取紅毛藻多糖的提取率相比提升了41.62%。
3.2 紅毛藻多糖的抗氧化生物活性
由于海藻多糖能夠有效地抑制和清除自由基,海藻多糖的抗氧化活性被廣泛研究。劉洪麗等[29]通過觀察馬尾藻(Sargassum)多糖對小鼠細胞內抗氧化能力的影響,得到馬尾藻多糖能夠有效清除羥自由基并且隨著多糖質量濃度的增加,對抗過氧化氫溶血的能力有所提高。劉亮等[30]選取紫菜(Porphyra)多糖進行抗氧化作用研究,發現紫菜多糖能有效清除DPPH·和·OH,并且抑制小鼠肝組織的脂質過氧化,保護由于Fe2+和H2O2引起的肝組織損傷。紅毛藻多糖具有潛在的降血壓和抗氧化等作用。孫惠潔[7]利用DPPH法對紅毛藻多糖的體外抗氧化進行初步的研究,發現經DEAE Cellulose-52得到3種紅毛藻多糖片段均具有清除DPPH自由基的活性,隨著多糖質量濃度的升高,對DPPH自由基的清除能力顯著增強。本試驗在紅毛藻多糖體外抗氧化試驗基礎之上對其進行細胞抗氧化損傷研究,以紫外誘導人皮膚成纖維細胞的光氧化為模型,探究其紅毛藻多糖對細胞作用效果。試驗結果表明,10~20 μg/mL的紅毛藻多糖能夠使受到UVA損傷的人皮膚成纖維細胞活力恢復至初始狀態的96.53%~98.49%,具有極強的防止紫外線氧化損傷效果,因此為紅毛藻多糖在護膚品和抗紫外損傷的生物醫學敷料中的開發和應用提供科學依據。
綜上,本試驗優化了紅毛藻多糖的提取工藝,并初步揭示了其具有抵抗人皮膚細胞光氧化紫外損傷的活性,研究結果為進一步研究紅毛藻多糖抗紫外光氧化損傷奠定研究基礎,同時也為紅毛藻多糖的工業化生產提供理論依據。
4 結 論
研究了酶輔助提取紅毛藻多糖的最優條件,通過單因素試驗、響應面法優化了紅毛藻多糖提工藝,得到如下結論:
(1)酶輔助提取紅毛藻多糖的優化工藝條件為:選用果膠酶,pH 6、酶活性0.22 U/mL、酶解時間100 min、酶解溫度50 ℃。
(2)此優化條件下得到紅毛藻多糖提取率為(16.60±0.13)%,與預測值(16.72%)的相對誤差在允許范圍內(0.12%),表明該模型擬合效果合理可靠。
(3) 紅毛藻多糖在1~100 μg/mL時對人皮膚成纖維細胞無顯著毒性作用,紅毛藻多糖具有抵抗人皮膚成纖維細胞光氧化能力,當多糖質量濃度為10~20 μg/mL時細胞活力可恢復至96.53%~98.49%。

