水稻株型相關性狀QTL定位研究
張習春 張應洲 圣忠華 龍武華 吳健強 朱速松 魏祥進


摘要:以粳稻日本晴(NIP)和秈型超級稻中嘉早17(YK17)構建的重組自交系(recombinant inbred line,簡稱RIL)群體為研究材料,于2015—2016年分3季種植于杭州和海南,成熟期考察株型相關性狀(分蘗數、株高、劍葉長、劍葉寬、劍葉長寬比、穗長)。并應用這2種群體已構建的分子連鎖圖譜,對株型相關性狀進行QTL分析,共檢測到34個相關QTL,分布于除第9染色體外的其他染色體上,LOD值介于2.68~14.39之間,表型貢獻率變幅為4.00%~26.62%,3個環境下重復檢測到10個QTL。對QTL與環境互作分析發現,24個QTL與環境互作,其中2個QTL對環境敏感。株型相關性狀QTL主要分布在第1、2、4、7染色體上,呈簇分布。qPH1、qLFL1和qLFLW1a在3個環境下重復檢測到,且貢獻率較高,有待于進行克隆和功能分析。
關鍵詞:水稻;重組自交系(RIL);株型性狀;QTL分析
中圖分類號: S511.03文獻標志碼: A
文章編號:1002-1302(2019)18-0102-06
收稿日期:2018-05-28
基金項目:“十二五”農村領域國家科技計劃課題(編號:2014AA10A604-11);貴州省科學技術基金(編號:黔科合J字[2015]2098號);貴州省科研機構服務企業行動計劃(編號:黔科合服企[2014]4005號);貴州省現代農業產業體系項目(編號:GZCYTX2018-06);貴州省科技重大專項(編號:黔科合重大專項字[2013]6023號);貴州省科技合作計劃(編號:黔科合LH字[2015]7074號);黔農科院青年基金(編號:黔農科院青年基金[2018]號)。
作者簡介:張習春(1991—),男,貴州織金人,碩士,研究實習員,主要從事水稻遺傳育種研究。E-mail:18358168852@163.com。
通信作者:魏祥進,博士,副研究員,主要從事水稻分子遺傳學研究。E-mail:weixiangjin@caas.cn。
水稻(Oryza sativa L.)是世界上主要的糧食作物,分別約占我國糧食播種面積與總產量的27%和35%,我國約有60%人口以稻米為主糧,因此,其在保障糧食安全中扮演著重要角色[1]。株型改良是提高產量的有效途徑;被譽為第一次“綠色革命”的矮化育種降低了水稻株高,實現了單位面積產量和總產量的大幅提升。近年來,育種家倡導理想株型的超級稻品種選育理念,力求實現水稻產量的新突破,因此開展株型相關性狀的遺傳研究對理想株型的超級稻品種選育具有重要的理論意義和實際參考價值。
已有研究表明,株型相關性狀屬于復雜的數量性狀,其遺傳表達容易受到環境條件的影響。不同群體甚至同一群體控制株型相關性狀在不同年份和環境條件下的QTL數量、位置、加性效應值和貢獻率可能出現明顯的差異[2-3]。張玲等選用瀘灰99和沈農265的RIL群體,株高、穗長、劍葉長、劍葉寬在2個環境下分別檢測到4、2、2、5個QTL[4];林澤川利用BG1和XJL的RIL群體,分別檢測到株高、穗長、劍葉長、劍葉寬性狀的QTL分別是2、5、5、8個,兩者報道的數量和位置都存在較大差異[5]。結合其他研究[6]發現:同一性狀在不同遺傳群體和環境條件下檢測到的QTL可能存在明顯差異,部分QTL重復檢測性極低,主效QTL具有較高可重復性,因此有必要使用不同遺傳群體開展相關研究,尋找能在不同群體中重復出現的QTL位點,為理想株型選育提供理論依據。
QTL定位是克隆基因的重要方法,目前已克隆到幾個調控株型性狀的重要基因,如IPA1(OsPL14)是1個克隆自少蘗粳稻的半顯性QTL,該基因調控水稻分蘗發生,同時影響水稻株高和穗長[7]。Huang等從沈農265中分離的DEP1是1個控制水稻產量性狀的主效QTL,它能調控水稻穗長、穗彎曲度、著粒密度[8]。這些已克隆的基因初步闡明部分株型性狀的遺傳機制,為水稻株型改良種提供理論依據和基因聚合材料,進一步挖掘相關基因能為育種工作提供更加豐富和準確的選擇。
目前已克隆控制株型相關性狀的基因較少,不足以揭示水稻株型復雜的遺傳機制以及滿足高產育種應用需求。本研究利用日本晴和中嘉早17構建的重組自交系群體,發掘在不同環境下能穩定表達的株高、分蘗和穗長等相關性狀的QTL,為揭示水稻株型復雜的遺傳機制和理想株型高產育種應用提供理論依據。
1?材料與方法
1.1?RIL群體構建
以日本晴(Nipponbare,NIP)為母本、中嘉早17(Zhongjiazao17,YK17)為父本,雜交產生F1代,使用單粒連續自交,構建性狀覆蓋度廣且遺傳相對穩定的200個株系重組自交系群體(recombinant inbred lines,簡稱RILs)。
1.2?材料種植及性狀考察
2地3季種植群體親本和200個RIL株系:2015年夏季種植于杭州富陽(E1表示),2015年冬季種植于海南陵水(E2表示),2016年夏季種植于杭州富陽(E3表示)。親本和群體每個株系種植8行×8列,田間管理同常規大田管理。成熟時,于每個區塊中部選取5株進行考種,具體參考Moncada等提出的方法[9]分別對分蘗數(tiller number per plant,簡稱TN)、株高(plant height,簡稱PH)、劍葉長(flag leaf length,簡稱LFL)、劍葉寬(flag leaf width,簡稱LFW)、劍葉長寬比(flag leaf length width rate,簡稱FLWR)、穗長(panicle length,簡稱PL)6個農藝性狀進行考察,取5株的平均值。
1.3?遺傳連鎖圖譜
利用629對SSR引物篩選NIP和YK17 2個親本間的多態,挑選出163個均勻分布在水稻12條染色體的多態性標記,檢測群體基因型,獲得163個標記的基因型數據。應用MAPMARKER/EXP V3.0進行連鎖分析,以LOD≥3.0進行標記分組,利用Kosambi函數將重組率轉為圖距,利用MapDraw 2.1繪制染色體,構建連鎖圖譜。連鎖圖譜總圖距約為1 479.40 cM,覆蓋水稻基因組的93.85%,標記間平均圖距為9.08 cM。
1.4?QTL定位分析
利用Windows QTL Cartographer 2.5軟件復合區間作圖法(CIM),每1 cM步長進行全基因組掃描,檢測目標性狀QTL。以Permutation 1 000次模擬運算確定LOD閾值,即當實際檢測到某個區段LOD值大于LOD閾值時,則認為該區段存在1個QTL,同時軟件運算給出對應該QTL的加性效應值和表型貢獻率[10]。檢測到的QTL遵循McCouch等QTL命名原則命名[11]。利用QTL Network 2.0軟件,基于混合模型的復合區間作圖法(MCIM),分析QTL與環境互作效應[12]。
2?結果與分析
2.1?RIL群體農藝性狀表型分析
由表1、圖1可知,RIL群體中不同株系在株型相關性狀中具有親本多種重組類型,考察的6個性狀呈連續性分布,表現為雙向超親分離,表明這些性狀由多個數量性狀基因座位控制;3個環境下峰度和偏度絕對值除了劍葉長寬比峰值在E1中大于1,其余均小于1,遵循正態分布,符合QTL分析的作圖要求。
2.2?RILs群體各性狀間的相關性
由表2可知,在3個環境下分蘗數與株高、劍葉長、劍葉寬、穗長呈極顯著負相關;株高、劍葉長、劍葉寬和穗長4個性狀間呈顯著或極顯著正相關;劍葉長寬比與劍葉寬呈負相關,與株高、劍葉長、穗長呈極顯著正相關。說明株型各性狀之間密切相關,同時在不同環境下相關系數存在一定差異,表明遺傳因素是調控株型形成的主要因素,環境條件對株型形成具有一定的影響。
2.3?株型性狀QTL分析結果
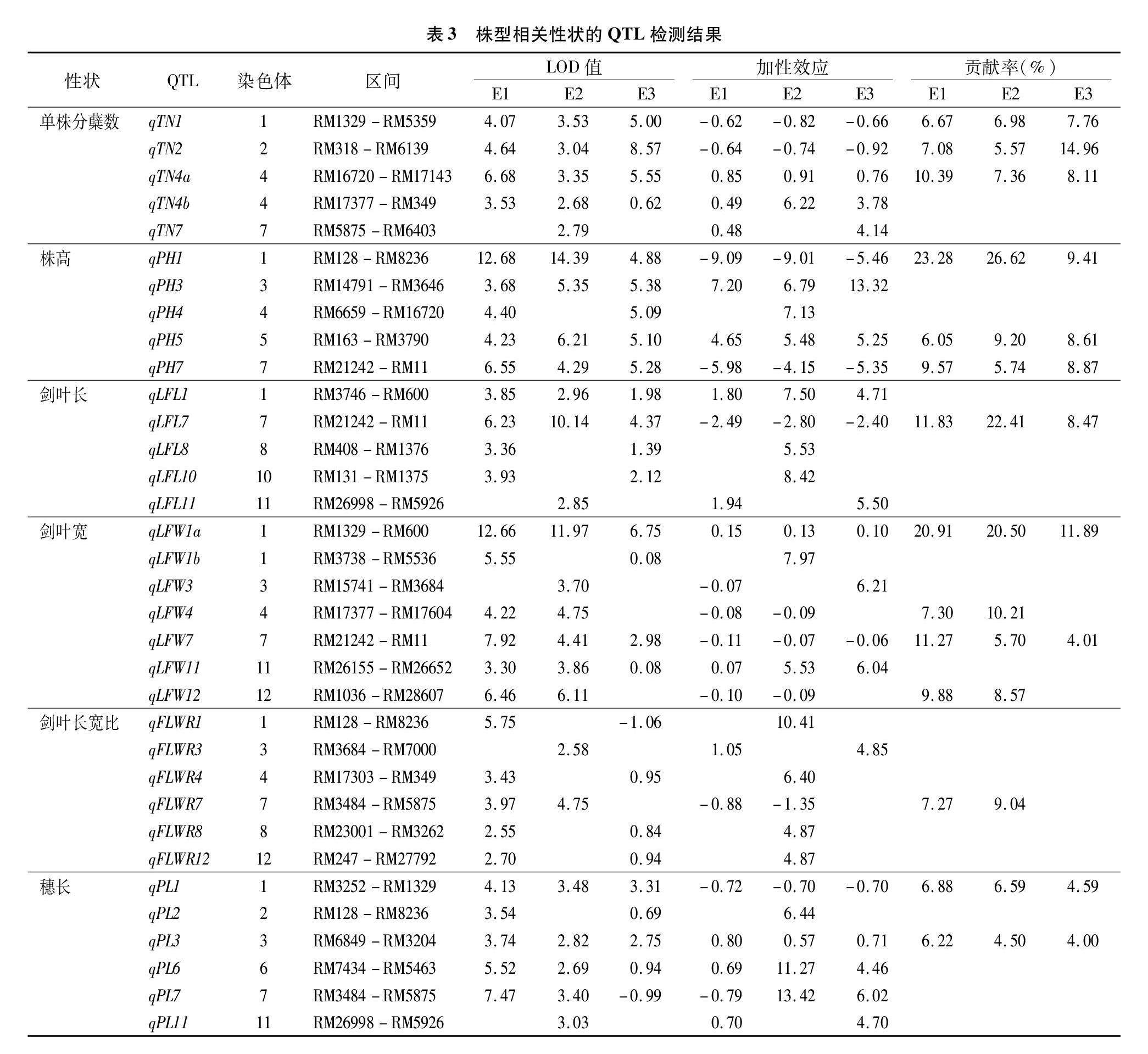
對不同環境下的6個株型相關農藝性狀表型值進行全基因組關聯分析,共檢測到34個QTL,分布于除第9染色體外的11條染色體上,LOD值介于2.55~14.39之間,表型貢獻率變幅為3.78%~26.62%。E1、E2、E3的環境下分別檢測到23、18、24個QTL,3個環境重復檢測到11個QTL(表3)。具體如下:
分蘗數(TN):3個環境下共檢測到5個控制分蘗數QTL,分布在第1、2、4、7染色體上,LOD值介于2.68~8.57之間,貢獻率變幅為3.78%~14.96%。其中,qTN1、qTN2和qTN4a在3個環境下重復檢測到,平均貢獻率為7.14%、920%、862%。qTN1和qTN2加性效應為負值,增效等位基因來自NIP,qTN4a加性效應為正值,增效等位基因來自YK17。
株高(PH):3個環境下共檢測到5個控制株高QTL,分布于第1、3、4、5、7染色體上,LOD值介于3.68~14.39之間,貢獻率變幅為5.74%~26.62%。其中,qPH1、qPH5、qPH7在3個環境下重復檢測到,平均貢獻率分別為19.80%、7.95%、8.06%,qPH1和qPH7加性效應為負值,增效等位基因來自NIP,qPH5加性效應為正值,增效等位基因來自YK17。
劍葉長(LFL):3個環境下共檢測到5個劍葉長QTL,位于第1、7、8、10、11染色體上,LOD值介于2.85~10.14之間,貢獻率變幅為4.71%~22.41%。其中qLFL7在3個環境下
重復檢測到,平均貢獻率14.24%,加性效應為負值,增效等位基因來自NIP,其余4個QTL加性效應為正值,增效等位基因來自于YK17。
劍葉寬(LFW):3個環境下共檢測到7個劍葉寬QTL,分布于第1、3、4、7、11、12染色體上,LOD值介于3.30~12.66之間,貢獻率變幅為4.01%~20.91%。其中qLFW1a和qLFW7在3個環境下重復檢測到,平均貢獻率分別為17.77%和699%;qLFW1a的加性效應為正值,增效等位基因來自中YK17,qLFW7的加性效應為負值,增效等位基因來自NIP。
劍葉長寬比(FLWR):3個環境下共檢測到6個劍葉長寬比QTL,分布于第1、3、4、7、8、12染色體,LOD值介于2.55~5.75,貢獻率變幅為4.85%~10.41%,未檢測到在3個環境下重復出現的QTL。
穗長(PL):3個環境下共檢測到6個穗長QTL,分布于第1、2、3、6、7、11染色體上,LOD值介于2.69~7.47之間,貢獻率變幅為4.00%~13.42%。qPL1和qPL3在3個環境下重復檢測到。qPL1加性效應為負值,增效等位基因來自NIP,qPL3加性效應為正值,增效等位基因來自YK17。
2.4?QTL與環境互作
應用QTL Network 2.0的MCIM分析方法聯合檢測株型相關性狀與環境互作效應,共檢測到24個QTL與環境互作(表4),占QTL總數的70.59%,其中控制株高性狀的qPH1在E3環境下互作效應達到顯著,控制穗長性狀的qPL6在E2和E3環境下互作效應達到顯著;其余QTL與環境互作均未達到顯著,表明環境對大部分QTL遺傳產生不同程度的影響,株高和穗長性狀更易受環境影響。
3?討論和結論
水稻株高、劍葉長、劍葉寬、穗部性狀等性狀遺傳機制較為復雜,易受環境條件的影響,QTL重復檢測率低。姚曉云等選用沈農265和麗江黑谷構建RIL群體對株高和穗長進行QTL檢測,3年3個環境下檢測的9個QTL中僅有3個可重復檢測到[13];張斌利用兩優培九和培矮64的RIL群體,在不同環境下檢測到20個株型相關的QTL中只有5個可重復[14]。本研究中,6個株型相關性狀在3個環境下共檢測到36個QTL,其中qTN1、qTN2、qTN4a、qPH1、qPH5、qPH7、qLFL7、qLFW1a、qLFW7、qPL1和qPL3在3個環境下能重復檢測,分別占單個環境QTL總數的39.13%、50.00%、37.50%,表明這些QTL具有穩定的重復性。此外,分析與環境的互作效應發現大部分株型相關性狀的QTL與環境互作,但只有qPH1和qPL6對環境敏感,說明3個環境下重復檢測到的QTL受環境影響有限,具有較好地遺傳穩定性,在不同環境下能穩定表達,可進一步進行基因克隆和功能分析。
本試驗檢測到株型性狀的部分QTL與已報道的結果位于相同或相近的區間。如位于第1染色體標記RM128-RM8236之間的qPH1,該區間內包含已克隆的矮稈基因sd1和d61,推測該QTL較高的表型貢獻率與該區間內sd1和d61功能有關[15-16];qPH5和qPH7的區間分別包含影響株高的EUI1和Ghd7[17-18]。qLFL7與李睿等報道的qLFL7-1 位于相同區間[19];qLFW1a區間包含影響葉寬的Osa-miR319b[20];qTN2區間包含調控有效穗數的MADS57[21];qPL3區間包含影響穗長OsPHR1[22]。部分重復檢測到的QTL區間內包含已克隆控制相關株型性狀的基因,這些基因可能對相應QTL位點較高的遺傳效應具有重要作用。qTN4a、qLFL1a和qPL1在3個環境下重復檢測到,具有較好的遺傳穩定性,區間尚未報道克隆相關基因,有必要進一步進行精細定位和基因功能分析。
QTL多效性是指多個性狀表型受到同一QTL的影響,這種情況在作物中是普遍存在的。圣忠華等在第10染色體標記RM1375-RM25664之間檢測到控制株高、劍葉長、劍葉寬、穗長和有效穗數的QTL[23];占小登等在第5染色體標記RM500-RM18之間檢測到控制株高和穗長的QTL[24]。本試驗使用日本晴和中嘉早17的RIL群體檢測到控制株型相關性狀的QTL主要分布在第1、3、4和7染色體上,多表現為成簇分布。在第1染色體標記RM1329-RM600之間同時檢測到控制劍葉長和劍葉寬且效應值較大的QTL;位于第7染色體標記RM21242-RM11之間同時檢測到控制株高、劍葉長、劍葉寬、劍葉長寬比、穗長的QTL。這些多效QTL位點對株型塑造具有整體協同作用,有待深入研究,為解釋株型遺傳機理和培育理想株型品種奠定理論基礎。
參考文獻:
[1]Zhang Q F. Strategies for developing green super rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16402-16409.
[2]彭茂民,楊國華,張菁晶,等. 不同遺傳背景下水稻劍葉形態性狀的QTL分析[J]. 中國水稻科學,2007,21(3):247-252.
[3]趙建國,蔣開鋒,楊?莉,等. 水稻產量相關性狀QTL定位[J]. 中國水稻科學,2013,27(4):344-352.
[4]張?玲,李曉楠,王?偉,等. 水稻株型相關性狀的QTL分析[J]. 作物學報,2014,40(12):2128-2135.
[5]林澤川. 水稻株型相關性狀的QTL定位[D]. 北京:中國農業科學院,2013.
[6]王?蘭,李?智,鄭杏梅,等. 普通野生稻矮化突變體的株高與分蘗基因的QTL定位及主效基因的遺傳分析[J]. 華北農學報,2014,29(5):5-9.
[7]Jiao Y,Wang Y,Xue D,et al. Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J]. Nature Genetics,2010,42(6):541-544.
[8]Huang X Z,Qian Q,Liu Z B,et al. Natural variation at the DEP1 locus enhances grain yield in rice[J]. Nature Genetics,2009,41(4):494-497.
[9]Moncada P,Martínez C P,Borrero J,et al. Quantitative trait loci for yield and yield components in an Oryza sativa × Oryza rufipogon BC2F2 population evaluated in an upland environment[J]. Theoretical and Applied Genetics,2001,102(1):41-52.
[10]Li J,Wang S C,Zeng Z B. Multiple-interval mapping for ordinal traits[J]. Genetics,2006,173(3):1649-1663.
[11]Blair M W,Panaud O,McCouch S R. Inter-simple sequence repeat (ISSR) amplification for analysis of microsatellite motif frequency and fingerprinting in rice (Oryza sativa L.)[J]. Theoretical and Applied Genetics,1999,98(5):780-792.
[12]Yang J,Hu C C,Hu H,et al. QTLNetwork:mapping and visualizing genetic architecture of complex traits in experimental populations[J]. Bioinformatics,2008,24(5):721-723.
[13]姚曉云,李?清,劉?進,等. 不同環境下水稻株高和穗長的QTL分析[J]. 中國農業科學,2015,48(3):407-414.
[14]張?斌. 不同環境下水稻劍葉形態與產量相關性狀的QTL分析[D]. 北京:中國農業科學院,2014.
[15]Sasaki A,Ashikari M,Ueguchi-Tanaka M,et al. Green revolution:a mutant gibberellin-synthesis gene in rice[J]. Nature,2002,416(6882):701-702.
[16]Yamamuro C,Ihara Y,Wu X,et al. Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint[J]. Plant Cell,2000,12(9):1591-1606.
[17]Zhang Y Y,Zhu Y Y,Peng Y,et al. Gibberellin homeostasis and plant height control by EUI and a role for gibberellin in root gravity responses in rice[J]. Cell Research,2008,18(3):412-421.
[18]Xue W,Xing Y,Weng X,et al. Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice[J]. Nature Genetics,2008,40(6):761-767.
[19]李?睿,趙姝麗,毛?艇,等. 水稻劍葉形態性狀QTL分析[J]. 作物雜志,2010(3):26-29.
[20]Wang S T,Sun X L,Hoshino Y,et al. MicroRNA319 positively regulates cold tolerance by targeting OsPCF6 and OsTCP21 in rice (Oryza sativa L.)[J]. PLoS One,2014,9(3):e91357.
[21]Guo S Y,Xu Y Y,Liu H H,et al. The interaction between OsMADS57 and OsTB1 modulates rice tillering via DWARF14[J]. Nature Communications,2013,4:1566.
[22]Guo M N,Ruan W Y,Li C Y,et al. Integrative comparison of the role of the PHOSPHATE RESPONSE1 subfamily in phosphate signaling and homeostasis in rice[J]. Plant Physiology,2015,168(4):1762-1776.
[23]圣忠華,朱子亮,馬?寧,等. 超級稻品種中嘉早17產量相關性狀QTL定位研究[J]. 中國水稻科學,2016,30(1):35-43.
[24]占小登,于?萍,林澤川,等. 利用大粒秈/小粒粳重組自交系定位水稻生育期及產量相關性狀QTL[J]. 中國水稻科學,2014,28(6):570-580.

