條斑紫菜多糖與薏米仁多糖復配物的制備及其降血脂功效研究
,周 圍,王筱瑜,陳冠男,張俊鵬,張 翔
(錦州醫科大學食品科學與工程學院,遼寧錦州 121001)
渤海條斑紫菜(Porphyrayezoensis)是渤海中呈紫紅色或略帶藍綠色,并生長于前海潮間帶巖石上互生藻類的統稱[1]。在中醫學中紫菜具有化痰軟堅,清熱利水,補腎養心的功效,而條斑紫菜富含蛋白質、碘、磷、鈣、多糖等以供食用或藥用,同時有研究表明紫菜多糖能夠明顯增強細胞免疫和體液免疫功能[2-3]、預防高膽固醇血癥形成[4]、抗腫瘤[5-6]、抗輻射[7]等作用。
目前隨著生活水平的提高,吃精米、精白面的人們越來越多,從營養學來講,人們越來越缺失粗糧中富含的維生素B族、胡蘿卜素、礦物質和纖維素,而這些物質都是有利于降低高血脂等指標的營養素。而粗糧含有豐富的不可溶性纖維素,有利于保障消化系統正常運轉。它與可溶性纖維協同工作,可降低血液中低密度膽固醇和甘油三酯的濃度;增加食物在胃里的停留時間,延遲飯后葡萄糖吸收的速度,降低高血壓、糖尿病、肥胖癥和心腦血管疾病的風險。
因此本文以渤海條斑紫菜為原料,為研發新型渤海紫菜降血脂功能性食品提供實驗依據。
首先響應面法優化條斑紫菜可溶性多糖的最佳工藝,同時在九種粗糧中篩選出最適復配的粗糧種類,以體外油脂吸附能力即吸油量為指標,篩選出條斑紫菜多糖和粗糧多糖的最佳復配比,最后對小鼠脂肪酶進行抑制率測定。
1 材料與方法
1.1 材料與儀器
干渤海條斑紫菜、爆玉米、薏仁米、糙米、蕎麥米、青稞、香糯米、大麥米、黃小米、香米、大豆油 購于2018年9月17日購于遼寧錦州大潤發超市;濃硫酸、蒽酮、葡萄糖(標準品)、95%乙醇、30%過氧化氫、硫酸亞鐵、水楊酸、氫氧化鈉等試劑 均為分析純;成年昆明小鼠 取自錦州醫科大學動物實驗中心,許可證號:SCXK(遼2014-0004)。
FS-100粉碎機 浙江屹立工貿有限公司;HH.600水浴鍋 上虞市道墟茂祥儀器設備廠;KQ3200B超聲波處理器 江蘇省昆山市超聲儀器有限公司;TDL-5A高速離心機 上海安亭飛鴿;752型紫外可見分光光度計 上海光譜儀器有限公司制造;FA2004N分析天平 上海精密科學儀器有限公司。
1.2 超聲波法提取條斑紫菜水溶性多糖
1.2.1 工藝流程 條斑紫菜→粉碎干粉→超聲波法提取水溶性多糖→離心→取上清液→加乙醇放置過夜→離心→取沉淀→烘干成粉
1.2.2 多糖提取過程 將干條斑紫菜用粉碎成粉過50目篩備用。取0.5 g的條斑紫菜粉,按照料液比1∶15 (g/mL)加入蒸餾水,放進超聲處理器(150 W)中[8-9],超聲溫度50 ℃,超聲時間40 min。冷卻至室溫后倒入50 mL離心管中,4000 r/min離心15 min,上清液即為條斑紫菜水溶性多糖溶液,備用待測。加入與蒸餾水等量的乙醇,放置過夜,4000 r/min離心15 min,取沉淀,烘干機烘干破碎成粉。
1.2.3 單因素實驗 以料液比、超聲溫度、超聲時間和超聲功率四個主要影響因素為研究因素,以條斑紫菜水溶性多糖得率為指標,優化四個主要因素的最佳條件。
1.2.3.1 提取溫度的影響 設置提取溫度分別為30、40、50、60、70 ℃,料液比為1∶15,超聲150 W處理40 min,考察提取溫度對多糖提取得率的影響。
1.2.3.2 提取時間的影響 設置提取時間分別為30、40、50、60、70 min,料液比為1∶15,提取溫度為50 ℃,超聲150 W處理,考察提取時間對多糖提取得率的影響。
1.2.3.3 料液比的影響 設置料液比分別為1∶10、1∶15、1∶20、1∶25、1∶30,提取溫度為50 ℃,超聲150 W處理40 min,考察提取料液比對多糖提取得率的影響。
1.2.3.4 超聲功率的影響 設置超聲功率分別為90、110、130、150、170 W。料液比為1∶15,提取溫度為50 ℃,超聲150 W處理40 min,考察提取功率對多糖提取得率的影響。
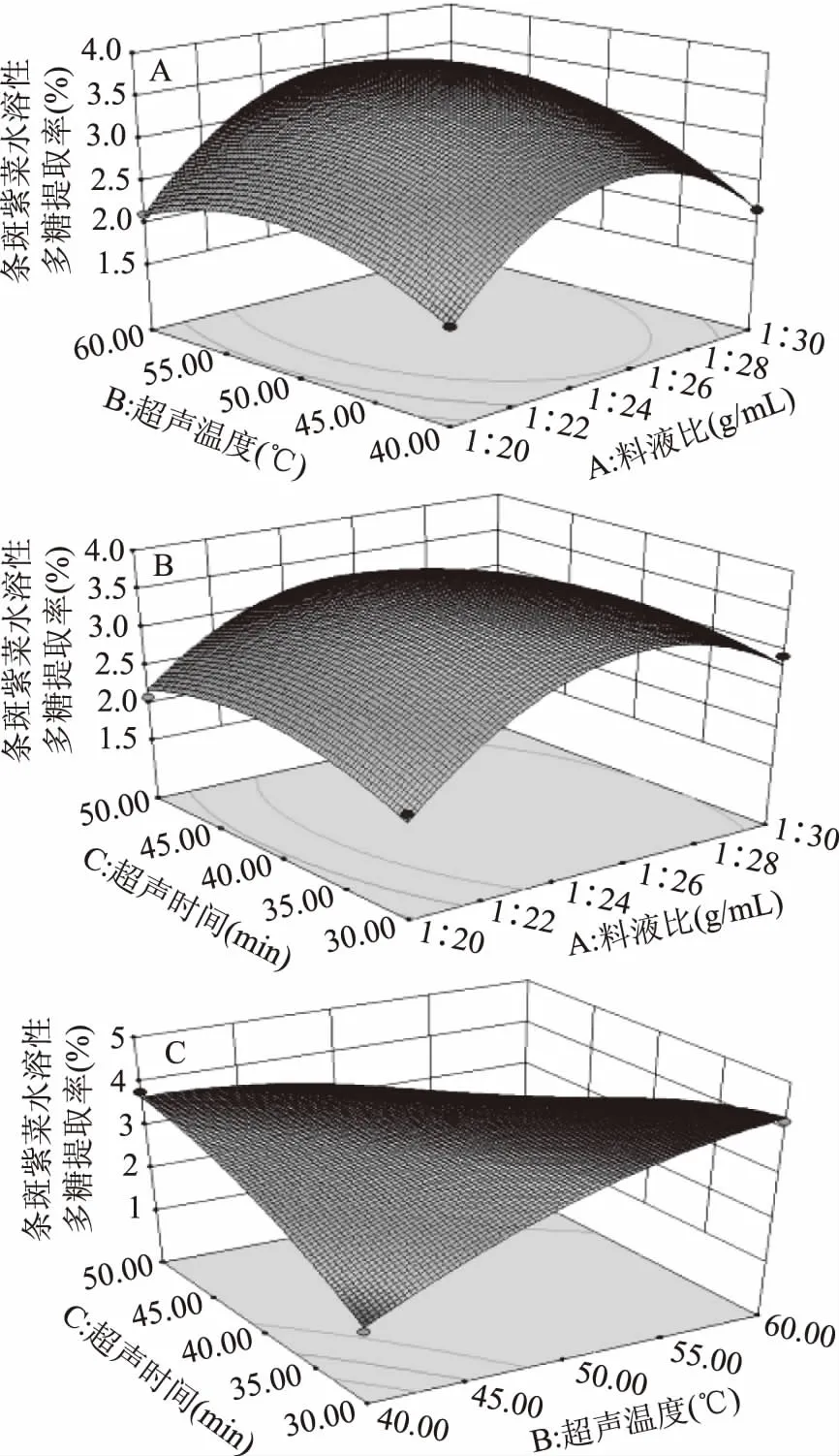
1.2.4 響應面法優化多糖超聲波提取工藝 在單因素實驗的基礎上,選取了對條斑紫菜多糖得率影響較大的3個因素——料液比(A,g/mL)、超聲溫度(B, ℃)、超聲時間(C,min)為自變量,條斑紫菜多糖得率為響應值,采用Box-Behnken中心組合試驗設計原理,通過三因素三水平的響應面分析方法,優化條斑紫菜多糖的提取工藝,具體因素水平設計見表1。
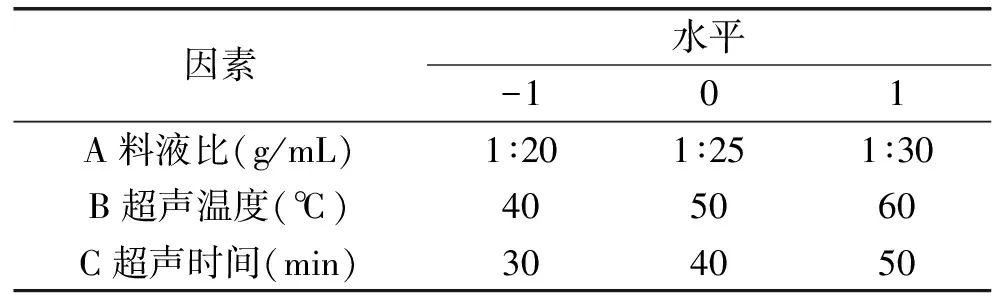
表1 響應面試驗因素水平表Table 1 Factors and levels of response surface experiment
1.3 粗糧多糖復配種類的確定
1.3.1 粗糧原料預處理 將爆玉米、薏仁米、糙米、蕎麥、青稞、香糯米、大麥米、黃小米、香米等原材料清水洗凈,干燥,各取20 g原料用100 ℃烘干成恒重,用研磨機磨碎成粉,用80目過篩,備用。
1.3.2 粗糧多糖的制備及初步篩選 改進程振玉等[10]提取粗糧多糖的方法:取各粗糧粉5 g(重量記為W1),按料液比(m/V,g/mL)1∶9比例加入蒸餾水,70 ℃ 150 W超聲提取60 min,4000 r/min離心10 min,取上清液,加入與蒸餾水等量的乙醇,放置過夜,4000 r/min離心10 min取沉淀,恒溫(60 ℃)干燥至恒重后,得粗糧多糖(重量記為W2),備用待測。以粗糧多糖得率(%)為評價標準,初步篩選粗糧復配種類。
1.3.3 粗糧多糖的二次篩選 本實驗獲得的條斑紫菜多糖(60 ℃恒溫干燥成粉)的溶解pH為≥8.0,而pH過高卻不利于復配物的廣泛應用,故本實驗將初步篩選獲得的粗糧多糖(爆玉米、薏仁米、糙米、蕎麥和青稞)分別加入到pH=7.0的25 ℃蒸餾水、pH=7.0的70 ℃熱蒸餾水、pH=8.0的25 ℃蒸餾水和pH=8.0的70 ℃熱蒸餾水,根據粗糧多糖溶解性對粗糧復配種類進行二次篩選。
1.3.4 粗糧多糖得最終篩選 復配物之所以能夠降脂,是由于復配物能夠與油脂結合,使胃腸內消化吸收脂肪量減少,從而達到降脂的目的,本實驗預制備具有降血脂作用的條斑紫菜多糖和粗糧粗多糖復配物,故本實驗以體外油脂吸附能力為評價指標篩選最終的粗糧復配種類。取0.1 g條斑紫菜多糖,以1∶1復配比,復配0.1 g二次篩選出的粗糧多糖(爆玉米或薏仁米),以吸油量(%)為指標篩選出最終的粗糧復配種類。
1.4 條斑紫菜多糖和薏仁米多糖復配物的制備
1.4.1 2×2析因法分析條斑紫菜多糖和薏仁米多糖交互作用關系 通過2×2析因法,以吸油量(%)為指標,分析條斑紫菜多糖(0.05 g和0.1 g兩個水平)和薏仁米多糖(0.05 g和0.1 g兩個水平)兩者之間的交互作用。
1.4.2 篩選最優多糖復配比 將條斑紫菜多糖和薏仁米多糖復配物的總重量設為0.2 g,設計不同多糖復配比(條斑紫菜多糖/薏仁米多糖:g/g)為1∶9、1∶4、3∶7、2∶3、1∶1、3∶2、7∶3、4∶1、9∶1,以吸油量(%)為指標,篩選出最佳多糖復配比。
1.5 最佳粗糧復配物對脂肪酶的測定
復配物能具有降脂的效果,其同時對體內的脂肪酶有一定的抑制效果,從而雙重減少脂肪的吸收量。以最佳復配物比例對小鼠脂肪酶進行測定,做為本實驗預制備具有降血脂作用復配物的有效依據。取2 mL 0.1 g/mL條斑紫菜和粗糧多糖復配物溶液,與加有底物甘油三油酸酯和小鼠脂肪酶進行酶抑制率的測定。
1.6 指標的測定
1.6.1 水溶性多糖得率的測定 取1 mL待測樣品或標準品溶液,分別加入4.0 mL 0.2%的蒽酮溶液(取0.2 g蒽酮粉末用濃硫酸定容在100 mL容量瓶中,注:現配現用[9]),速用冷水冷卻,然后放到沸水浴中加熱10 min取出,迅速冷卻,室溫放置10 min,于620 nm處進行比色。以蒸餾水為空白,準確測定濃度為0.02、0.04、0.06、0.08、0.10 mg/mL的葡萄糖標準品溶液,并繪制葡萄糖標準曲線。根據葡萄糖標準曲線,計算水溶性多糖濃度和水溶性多糖得率(%)(見式1)。
式(1)
式中:c1為水溶性多糖濃度;V多糖溶液體積;n為稀釋倍數;m為條斑紫菜原料重量。
1.6.2 粗糧多糖得率的測定 干燥至恒重的粗糧粉重量記為W1,經提取后獲得的粗糧多糖重量記為W2。按照式2計算粗糧多糖得率(%)。
式(2)
1.6.3 體外油脂吸附能力的測定 將段振等[11]的體外油脂吸附能力測定方法改進如下:稱取0.2 g條斑紫菜多糖和粗糧多糖復配混合物(重量記為S1)置于50 mL離心管中,向其中加入食用大豆油1.6 g,在恒溫振蕩器中37 ℃靜置1 h,結束后4000 r/min條件下離心20 min,棄去上層油,用濾紙將殘渣中的游離大豆油吸干,稱重得S2。按式3計算吸油量(%)。

式(3)
1.6.4 粗糧復配物對體外脂肪酶的抑制率測定
1.6.4.1 小鼠脂肪酶制備 酶制備方法參照文獻略加修改[12],取冷凍的成年小鼠小腸和胰臟混合物,用生理鹽水沖洗干凈并剪碎,用100 mL磷酸鹽緩沖液(pH6.8)在冰水浴中分批倒入勻漿器,研磨至勻漿,放入4 ℃冰箱過夜,在0~4 ℃下5000 r/min離心15 min取上清液,即為小鼠脂肪酶液,4 ℃備用,使用時先將小鼠脂肪酶放入37 ℃水浴鍋預熱10 min,以激活酶。
1.6.4.2 小鼠脂肪酶活性測定 根據文獻方法[11],稍作修改,進行小鼠脂肪酶活性測定,方法如下:取四個100 mL錐形瓶,一個為空白對照組,另外兩個為測定組。每瓶加5 mL 0.025 moL/L PBS磷酸鹽緩沖液(pH7.4)和4 mL甘油三油酸酯底物乳化液,置37 ℃水浴鍋中預熱10 min。然后加入1 mL 2 mg/mL小鼠脂肪酶液(以pH7.4 0.025 mol/L 磷酸鹽緩沖液配制(除空白外)),從加入小鼠脂肪酶液開始計時,保溫15 min后立即向其中加入15 mL 95%乙醇,停止酶反應。加酚酞指示劑三滴(2 g酚酞加上100 mL 95%乙醇配制),用0.025 mol/L氫氧化鈉標準溶液滴至微紅色。空白實驗先不加小鼠脂肪酶液,保溫15 min后立即加入15 mL 95%乙醇,最后加入1 mL小鼠脂肪酶液。根據式5計算胰脂肪酶活力:
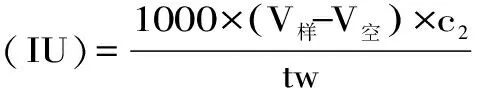
式(5)
式中:c2為NaOH標準溶液的濃度,mol/L;V樣為樣品消耗NaOH標準溶液的體積,mL;V空為對照實驗消耗NaOH標準溶液的體積,mL;t為加酶后反應時間,min;w為小鼠小腸酶添加量,mL。
1.6.4.3 小鼠脂肪酶抑制率的測定 據文獻[11],向100 mL三角瓶中加入PBS緩沖液及底物乳液,置于37 ℃恒溫培養10 min后,加入2 mL 0.1 g/mL條斑紫菜薏仁米多糖(1∶1)混合溶液,保溫10 min,然后加入1 mL小鼠脂肪酶液,從加入酶液開始計時15 min,結束后立即加入15 mL 95%乙醇,測定其剩余酶活。空白試驗不加入條斑紫菜薏仁米多糖混合溶液。
抑制活力單位定義:在pH7.5,溫度為37 ℃的條件下,使一個酶活力單位失活為一個抑制劑活力單位。條斑紫菜薏仁米多糖對胰脂肪酶的抑制率計算如式6:
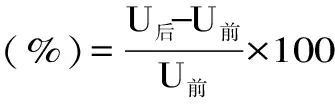
式(6)
式中:U前為抑制前小鼠脂肪酶活力,U后為抑制后小鼠脂肪酶活力。
1.7 數據處理

2 結果與分析
2.1 超聲波法提取條斑紫菜水溶性多糖實驗結果分析
2.1.1 葡萄糖標準曲線繪制 以葡萄糖標準品質量濃度(mg/mL)為橫坐標,以吸光度(A620 nm)為縱坐標,繪制葡萄糖標準曲線圖,見圖1(A),得到葡萄糖標準品質量濃度與吸光度的線性關系方程為y=9.84x+0.0057,決定系數R2=0.9973。
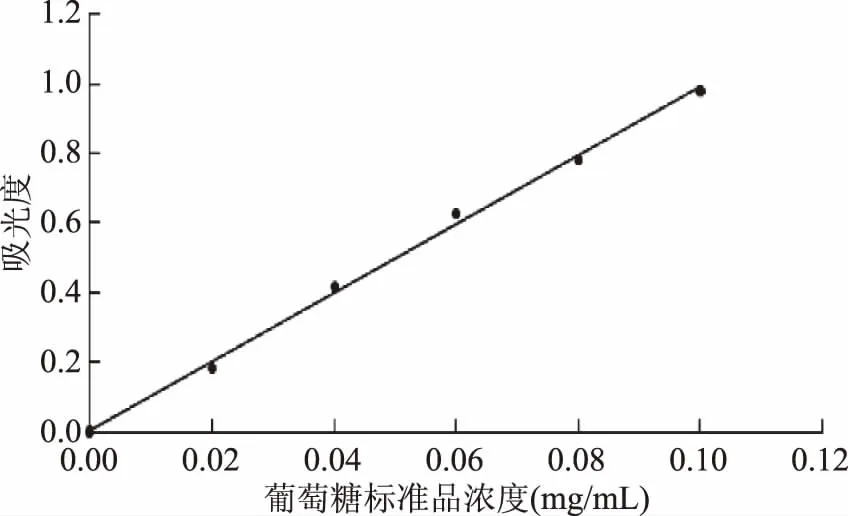
圖1 葡萄糖標準曲線Fig.1 Glucose standard curve
2.1.2 單因素對條斑紫菜水溶性多糖得率的影響
2.1.2.1 料液比對條斑紫菜水溶性多糖得率的影響 由圖2可知,隨著料液比的增加,條斑紫菜水溶性多糖得率先顯著增加后極顯著急速增加(P≤0.01),當料液比為1∶20時條斑紫菜水溶性多糖得率最大(3.63%±0.08%),之后隨著料液比的增加,多糖得率變化不顯著(P>0.05)。可能是由于用水量過少時,條斑紫菜可溶性多糖浸出不完全;隨著用水量增加,條斑紫菜可溶性多糖溶解程度增加,最終達到最高值;隨著料液比的繼續增加,多糖的得率提升空間較為有限[13]。因此,選擇較優料液比為1∶20。
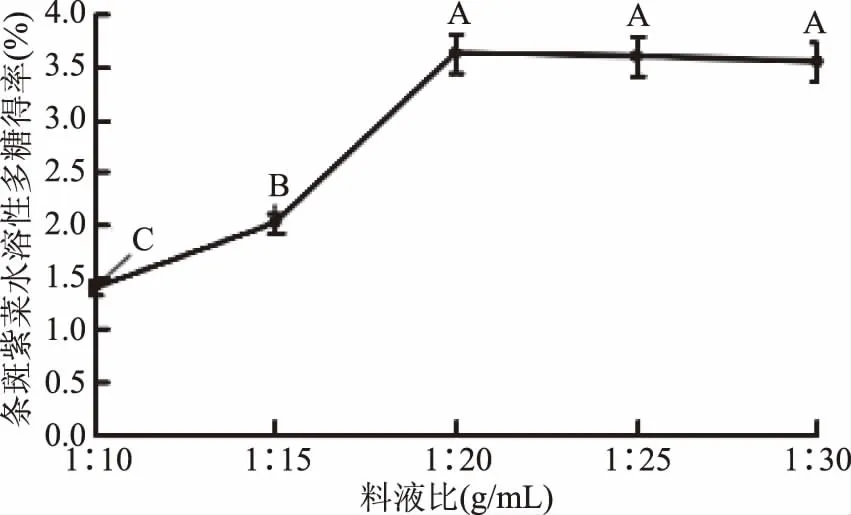
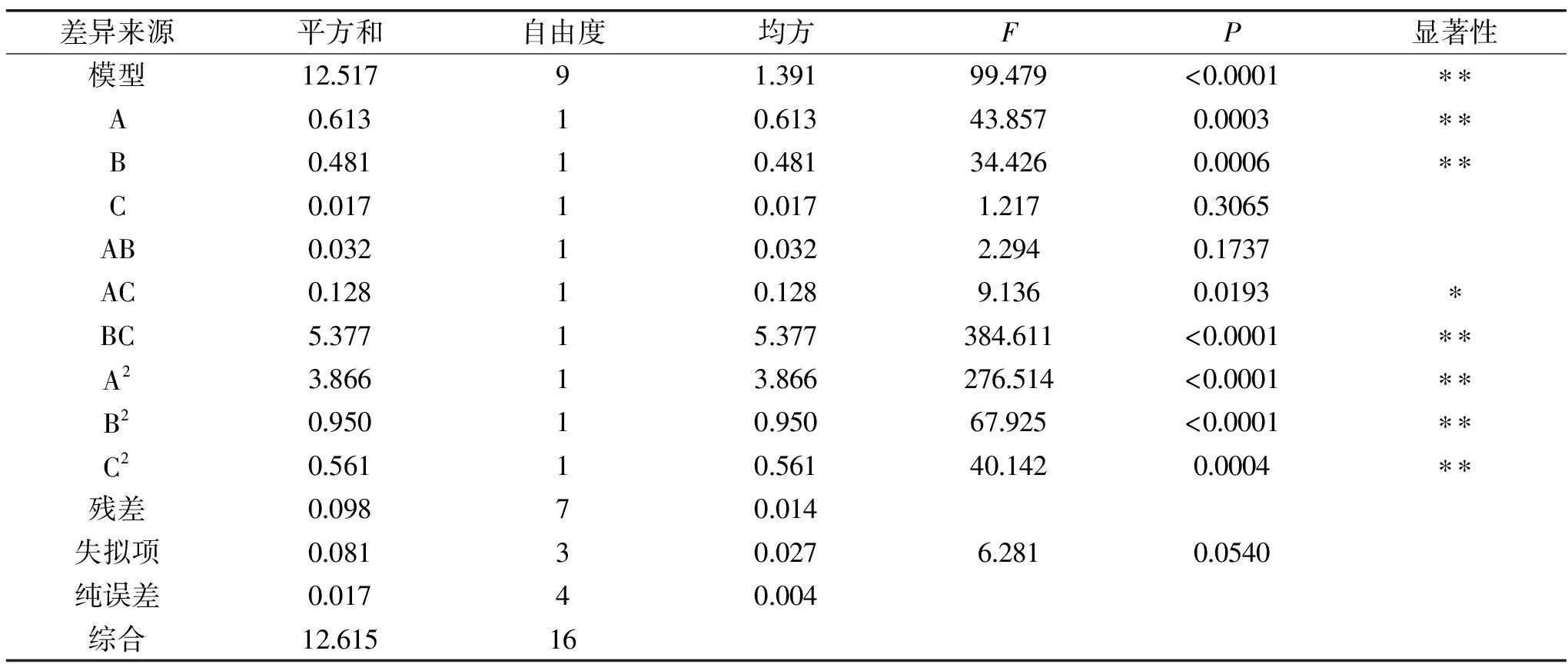
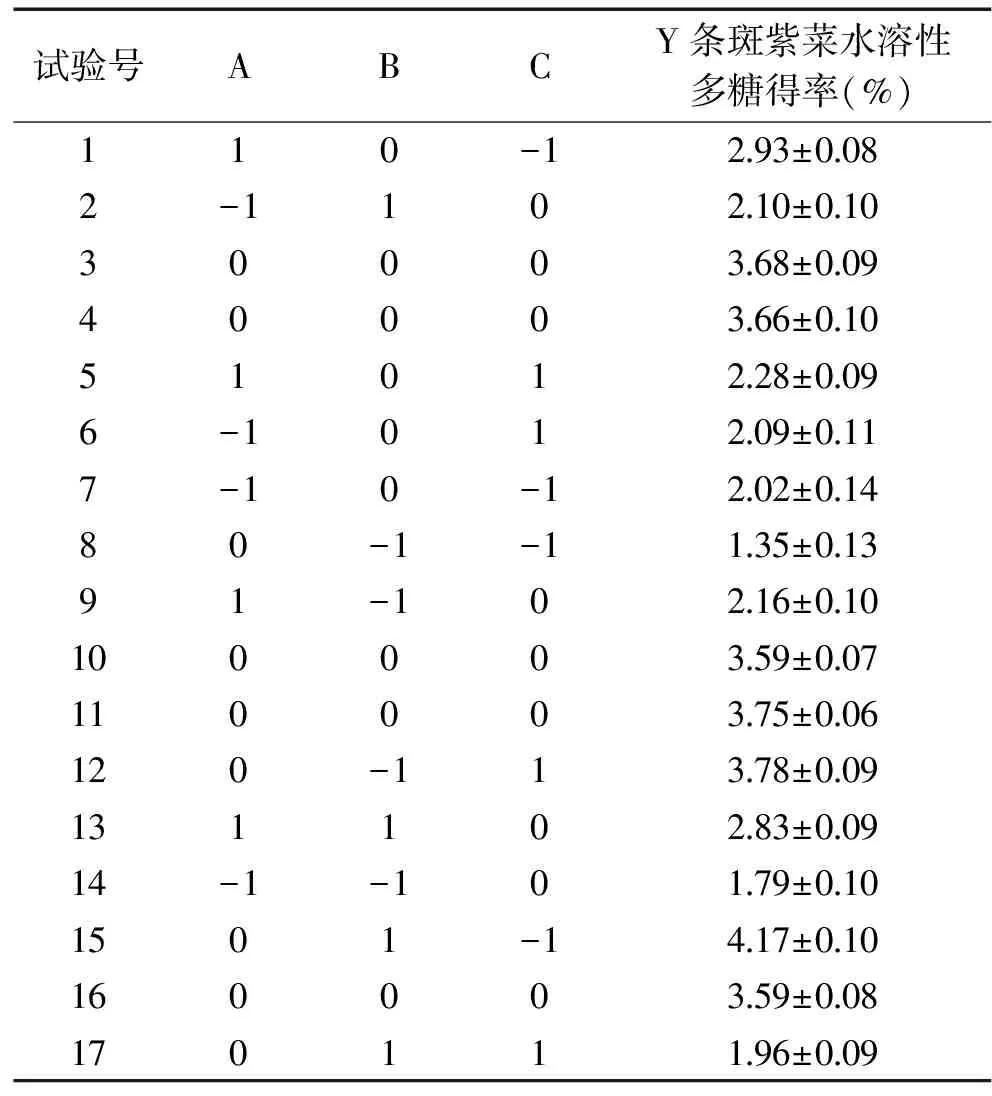
圖2 料液比對條斑紫菜水溶性多糖得率得影響Fig.2 Effect of liquid-liquid ratio on the yield ofwater-soluble polysaccharides of Porphyra yezoensis注:同一比較組中標有不同大寫字母表示差異極顯著(P≤0.01);相同大寫字母不同小寫字母表示差異顯著(0.01 2.1.2.2 提取溫度對條斑紫菜水溶性多糖得率的影響 從圖3可知,隨著超聲溫度的升高,條斑紫菜水溶性多糖得率先升高不明顯,而后極顯著升高(P≤0.01),當超聲溫度為50 ℃時,條斑紫菜水溶性多糖得率最大(2.97%±0.10%),之后又極顯著降低(P≤0.01)。當超聲溫度過低時,分子運動速度慢[13],導致條斑紫菜可溶性多糖得率低;而當超聲溫度過高時,分子運動速度雖然變快了,但可能是條斑紫菜可溶性多糖高溫易被破壞[14-15],導致可溶性多糖得率下降。因此選擇適宜的超聲溫度為50 ℃。 2.1.2.3 提取時間對條斑紫菜水溶性多糖得率的影響 由圖4可知,隨著超聲時間的延長,條斑紫菜水溶性多糖得率先極顯著升高(P≤0.01),當超聲時間為40 min時得率最大(3.95%±0.10%),超聲時間在40~50 min之間水溶性多糖得率數值極顯著降低(P≤0.01),50 min以后得率變化不顯著(P>0.05)。當超聲時間過短時,條斑紫菜中水溶性多糖尚未完全和水充分接觸[14],水溶性多糖得率較低;而當超聲時間過長時,條斑紫菜可能有部分降解現象[16],導致水溶性多糖得率降低。因此選擇適宜的超聲時間為40 min。 圖4 超聲時間對條斑紫菜水溶性多糖得率的影響Fig.4 Effect of ultrasonic time on the yield ofwater-soluble polysaccharides of Porphyra yezoensis 2.1.2.4 超聲功率對紫菜水溶性多糖得率的影響 由圖5可知,隨著超聲功率的增加,條斑紫菜水溶性多糖得率逐漸增加(P≤0.01),當超聲功率為150 W時,紫菜水溶性多糖得率達到最大值(3.50%±0.1%),隨后隨著超聲功率的繼續增加,多糖得率變化不顯著(P>0.05)。可能是由于用破碎的還不夠完全,能溶解的多糖有限時,條斑紫菜可溶性多糖浸出不完全;隨著超聲功率增加,條斑紫菜可溶性多糖溶解程度增加,最終達到最高值;隨著超聲功率的增加,多糖的得率提升空間較為有限[13]。因此選擇適宜的超聲功率為150W。 表3 回歸模型方差分析Table 3 Analysis of variance by response surface methodology 圖5 超聲功率對條斑紫菜水溶性多糖得率的影響Fig.5 Effect of ultrasonic power on the yield ofwater-soluble polysaccharides of Porphyra yezoensis 注:0.01 Y=3.65+0.28A+0.25B-0.04C+0.090AB-0.18AC-1.16BC-0.96A2-0.47B2-0.37C2。 表2 響應面法實驗設計及結果Table 2 Experimental results of response surface methodology 表3顯示,回歸模型F=99.479,P<0.0001表示該回歸模型極顯著,而且失擬項F=6.281,失擬項P=0.0540,即P>0.05,表明回歸方程無失擬項存在,回歸方程擬合程度極好,此模型中A、B、BC、A2、B2和C2因素對條斑紫菜水溶性多糖得率存在極顯著影響(P<0.01)。 圖6(A~C)能夠直接反映料液比、超聲溫度、超聲時間之間的交互作用。根據圖6(A)響應面彎曲程度先上升后平緩的趨勢分析得出,在料液比較低時,得率隨著超聲溫度升高而增大。適當提高提取超聲溫度能彌補料液比過低時對得率的影響。但料液比逐漸提高,得率變得平緩,隨著超聲溫度升高而降低。圖6(B)所示其響應面彎曲程度先上升后平緩的趨勢分析得出,在不同料液比的條件下,得率隨著超聲時間的增大而增大,最大料液比逐漸趨向平緩,隨著超聲時間和液料比的增大,得率不再增加。圖 6(C)所示其響應面彎曲程度先上升后平緩且有下降的趨勢分析得出,在超聲溫度較低時,得率隨著超聲時間增大而增大。但由于超聲溫度過高或超聲時間過長得率保持在一定水平不再提升或者下降,說明超聲溫度與超聲時間的交互作用對得率有影響。 圖6 交互作用對條斑紫菜水溶性多糖得率的影響Fig.6 Effects of interaction on the extraction rate ofwater-soluble polysaccharides from Porphyra yezoensis 利用Design Expert 8.0.6軟件對二次回歸模型進行分析,預測最優提取條件為料液比1∶26.42,超聲溫度60.00 ℃,超聲時間30.00 min,估測響應值的理論值為4.34%。由于實驗室條件限制采取優化條件為料液比1∶25,超聲溫度60 ℃,超聲時間30 min進行試驗,水溶性多糖得率為4.24%±0.19%,相對誤差為0.10%,其預測值與實際值接近。羅彤等[13]人對我國南方紫菜多糖超聲波法提取最佳條件為:液固比為50∶1,90 ℃超聲時間30 min,紫菜多糖得率為6.78%。相比較,本實驗結果超聲溫度較低,可能是由于渤海條斑紫菜中高溫不穩定多糖含量較高的緣故,溫度較低無法完全提出。 表4 以粗糧多糖得率篩選粗糧復配種類的結果Table 4 Results of screening compound types of coarse grain by extraction rate of polysaccharides 表5 粗糧多糖溶解性結果Table 5 Solubility results of coarse grain polysaccharides 注:+為溶解,-為不溶解。 2.2.1 粗糧多糖的初篩 表4表明,因為實驗設計的用量,多糖得率在6%以下的粗糧其每5 g所得得多糖過于少不足以進行一次實驗,進行下一步實驗時需要加倍提取,因此未超過6%篩除,香糯米、大麥米、黃小米、香米的粗糧多糖得率在6%以下,故本實驗將此四種粗糧篩除。保留爆玉米、薏仁米、糙米、蕎麥和青稞進行二次篩選。 2.2.2 粗糧多糖的二次篩選 表5表明,糙米、蕎麥和青稞在pH=7.0的25 ℃蒸餾水、pH=7.0的70 ℃熱蒸餾水、pH=8.0的25 ℃蒸餾水、pH=8.0的70 ℃熱蒸餾水這四種情況都不溶解,原因可能是提取出的糙米、蕎麥、青稞多糖為偏酸性多糖不易溶于堿性。因此不適用與條斑紫菜多糖進行復配。 2.2.3 粗糧多糖的最終篩選 表6表明,條斑紫菜多糖和薏仁米多糖復配物的吸油量顯著高于條斑紫菜多糖和爆玉米多糖復配物的吸油量(P<0.01)。復配物通過與油脂結合,使胃腸內消化吸收脂肪量減少,從而達到降脂的目的[17-18]。 表6 復配物的吸油量結果Table 6 Oil absorption results of the compound 注:P≤0.01為差異具有極顯著性,用**表示。 通過以上三次篩選,本實驗最終篩選出薏仁米為與條斑紫菜復配的最佳粗糧種類,以及其二者最佳復配比,并以此進一步開展后續實驗。 表8 吸油量的析因法方差分析結果Table 8 Factorial variance analysis of oil absorption 表9 不同復配比添加量的吸油量的結果Table 9 Results of oil absorption amounts with different compound ratios 2.3 條斑紫菜多糖和薏仁米多糖復配物的制備 2.3.1 2×2析因法分析條斑紫菜多糖和薏仁米多糖交互作用關系結果 析因分析結果(見表7和表8)表明,條斑紫菜多糖的主效應、薏仁米多糖的主效應都差異顯著(P<0.05),而其條斑紫菜多糖×薏仁米多糖交互作用對吸油量影響差異極顯著(P<0.01)。圖7表明,條斑紫菜多糖與粗糧多糖之間為正協同作用,說明兩者能有效共同作用使其吸附油能力增強。為后期研制條斑紫菜多糖和粗糧多糖復配物的奠定實驗基礎。 表7 2×2析因法設計吸油量(%)的合計值Table 7 2×2 Factorial design of oil absorption(%) 圖7 吸油量的析因分析圖Fig.7 Factorial analysis chart of oil absorption 2.3.2 篩選最佳多糖復配比的結果 以吸油量(%)篩選出最佳的多糖復配比(見表9),結果表明條斑紫菜多糖:薏仁米多糖為1∶1時,吸油量最高(45.87%±5.27%),即為最佳的多糖復配比。實驗結果顯示條斑紫菜多糖與薏仁米多糖復配具有較高的可行性,具有較強的油脂吸附能力,可間接判斷其具有較高的降血脂能力[18]。 條斑紫菜多糖和薏仁米的最佳復配比為1∶1,其二者最佳復配比下對小鼠脂肪酶測定結果為34.67%,抑制率較好,即復配物不僅可以吸附油脂,同時可以對脂肪酶起一定的抑制作用,復配物可以通過抑制脂肪酶分解脂肪,使胃腸內易吸收的脂肪酸減少,減少脂肪吸收從而達到降脂的目的。因為酶提取的方式和滴定方式,導致上下浮動較大,但結果較為理想。 本實驗優化超聲波法最佳提取條斑紫菜中的多糖的工藝為目的,料液比(m/V,g/mL)1∶25,超聲功率為150 W,超聲溫度60 ℃,超聲時間30 min,獲得水溶性多糖得率為4.24%±0.19%。篩選9種粗糧中薏仁米最適合與條斑紫菜多糖復配,且最佳復配比為1∶1,吸油量最大為45.87%±5.27%,其二者復配物對小鼠脂肪酶的抑制率為34.67%。本實驗為研發新型渤海紫菜降血脂功能性食品提供實驗依據。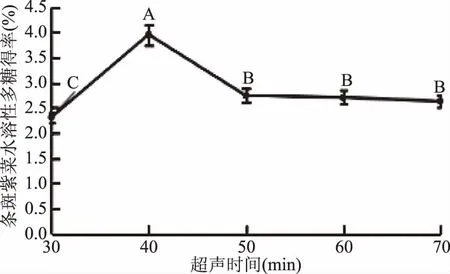



2.2 條斑紫菜多糖和粗糧多糖的復配篩選結果分析



2.4 最佳粗糧復配物對脂肪酶的測定
3 結論

