利用高效液相色譜法測定不同發(fā)酵時長郫縣豆瓣醬醬中的8種生物胺
,*
(1.四川省食品發(fā)酵工業(yè)研究設計院,四川成都 611130;2.四川東坡中國泡菜產業(yè)技術研究院,四川眉山 620030)
生物胺(biogenic amine,BA)是一類低分子量的堿性含氮化合物,可在微生物代謝分泌的氨基酸脫羧酶、轉氨酶的作用下,通過游離氨基酸的脫羧反應,醛、酮類物質的胺化或轉氨作用產生[1]。生物胺廣泛存在于酸乳[2]、奶酪[2]、酒類[3]、醬油[4]、食醋[5]以及泡菜[6]等發(fā)酵食品中,往往具有較強毒性,人在超量攝入后會出現(xiàn)頭痛、呼吸窘迫、血壓異常、心悸、過敏等不良癥狀[7]。生物胺還會與食品中的亞硝酸鹽發(fā)生反應,生成具有強致癌性的亞硝基胺類化合物[8]。因此,生物胺一般被看作一種食品內源性危害物,用以表征腐敗菌繁殖和不良代謝產物積累的程度。鑒于其對食品品質及安全性的不良影響,食品加工儲存中,應盡可能采取措施抑制生物胺的生成。
色譜法是檢測食品中生物胺的重要方法,不僅能有效分離鑒定樣品中的生物胺組分,還可檢測樣品中各類生物胺的含量。在各類色譜法中,高效液相色譜(high performance liquid chromatography,HPLC)法是測定生物胺最常用、最可靠的手段之一。現(xiàn)有研究表明,利用HPLC測定食品體系中的生物胺,具有良好的重復性、靈敏度和準確性[9-10]。
郫縣豆瓣醬是西南地區(qū)著名的傳統(tǒng)調味品,主要利用蠶豆瓣、辣椒等原料經微生物發(fā)酵制成。郫縣豆瓣醬以其獨特的風味深受消費者歡迎,廣泛應用于川菜烹飪和特色食品加工,被譽為“川菜之魂”[11]。傳統(tǒng)工藝制作的郫縣豆瓣醬需經過“晴天曬、雨天蓋、白天翻、夜晚露”[12]的發(fā)酵階段,往往持續(xù)數(shù)月甚至數(shù)年,以在多種微生物的參與下形成良好的風味。此階段中,郫縣豆瓣醬的微生物群落結構會發(fā)生明顯的變化[13],這些微生物中不乏具有高氨基酸脫羧能力的菌株,能夠催化氨基酸脫羧產生生物胺,因此,郫縣豆瓣醬后發(fā)酵過程中生物胺的生成應引起人們足夠的關注。然而,目前對郫縣豆瓣醬中生物胺的研究還十分少見,傳統(tǒng)發(fā)酵食品領域也沒有專門針對郫縣豆瓣醬中生物胺的檢測方法。本研究利用高效液相色譜法(HPLC),對不同發(fā)酵時長郫縣豆瓣醬中的8種生物胺(色胺、β-苯乙胺、腐胺、尸胺、組胺、酪胺、亞精胺和精胺)含量進行了分析,以期為郫縣豆瓣醬生物胺的控制與監(jiān)測研究提供相應的數(shù)據(jù)參考。
1 材料與方法
1.1 材料與儀器
發(fā)酵1、10、12、24、30、42、54、96個月的郫縣豆瓣醬 取樣自成都市郫都區(qū)某豆瓣生產企業(yè),樣品從陶制發(fā)酵缸中采集后置于-20 ℃保存?zhèn)溆?色胺、β-苯乙胺、腐胺、尸胺、精胺、亞精胺、1,7-二氨基庚烷、乙腈、脯氨酸、乙酸銨 色譜純,美國Sigma公司;酪胺 色譜純,德國Dr公司;丹磺酰氯(DNS-Cl)、組胺,色譜純 美國霍尼韋爾公司;正己烷、甲醇、丙酮,色譜純 德國Merck公司;碳酸氫鈉、氫氧化鈉、鹽酸 分析純,成都科龍化學試劑廠。
LC-2030液相色譜一體機(配有紫外檢測器、柱溫箱和自動進樣器) 日本島津制作所;TGL-20bR冷凍離心機 上海安亭科學儀器廠;VORTEX-2旋渦混合器 美國GENE公司;HH-2數(shù)顯恒溫水浴鍋 金壇市晶波實驗儀器廠;TP-214型分析天平 美國Denver公司;Orion 868酸度計 美國Orion公司;Milli-Q超純水器 美國Millipore公司;0.22 μm有機系濾器 上海安譜科學儀器有限公司;Thermo移液器(200~1000 μL) 美國Thermo Fisher公司。
1.2 實驗方法
1.2.1 溶液的制備
1.2.1.1 內標溶液的制備 準確稱取1,7-二氨基庚烷0.1 g于100 mL容量瓶中,用0.1 mol/L鹽酸溶解并定容,即得1 mg/mL內標儲備液。取10 mL內標儲備液,用0.1 mol/L鹽酸定容至100 mL,即得0.1 mg/mL內標使用液。
1.2.1.2 生物胺標準液的制備 生物胺單標儲備液(600 mg/mL):準確稱取各生物胺標準品0.0600 g,用0.1 mol/L HCl溶液溶解并定容至100 mL,-20 ℃儲存。生物胺混標工作液:分別吸取各單標儲備液1.0 mL于10 mL容量瓶中,用0.1 mol/L HCl定容至刻度,混勻。然后將其稀釋并加入適量內標儲備液,制得含有25 mg/L內標且各標樣質量濃度分別為60、40、20、10、5、2.5和1 mg/L的生物胺混標工作液待用。
1.2.2 試樣中生物胺的提取及衍生 預處理及衍生過程參照Frias J等的方法[14],并做優(yōu)化改進,以適用于郫縣豆瓣醬樣品。將樣品切碎研磨后,準確稱取10 g置于離心管中,加入1.25 mL內標工作液和15 mL 0.1 mol/L HCl溶液,混勻后震蕩提取30 min,4000 r/min離心10 min,取上清液。沉淀依照相同方法重復提取1次。合并2次上清液并混勻,用0.1 mol/L HCl溶液定容至50 mL待用。
準確取上清液1.0 mL,然后依次加入200 μL NaOH溶液(2 mol/L)、300 μL飽和NaHCO3溶液、2.0 mL DNS-Cl溶液(10 mg/mL),混勻后于40 ℃避光衍生60 min,加入200 μL脯氨酸溶液(100 mg/mL),漩渦震蕩1 min后于室溫避光放置15 min,以去殘余的DNS-Cl試劑。隨后加入0.4 g NaCl,漩渦振蕩,加入1.0 mL乙醚,渦旋振蕩30 s,靜置分層后,吸出上層有機相,重復操作2次,合并有機相,40 ℃揮發(fā)至干,用1.0 mL乙腈溶解殘留物,0.22 μm有機系濾器過濾后4 ℃避光保存?zhèn)溆谩?/p>
1.2.3 高效液相色譜條件 高效液相色譜條件參照Frias J等的方法[14],并做改進。色譜柱:Dikma Diamonsil C18分析色譜柱(250 mm×4.6 mm,5 μm);流速:0.8 mL/min;柱溫:35 ℃;進樣量:10 μL;采用二元梯度洗脫,流動相A:0.01 mol/L乙酸銨緩沖液—乙腈(90∶10,V/V),流動相B:乙腈-0.01 mol/L乙酸銨緩沖液(90∶10,V/V);梯度洗脫程序如下:0~22 min,60%~85%流動相B,23~24 min,85%~100%流動相B,25~32 min,100%流動相B,33~37 min,100%~60%流動相B,各色譜峰在250 nm處檢出。
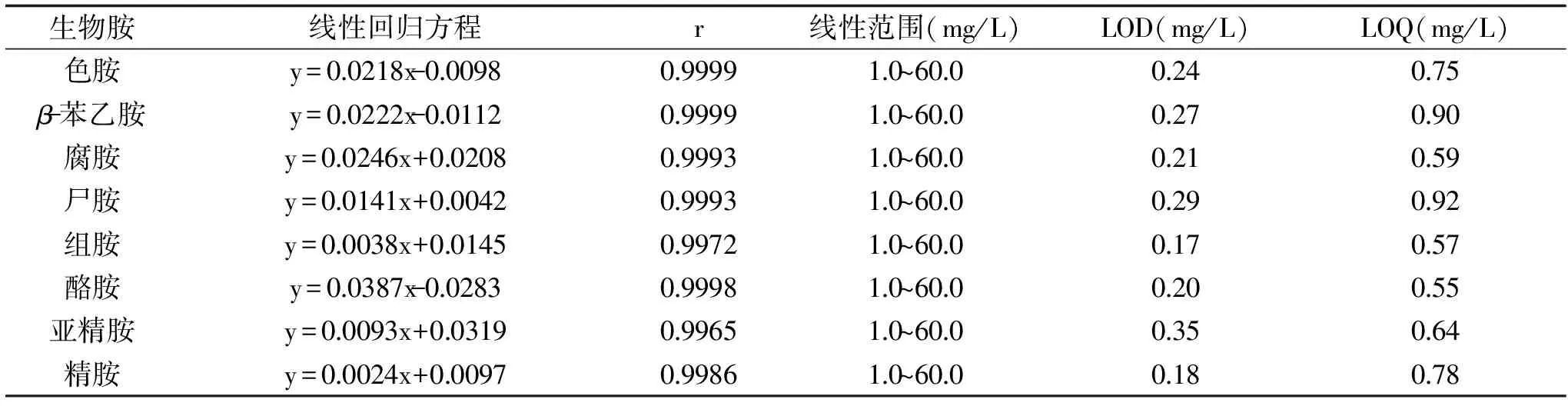
表1 HPLC測定8種生物胺的回歸方程、線性范圍、檢出限和定量限Table 1 Regression equation,linear range,detection limit and quantitative limit for thedetermination of 8 biogenic amines by high performance liquid chromatography
1.3 數(shù)據(jù)處理
采用IBM SPSS statistic 22統(tǒng)計分析軟件進行數(shù)據(jù)的線性回歸分析,使用Origin 9.1軟件對實驗數(shù)據(jù)進行統(tǒng)計和作圖。
2 結果與討論
2.1 標準曲線的構建
生物胺在測定之前需要進行衍生處理以產生紫外光區(qū)的特征性吸收峰。本研究中,樣品通過單磺酰氯衍生法衍生完成后,基于1.2.3的色譜條件,將混標色譜圖與單標進行比對,根據(jù)保留時間確定了8種生物胺的出峰順序,如圖1。
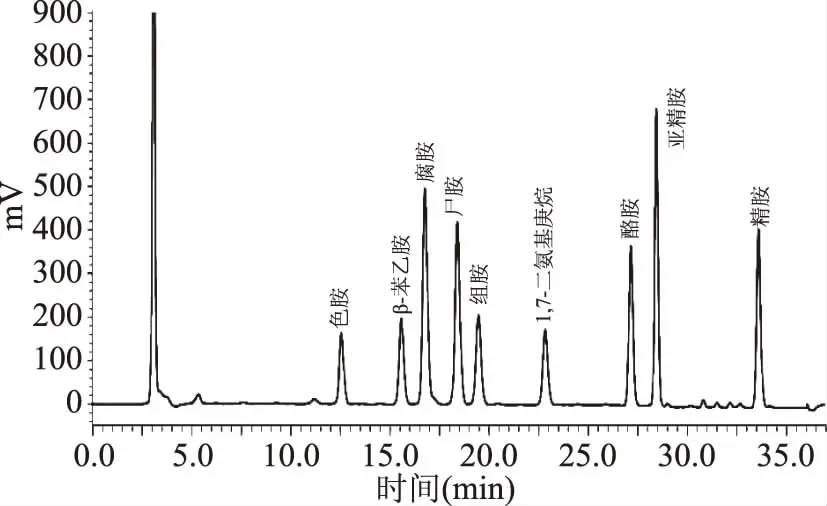
圖1 40 mg/L生物胺混標的DNS-Cl衍生物高效液相色譜圖Fig.1 HPLC chromatographic profile of DNS-Clderivatives of 40 mg/L biogenic amine standards
如圖1所示,8種生物胺皆在進樣后35 min內出峰,各色譜峰無重疊、峰形對稱完整,說明所采用的洗脫程序能夠較好地分離郫縣豆瓣醬樣品中的各種生物胺。通過與單標保留時間的對比可知,該混標中各生物胺的出峰順序依次為色胺(12.70 min)、β-苯乙胺(15.71 min)、腐胺(16.94 min)、尸胺(18.57 min)、組胺(19.61 min)、酪胺(27.26 min)、亞精胺(28.52 min)和精胺(33.61 min)。
2.2 方法學考察結果
2.2.1 線性范圍、檢出限、定量限 制備不同質量濃度(1、2.5、5.0、10.0、20.0、40.0、60.0 mg/L,含有25 mg/L內標)的生物胺混標進行上樣檢測,以進樣濃度為自變量,各生物胺與內標的峰面積之比為因變量,得到8種生物胺的線性回歸方程及其回歸系數(shù)(r)。此外,將生物胺混標工作液稀釋后上樣檢測,以3倍信噪比(S/N)作為各生物胺的檢出限(limit of detection,LOD),以10倍信噪比作為各生物胺的定量限(limit of quantitation,LOQ),測定儀器所能檢出和定量的最低濃度,結果如表1所示。
由表1可知,8種生物胺回歸方程的回歸系數(shù)(r)均大于0.99,表明各生物胺標品的回歸模型均具有顯著性,各生物胺標曲在1.0~60.0 mg/L的范圍內線性關系良好。同時各生物胺的LOD在0.17~0.35 mg/L之間,LOQ在0.55~0.92 mg/L之間。現(xiàn)有色譜條件下,各生物胺的LOD與LOQ均低于線性范圍的最小值,說明各生物胺在1.0~60.0 mg/L的范圍可被準確定量。
2.2.2 精密度實驗結果 對質量濃度為40 mg/L的生物胺混標溶液連續(xù)進樣7次,同時加入內標定量,根據(jù)定量結果測定生物胺測定方法的日內重復性,結果見表2所示。各生物胺日內7次測定結果的相對標準偏差范圍在0.04%~0.56%之間,T Tao等利用高效液相色譜測定腐乳中的生物胺,其結果表明日內連續(xù)6次進樣的相對標準偏差為1.56~3.22%[15],本研究中各生物胺測量值的相對標準偏差均小于1%,說明實驗采用的檢測方法精密度較高。
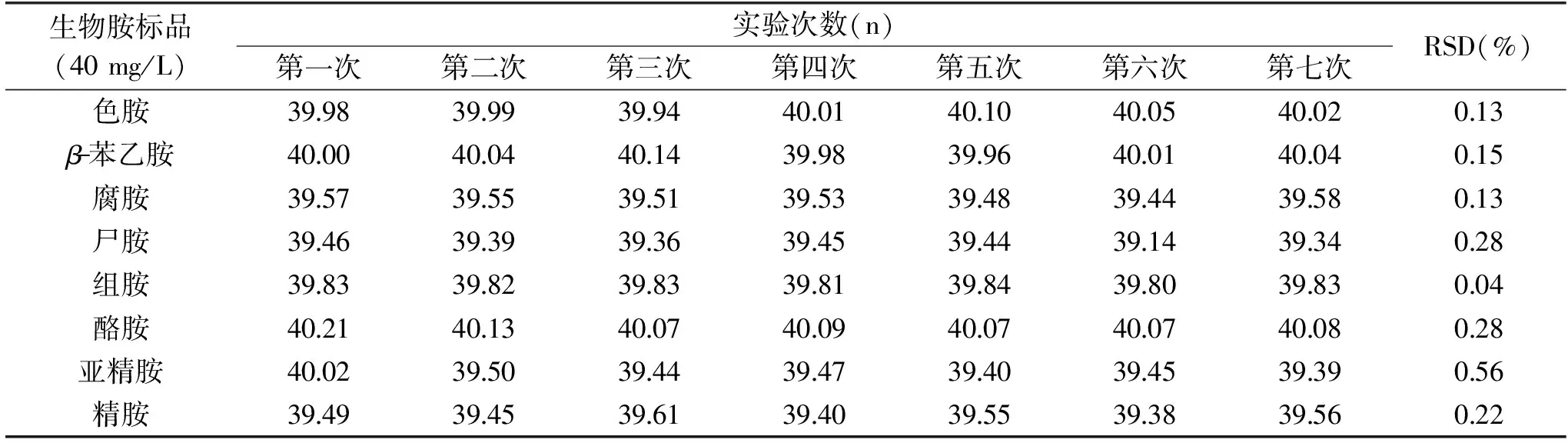
表2 儀器日內重復性測定結果Table 2 Results of intra-day repeatability determination
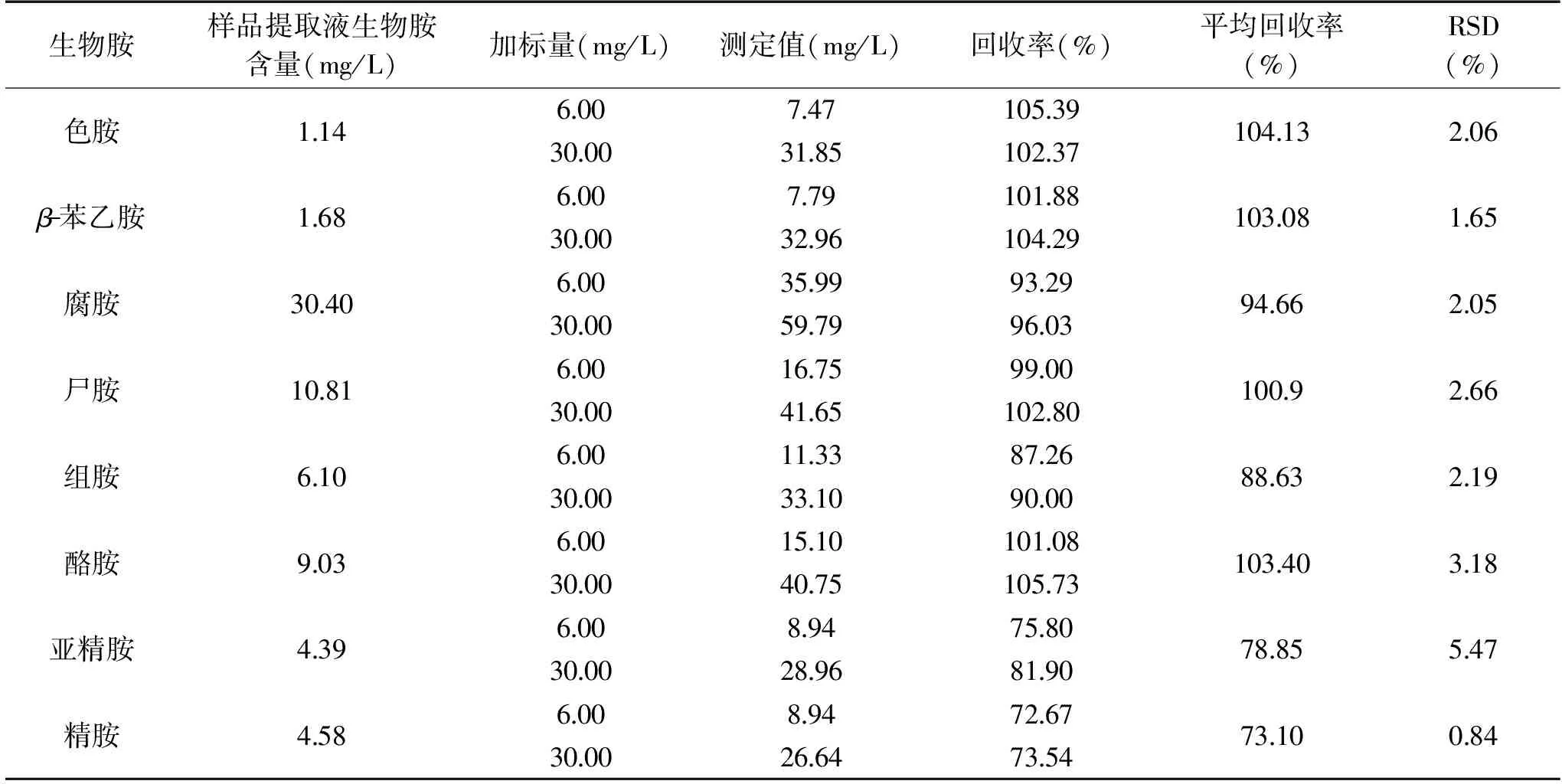
表3 郫縣豆瓣醬中生物胺的回收率Table 3 Recoveries of biogenic amines in broad bean paste
2.2.3 加標回收率實驗結果 稱取郫縣豆瓣醬10 g,按照1.1.2的方法制備成50 mL提取液,同時加入內標至最終質量濃度為25 mg/L,分別加入生物胺標準品至最終質量濃度為6.0和30.0 mg/L,吸取1 mL提取液測定生物胺,各加標水平樣品獨立測定3次,所得平均回收率和相對標準偏差結果如表3所示。
由表3可知,8種生物胺標準品的平均回收率在73.10%~104.13%之間,相對標準偏差在0.84%~5.47%之間。Tao等[15]對腐乳生物胺的研究中,各生物胺的回收率在83.6%~103.5%之間,相對標準偏差在1.26%~5.24%之間,與本研究結果類似。本研究所采用的測定方法能夠滿足實際檢測對數(shù)據(jù)準確度的要求,因此用來檢測郫縣豆瓣醬樣品中生物胺含量是可行的。
2.3 不同發(fā)酵時長郫縣豆瓣醬樣品生物胺含量分析
按照本研究方法對不同發(fā)酵時長(1、10、12、24、30、42、54、96個月)的郫縣豆瓣醬進行生物胺檢測,并將樣品中各生物胺與內標峰面積的比值帶入標準曲線,求得各樣品的生物胺含量。檢測結果如圖2所示。
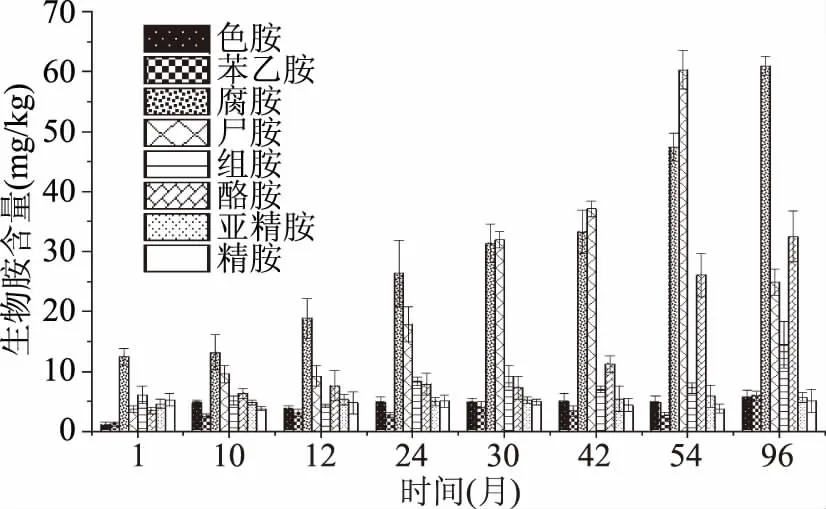
圖2 不同發(fā)酵時長郫縣豆瓣醬中生物胺含量的變化Fig.2 Changes of biogenic amine contentsin Pixian broad bean pastes with different fermentation time

圖3 不同發(fā)酵時長郫縣豆瓣醬中總生物胺的含量Fig.3 Total biogenic amines in Pixianbroad bean pastes with different fermentation time注:圖中各點上的不同字母代表樣本間具有顯著性差異(P<0.05)。
由圖2可看出,8種生物胺在不同發(fā)酵時長的郫縣豆瓣醬中均可檢出,其中腐胺、尸胺、酪胺和組胺的含量相對較高,是郫縣豆瓣醬中的主要生物胺,其他生物胺含量相對較低。隨著郫縣豆瓣醬發(fā)酵時間的延長,腐胺不斷累積,含量逐漸增加,發(fā)酵1~96月間,腐胺含量由(12.46±1.43) mg/kg增長至(60.98±1.53) mg/kg;郫縣豆瓣醬中的尸胺含量在發(fā)酵前54個月增長迅速,是所有生物胺中增長最快的一種,由初始的(3.70±0.55) mg/kg增長至54個月的(60.30±3.24) mg/kg,但在發(fā)酵第96個月明顯下降,僅有(24.88±2.12) mg/kg。此外,豆瓣醬發(fā)酵至54個月之后,組胺和酪胺明顯積累,分別由1個月時的(6.10±1.43) mg/kg和(3.47±0.57) mg/kg,增長至96個月的(14.45±3.88) mg/kg和(32.48±4.21) mg/kg。色胺、β-苯乙胺、亞精胺、精胺在不同發(fā)酵時間的郫縣豆瓣醬中的含量均在6 mg/kg以下,且在郫縣豆瓣醬發(fā)酵期間變化較小,含量趨于穩(wěn)定。
腐胺與尸胺是食品中常見的生物胺[16],對魚肉制品[17]、香腸及發(fā)酵豆制品[18]的研究均表明,腐胺、尸胺在生物胺中占有相當比例。腐胺來自于精氨酸的脫羧和轉氨基反應及鳥氨酸的脫羧反應,而尸胺主要由賴氨酸脫羧生成,研究表明郫縣豆瓣醬制作的主要原料蠶豆和面粉中的精氨酸和賴氨酸含量相對較高[19-20],這可能為發(fā)酵過程中腐胺和尸胺的生成提供了豐富的底物。本實驗室之前的研究發(fā)現(xiàn),芽孢桿菌屬(Bacillus)是郫縣豆瓣醬發(fā)酵中的主導微生物[21];蒯輝等[22]對豆瓣醬的研究也報道了類似的結果。而對韓國豆醬(cheonggukjang)的研究則表明,芽孢桿菌的量與豆醬中的尸胺、腐胺和組胺呈現(xiàn)明顯的正相關[23]。因此,可以推測郫縣豆瓣醬中含量較高的尸胺和腐胺是芽孢桿菌對原料中豐富的精氨酸和賴氨酸作用的結果。此外,在發(fā)酵42個月之后,組胺含量明顯增加,這也可能與芽孢桿菌有關。隨著發(fā)酵時間的延長,豆瓣醬中腐胺和尸胺的含量不斷增長,這說明在郫縣豆瓣醬發(fā)酵過程中產生這些生物胺的微生物持續(xù)活動。發(fā)酵54個月后,尸胺的含量明顯下降,這可能是因為分解尸胺的某些微生物,如枯草芽孢桿菌(Bacillussubtilis)[24]作用的結果。Qi W等[25]發(fā)現(xiàn)在醬油中接種易變圓酵母(Candidaversatilis)和魯氏結接合酵母能夠顯著提高豆瓣醬中酪胺的含量。鑒于接合酵母(Zygosaccharomyces)和假絲酵母(Candida)在豆瓣醬后發(fā)酵階段的重要作用[21,26],酪胺可能來自于酵母菌對原料種酪氨酸的代謝。其余生物胺的含量均相對較低,這可能與原料中生成這些生物胺的氨基酸含量較低有關。
將不同樣品中的八種生物胺的含量加和,得到各樣品中的總生物胺含量,結果見圖3所示。由圖3可知,發(fā)酵時長從1個月增加到96個月,郫縣豆瓣醬的生物胺含量大幅增加,總生物胺含量從(37.86±6.69) mg/kg增加到(155.09±8.53) mg/kg,增長達4倍有余。郫縣豆瓣醬中的總生物胺含量在1~54個月中增長較快,而54個月后則趨于穩(wěn)定。目前,除組胺外,相關標準法規(guī)中尚沒有對食品中的生物胺含量做出限制[1]。據(jù)估計,食品中的生物胺含量達到1000 mg/kg時,會對人體健康產生危害[1],食品中的色胺含量達到100~800 mg/kg,β-苯乙胺含量在30 mg/kg時也會引起人的毒性反應[7]。對比以上數(shù)據(jù),不同年份郫縣豆瓣醬的生物胺含量均低于這些標準,就生物胺含量來說,本研究所取的豆瓣醬是相對安全的。
3 結論
本研究利用高效液相色譜,測定了不同發(fā)酵時長郫縣豆瓣醬中的8種生物胺(色胺、β-苯乙胺、腐胺、尸胺、組胺、酪胺、亞精胺和精胺)含量。所采用的高效液相色譜檢測方法能同時檢測郫縣豆瓣醬中的8種生物胺,色譜分離度較好;8種生物胺檢出限在0.17~0.35 mg/L之間,定量限在0.55~0.92 mg/L之間,各生物胺標品在1.0~60.0 mg/L的濃度范圍內的線性關系良好,且可準確定量;本方法日內7次進樣的相對標準偏差為0.04%~0.56%,加標回收率為73.10%~104.13%,具有較高的精密度和準確度。采用該方法對發(fā)酵時長為1~96月不等的郫縣豆瓣醬中8種生物胺進行檢測,結果表明,郫縣豆瓣醬中的主要生物胺為腐胺、尸胺、酪胺和組胺,隨著發(fā)酵時長的增加,腐胺含量不斷增加,尸胺前期增加較快,但發(fā)酵96個月明顯下降,酪胺和組胺含量在發(fā)酵42個月以后含量有所增加,其他生物胺含量較低且相對穩(wěn)定;郫縣豆瓣醬中的總生物胺含量在發(fā)酵1~96個月內逐漸積累,從(37.86±6.69) mg/kg增加到(155.09±8.53) mg/kg,并在發(fā)酵第54個月達到穩(wěn)定;對比以往的毒理學數(shù)據(jù),本研究樣品中生物胺的含量是相對安全的。郫縣豆瓣醬中生物胺生成與發(fā)酵條件及微生物的關系以及郫縣豆瓣醬生物胺安全性的評價仍有待進一步的研究。

