HSPA13在ARPE19細胞氧化應激中的作用
李夢雯, 呂亞莉, 徐國彤, 呂立夏
(1. 同濟大學醫學院再生醫學系生物化學與分子生物學教研室,上海 200092; 2. 同濟大學附屬第十人民醫院眼科,上海 200072)
年齡相關性黃斑變性(age-related macular degeneration, AMD),也稱老年性黃斑變性,是全世界老年人失明的主要原因之一[1]。視網膜色素上皮(retinal pigment epithelial, RPE)細胞的氧化損傷和慢性炎癥被認為是AMD的發展過程中重要的影響因素[2-3]。應激分子伴侶也稱為HSPA13,是熱休克蛋白家族的一員,由鈣離子誘導[4]。活性氧類(reactive oxygen species, ROS)導致細胞內鈣離子超載,引發細胞凋亡[5-6]。
細胞內鈣離子水平升高誘導HSPA13基因的表達上升,因此,本研究探討HSPA13在氧化應激誘導的人視網膜上皮ARPE19細胞中的表達情況,以及HSPA13的表達水平對氧化應激誘導的ARPE19細胞中相關氧化應激指標和促炎因子的影響;并在干擾HSPA13表達后進行RNA測序,對差異表達的基因進行基因本體(gene ontology, GO)分析及京都基因和基因組數據庫(Kyoto Encyclopedia of Genes and Genomes, KEGG)信號通路分析,為進一步探索HSPA13在AMD中的作用機制提供依據。
1 材料與方法
1.1 材料及試劑
DME/F12培養基購自美國HyClone公司;胎牛血清購自美國Gibco公司;鏈霉素及青霉素、CCK8試劑盒、丙二醛(malondialdehyd,MDA)試劑盒、還原型谷胱甘肽(glutathione,GSH)檢測試劑盒購自碧云天公司;3%H2O2購自美國Sigma公司;anti-HSPA13、anti-β-actin、二抗購自Proteintech公司;TNF-α、IL-8、IL-2和IL-1β ELISA試劑盒購自美國BD公司。
1.2 實驗方法
1.2.1 細胞培養 使用DME/F12基礎培養基,添加10%的胎牛血清和500μL的青霉素鏈霉素雙抗,在37℃、5%CO2的恒溫培養箱中培養人ARPE19細胞。
1.2.2 CCK8法測定細胞活力的改變 實驗前使用細胞培養基配制H2O2處理液,以2×104/mL的密度將ARPE19細胞接種在96孔板中,細胞貼壁后,分別添加含終濃度為10、25、50、100、200、300、400μmol/L H2O2的細胞培養基處理細胞,處理4h。將體積分數為10%的CCK8工作液加入H2O2空白對照組(不含H2O2的細胞培養組)、各濃度H2O2處理組和只含培養基的無細胞對照組中,將細胞培養板置于37℃恒溫培養箱30min。隨后在450nm波長處檢測各孔的光密度值(D450)。每組設6個復孔,實驗重復3次。
1.2.3 實時熒光定量PCR 待200μmol/L H2O2處理4h,TRIzol裂解液收集總RNA,抽提RNA,反轉錄成cDNA,實時熒光定量PCR(quantitative reverse transcription-polymerase chain reaction, qRT-PCR)檢測HSPA13和抗氧化酶[超氧化物歧化酶1(superoxide dismutase 1, SOD1)、谷胱甘肽過氧化物酶1(glutathione peroxidase 1, GPX1)、過氧化氫酶(catalase, CAT)]的表達。各待測物引物序列如下。HSPA13 SOD1上游引物: 5′-TGTGGCCG-ATGTGTCTAT-TG-3′;下游引物: 5′-GCGTTTCC-TGTCTTTGTACTTTC-3′。GPX1上游引物: 5′-GACTACACCCAGATGAACGAG-3′;下游引物: 5′-GGACGT-ACTTGAGGGAATTCAG-3′。CAT上游引物: 5′-CAGATAGCCTTCGACCCAAG-3′;下游引物: 5′-GTAGGGACAGTTCACAGGTATATG-3′。β-actin上游引物: 5′-GAATCCCCGCCTAAGCTGA-3′;下游引物: 5′-AAGTTCGCGCTGGATAGGGCT-AC-3′。數據分析: 3次同樣處理,測得的數據進行統計學分析。以β-actin作為內參基因,使用2-ΔΔCT方法進行數據分析。
1.2.4 Western印跡法檢測HSPA13蛋白含量 200μmol/L H2O2處理4h,使用RIPA裂解液裂解細胞沉淀后,進行BCA定量和蛋白變性。經SDS-PAGE電泳后將蛋白轉到0.45μm的PVDF膜上。5%脫脂牛奶室溫封閉1h,HSPA13一抗4℃孵育過夜,相應種屬的二抗室溫孵育1h,ECL顯影采集蛋白條帶圖。實驗重復3次,使用Image J軟件進行條帶分析,以β-actin作為內參,對條帶的灰度值進行半定量分析。
1.2.5 免疫熒光檢測HSPA13的表達 待200μmol/L H2O2處理4h,經4%多聚甲醛固定、0.1%TritonX-100透膜和3%BSA封閉步驟之后,HSPA13一抗4℃冰箱過夜,二抗室溫孵育1h,DAPI染核封片,使用Nikon激光共聚焦顯微鏡,拍照分析HSPA13蛋白的表達。
1.2.6 質粒轉染 根據LipofectamineTM3000說明書將HSPA13過表達質粒(pEGFP-N2-HSPA13)或siRNA(siHSPA13)轉染到ARPE19細胞中。pEGFP-N2空載體作對照。pEGFP-N2-HSPA13上游引物: 5′-GTGATGCCCAGAGAGATGACGATC-3′;下游引物: 5′-TCAGTTGAAGTTGGTTTTTTGT-AAATG-3′。靶向GATCCCCGGCTGACGTCTTCC-ACGTC的HSPA13的小干擾RNA(siHSPA13)由拓然生物公司合成。質粒轉染48h后,采用經培養液稀釋的200μmol/L H2O2處理4h,進行相關的檢測。
1.2.7 MDA和GSH含量測定及ROS檢測 根據試劑盒說明書,采用比色法檢測ARPE19細胞內MDA、GSH的含量;采用DCF法測定ROS,用激光共聚焦顯微鏡Nikon A1R檢測細胞內的熒光強度。
1.2.8 ELISA檢測促炎因子的分泌 使用200μmol/L H2O2處理過表達或干擾HSPA13的ARPE19細胞4h后,收集細胞培養上清液,分別根據TNF-α、IL-8、IL-2和IL-1β ELISA試劑盒說明書進行測定。
1.2.9 差異表達基因的基因本體與通路分析 將RNA測序得到的有效數據中空載組與HSPA13干擾組進行比較,對差異倍數≥1.5并且P<0.05的基因使用數據庫(DAVID)進行GO富集分析和KEGG分析。
1.3 統計學處理
2 結 果
2.1 不同濃度H2O2處理對ARPE19細胞活力的影響
為探討合適的H2O2處理濃度,使用不同的濃度處理細胞4h,進行細胞活力檢測。CCK8法檢測結果顯示,隨著H2O2處理濃度的上升,細胞活力降低。H2O2空白對照組及10、25、50、100、200、300、400μmol/L H2O2處理組的細胞活力分別為1.002±0.008991、0.9563±0.0427、0.9666±0.02949、0.8157±0.04948、0.7787±0.03957、0.6405±0.05403、0.4475±0.06583和0.2822±0.03536。100、200、300、400μmol/L的H2O2處理組與H2O2空白對照組相比較差異均有統計學意義(P<0.05)。
2.2 氧化應激誘導ARPE19細胞中HSPA13的表達上調
為模擬氧化損傷的自然條件,本研究后續均采用差異有統計學意義的200μmol/L的H2O2處理ARPE19細胞4h建立氧化損傷模型。收集H2O2空白對照組和200μmol/L H2O2處理組的ARPE19細胞,檢測HSPA13的表達變化。Western印跡法結果表明,與H2O2空白對照組相比,200μmol/L H2O2處理組HSPA13蛋白的表達上升,差異具有統計學意義(P=0.0097,P=0.0152)。另外,采用免疫熒光方法在激光共聚焦顯微鏡下觀察HSPA13的表達與定位情況,結果見圖1。

圖1 HSPA13在氧化應激誘導的ARPE19細胞中表達上升Fig.1 The expression of HSPA13 was increased in oxidative stress-induced ARPE19 cells A: HSPA13蛋白的表達水平;B: 細胞免疫熒光(標尺: 50μm);實驗重復3次
2.3 CCK8法檢測HSPA13的表達水平對過氧化氫誘導的細胞活力的影響
ARPE19細胞受到氧化刺激后,HSPA13的表達上調。為了明確HSPA13的表達水平對氧化應激狀態下細胞活力的影響,分別過表達或干擾HSPA13,200μmol/L H2O2處理后,CCK8法檢測細胞活力。CCK8法結果顯示,H2O2空白對照組、200μmol/L H2O2處理組、過表達HSPA13加200μmol/L H2O2處理組和siHSPA13加200μmol/L H2O2處理組的細胞活力分別為1.145±0.0472、0.593±0.0319、0.808±0.0428、0.394±0.0492。因此,這一結果提示HSPA13的表達水平可能在ARPE19的氧化應激中發揮保護作用。
2.4 HSPA13的表達水平對ARPE19細胞內SOD1、GPX1和CAT mRNA的影響
空載體200μmol/L H2O2處理組(Vector+H2O2)的ARPE19細胞中SOD1、GPX1和CAT的mRNA的表達均顯著降低,與空載體對照組(Vector)相比,差異有統計學意義(P<0.05);與空載體200μmol/L H2O2處理組相比,過表達HSPA13加200μmol/L H2O2處理組(HSPA13+H2O2)中SOD1和GPX1的mRNA表達上升,差異有統計學意義(P<0.05),見圖2A~D。相反地,與單獨200μmol/L H2O2處理組相比,siHSPA13加200μmol/L H2O2處理組中SOD1、GPX1和CAT的mRNA表達均降低,且差異有統計學意義(P<0.05),見圖2E~H。
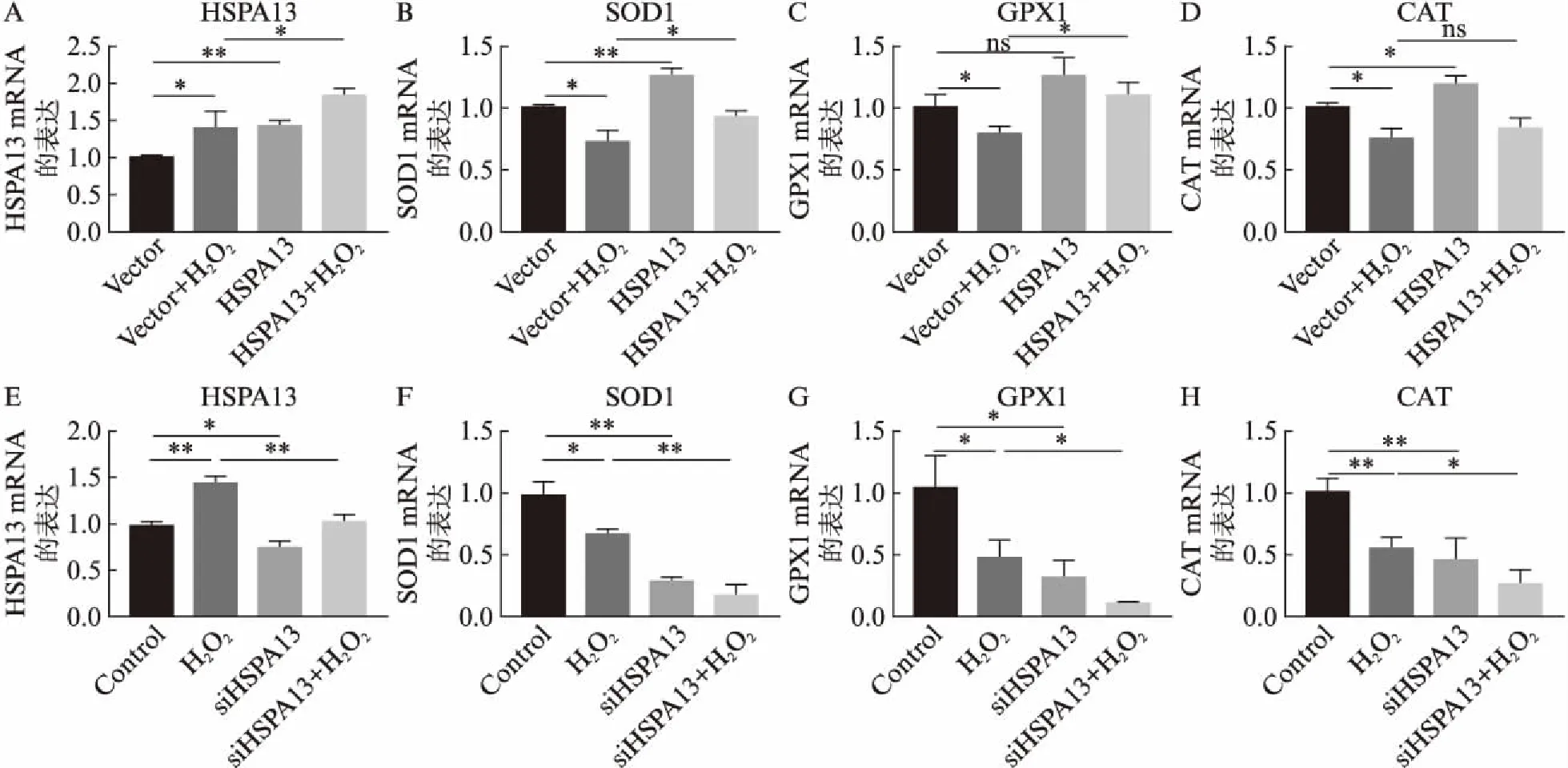
圖2 HSPA13的表達水平對ARPE19細胞內SOD1、GPX1和CAT mRNA的影響Fig.2 Effect of the expression level of HSPA13 on SOD1, GPX1 and CAT mRNA in ARPE19 cells A~D: HSPA13過表達;E~F: HSPA13被干擾;實驗重復3次;*P<0.05;**P<0.01
2.5 HSPA13的表達水平對ARPE19細胞內MDA、GSH含量的影響
200μmol/L H2O2處理4h后,MDA的含量顯著上升(P<0.05),GSH含量顯著下降(P<0.05);與空載體200μmol/L H2O2處理組相比,HSPA13過表達加200μmol/L H2O2處理4h后,MDA含量降低(P<0.05),GSH含量上升(P<0.05);相反地,與200μmol/L H2O2處理組相比,siHSPA13加200μmol/L H2O2處理組的MDA含量上升,GSH含量下降,且差異有統計學意義(P<0.05),見圖3。

圖3 HSPA13的表達水平對ARPE19細胞內MDA和GSH含量的影響Fig.3 Effect of the expression level of HSPA13 on MDA and GSH content in ARPE19 cells 實驗重復3次;*P<0.05;**P<0.01;***P<0.001
2.6 HSPA13的表達水平對ARPE19細胞內促炎因子分泌的影響
細胞遭受氧化損傷后可引發一系列炎癥反應,其中包括促炎因子的分泌。200μmol/L H2O2處理過表達或干擾HSPA13的ARPE19細胞4h后,收集細胞培養基上清液檢測TNF-α、IL-8、IL-2和IL-1β的含量。與空載體對照組相比,空載體200μmol/L H2O2處理組中TNF-α、IL-8、IL-2和IL-1β的含量均上升,且差異有統計學意義(P<0.05)。與空載體200μmol/L H2O2處理組相比,過表達HSPA13加200μmol/L H2O2處理組中IL-8、IL-2和IL-1β的含量下降,且差異有統計學意義(P<0.05),見圖4A~D。相反地,與200μmol/L H2O2處理組相比,siHSPA13加200μmol/L H2O2處理組中TNFα、IL-8、IL-2和IL-1β的含量均上升,且差異有統計學意義(P<0.05),見圖4E~H。

圖4 HSPA13的表達水平對ARPE19細胞內促炎因子分泌的影響Fig.4 Effect of the expression level of HSPA13 on the secretion of related-proinflammatory cytokines in ARPE19 cellsA~D: HSPA13過表達;E~F: HSPA13被干擾;實驗重復3次;*P<0.05;**P<0.01;***P<0.001;****P<0.0001
2.7 干擾HSPA13的表達增加氧化應激誘導的ARPE19細胞中ROS的水平
ROS常被用作判定細胞水平氧化損傷程度的指標[7]。與H2O2空白對照組相比,200μmol/L H2O2處理組的DCF熒光信號明顯增強;與200μmol/L H2O2處理組相比,siHSPA13加200μmol/L H2O2處理組DCF熒光信號顯著增強,見圖5。結果表明,ARPE19細胞內HSPA13的水平影響氧化應激狀態下細胞內ROS的產生。
2.8 基因芯片檢測兩組之間差異表達的基因
提取空載組和HSPA13干擾組的總RNA進行RNA測序分析,共檢測到18660個基因。其中包括HSPA13基因的表達差異,差異倍數約為1.33。為了獲得精準的基因GO富集分析和KEGG信號通路分析結果,只將RNA測序結果中差異倍數≥1.5且差異表達(P<0.05)的基因使用DAVID進行分析,因此HSPA13沒有被篩選進入后續分析步驟。根據設定的前提條件進行篩選后發現,差異倍數≥1.5且P<0.05的差異表達的基因有318個,其中表達上調的有64個,下調的有254個,對這些差異表達的基因進行GO富集和KEGG分析。
2.9 差異基因的GO功能分析
通過GO分析,可以將差異表達的基因根據功能分為生物過程(biological process)、細胞組分(cellular component)和分子功能(molecular function)3類。表達上調的基因分為細胞外空間、細胞因子活性和光刺激的感覺知覺類,表達下調的基因分為骨骼系統發展、細胞外基質、細胞黏附和腫瘤壞死因子細胞應答類,見圖6。

圖5 干擾HSPA13的表達增加氧化應激誘導的ARPE19細胞中ROS的水平(標尺: 50μm)Fig.5 Knockdown of HSPA13 expression increased oxidative stress-induced levels of ROS in ARPE19 cells(scale: 50μm)

圖6 差異基因的GO富集分析Fig.6 GO enrichment analysis of differentially expressed genes
2.10 差異基因的KEGG信號通路分析
對差異基因進行KEGG分析,結果表明共有8條信號通路與下調基因相關(均P<0.05),見表1。下調基因的KEGG信號通路分析結果顯示多條信號通路發生下調,如ECM-受體相互作用(ECM-receptor interaction)、PI3K-Akt信號通路(PI3K-Akt signaling pathway)、黏著斑(focal adhesion)、TGF-β信號通路(TGF-β signaling pathway)和細胞因子-細胞因子受體相互作用(cytokine-cytokine receptor interaction)。

表1 下調基因的KEGG相關信號通路分析
3 討 論
AMD是發達國家老年人視力喪失的主要原因,但這種復雜疾病的發病機制尚不明確[8]。目前研究證據表明氧化應激和慢性炎癥在年齡相關的RPE細胞損傷中發揮重要作用[9-10]。RPE細胞遭受長期氧化刺激導致DNA損傷,細胞結構發生變化,細胞功能被破壞[11]。細胞遭受氧化損傷可引起細胞內鈣離子內流,細胞內鈣離子濃度升高,導致細胞鈣超載[12-13]。
HSPA13作為熱休克蛋白70家族中重要的一員被克隆并明確定位于人類染色體21q11.1[14]。該基因編碼一個相對分子質量為60000的蛋白,亞細胞定位于內質網,其編碼的蛋白N端含有特殊前導疏水序列,這種特殊的結構導致它與其他熱休克蛋白不同的是HSPA13受鈣離子誘導,對熱刺激無反應[15]。在鱗狀頭頸癌中,在腫瘤細胞中高表達的蛋白BAK1、HSPA13和CCND1表達降低在很大程度上可以抑制腫瘤的發生[16]。此外,HSPA13還與神經退行性疾病如阿爾茲海默癥、癲癇等有關[17-18]。日本科學家發現HSPA13在體外過表達通過調節細胞死亡通路來增強細胞的存活率[19]。目前,HSPA13在AMD中的作用尚未有相關報道。因此,根據HSPA13的特殊性,本研究推測HSPA13可能參與了鈣離子介導的RPE細胞的氧化應激過程。HSPA13是細胞內鈣離子依賴性蛋白,RPE細胞氧化應激狀態下,細胞鈣超載,可上調HSPA13的表達。
本研究結果表明,200μmol/L H2O2處理4h引起ARPE19細胞中HSPA13的表達上升。發現在ARPE19細胞中過表達HSPA13能夠減弱H2O2誘導的促炎因子的釋放并上調抗氧化酶的表達,提高GSH的細胞內含量,保護細胞活力,提示HSPA13可能在AMD的發生發展中有一定的作用。與預期一致,HSPA13被干擾后轉染ARPE19細胞,ROS產生增加,加劇了RPE細胞的氧化損傷。
為了更全面了解HSPA13在ARPE19氧化應激中的作用機制,本研究收集空載體組和HSPA13被干擾組的ARPE19細胞進行RNA測序分析,結果顯示有318個基因有顯著的表達差異。KEGG信號通路分析發現,與空載組相比,HSPA13被干擾組有8條信號通路參與其中。其中包括PI3K-Akt通路、細胞因子相關受體通路、TGFβ信號通路、ECM受體相互作用等。PI3K-Akt信號通路參與多種細胞生存與代謝過程[20-21]。有研究表明,PI3K-Akt通路在氧化應激中發揮重要作用,在AMD體外氧化應激模型中,Akt磷酸化的增強可以保護RPE細胞免受氧化損傷觸發的細胞凋亡和壞死[22]。
KEGG分析表明,HSPA13干擾組中ECM受體相互作用下調。ECM參與細胞的分裂、增殖、代謝以及凋亡等多種細胞生命活動,為細胞存活和代謝的正常進行提供穩定的內環境[23]。之前研究證實,ECM的異常與AMD的形成有關[24-25]。GO分析發現,ECM相關信號通路的基因LAMA4、COL4A1、BMPER、TENM2、COL1A1、MAMDC2、ITGB3、ZNF469和THBS1的表達均降低,這提示HSPA13影響RPE細胞的ECM,參與氧化應激過程中ECM的調節。另外,KEGG分析還可以發現,HSPA13干擾組中細胞因子-細胞因子受體相互作用通路下調,該通路在AMD模型的炎癥反應研究中發揮重要作用[26]。因此,對于RNA測序信號通路結果的進一步驗證是后續的研究方向。
綜上所述,外源性H2O2可以誘導ARPE19細胞中鈣應激蛋白HSPA13的表達上升,過表達HSPA13能夠減少促炎因子的釋放,提高抗氧化酶的表達和細胞內GSH水平,提示HSPA13對ARPE19細胞氧化應激的保護作用。本研究從分子水平解析AMD的發病機制,為尋找AMD新的治療靶點提供有益的線索。

