外源性一氧化碳釋放分子2對膿毒癥大鼠T淋巴細胞凋亡的影響
李佳紅 費東生 于 未 楊松林 趙鳴雁
膿毒癥的主要病理生理學變化是嚴重全身感染引起的炎性反應過度激活、免疫功能紊亂及凝血機能障礙[1]。免疫功能紊亂尤其是免疫功能抑制被認為是膿毒癥發生、發展的重要環節,而且貫穿膿毒癥始終。其中免疫細胞凋亡是膿毒癥免疫抑制狀態發生、發展的重要機制之一,并直接影響膿毒癥患者的預后和轉歸[2]。膿毒癥可顯著降低B細胞、CD4+T細胞和濾泡樹突狀細胞的水平,分別導致抗體生成減少、巨噬細胞活化降低和抗原遞呈下降。淋巴細胞的消失尤為重要,因為它們的缺失使機體發生感染概率增加。基于對炎性反應和膿毒癥認識的變化,免疫調理治療看來是解決膿毒癥的根本途徑,但無論賴以指導治療的免疫學指標還是糾正免疫紊亂的手段目前都還處在起步階段,而且十分有限[3]。Hotchkiss等研究發現,膿毒癥能夠加速淋巴細胞凋亡并耗竭脾T淋巴細胞,免疫細胞凋亡與凋亡蛋白(Fas、caspase-9等)的表達有關,通過表達膿毒癥大鼠模型凋亡蛋白基因,可以減少膿毒癥誘導的淋巴細胞凋亡。由此,調控免疫細胞的凋亡過程有可能改善膿毒癥模型的免疫抑制狀態,改善預后[4]。
CO作為第二種氣體信號分子,在膿毒癥時能介導產生一系列細胞保護作用,在抗炎、抗凋亡、抗氧化過程中扮演著重要的角色。很多研究都證明CO的吸入提高了由盲腸結扎和穿刺(CLP)、內毒素(LPS)、糞腸球菌或大腸桿菌等誘導的敗血癥嚙齒動物的存活率。在膿毒癥小鼠中CO的供體化合物即外源性CO釋放分子可以發揮類似的保護作用。值得注意的是,CO對膿毒癥的抑制作用不僅限于嚙齒動物模型,也包括在大型動物模型中,例如豬和非人類的LPS或肺炎鏈球菌的靈長類動物模型[5]。且現有研究證明HO-1和外源性CO對膿毒癥中細胞凋亡有影響和作用,通過觀察HO-1/CO系統干預MAPKS信號轉導通路活化對免疫細胞凋亡的影響,從基因-蛋白-功能方面揭示HO-1/CO系統對于膿毒癥免疫抑制調節機制,對于膿毒癥治療的探索及預防MODS的發生將具有重要的理論意義和臨床應用前景[6]。CO通過調控絲裂原活化蛋白激酶(MAPKs)通路參與細胞生長、增殖、分化及凋亡等重要的生物學過程,其中ERK信號通路是經典的MAPKs途徑,主要調控細胞增殖與分化;而JNK和p38通路在多種應激因子作用下均可激活,發揮介導細胞炎癥、凋亡等多種生物效應,p38通路下游的凋亡蛋白(Fas、caspase-9、caspase-3等)參與淋巴細胞的凋亡,這為本研究提供了一定的理論基礎[7]。本研究將應用LPS處理大鼠建立體內膿毒癥炎性反應模型,觀察外源性CO對LPS處理后各膿毒癥大鼠模型T淋巴細胞凋亡與凋亡蛋白(Fas、caspase-9、caspase-3)的表達的關系,觀察外源性一氧化碳對膿毒癥模型凋亡蛋白(Fas、caspase-9、caspase-3)的表達的影響,進而探討外源性一氧化碳釋放分子2對膿毒癥模型T淋巴細胞凋亡的影響。
材料與方法
1.實驗動物:雄性Wistar大鼠28只,體重250~300g,由筆者醫院動物實驗中心提供,人工控制條件下進行飼養,室內溫度為22℃,每日光照時間為12h(7:00~19:00),取食和飲水無限制。
2.藥物、試劑與儀器:脂多糖(LPS)購自美國Sigma公司;CORM-2購自美國BD公司;APC Mouse Anti-Rat CD4、PE Mouse Anti-Rat CD8a Clone OX-8、 FIFC Mouse Anti-Rat CD3 Clone G4.18購自美國BD公司;Fas、caspase-3、caspase-9及小鼠β-actin單克隆抗體購自英國Abcam公司;辣根過氧化酶標記的山羊抗兔、小鼠抗小鼠抗體均購自北京中杉金橋生物技術有限公司;流式細胞儀來自筆者醫院中心實驗室。
3.藥物的配置:CORM-2的制備,用500μl DMSO溶解 10.25mg CORM-2配制成 CORM-DMSO溶液,然后將其溶解于等體積等滲生理鹽水中[8]。iCORM-2(無活性的CORM-2)溶液的制備,用DMSO溶劑充分溶解CORM-2,室溫下放置2天,再通入氮氣去除溶液內殘余的CO。LPS溶液的制備,將10mg LPS粉末溶于10ml生理鹽水,溶液濃度10mg/ml。
4.動物分組、模型制備及給藥:采用數字表法將大鼠隨機分為4組,即陰性對照組、LPS組、LPS+CORM-2組、LPS+iCORM-2組。腹腔注射戊巴比妥鈉(50mg/kg)麻醉大鼠,經腹腔注射LPS建立膿毒癥模型,經腹腔給予配制的CORM-2與iCORM-2 6mg/kg建立LPS+CORM-2與LPS+iCORM-2模型,陰性對照組:不進行任何處理;LPS組:經大鼠腹腔注射LPS,劑量為10mg/kg;LPS+CORM-2組經腹腔注射LPS,劑量為10mg/kg,待0.5h后經腹腔注射給予配置的CORM-2 6mg/kg;LPS+iCORM-2組經腹腔注射LPS,劑量為10mg/kg,待0.5h后經腹腔給予配制的iCORM-2 6mg/kg,經相應試劑預處理24h后終止實驗,留取所需實驗樣本。
5.實驗過程:給予相應試劑預處理,在24h后,收集血液、脾臟、小腸等標本,觀察大鼠小腸光鏡下結果進行模型驗證;將抗凝血進行流式細胞檢測;將部分脾臟4%多聚甲醛固定,石蠟包埋切片,HE染色,觀察病理改變;其余脾臟組織置于-80℃冰箱備用做Western blot法檢測蛋白的表達。
6.觀察和檢測指標:(1)觀察大鼠小腸光鏡下結果進行模型驗證。(2)外周血T細胞亞群檢測:在流式細胞儀上用射門法觀察和計數CD4與CD8標記陽性T細胞數,計算CD4/CD8陽性細胞比值(CD4+/CD8+),從大鼠的血標本 100μl抗凝血,分別加入1μg熒光標記的單克隆抗體 CD4-APC/CD8-PE/CD3-FIFC混勻,室溫避光孵育15~30min,加入2ml 1×RBC Lysis Buffer,搖勻后室溫避光孵育15min,300×g離心5min,棄上清,PBS 500μl懸浮,送筆者醫院中心實驗室用流式細胞儀檢測CD3+CD4+、CD3+CD8+的絕對值及CD4+/CD8+的比值。(3)取脾臟病理學觀察,取脾臟組織 10%甲醛固定,常規石蠟切片,HE染色,普通光鏡下觀察脾臟組織的情況。(4)Western blot法檢測Fas、caspase-3、caspase-9蛋白的表達:BCA法測蛋白濃度,取25μg蛋白進行不連續聚丙烯酰胺凝膠電泳(SDS-PAGE),電轉移至聚偏二氟乙烯膜(PVDF),用含5%脫脂奶粉的TBST室溫封閉1h,加入相應一抗,4℃孵育過夜,洗膜,加入相應的辣根過氧化酶標記的二抗,室溫孵育1h,ECL化學發光法檢測,以β肌動蛋白作為內參。
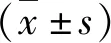
結 果
1.模型的驗證:與陰性對照組大鼠比較,LPS組大鼠小腸明顯充血水腫伴大量炎性細胞浸潤,24h后膿毒癥模型造模成功(圖1、圖2)。
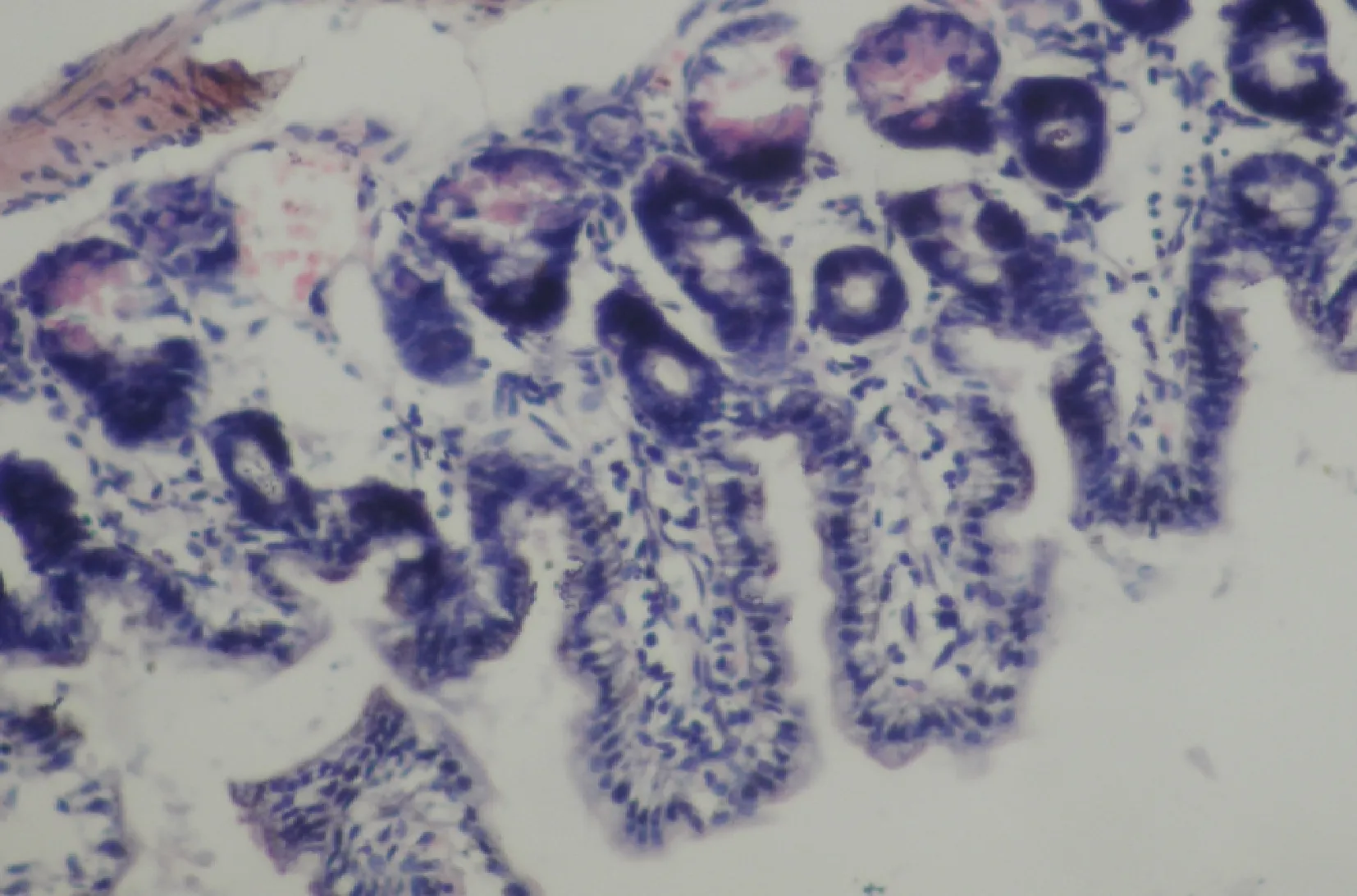
圖1 陰性對照組大鼠24h后小腸光鏡下病理形態結果小腸絨毛排列有序,尖聳致密,腸腔內極少量炎性滲出以及中性粒細胞浸潤,形態正常(HE染色,×200)
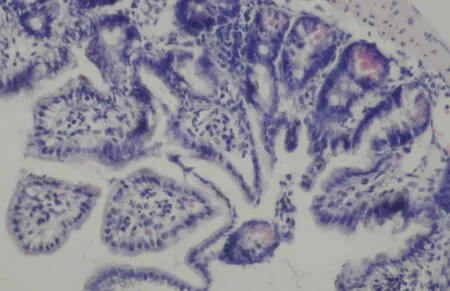
圖2 LPS組大鼠24h后小腸光鏡下病理形態結果小腸絨毛變短,排列基本整齊,但充血、水腫明顯,可見炎性細胞浸潤,管腔內微血栓形成(HE染色,×200)
2.膿毒癥患者T淋巴細胞亞群變化:分析膿毒癥患者 T 淋巴細胞各亞群構成比的變化,與陰性對照組比較,LPS組CD4+與CD8+T淋巴細胞數明顯減少(P<0.05);與陰性對照組比較,LPS組CD4+/CD8+比值明顯減少,差異有統計學意義(P<0.05)。與LPS組比較,LPS+CORM-2組CD4+與CD8+T淋巴細胞數明顯增加(P<0.05);與LPS組比較,LPS+CORM-2組CD4+/CD8+比值明顯增加,差異有統計學意義(P<0.05);與LPS組比較,LPS+iCORM-2組CD4+與CD8+T淋巴細胞數比較差異無統計學意義;與LPS組比較,LPS+iCORM-2組CD4+/CD8+比值比較差異無統計學意義(表1),流式細胞儀檢測結果(圖3)。
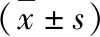
表1 膿毒癥患者 T 淋巴細胞亞群構成比的變化
與陰性對照組比較,*P<0.05;與LPS組比較,#P<0.05

圖3 流式細胞儀檢測膿毒癥大鼠陰性對照組、LPS組、LPS+CORM-2組、LPS+iCORM-2組CD4+T淋巴細胞、CD8+T淋巴細胞凋亡及兩者的比值
3.病理形態學觀察:陰性對照組大鼠脾臟紅、白髓結構清晰,小梁結構明顯,白髓內含有大量淋巴小結;LPS組與LPS+iCORM-2組脾臟紅、白髓分界尚清,脾白髓淋巴細胞減少,脾小結體積變小;LPS+CORM-2組較LPS組脾索增寬,其內淋巴細胞數量增多,同時淋巴結淋巴濾泡生發中心增大(圖4)。與陰性對照組比較,LPS組T淋巴細胞明顯減少;與LPS組比較,LPS+CORM-2組T淋巴細胞明顯增加,陰性對照組與LPS+iCORM-2組比較,T淋巴細胞數比較差異無統計學意義(圖5)。

圖4 各組大鼠HE染色脾臟組織病理切片A.陰性對照組(×40);B.LPS組(×200);C.LPS+CORM-2組(×200);D.LPS+iCORM-2組(×200)
4.外源性一氧化碳2對膿毒癥模型凋亡蛋白Fas/Fasl、caspase-9、caspase-3的表達的影響。與陰性對照組比較,LPS組與LPS+iCORM-2組的Fas、caspase-9和caspase-3的表達明顯增加,差異有統計學意義(P<0.05);與LPS組比較,LPS+CORM-2組Fas、caspase-9和caspase-3的表達明顯減少,差異有統計學意義(P<0.05);與LPS組比較,LPS+iCORM-2組的Fas、caspase-9和caspase-3的表達差異無統計學意義(圖6)。

圖5 各組T淋巴細胞相對百分數與陰性對照組比較,LPS組T淋巴細胞明顯減少,與LPS組比較,LPS+CORM-2組T淋巴細胞明顯增加
討 論
免疫功能紊亂尤其是免疫功能抑制被認為是膿毒癥發生、發展的重要環節,而且貫穿膿毒癥始終。Hotchkiss等[10]研究顯示膿毒癥患者脾臟大量的淋巴細胞凋亡,且在最近的膿毒癥動物模型以及死于膿毒癥和多器官衰竭的患者中,已經證明了膿毒癥通過細胞凋亡誘導淋巴細胞大量丟失[9~12]。在目前的研究中,膿毒癥中淋巴細胞的凋亡可能是削弱免疫系統的原因,進而導致了炎性反應爆發[11,13]。膿毒癥主要誘導各種淋巴細胞亞群,即B細胞、CD4T細胞、CD8T細胞,研究了脾臟CD4T細胞、CD8T細胞的凋亡情況[14]。本研究發現,膿毒癥大鼠24h后與陰性對照組比較,脾臟淋巴細胞明顯減少,即出現了免疫抑制,導致炎癥的爆發;經外源性一氧化碳釋放分子2干預后,膿毒癥大鼠脾臟淋巴細胞明顯增加,外源性一氧化碳釋放因子2可削弱免疫抑制作用,進而發揮抗炎作用。
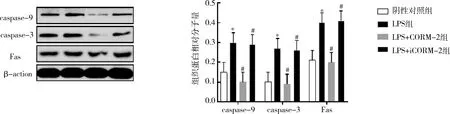
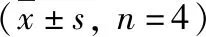
圖6 Western blot法檢測膿毒癥大鼠各凋亡蛋白的表達與陰性對照組比較,*P<0.05;與LPS組比較,#P<0.05
HO體系是內源性CO產生的主要體系。HO-1被誘導后其表達增加的幅度可高達100倍,具有抗氧、抗炎、抑制血小板凝集、細胞保護、調節血管張力等重要作用,在維持組織和細胞功能以及內環境的穩定上有著廣泛的生理作用[15]。有研究提示通過CORM釋放的外源性CO能夠緩解內毒素型和多重感染型膿毒癥的急性炎癥。相關研究使用LPS或者盲腸結扎穿孔模型(CLP),CORMs輸注能夠減少這些類型膿毒癥模型的病死率。輸注CORM-2能夠增加野生小鼠的噬菌作用,在CLP后24h輸注能在Hmox1-/-小鼠膿毒癥模型中起到保護作用[16]。CO亦可減少促凋亡蛋白p53表達和線粒體釋放細胞色素C抑制凋亡,故CO可作為凋亡抑制劑。CO通過調控JNK和p38通路發揮介導細胞炎癥、凋亡等多種生物效應,進而再通過Fas/Fasl途徑調控淋巴細胞的凋亡[17,18]。因而了解細胞凋亡的確切途徑將有助于發現治療膿毒癥的新療法,細胞凋亡的起始有兩個主要途徑,分別Fas/Fas配體介導的caspase-8通路和caspase-9通路,caspase-8或caspase-9隨后激活caspase-3,經共同途徑最終將導致淋巴細胞的凋亡[13,18]。Fas(CD95)/Fas配體(CD95L)系統是調節細胞凋亡的一個關鍵。
Fas通過其配體FasL的結合可以誘導caspase-9激活并導致下游激活半胱天冬酶隨后切割關鍵調節蛋白,調節caspase-3等導致淋巴細胞的凋亡[14,19]。本研究經此通路發現在膿毒癥大鼠組(Fas、caspase-9、caspase-3)凋亡蛋白明顯增加,加速了T淋巴細胞的凋亡,免疫反應受抑制,在經外源性一氧化碳釋放分子2干預后,凋亡蛋白(Fas、caspase-9、caspase-3)表達明顯減少,T淋巴細胞凋亡減少,增強了免疫反應,進而發揮其抗炎作用。
綜上所述,膿毒癥大鼠在受到CORM-2干預后,引起凋亡蛋白(Fas、caspase-9、caspase-3)表達的明顯減少,說明外源性一氧化碳釋放分子2能夠在膿毒癥模型中抑制凋亡蛋白的表達,且在CORM-2干預組的膿毒癥大鼠T淋巴細胞較膿毒癥組明顯增加,即通過Fas/Fasl配體調控下游的(caspase-9、caspase-3)抑制T淋巴細胞的凋亡,外源性一氧化碳釋放分子2通過抑制凋亡蛋白的增加而有效的削弱了膿毒癥對T淋巴細胞的凋亡效應。由此可以說明外源性一氧化碳釋放分子2通過抑制凋亡蛋白的表達減少T淋巴細胞的凋亡。
此外,本研究的創新點為闡述了外源性一氧化碳對膿毒癥模型的免疫系統方面的作用,證實了外源性CO通過抑制凋亡蛋白的表達減少T淋巴細胞的凋亡,這也為外源性CO的抗凋亡作用提供了新的理論基礎,外源性CO誘導的抗凋亡作用可能涉及其他的信號轉導通路(其上游P38通路等),本研究仍有不足,需要在今后開展的研究中進一步證實。

