應用高通量測序研究三文魚片冷藏過程中的菌相變化
房 杰,孟永宏,張 英,尤毅娜,郭玉蓉
(陜西師范大學 食品工程與營養科學學院,陜西 西安 710119)
關鍵字:高通量測序;三文魚片;菌相分析;優勢菌
目前,食源性疾病和食物中毒是食品行業的兩個主要問題,威脅著消費者的身體健康和食品工業的發展[1]。許多類型的微生物都可以感染食物,從而增加食物中毒和食源性疾病的風險[2]。即食食品由于在食用前不進行加熱,導致其被致病菌感染的概率大大增加。近年來,隨著經濟水平的提高,人們對海產品的消費不斷增加,三文魚以其鮮美的肉質、獨特的口味和豐富的營養深受消費者的青睞。
由于三文魚肉質細膩、口感爽滑、色澤鮮艷,主要以生食為主。此外,目前中國市場上的三文魚多為挪威三文魚,在挪威養殖捕撈、冷鏈運輸后以冰藏方式銷售[3]。冰藏溫度并不足以完全抑制有害微生物的生長繁殖,生食冰鮮三文魚的質量狀況受到廣泛關注。魚的腐敗是一個非常復雜的過程,涉及物理、化學及微生物三個方面[4],其中微生物是導致其腐敗變質的主要原因[5]。因此,對三文魚的菌相進行分析,探明其優勢菌,對提高其防腐保鮮效果,降低食物中毒及食源性疾病發生的風險至關重要。但是,目前對三文魚的菌相分析報道較少,且主要是通過傳統培養、分離和鑒定的方法來進行研究[6]。然而傳統的方法不能真正反映菌群多樣性[7],難以對微生物的變化進行實時分析。此外,研究人員推測在自然界中有85%~90%的微生物目前還無法培養[8],大大限制了傳統方法研究細菌群落的能力。變性梯度凝膠電泳(DGGE)雖屬常規的分子生物學方法,但因操作復雜、成本高、DNA分離及測序的局限性等影響因素無法達到深入分析微生物多樣性的目的[9]。2005 年,Margulies等在《Nature》上報道了一種快速、簡單、成本低的測序方法—高通量測序技術(High throughput sequencing),在學術界引起了很大的反響。該方法測序信息豐富、速度快,僅100多天就可以完成對人類基因組的測序[10]。目前,許多科學家都在使用這種技術,是目前公認的分析細菌群落結構、確定優勢菌的工具,已廣泛應用于土壤[11-13]、水[14]、牛瘤胃[15]、腸道[16-17]等細菌群落的分析。雖然該技術已具有廣泛的應用背景,但其在食品領域的應用較少。
作者以三文魚片為研究對象,采用高通量測序技術,研究了其在冷藏過程中的群落多樣性、菌相構成及菌相變化規律,并確定了優勢腐敗菌。
1 材料與方法
1.1 主要儀器、設備及試劑
高速離心機 (1-14型):Sigma公司;PCR儀:BIO-RAD公司;電泳儀(DYY-6C型):北京市六一儀器廠;培清JS-680B全自動凝膠成像分析儀(JS-680B型):上海培清科技有限公司。
Ezup柱式土壤基因組DNA抽提試劑盒:上海生工生物有限公司;Qubit2.0 DNA檢測試劑盒:Life;SanPrep柱式DNA膠回收試劑盒:上海生工生物有限公司;引物合成及高通量測序:上海生工生物有限公司進行。
1.2 試驗方法
1.2.1 三文魚樣品的處理采購于麥德龍超市的新鮮挪威三文魚,將其分割為均勻的三文魚片(3 cm×5 cm×0.3 cm)。放入無菌培養皿內,用聚氯乙烯保鮮膜密封,置于4℃冰箱內保存,分別于第0、1、2、3、4 天取樣進行分析。
1.2.2 細菌總DNA的提取精確稱取25 g肉樣,用無菌剪刀剪碎放入50 mL離心管中,加入25 mL無菌水振蕩混勻。4℃下2 500g離心5 min,轉移上清液至10 mL離心管中,12 000g離心5 min,棄上清液。離心所得沉淀,采用Ezup柱式土壤基因組DNA抽提試劑盒,方法稍作調整。沉淀加入400 μL的SCL緩沖液,振蕩混勻后,置于65℃水浴10 min,然后繼續按照說明書上的操作步驟進行提取。提取的總DNA溶于40 μL TE緩沖液中,Qubit2.0檢測DNA濃度,1 g/dL瓊脂糖凝膠檢測DNA完整性,置于-20℃保存。
1.2.3 PCR反應采用PCR擴增肉樣細菌16S rRNA基因V3-V4可變區。第一輪PCR采用引物341F和 805R 進行擴增,PCR 反應體系 (50 μL):10×PCR 緩沖液 5 μL,dNTP(10 mmol/L)0.5 μL,基因組總 DNA 0.5 μL(20 ng/μL),Bar-PCR 引物 F(50 μmol/L)0.5 μL,引物 R(50 μmol/L) 0.5 μL,Plantium Taq(5 U/μL) 0.5 μL,ddH2O 42.5 μL。 PCR 擴增程序:94℃預變性 3 min;94℃變性30 s,45℃退火 20 s,65 ℃延伸 30 s,5個循環;94 ℃變性 20 s,55℃退火 20 s,72℃延伸 30 s,20個循環;72℃延伸5 min。以該PCR產物為模板進行第二輪PCR反應,第二輪擴增,引入Illumina橋式PCR兼容引物,PCR 體系 (50 μL):10×PCR 緩沖液5 μL,dNTP(10 mmol/L each)0.5 μL, 基因組總 DNA 1 μL(20 ng/μL),引物 F(50 μmol/L)0.5 μL,引 物 R(50 μmol/L)0.5 μL,Plantium Taq(5 U/μL) 0.5 μL,ddH2O 42 μL。 PCR擴增程序:95℃預變性 30 s;95℃變性 15 s,55℃退火 15 s,72℃延伸 30 s,5個循環;最后72℃再延伸5 min。PCR產物進行瓊脂糖電泳檢測后,對DNA進行回收。
1.2.4 DNA回收及高通量測序以PCR產物進行瓊脂糖電泳后,在凝膠圖像系統的紫外燈照射下切割高亮度條帶所在位置的凝膠,稱質量,進行膠回收。切下的凝膠置入1.5 mL EP管稱重,然后加入質量∶體積=1∶1的連接緩沖液,置于56℃ 孵育,直至凝膠完全融化。取上述溶液 700 μL加入帶有Hibind DNA柱子的 2 mL收集管中,室溫10 000g離心 1 min。棄收集管中的液體,再加入300 μL的連接緩沖液,室溫10 000g離心1 min。再次棄收集管中的液體,再加入700 μL的用無水乙醇稀釋的SPW 洗脫緩沖液,室溫10 000g離心 1 min。再次倒掉液體,將收集管空管室溫13 000g離心 2 min,除去柱子中的無水乙醇。將Hibind DNA柱子置入新的1.5 mL離心管中,加入30 μL預熱60℃的洗脫緩沖液,室溫下13 000g離心1 min。所得PCR產物進行凝膠電泳檢測。采用高通量測序技術,在Miseq測序平臺上對回收DNA進行測序。
2 結果與分析
2.1 細菌總DNA的提取及PCR擴增結果
提取三文魚片上的細菌總DNA,經1 g/dL瓊脂糖凝膠電泳檢測,表明在第 0、1、2、3、4 天從三文魚片中均提取出了細菌總DNA且其完整性較好。以細菌總DNA為模板,采用引物341F和805R進行第一輪擴增,再以該PCR產物為模板,引入Illumina橋式PCR兼容引物進行第二輪PCR反應,將擴增產物經2 g/dL瓊脂糖凝膠電泳檢測后,直接對目的片段進行割膠回收,進行瓊脂糖凝膠電泳檢測,結果見圖1,產物約為600多bp,其中包含了約為120 bp的測序接頭和10 bp左右的標簽,表明PCR擴增后獲得約450 bp的特異性擴增片段。各樣品均有較亮的帶,擴增產量大,無副帶或拖帶,說明各樣品總DNA提取成功,PCR擴增條件合適,可用于后續的高通量測序分析。
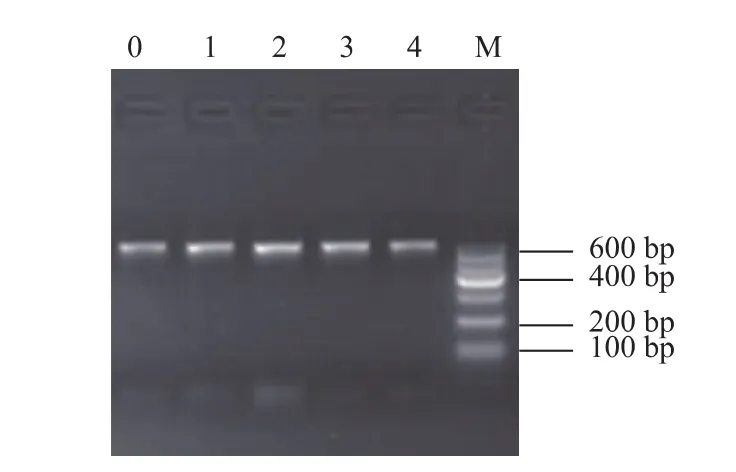
圖1 樣品中細菌16S rDNA的V3-V4可變區的PCR擴增產物電泳圖Fig.1 PCR amplification products of V3-V4regions of sample DNA
2.2 測序基本數據分析
作者通過高通量測序技術檢測三文魚片細菌群落微生物細胞內特定的遺傳物質16S rRNA,這些特定的遺傳物質具有一定的保守性,保守區序列為同類微生物所共有,可變區序列反映了物種之間的序列差異[18-20]。因此,通過對可變區域序列的檢測和對比分析,可以揭示三文魚片的菌群結構及多樣性。此外,作者主要在屬水平對冷藏條件下三文魚片的菌群結構進行分析,使用boot strapping方法估計分類的可信度。當可信度設為80%時,V3、V4區的序列可以正確分配到屬的概率分別為98.1%和95.7%,滿足分析需要。
在PCR擴增過程中會產生嵌合體和靶區域外序列,其中嵌合體是由于不同的模板混雜產生的錯誤序列,并非真實存在,而靶區域外序列則是引物非特異性靶定產生的序列,都會影響后續的序列分析質量。為了得到更高質量及更精準的分析結果,需要進行質量控制,即對有效序列進行去雜。如表1所示,采用高通量測序技術對三文魚片在冷藏過程中的菌相進行分析,樣品測序的總序列數為128531,其中,第 0、1、2、3、4 天五個樣品的測序的序列數分別為 22742、25858、29643、25968及24320。質量控制后樣品的總序列數為116180,各樣品的序列數分別為21594、25356、25873、22796、20561,平均長度分別為 421.7、423.6、424.5、424.2、424.1 bp。質量控制后所有序列長度均為420~480 bp,滿足前期設計引物時對目的片段約為465 bp的要求[21-22]。

表1 各樣品測序基本數據信息Table 1 Basic sequencing data of each sample
2.3 樣品的菌群結構
16S rRNA基因測序用于分析不同貯藏時期三文魚樣品的群落結構,在本研究中,采用高通量測序技術對16S rRNA的V3-V4區進行測序來評價三文魚片的細菌群落結構。測序結果表明,在三文魚片的菌群結構中含有281種菌屬。如圖2所示,在所有的三文魚樣品群落中,其優勢菌屬(>1%)為假單胞菌屬 (Pseudomonas,37.20%)、發光桿菌屬(Photobacterium,36.08%)、 希瓦氏菌(Shewanella,11.32%)、不動桿菌屬(Acinetobacter,5.19%)、黃桿菌屬 (Flavobacterium,2.48%) 和金黃桿菌屬(Chryseobacterium,1.98%)。 第 0天時,樣品的優勢菌屬依次為希瓦氏菌 (27.94%)、發光桿菌(13.74%)、假單胞菌(12.32%)、黃桿菌(12.15%)、金黃桿菌(9.54%)及不動桿菌(4.44%);第 1天時,各優勢菌按其豐度大小依次為發光桿菌(40.75%)、假單胞菌(36.06%)、希瓦氏菌(10.96%)、金黃桿菌(5.44%)及不動桿菌(0.47%);第 2天時,依次為發光桿菌83.44%,假單胞菌9.74%、不動桿菌3.5%和希瓦氏菌3.1%;在第3天,各優勢菌依次為假單胞菌 (64.82%)、發光桿菌 (22.83%)、希瓦氏菌(4.80%)、金黃桿菌(3.83%)及不動桿菌(2.97%);在儲藏第4天,細菌群落中假單胞菌所占的豐度最大,為68.66%,其他的依次為希瓦氏菌11.88%、不動桿菌9.69%和發光桿菌8.88%。結果表明,隨著儲藏時間的延長,三文魚片樣品的細菌群落及優勢菌的相對豐度不斷地發生變化,但其主要優勢菌的菌屬種類保持不變。同時,在儲藏后期,假單胞菌屬的相對豐度達到最大,成為最優勢菌屬。水產品在儲藏過程中其菌相不斷變化,其原因可能是由于水產品上的微生物在不同的儲藏條件下,其忍耐力不同,經過一定的適應、生長過程后,最終成為該條件下的優勢菌[23]。三文魚片在冷藏過程中,隨著時間的延長,pH、水分、脂肪氧化程度等條件發生改變,導致在不同儲藏時間其優勢菌豐度的不同。
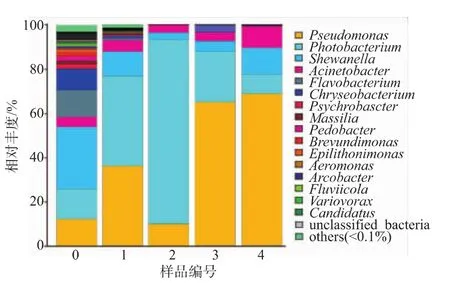
圖2 三文魚樣品中優勢菌屬的相對豐度分布圖Fig.2 Relative abundances of dominant bacterial genus in all salmon samples
2.4 樣品多樣性分析
選取Chao1指數、ACE指數、香農指數(Shannon Index)及Simpson指數初步評價樣品的菌群豐度及多樣性。Chao1指數及ACE指數常用于計算樣品的菌群豐度,估計群落中含OTU數目。Shannon指數及Simpson指數用于估算樣品中微生物的多樣性,Shannon指數越大,群落多樣性越高,Simpson指數越大,群落多樣性越低。在97%的序列相似度下,從5個三文魚樣品中共鑒定出17 382個OTU,第 0、1、2、3、4 天時,樣品 OTU 數目分別為3 322、4 053、3 259、3 412 及 3 336 個。
如表2所示,在第0天時,樣品的Chao 1指數及ACE指數最大,表明此時三文魚片上的細菌群落的OUT數目最多,菌群豐度最大。同時,其Shannon指數數值最大,而Simpson指數數值最小,表明在第0天時,三文魚片的細菌群落的多樣性最高。此外,Simpson指數在第2天時最大,表明第2天時樣品的群落多樣性最低。結合圖2可知,可能是由于在第2天時,發光桿菌大量繁殖,其相對豐度已達到83.44%,抑制了其他微生物的生長,導致細菌群落多樣性降低。此外,從各樣品多樣性指標可以看出,三文魚片在冷藏過程中,其細菌群落的OTU數目及多樣性均不斷變化。
2.5 不同時間的三文魚樣品上的菌群結構的比較
作者采用高通量測序技術對三文魚片在冷藏過程中第 0、1、2、3、4天的細菌群落進行深度分析,將所測得的序列按其序列間的距離進行聚類,在97%的相似度下分為操作分類單元 (OTU)。采用VENN圖統計樣本中共有的和獨有的OTU數目,直觀地展現出樣品之間的異同。
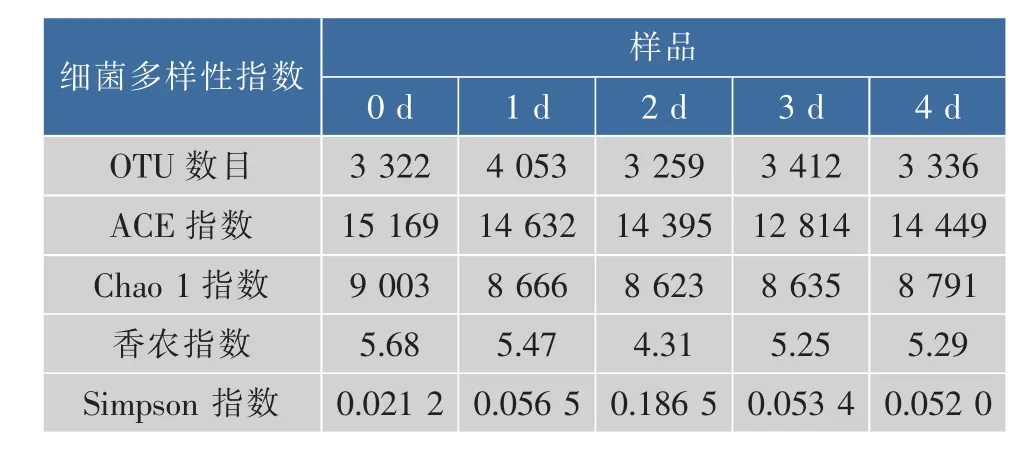
表2 三文魚樣品細菌多樣性指數Table 2 Bacterial richness indices of salmon samples
在97%的序列相似性條件下,各樣品的OTU數目共計17 382,每個樣品平均含有3 476個OTU。 在第 0、1、2、3、4 天五個樣品含有 502 個共有OTU,第0天與第1天、第1天與第2天、第2天與第3天以及第3天與第4天的共有OTU數目分別為 1 357、1 409、1 178 及 1 260,見圖 3。 同時,第 0、1、2、3、4天五個樣品的獨有 OTU數目分別為1 644、1 498、1 478、1 271 及 1 396。 結果表明,三文魚片在冷藏過程中,在第 0、1、2、3、4 天五個樣品既有共有OTU也有各自獨有的OTU,其細菌群落快速變化。結合前面的細菌群落豐度圖,可以看出,盡管三文魚片在冷藏過程中其菌群結構變化很大,但其主要優勢菌屬基本相同。
3 結 語
本研究首次應用高通量測序技術研究了三文魚片在冷藏過程中的優勢菌及菌相變化。結果表明,高通量測序所得序列中,相似度在97%以上且其豐度大于0.1%的有16個菌屬,其中豐度大于1%的有6個菌屬,分別為假單胞菌屬(Pseudomonas)、發光桿菌屬 (Photobacterium)、 希瓦氏菌(Shewanella)、不動桿菌屬(Acinetobacter)、黃桿菌屬 (Flavobacterium) 和 金 黃 桿 菌 屬(Chryseobacterium)。 在第 0 天時,Chao 1 指數及ACE指數表明,樣品細菌群落的豐度最高;多樣性指數表明,此時其微生物多樣性最高。隨著儲藏時間的延長,樣品的多樣性逐漸降低,且假單胞菌的豐度逐漸增大。而第2天時,由于發光桿菌大量繁殖,其相對豐度已達到83.44%,抑制了其他微生物的生長,導致其微生物多樣性減少,假單胞菌的豐度降低。在第3、4天時,樣品細菌群落中發光桿菌的相對豐度減少,假單胞菌屬的相對豐度最大;在第4天時已達到68.66%,其優勢性最強。高通量測序結果表明,三文魚片在儲藏過程中其菌相不斷變化,但其主要的優勢菌屬保持不變。此外,在儲藏后期(第4天),假單胞菌屬成為三文魚片最主要的優勢菌。
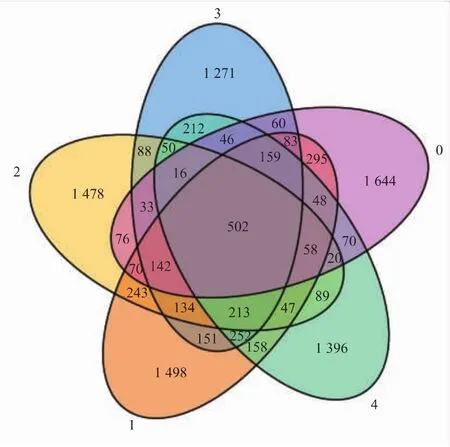
圖3 三文魚樣品維度圖Fig.3 Venn diagram of all salmon samples

