玉米赤霉烯酮水解酶耐熱性的分子改造
許中霞,劉桂智,劉衛東, 郭瑞庭,李華鐘*, 鄭迎迎
(1.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122;2.中國科學院 天津工業生物技術研究所,天津300308)
玉米赤霉烯酮(zearalenone,ZEN)是一類由鐮刀菌屬真菌產生的類雌激素毒素,是目前全球污染最嚴重的三種霉菌毒素之一。ZEN主要存在于玉米、小麥、大麥和黍等農作物及其制品中,能導致攝入者出現早熟、生殖周期紊亂等雌激素紊亂癥,給種植業和養殖業帶來巨大損失[1-3]。ZEN還具有強致癌性,能夠引起乳腺癌、食管癌等疾病[4-5]。為減輕霉菌毒素造成的飼料業和畜牧業的損失,人們陸續開發出多種物理、化學和生物學的方法來降解或吸附飼料中的霉菌毒素。化學法和物理法脫毒通常缺乏選擇性,造成飼料中其它營養成分的破壞和流失。而生物酶法脫毒因其高選擇性、脫毒徹底、操作簡易,受到廣泛關注。
Naoko Takahashi-Ando等[6]首次從粉紅粘帚菌中分離出了一種可降解玉米赤霉烯酮的內酯水解酶ZHD101。ZHD101是目前研究最為廣泛的玉米赤霉烯酮降解酶,其在大腸桿菌和釀酒酵母中的表達產物可以高效的降解ZEN[7],另外,zhd101轉基因水稻和轉基因玉米的種子也可以有效降解ZEN[8-9],表明ZHD101具備良好的降解玉米赤霉烯酮的能力和巨大的應用前景。Takahashi-Ando等[10]通過對ZHD101的酶學性質表征,發現ZHD101的熱穩定性較差,在50℃下迅速失活。較低的熱穩定性使其無法滿足飼料工業中制粒工藝的溫度需求,為促進ZHD101在飼料工業中的應用,需要通過分子改造等手段提高其熱穩定性。
在結構中引入二硫鍵是提高酶的熱穩定性的常用手段[11-14],二硫鍵通過降低蛋白解折疊狀態的主鏈熵值和降低解折疊速度來穩定蛋白結構[15-16]。溫度因子(temperature factor,B factor)是表征氨基酸殘基擺動度的重要結構參數,溫度因子越高,氨基酸所在部位的構象就越不穩定,相應的蛋白質熱穩定性就越差。在溫度因子高的蛋白質結構部位處引入二硫鍵,可以有效降低該部位的擺動度,從而提高蛋白質的熱穩定性。
我們在前期研究中曾解析出ZHD101與底物ZEN的復合物分子結構[17]。在此基礎上,作者進行基于結構的理性設計和分子改造,在蛋白質結構中溫度因子較高的部位引入二硫鍵以提高ZHD101的熱穩定性。我們選擇了7對殘基進行半胱氨酸突變以形成潛在的二硫鍵,進而構建四突變考察對熱穩定性的影響。最后,對熱穩定性提高的突變體進行分析,分析二硫鍵形成的可能性和對穩定結構的分子基礎。本研究將對ZHD101在飼料工業的應用打下基礎。
1 材料與方法
1.1 材料
1.1.1 質粒pET-46 EK/LIC-ZHD101:由臺灣大學生物科技研究所劉嚞睿教授課題組構建。
1.1.2 試劑LB培養基:購自碧迪醫療器械(上海)有限公司;Phusion高保真DNA聚合酶:購自Thermo Science公司;Dpn I酶:購自Fermentas公司;咪唑:購自Merck公司;PCR產物純化試劑盒:購自康維世紀生物科技有限公司;其他試劑均為國產分析純。
1.1.3 儀器PCR儀:購自德國Eppendorf公司;AKTA purifier純化系統:購自美國GE公司;高效液相色譜儀:購自安捷倫科技有限公司;Ultimate XB C18 Column:購自月旭科技上海有限公司;BCA試劑盒:購自康維世紀生物科技有限公司。
1.2 方法
1.2.1 突變體構建我們前期工作中解析了ZHD101 的分子結構(PDB ID:3wzm),發現其結構中存在兩處B factor明顯較高的部位。我們在這兩個區域中引入七對半胱氨酸雙突變:A110C/P196C、S136C/R189C、D143C/P181C、S147C/P181C、D199C/A202C、L200C/A231C、R204C/G205C,以形成潛在的二硫鍵,研究其對熱穩定性的影響。所采用的定點突變正向引物見表1。

表1 本研究中使用的引物Table 1 Primers used in the study
定點突變采用QuikChange定點突變試劑盒進行。PCR產物轉化大腸感受態DH5ɑ,挑取單克隆送至華大基因測序。測序突變正確的克隆提取質粒轉大腸表達菌株BL21(DE3)中,進行后續表達實驗。
1.2.2 ZHD101突變體的表達與純化挑取單菌落于5 mL含有100 μg/mL氨芐青霉素(Amp)的小試管中,37℃、220 r/min培養4 h。菌體生長至OD 600值達0.6~0.8時,轉接1%至100 mL的LB培養基,37℃、220 r/min培養6 h。轉接1%至3 L的 LB大瓶,37℃、220 r/min培養4 h,降溫至16℃,加誘導劑IPTG至終濃度1 mmol/L,誘導24 h后離心收集菌體。將誘導表達的菌體用25 mmol/L Tris、150 mmol/L NaCl、20 mmol/L 咪唑、pH 7.5 的緩沖液重懸,經高壓破碎機破碎,離心后的上清液為蛋白粗酶液。將粗酶液分別用Ni-NTA親核層析柱和DEAE Sepharose Fast Flow陰離子交換樹脂進行純化。純化產物透析在 25 mmol/L Tris、150 mmol/L NaCl、pH 7.5的緩沖液中,并用Amicon Ultra-10k濃縮至20 mg/mL貯存。蛋白質濃度用BCA試劑盒測定表征。
1.2.3 ZHD101野生型和突變體的活性與熱穩定性的表征ZHD101活性測定方法由底物減少量來表征。 每個反應體系(210 μL)包含 5 μL 底物(1 mg/mL ZEN)和 5 μL 酶(0.25 mg/mL ZHD101,野生型或突變體),反應緩沖液為150 mmol/L NaCl、25 mmol/L Tris-HCl、pH 7.5。30 ℃反應 10 min之后,加入 50 μL 1 mol/L HCl和 300 μL 甲醇終止反應,產物過濾后取20 μL用于HPLC分析。樣品被60%的乙腈以0.6 mL/min的流速洗脫下來,吸光度檢測波長為254 nm。根據峰面積計算底物的減少量。
野生型蛋白分別在 45、55、65、75、85 ℃下加熱處理1、2、10 min。熱處理過后的蛋白質進行活性測定以表征其熱穩定性。突變體蛋白質在55℃下熱處理2 min后,測殘余活性表征熱穩定性。
2 結果與討論
2.1 ZHD101熱穩定性
將 ZHD101 蛋白質分別經過 45、55、65、75、85℃加熱處理 1、2、10 min,測定殘余酶活性,見圖 1。ZHD101在45℃熱處理1、2 min后,殘余活性仍保持在90%以上;熱處理10 min后,殘余活性至少能保留70%。但是經過55℃熱處理1 min后活性直接下降到30%。65、75、85℃熱處理1 min后,殘余活性直接降到20%以下。說明ZHD101熱穩定性較差,難以耐受飼料生產制粒過程中的溫度要求,需要通過分子改造的方法提高其熱穩定性。
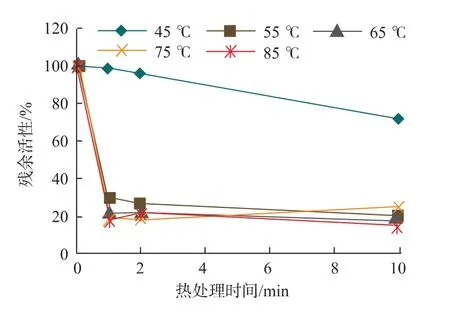
圖1 ZHD101的熱穩定性Fig.1 Thermostability of ZHD101
2.2 突變位點的選擇
通過對ZHD101的分子結構(PDB ID:3wzm)的分析,發現其結構中存在兩處B factor明顯較高的部位(圖2(a))。B factor是表征氨基酸殘基的熱不穩定狀態和自由活動程度的重要參數,B factor高說明該殘基的活動度可能較高,B factor平均值高的區域往往具有更彈性的狀態和較低的熱穩定性[18]。因此,在B factor較高即彈性較高的區域引入二硫鍵應能起到穩定局部結構的作用,從而提高酶的熱穩定性[19-21]。基于上述普適原則,人們已開發相應的程序,根據B factor的高低更好的推測引入二硫鍵的位置以有效提高蛋白質的熱穩定性[22]。在本研究中,我們將ZHD101分子結構在Pymol軟件中根據B factor的大小直觀的顯示,在其中B factor較高的區域中引入七對二硫鍵(圖2(b)),研究其對熱穩定性的影響。
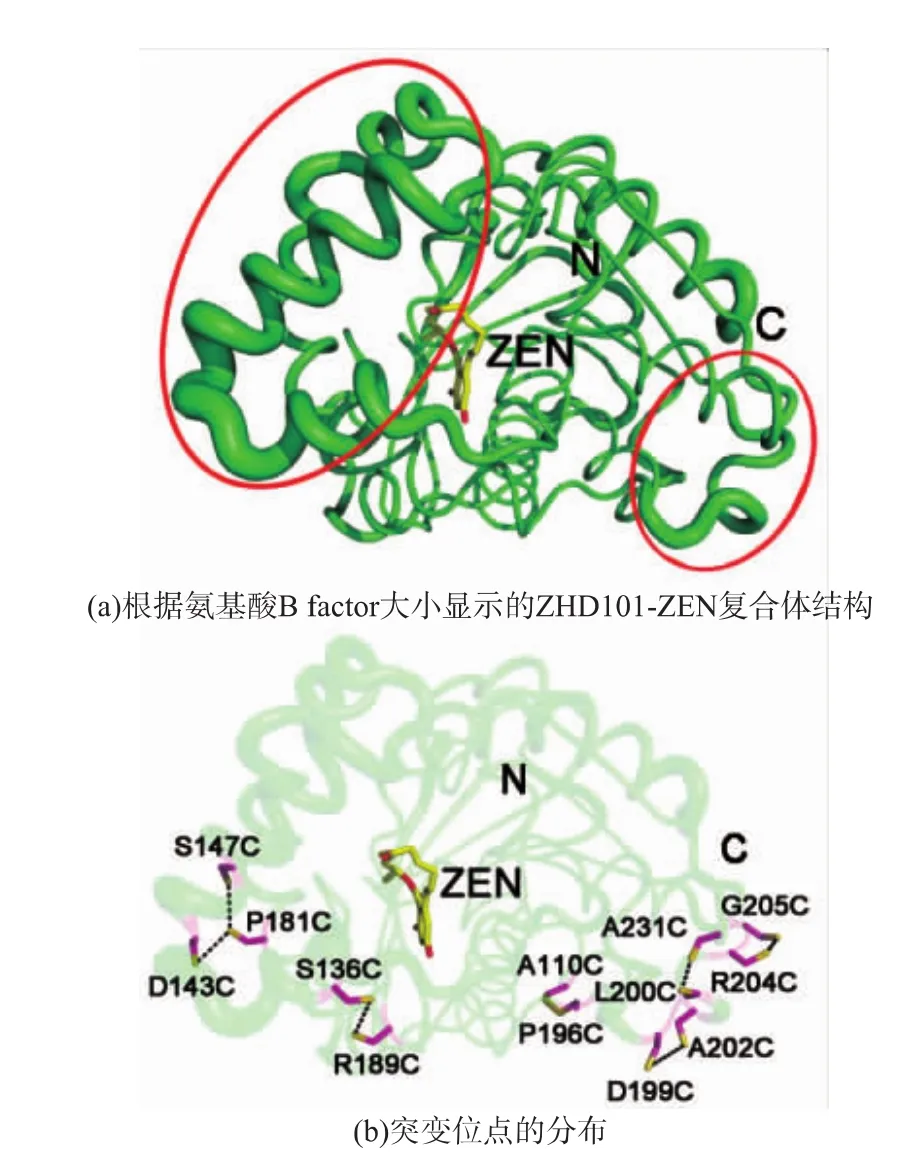
圖2 ZHD101-ZEN復合體的結構和突變位點的選擇Fig.2 Complex structure of ZHD101 with the substrate ZEN and the mutation sites distribution
2.3 ZHD101突變體的表達與純化
含突變質粒pET46-zhd101-mutants的菌液經IPTG誘導后,離心收集上清液,高壓破碎后離心制備總蛋白質,采用SDS-PAGE分析,結果見圖3。IPTG誘導24 h后,在相對分子質量28 700附近處有明顯的誘導條帶,大小與目的片段相符,表明突變體蛋白獲得成功表達。
突變重組酶經過Ni親和層析和DEAE Sepharose Fast Flow陰離子交換樹脂進行兩步純化并透析除鹽后,對純化樣品進行SDS-PAGE分析,結果見圖4。純化的蛋白質在28 700附近處顯示為單一條帶,與目的蛋白質相對分子質量大小相符,經活性測試驗證為目的蛋白質,可用于后續酶學性質分析。

圖3 ZHD101突變體表達的電泳圖Fig.3 Expression of ZHD101 mutants
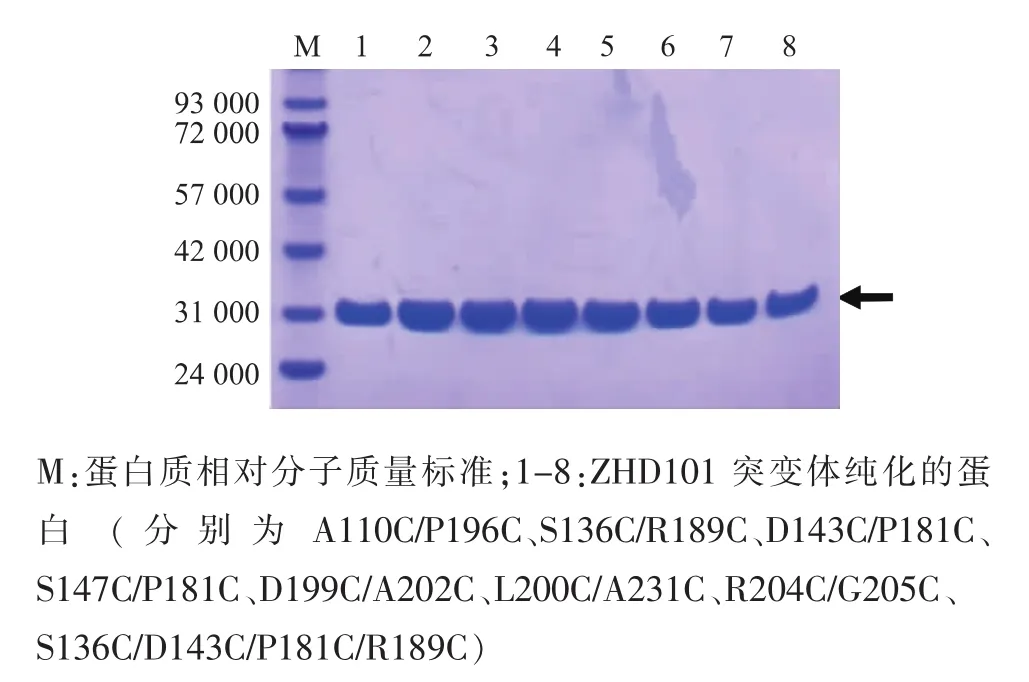
圖4 ZHD101-mutants純化電泳圖Fig.4 Purification and the SDS-PAGE analysis of ZHD101-mutants
2.4 突變體的活性和耐熱性表征
突變體蛋白純化后稀釋至0.25 mg/mL,進行活性和耐熱性的測定,結果見圖5(a)。D143C/P181C、S147C/P181C、L200C/A231C三個突變體的活性均為WT的90%以上;另外三個突變體A110C/P196C、D199C/A202C、R204C/G205C 的 活 性 僅 為WT的70%以上;而突變體S136C/R189C的活力只有WT的50%左右。50℃加處理2 min后,突變體R204C/G205C和L200C/A231C的殘余活性和野生型一致;突變體 D199C/A202C、S147C/P181C和A110C/P196C的殘余活性低于野生型,其中突變體A110C/P196C的殘余活性最低。而突變體S136C/R189C和D143C/P181C的殘余活性高于野生型,其中突變D143C/P181C的殘余活性是野生型的兩倍左右。在此基礎上,我們設計了四突變S136C/D143C/P181C/R189C,活性測試結果見圖 5(b)。 該突變體的活力為野生型的75%,而50℃加熱處理2 min后的殘余活性大約為野生型活性的兩倍,即相對于雙突變D143C/P181C,活性降低,熱穩定性沒有明顯的改善。
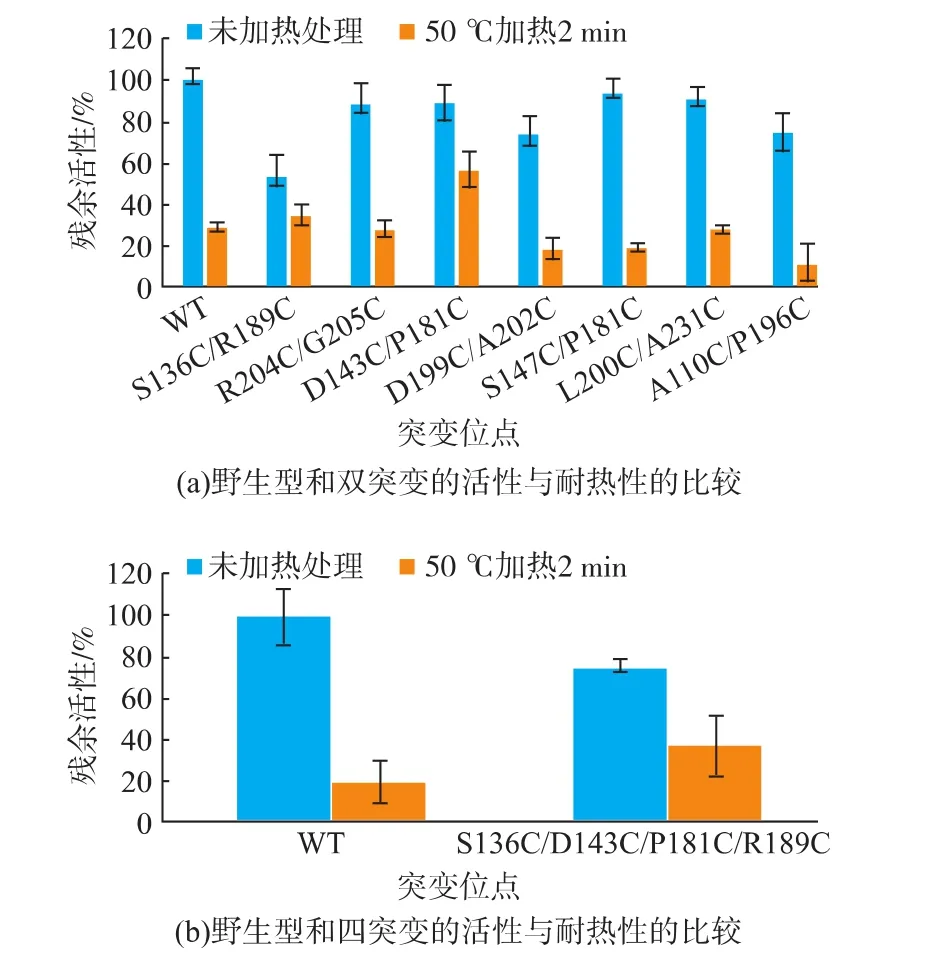
圖5 突變體和野生型的活性和耐熱性比較Fig.5 Thermostability and activity comparison of the wide type and mutants
2.5 熱穩定性提高的突變體形成二硫鍵的潛力分析
已知二硫鍵的χ3扭轉角呈雙相分布,集中在-80°和+100°兩個區域,而形成二硫鍵的能量一般在0~4.5 kcal/mol范圍內,均值為1.07 kcal/mol。經過Disulfide by Design軟件分析,突變體D143C/P181C的兩個半胱氨酸位點形成潛在二硫鍵的χ3扭轉角和能量均符合要求,見表2,說明突變體在該位置有較大可能形成二硫鍵。而S136C/R189C兩個半胱氨酸形成二硫鍵的χ3扭轉角和能量不在上述范圍內,表明形成二硫鍵的穩定性可能較低。

表2 突變體形成潛在的二硫鍵的扭轉角和能量Table 2 Estimated χ3 torsion angle and an energy value of the mutation
2.6 突變體熱穩定性提高的結構基礎
通過對突變體D143C/P181C的結構分析,發現D143C存在于α1和α2之間的loop環上,P181C存在于α3的中間位置,二者形成的二硫鍵穩定了分子結構中B factor最高的這三個α螺旋,見圖6。且α3螺旋中存在對酶活性起關鍵作用的重要氨基酸W183,W183通過與底物ZEN形成的氫鍵和堆疊作用穩定底物,該氨基酸的突變將使ZHD101完全失活[16]。因此,在此處引入二硫鍵,對穩定這三個α螺旋的位置、減少擺動、同時固定關鍵氨基酸W183的位置,均起重要的作用。因此,此處引入的二硫鍵能有效提高酶的熱穩定性。同時,D143C/P181C二硫鍵的位置遠離底物結合中心和催化三聯體,對活性的影響很小。
另外,R189C/S136C雙突變也增加了ZHD101的熱穩定性。由圖6可知,該處的二硫鍵同樣可能是由于穩定了α1螺旋而增加結構的熱穩定性。由于該處的二硫鍵僅穩定了一個α1螺旋,因此相對于D143C/P181C來說,熱穩定性提高的程度略低。而四突變將上述兩個二突變組合起來,R189C/S136C對α1螺旋的穩定作用被D143C/P181C對α1-α3三個螺旋的穩定作用所覆蓋,因此四突變對熱穩定性的貢獻并不優于D143C/P181C雙突變。

圖6 兩個熱穩定性提高的雙突變在分子結構中的位置Fig.6 Location of D143C/P181C andR189C/S136C double-mutations in ZHD101 structure
3 結 語
通過對蛋白質分子結構的分析,利用定點突變在結構中擺動度較大的位置引入半胱氨酸以形成潛在的二硫鍵,成功提高了內酯水解酶ZHD101的熱穩定性。經過Disulfide by Design軟件分析,證明其中引入的一對半胱氨酸符合形成二硫鍵的條件。進一步分析了兩處二硫鍵提高ZHD101熱穩定性的分子基礎。本研究為酶的熱穩定性改造提供了新的思路,同時為促進霉菌毒素降解酶ZHD101在飼料工業的應用打下了基礎。

