低氮對茶樹生長及葉片抗氧化酶活性的影響
林鄭和,鐘秋生,游小妹,陳志輝,陳常頌,單睿陽,阮其春
(福建省農業科學院茶葉研究所,福建 福安 355015)
近幾年來,我國的茶業產業發展較快速。據相關數據統計,截至2017年底,我國茶園面積超過4588萬畝,占世界茶園面積總量的一半,年茶葉產量達到269多萬噸[1],已成為世界上茶葉面積最大,產量最高的國家,茶園氮肥的施用年均66萬噸(每畝茶園按施氮量15 kg計算)。產量隨作物氮肥用量呈線性增加[2]。氮素虧缺直接影響著作物的生命活動和產量形成[3],氮素虧缺條件下植物的次生代謝發生的變化,如葉綠體色素和蛋白質的丟失、脂質過氧化和膜的改變,導致葉片光合能力的逐步下降。然而,Logan等人[4]發現缺氮的菠菜葉片抗氧化酶顯著增加。為了保護光合作用器官免受氧化脅迫,植物必須消耗掉多余的光能,可以通過葉黃素循環或者過氧化物酶反應降低光化學效率[5]。活性氧(ROS)對所有植物體都具有高度破壞性和毒性,必須盡量減少其產生[6,7],細胞內ROS的積累通常較低,但在不利的環境因素下,ROS的產生可能增強[8],可引起膜質的脫脂化和過氧化,破壞生物膜的結構和功能。然而植物體內存在抗氧化機制,可以在一定程度上減緩這種傷害。為了應對細胞內ROS的產生,植物具有復雜的酶抗氧化系統,其中包括細胞解毒的關鍵酶,如:單脫氫抗壞血酸還原酶(MDAR)、超氧化物歧化酶(SOD)、抗壞血酸過氧化物酶(APX)、過氧化氫酶(CAT)、谷胱甘肽還原酶(GR)、脫氫抗壞血酸還原酶(DHAR)等;非酶促抗氧化體系重要的有抗壞血酸(ASC)、還原型谷胱甘肽(GSH)等[9,10],有效地清除細胞內過多的ROS,維持細胞內ROS的產生和清除在一個平衡狀態,使細胞免受傷害。目前低氮對植物活性氧變化影響主要集中在苦蕎[11]、咖啡[12]、小麥[3,13]、玉米[14],而關于茶樹氮虧缺對抗氧化酶的影響相關并未見到。本研究以前期篩選出的耐低氮茶樹品種‘黃棪’與氮敏感茶樹品種‘本山’為試驗材料[15],測定低氮下ROS及各抗氧化酶活性的變化,以期為茶樹耐低氮種質的篩選與鑒定提供參考依據。
1 材料與方法
1.1 試驗方法
試驗于2017年3~10月在福建省福安市社口鎮福建省農業科學院茶葉研究所完成。試驗采用盆栽沙培。沙子用干凈的河沙,盆用陶土花盆,大小:高為20 cm,底部直徑為20 cm,頂部直徑為30 cm,每盆裝入6 kg的沙子,沙子使用前用去離子水洗凈、晾干備用。試驗用10月齡的黃棪與本山的扦插苗為材料,每盆栽2株,6個不同濃度(0、50、100、300、1200、6000 μmol·L-1N)的氮處理,每處理20盆,于自然溫、光條件下培養。營養液參照林鄭和[16]的配方配制,完全營養液包含3 mmol·L-1NH4NO3,0.5 mmol·L-1Ca(H2PO4)2,1.0 mmol·L-1K2SO4,0.5 mmol·L-1CaCl2,0.6 mmol·L-1MgSO4,46 μmol·L-1H3BO3,9 μmol·L-1MnSO4,9 μmol·L-1ZnSO4,2 μmol·L-1CuSO4,2.6 μmol·L-1Na2MoO4和30 μmol·L-1Fe-EDTA。具體實施:移栽,待幼苗成活后每次每盆各處理分別施含0、50、100、300、1200、6000 μmol·L-1N的NH4NO3營養液約500 mL,每周3次,處理18周后(缺氮處理出現明顯的癥狀:葉色變黃、植株矮小、分枝減少、葉片衰老加快等),進行取樣、檢測。為了防止盆栽苗澇害,盆底有個漏洞,放有瓦片,避免積水及沙子遺漏。
1.2 測定方法
1.2.1 植株分枝數、株高及根莖葉干重的測定 分枝數與株高的觀測參照《茶樹種質資源描述規范和數據標準》。根、莖、葉干重測定參考林鄭和等[16]。茶樹小心從花盆中拔起(保持完整的根系),用自來水沖洗干凈,然后用剪刀把根、莖、葉分開,每個處理設置4個重復(不同盆中的1株為1個重復),將鮮樣涼干后,放入烘箱中,80℃下烘48 h(至恒重),然而用電子天平測定各部分的重量。
1.2.2 茶樹根莖葉氮含量的測定 氮含量的測定:采用濃H2SO4-H2O2消煮,用凱氏定氮儀(FOSS)進行測定,參照林鄭和等[15,16]。
1.2.3 茶樹葉片丙二醛(MDA)與過氧化氫(H2O2)的測定 丙二醛(MDA)含量采用硫代巴比妥酸法(TBA)測定,具體參照Hodges等[18]的方法進行。雙氧水(H2O2)的測定參照Chen等[19]。
1.2.4 抗氧化酶活性測定 葉片抗氧化酶活性的提取與測定參考林鄭和等[9]與Chen等[19],具體步驟如下:從超低溫冰箱中取3個圓葉片(每個葉面積0.608 cm2),放入研缽中,加2 mL提取液緩沖液[0.5%(w/v)曲拉通X-100,1 mM EDTA,50 mM KH2PO4-KOH(pH 7.5),5%(w/v)不溶性PVPP],在冰浴中研磨成勻漿,勻漿用冰凍離心機15 000 g下離心10 min,上清液用于酶活性測定。CAT、APX、MDAR、DHAR和 GR活性測定按Chen等[19]與林鄭和[9]。SOD活性采用氮藍四唑(NBT)光還原法測定,GSH和ASC含量測定按照Chen等[19]的方法進行。過氧化物酶(POD)活性的測定采用愈創木酚法,參考Chen等[19]進行。
1.3 數據分析
采用DPS(V15.10)軟件進行差異顯著性(LSD法)分析,利用Sigmaplot 10.0軟件進行作圖。所有數據均重復4~6次(不同植株為1個重復)。
2 結果與分析
2.1 不同供氮處理對茶樹分枝數、株高及根莖葉干重的影響
從圖1(A)可看出,隨著供氮濃度的增加兩品種的分枝數依次顯著增加,除供氮1200 μmol·L-1N處理外,其余處理中黃棪品種的分枝數顯著高于本山品種,特別在低氮處理(供氮處理為0、50、100 μmol·L-1)下。從圖1(D)中發現兩品種植株高度在供氮為0、50、100 μmol·L-1顯著下降,其余處理間未見顯著變化。圖1(B、C、E)發現,隨著供氮濃度的增加,除本山品種在供氮為6000 μmol·L-1外,兩品種根、莖、葉干重依次增加。根系干重除50、100 μmol·L-1氮處理外,其余處理黃棪干重都高于本山,葉片干重在供氮處理為0、50 μmol·L-1時,黃棪品種顯著高于本山,其余處理未見明顯差異。莖干重除供氮處理6000 μmol·L-1,其余處理兩品種未見顯著差異。根冠比(圖1F)在供氮處理下未見顯著差異,而本山品種的根冠比顯著高于黃棪。隨著供氮濃度的增加,兩品種植株干重(圖1G)都依次增加,然而黃棪品種的干重除供氮300 μmol·L-1處理外,其余處理均高于本山。
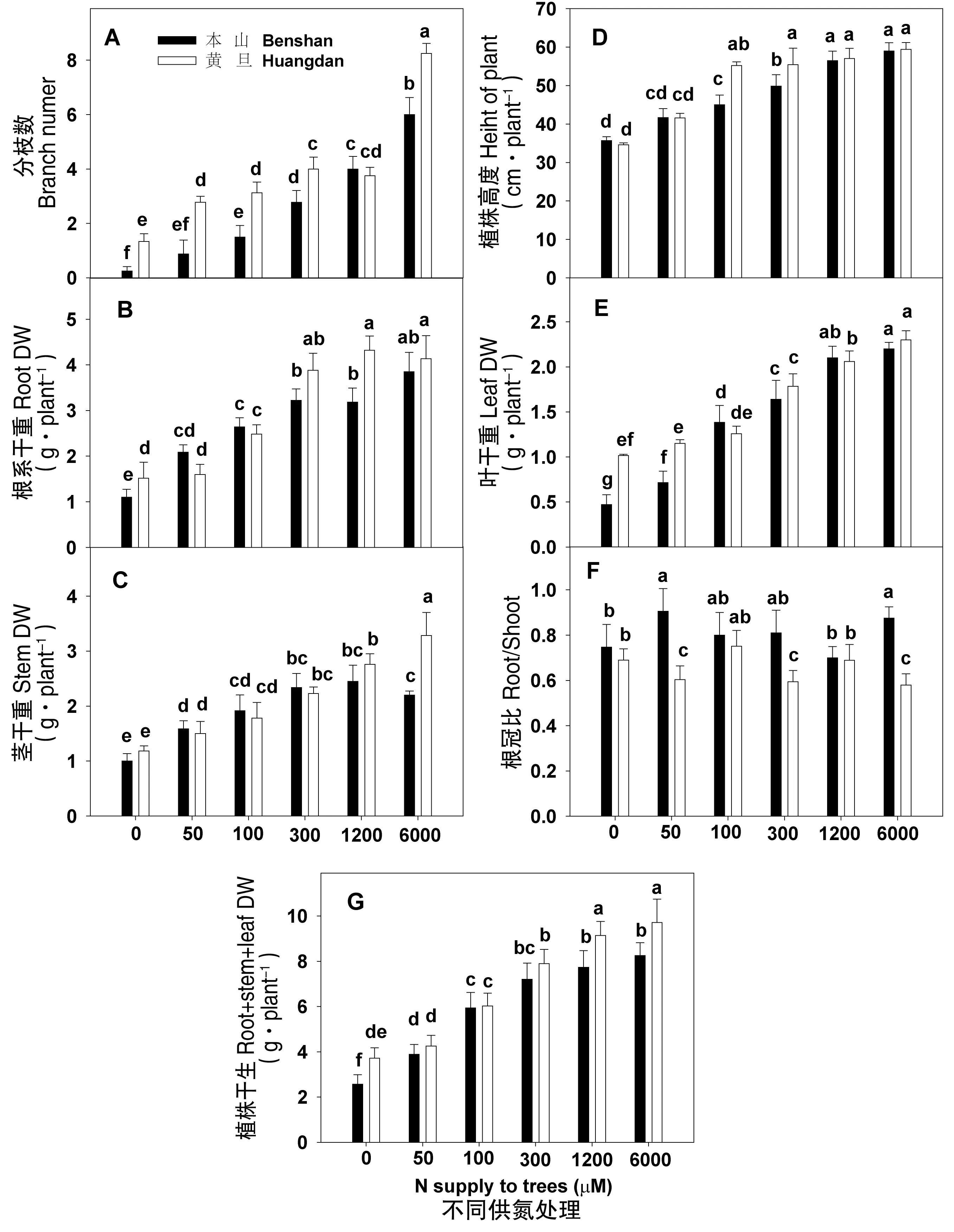
圖1 供氮處理對茶樹分枝數、株高及根莖葉干重的影響Fig.1 Branch count, plant height, and dry weight (DW) of roots, stems, and leaves of tea plants in relation to N supply注:每個柱為4次重復的平均值±標準差,同一點字母不同表示差異顯著(P<0.05)。
2.2 不同供氮處理對茶樹根系、莖、葉氮含量的影響
從圖2中看出,茶樹隨著供氮濃度從0增加到6000 μmol·L-1,茶樹根、莖、葉氮含量依次增加,其中氮含量葉片>根系>莖。從圖2A與C中發現相同供氮處理下,黃棪葉片、根系的氮含量都高于本山品種,莖的氮含量(圖2B)除0、100 μmol·L-1處理外,其余處理黃棪都高于本山。
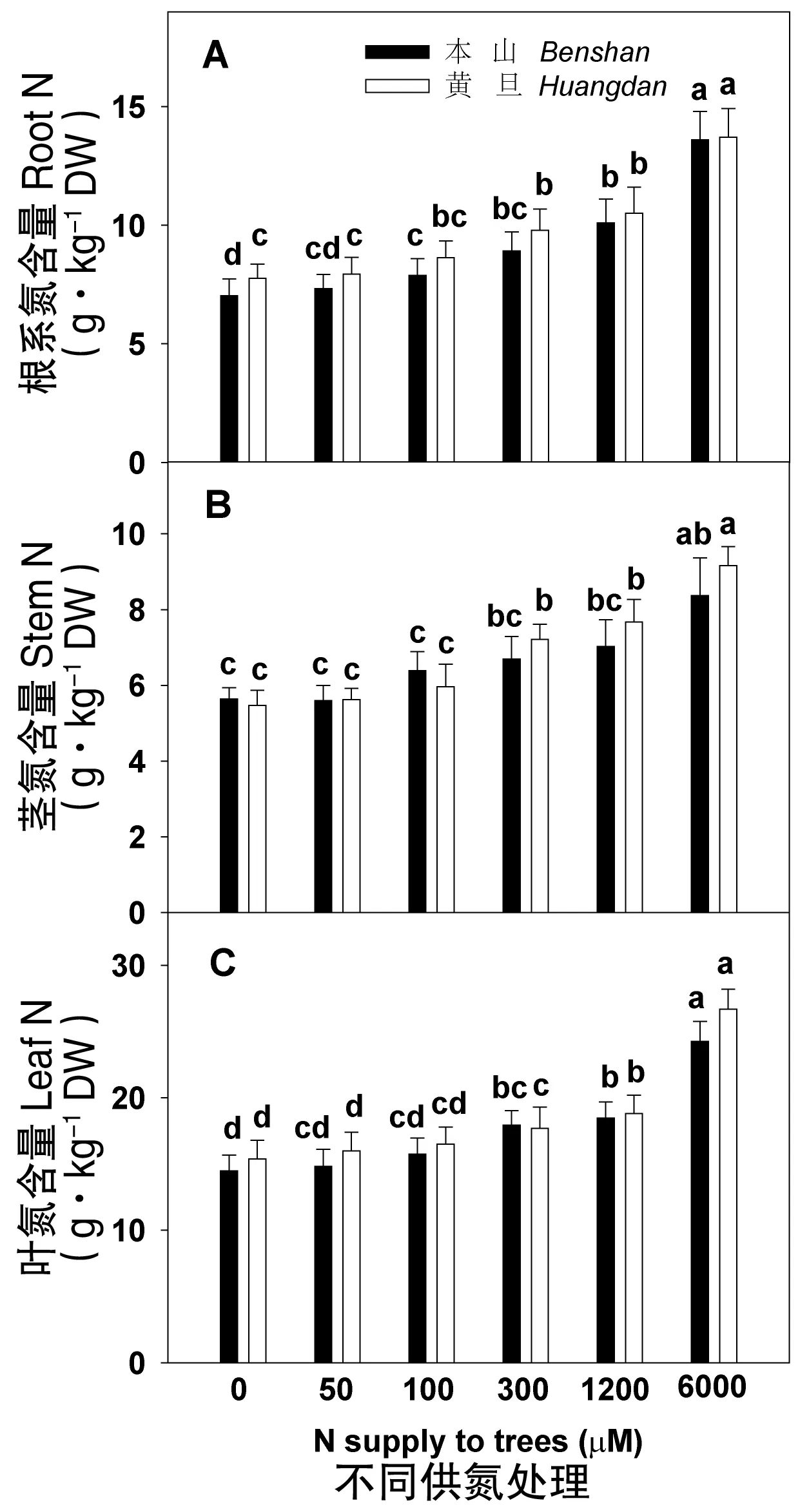
圖2 供氮處理對茶樹根莖葉氮含量的影響Fig.2 N content in roots, stems, and leaves of tea plants in relation to N supply注:每個柱為6次重復的平均值±標準差,同一點字母不同表示差異顯著(P<0.05)。
2.3 不同供氮處理對茶樹葉片過氧化氫與MDA含量的影響
從圖3發現,供氮處理為0、50 μmol·L-1時,葉片過氧化氫的產生速率(圖3A)與MDA(圖3B)含量顯著增加,并且發現,本山品種中的過氧化氫與丙二醛都顯著高于黃棪品種。供氮處理從300增加到6000 μmol·L-1,各處理間未見明顯變化。
2.4 不同供氮處理對茶樹葉片抗氧化系統各酶活性的影響
從圖4A中發現隨著供氮濃度的增加,葉片SOD(圖4A)活性依次下降,而GR(圖4B)、CAT(圖4C)、DHAR(圖4D)、MDAR(圖4E)、APX(圖4F)、POD(圖4G)活性卻依次增加。供氮處理為0、50 μmol·L-1時,黃棪品種葉片的GR(圖4B)、CAT(圖4C)顯著高于本山品種,其余各處理除CAT供氮100 μmol·L-1處理外,其余各處理兩品種間未見顯著變化。DHAR(圖4D)活性除供氮為50 μmol·L-1處理外,其余處理黃棪葉片中的DHAR活性都高于本山;MDAR(圖4E)活性黃棪與本山相當或者本山略高于黃棪;APX(圖4F)活性在供氮從0增加到100 μmol·L-1時,黃棪品種顯著高于本山,其余各處理兩品種未見顯著變化;POD活性(圖4G)除300、1200 μmol·L-1處理本山顯著高于黃棪外,其余處理兩品種未見顯著變化。

圖3 供氮處理對H2O2(A)與MDA(B)含量的影響Fig.3 H2O2 (A) and MDA content (B) in leaves of tea plants in relation to N supply注:每個柱為4次重復的平均值±標準差,同一點字母不同表示差異顯著(P<0.05)。
2.5 不同供氮處理對茶樹葉片ASC與GSH含量的影響
從圖5發現,隨著供氮濃度的增加,ASC含量依次增加,而除本山1200 μmol·L-1處理外,GSH含量也隨著供氮的增大而增加。還發現ASC含量在兩品種間未見明顯差異,而GSH含量黃棪品種明顯高于本山。
3 討論與結論
作物氮肥通常直接影響作物的生物量、代謝、結構,了解作物對氮素的反應機制是維持和提高作物生長和產量的關鍵,也是提高氮素利用率的關鍵[20, 21]。缺氮下茶樹分枝數與樹高顯著的下降(圖1A與D),氮素限制的主要目標是分生組織[22],這一結果與本研究相類似。
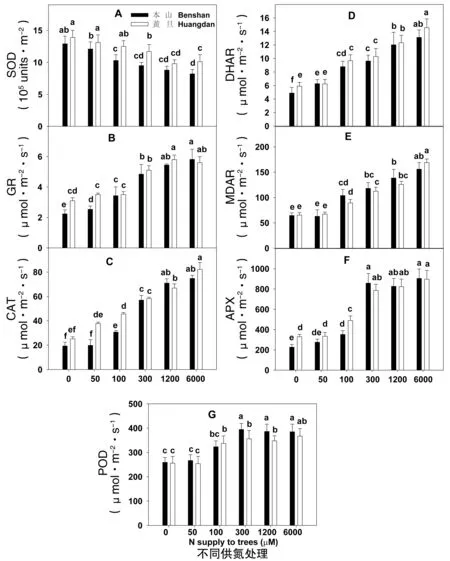
圖4 供氮對茶樹葉片SOD(A)、GR(B)、CAT(C)、DHAR(D)、MDAR(E)、APX(F)與POD(G)活性的影響Fig.4 Activities of SOD (A), GR (B), CAT (C), DHAR (D), MDAR (E), APX (F), and POD (G) in leaves of tea plants in relation to N supply注:每個柱為4次重復的平均值±標準差,同一點字母不同表示差異顯著(P<0.05)。
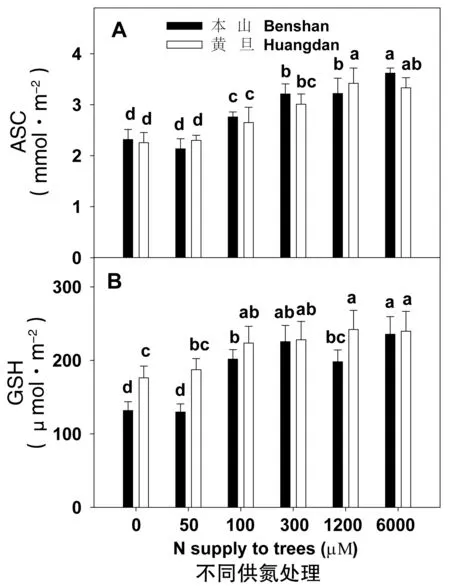
圖5 供氮對茶樹葉片ASC(A)與GSH(B)含量的影響Fig.5 ASC (A) and GSH (B) in leaves of tea plants in relation to N supply注:每個柱為4次重復的平均值±標準差,同一點字母不同表示差異顯著(P<0.05)。
本研究表明,隨著供氮濃度的增加,茶樹根、莖、葉干重顯著增加,說明高氮能引起茶樹對氮的奢侈吸收,增加植株氮積累,加速茶樹營養生長,這與水稻[22]、玉米[23]等報到相一致。研究發現,低氮下茶樹根、莖、葉干重都顯著下降(圖1B、C、E),這與阮建云等[24]、蘇有健等[25]在茶樹低氮下的報道相一致。主要因為氮含量降低嚴重影響茶樹根、莖、葉中蛋白質、氨基酸、光合產物等的合成所致。
本研究還發現,黃棪品種施氮下根、莖、葉干重明顯高于本山品種,除根系干重除50、100 μmol·L-1,莖干重6000 μmol·L-1處理外,其余處理黃棪品種均高于本山。從干物質分配角度看,品種和氮肥同時起作用,不同基因型茶樹品種對氮肥吸收、利用是不同的,這表明施氮對不同茶樹品種調節程度不同,這與徐祥玉等[26]報道相一致。本研究發現本山品種根冠比都大于黃棪品種,這可能因為供氮下本山品種增強對N及光合作用產物吸收,而使得這些產物累積在根部所致[27-29],也側面說明了氮高效品種黃棪在低氮下氮素利用較本山品種高。
氮含量是指單位土地面積上植物各器官所含氮元素的質量。缺氮明顯減少茶樹根、莖、葉氮含量,根、葉氮含量的減少較莖更為顯著,葉片氮含量高于根、莖,說明氮素從根系向葉片轉運,最后主要累積在葉片,供蛋白質、氨基酸等代謝物質合成用。在最大供氮時,葉片氮含量增加最大,而在不供氮或者低氮處理時,根莖葉之間氮含量差異很小,說明低氮處理使氮素向地上部(莖和葉)的轉移比例增加。這與李強等[30]在水稻上的研究結果相類似。低氮下本山品種根、莖、葉氮含量都要低于黃棪品種,說明低氮下黃棪品種能更有效的吸收、轉運氮。這與魏艷麗等[31]在施氮對不同小麥品種氮素效率利用的報到相一致,氮高效品種氮素利用率更大。其中還發現黃棪品種根系氮含量隨著供氮的增加,氮含量變化尤為顯著,說明黃棪對氮肥的利用率要高于本山。
MDA是膜脂過氧化的產物,是衡量細胞膜損傷程度的重要指標。張英鵬等[35]研究表明,在低氮導致了菠菜體內MDA和超氧自由基積累,從而使膜脂產生過氧化作用,影響菠菜的正常生長,這與本研究缺氮下葉片MDA含量顯著增加相類似。本研究還發現缺氮下黃棪品種的GR、CAT、APX與GSH活性都高于本山品種,這與耐氮玉米品種[14]、耐低氮苦蕎品種(‘迪慶苦蕎’、‘廣苦1號’)[11]低氮脅迫下的報道相一致。
綜上所述,缺氮脅迫下導致茶樹幼苗的生長發育受到抑制(根、莖、葉干重顯著下降),本山品種根冠比都大于黃棪品種,說明其缺氮對本山品種生長影響較大,耐低氮品種在低氮環境中具有明顯的生長優勢,耐低氮能力較強。缺氮下茶樹MDA與H2O2有所增加,且本山品種增加的尤為顯著,且相關的抗氧化酶(POD、CAT、GR、GSH等)黃棪品種都高于本山,說明耐低氮品種黃棪缺氮環境下能更好調節保護自身,免受傷害,更好的適應缺氮環境。

