熱環境下黃羽肉雞心臟MCEE基因表達分析
張權 羅毅康 張柏海


摘要:為研究熱應激對黃羽肉雞生長性能的影響,對新廣黃公雞和懷鄉公雞進行熱應激處理,分析其對黃羽肉雞體質量、心臟相對質量和心臟MCEE基因表達的影響。試驗隨機選取新廣黃公雞和懷鄉公雞各60羽,每個品種隨機分6組,每組10羽。每個品種的前3組于22~28日齡時,每天進行熱處理[(38±1 )℃,8 h/d,7 d,試驗組];每個品種的后3組于22~28日齡時處于室溫[(25±1 )℃,對照組]。分別測定新廣黃公雞和懷鄉公雞21、28日齡體質量。于28日齡時隨機抽取每組公雞各2羽,每個品種試驗組和對照組各6羽,測定心臟絕對質量并采集心臟左心室組織用于提取總RNA。MCEE基因相對表達量采用2-ΔΔCT法,利用單因素方差分析其顯著性;雙因素方差分析黃羽肉雞體質量和心臟相對質量顯著性。結果表明,新廣黃公雞和懷鄉公雞21、28日齡體質量以及28日齡心臟絕對質量顯著高于懷鄉公雞(P<0.05),心臟相對質量差異不顯著(P>0.05)。熱環境處理7 d后,28日齡新廣黃公雞體質量試驗組顯著低于對照組(P<0.05),而28日齡懷鄉公雞試驗組與對照組差異不顯著(P>0.05);心臟相對質量差異不顯著(P>0.05)。新廣黃公雞心臟MCEE基因相對表達量顯著高于懷鄉公雞(P<0.05)。熱環境顯著降低新廣黃公雞心臟MCEE基因相對表達量(P<0.05),而對懷鄉公雞心臟MCEE基因相對表達量影響不顯著(P>0.05)。初步研究說明,熱環境顯著降低新廣黃公雞體質量及心臟MCEE基因表達水平,而對懷興公雞無顯著影響(P>0.05)。MCEE基因表達與黃羽肉雞生長速度相關,在黃羽肉雞其他組織器官的表達有待進一步研究。
關鍵詞:黃羽肉雞;熱應激;心臟相對質量;MCEE基因表達
中圖分類號: S831.1 ?文獻標志碼: A ?文章編號:1002-1302(2019)13-0049-03
全球氣候變暖正在影響全球肉雞業[1]。在過去的幾十年中,通過遺傳選擇,肉雞的生產性能,特別是在生長率方面得到了顯著改善[2]。然而,與生長緩慢的肉雞相比,高環境溫度對生長迅速的肉雞的不利影響更大[3-5],尤其是這些快大型肉雞的體質量[6]。黃羽肉雞是亞洲特別是我國很受歡迎的家禽品種,其生長速度慢于商品肉仔雞,具有獨特的肉味。以往對雞的研究表明,快速生長的肉雞會出現左心室損傷的癥狀[7],而左心室衰竭會導致抽血功能喪失[8]。鳥類有一個有效的心血管系統,提供營養和熱量的代謝需求。然而,迄今為止,黃羽肉雞對熱應激反應的研究還很有限。
MCEE基因是丙酸代謝通路基因,編碼丙二酰輔酶A表位異構酶,是丙酰輔酶A代謝為丁二酰輔酶A的重要的代謝途徑,是研究人類丙酸血癥的主要候選基因[9]。缺乏甲基丙二酰輔酶A導致機體組織和體液中積累甲基丙二酸,并表現出繼發性代謝紊亂,如高血糖、高氨血癥和間歇性低血糖[10]。丙酸代謝通路基因與模式動物代謝相關疾病的關系已被廣泛研究[9,11-13],但在家禽中尚無報道。本研究從熱應激反應角度出發,研究黃羽肉雞體質量、心臟相對質量及心臟MCEE基因的表達,分析熱應激對黃羽肉雞的影響。
1 材料與方法
1.1 試驗材料
新廣黃公雞和懷鄉公雞分別來自廣東省佛山市新廣畜牧發展有限公司和廣東省信宜市盈富農業有限公司懷鄉公雞保種場,各60羽1日齡公雛。每個品種隨機分6組,每組10羽,飼養管理條件一致,自由采食與飲水。每個品種的前3組于 22~28日齡時,每天進行熱處理(38±1) ℃ 8 h后溫度降至室溫(25±1) ℃的條件下飼養(試驗組);每個品種后3組于 22~28日齡時處于室溫(25±1) ℃的條件下飼養(對照組)。分別測定新廣黃公雞和懷鄉公雞21、28日齡體質量。于28日齡時隨機抽取每組公雞各2羽,每個品種試驗組和對照組各共6羽,頸部放血處死,測定心臟絕對質量并采集心臟左心室組織于液氮保存,用于提取總RNA(核糖核酸)。
1.2 總RNA的提取與逆轉錄
雞心臟組織總RNA提取參見Trizol試劑說明書的操作步驟進行,RNA濃度和純度用Nanodrop紫外分光光度計檢測,1.5%瓊脂糖凝膠電泳檢測RNA完整性,根據BeyoRTTM Ⅱ cDNA(互補脫氧核糖核酸)合成試劑盒說明書進行RNA逆轉錄,獲得cDNA于-20 ℃用于熒光定量PCR檢測。
1.3 引物的設計與合成
根據NCBI中雞MCEE和GAPDH基因mRNA(信使RNA)序列(NM_001293217.1和NM_204305.1),采用引物在線設計軟件Primer 3(http://primer3.ut.ee)設計引物,引物序列信息見表1。引物由金唯智(廣州)生物科技公司合成。
1.4 熒光定量PCR
運用SYBR Green Ⅰ染料法,進行熒光定量PCR檢測,以GAPDH為內參基因,檢測MCEE基因表達量。熒光定量PCR反應體系:2×SYBR綠色熒光染料PCR混合液(2×SYBR Green Ⅰ PCR Mix)7.5 μL,10 μmol/L上下游引物各0.5 μL,1.0 μL 500 ng/μL cDNA,去RNA酶水(RNase-free Water)至15.0 μL。PCR反應條件為95 ℃預變性5 min;95 ℃變性10 s,60 ℃退火30 s,72 ℃延伸30 s進行40個循環。
1.5 統計分析
利用SPSS 19.0軟件分析黃羽肉雞體質量和心臟相對質量顯著性。MCEE基因相對表達量采用2-ΔΔCT法計算,利用SPSS 19.0軟件分析其顯著性。數據采用平均值±標準差表示。
2 結果與分析
2.1 熱環境對黃羽肉雞體質量和心臟的影響
由圖1可見,新廣黃公雞21、28日齡體質量以及28日齡心臟絕對質量顯著高于懷鄉公雞(P<0.05),28日齡心臟相對質量差異不顯著。熱環境處理7 d后,28日齡新廣黃公雞絕對體質量試驗組顯著低于對照組(P<0.05),而28日齡懷鄉公雞試驗組與對照組差異不顯著(P<0.05)。試驗組新廣黃公雞和懷鄉公雞心臟絕對質量均顯著低于對照組(P<0.05),心臟相對質量差異不顯著(P>0.05)。結果表明,高溫環境顯著影響快速型黃羽肉雞(新廣黃公雞)的生長速度,對慢速型黃羽肉雞(懷鄉公雞)影響不顯著(P>0.05),對黃羽肉雞心臟相對質量無顯著影響(P>0.05)。
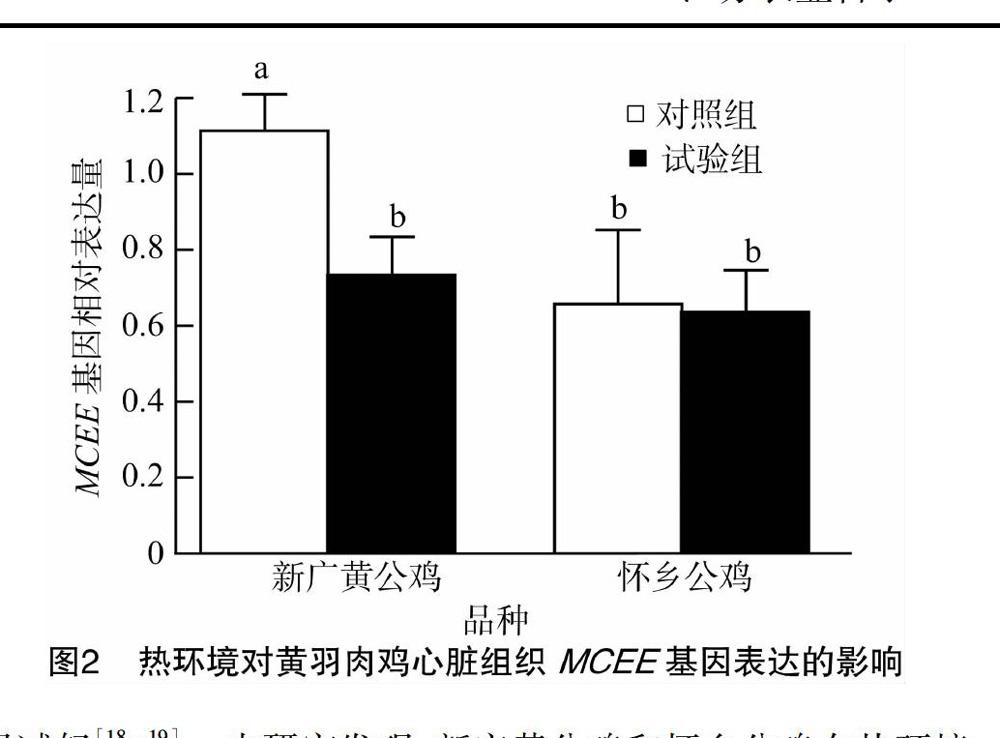
2.2 熱環境對黃羽肉雞心臟組織MCEE基因表達的影響
熱環境對黃羽肉雞心臟組織MCEE基因表達的影響結果見圖2。新廣黃公雞對照組心臟MCEE基因相對表達量顯著高于對照組懷鄉公雞(P<0.05)。熱環境顯著降低新廣黃公雞心臟MCEE基因相對表達量(P<0.05),而對懷鄉公雞心臟MCEE基因相對表達量影響不顯著(P>0.05)。
3 討論與結論
在熱環境下,28日齡新廣黃公雞試驗組體質量顯著低于對照組體質量(P<0.05),而28日齡懷鄉公雞試驗組與對照組體質量差異不顯著(P>0.05)。有研究表明,白羽肉雞在12.8%[14-15];耐熱型高度近交品系[16]暴露在熱環境(35 ℃、7 h/d、7 d)下時,體質量增加率為58.9%[17]。本研究中,新廣黃公雞在熱環境條件下,7 d的體質量增加率約為59.7%,懷鄉公雞質量增加約為45.1%。表明黃羽肉雞具有一定的耐熱能力,且經過選育的新廣黃公雞在熱環境下的增質量率較懷鄉公雞高。而熱環境對懷鄉公雞的增質量率無顯著影響,在黃羽肉雞選育中,可以作為耐熱型黃羽肉雞品種。在熱環境下,雞生產性能的降低與機體組織器官的各種變化有關,這些器官變化包括腸道受損、相關免疫器官和心臟的相對質
量減輕[18-19]。本研究發現,新廣黃公雞和懷鄉公雞在熱環境條件下,心臟相對質量與對照組之間差異不顯著,表明在高溫熱環境(32 ℃,2~4周齡)條件下,28日齡體質量較室溫下白羽肉雞體質量降低約環境下,黃羽肉雞的心臟生理發育正常[20]。
MCEE基因是丙酸代謝通路基因,編碼丙二酰輔酶A表位異構酶,是丙酰輔酶A代謝為丁二酰輔酶A的重要的代謝途徑。缺乏甲基丙二酰輔酶A突變酶或酶輔因子腺苷鈷胺的患者,在其組織和體液中積累甲基丙二酸,并表現出繼發性代謝紊亂,如高血糖、高氨血癥和間歇性低血糖[10]。丙酸代謝通路基因與模式動物代謝相關疾病的關系已被廣泛研究[9,11-13],但在家禽中尚無報道。本研究中,心臟MCEE基因表達與黃羽肉雞生長速度呈正相關,且差異顯著。快速型黃羽肉雞心臟MCEE基因表達受熱環境影響顯著下降而導致生長速度減慢;慢速型黃羽肉雞心臟MCEE基因表達受熱環境影響及其生長速度差異不顯著。
熱環境顯著降低新廣黃公雞體質量及心臟MCEE基因表達水平,而對懷興公雞無顯著影響。初步表明MCEE基因表達水平與黃羽肉雞生長速度相關,在黃羽肉雞其他組織器官的表達有待進一步研究。
參考文獻:
[1]Windhorst H W. Changes in poultry production and trade worldwide[J]. Worlds Poultry Science Journal,2006,62(4):585-602.
[2]Deeb N,Cahaner A. Genotype-by-environment interaction with broiler genotypes differing in growth rate. 3. Growth rate and water consumption of broiler progeny from weight-selected versus nonselected parents under normal and high ambient temperatures[J]. Poultry Science,2002,81(3):293-301.
[3]Cahaner A. Effects of temperature on growth and efficiency of male and female broilers from lines selected for high weight gain,favorable feed conversion,and higher low fat content[J]. Poultry Science,1992,71(8):1237-1250.
[4]Lu Q,Wen J,Zhang H. Effect of chronic heat exposure on fat deposition and meat quality in two genetic types of chicken[J]. Poultry Science,2007,86(6):1059-1064.
[5]Cheng C Y,Tu W L,Chen C J,et al. Functional genomics study of acute heat stress response in the small yellow follicles of layer-type chickens[J]. Scientific Reports,2018,8(1):1320.
[6]Sohail M U,Hume M E,Byrd J A,et al. Effect of supplementation of prebiotic mannan-oligosaccharides and probiotic mixture on growth performance of broilers subjected to chronic heat stress[J]. Poultry Science,2012,91(9):2235-2240.
[7]Olkowski A A. Pathophysiology of heart failure in broiler chickens:Structural,biochemical,and molecular characteristics[J]. Poultry Science,2007,86(5):999-1005.
[8]Baghbanzadeh A,Decuypere E. Ascites syndrome in broilers:physiological and nutritional perspectives[J]. Avian Pathology,2008,37(2):117-126.
[9]Chandler R J,Aswani V,Tsai M S,et al. Propionyl-CoA and adenosylcobalamin metabolism in Caenorhabditis elegans:evidence for a role of methylmalonyl-CoA epimerase in intermediary metabolism[J]. Molecular Genetics and Metabolism,2006,89(1/2):64-73.
[10]Chalmers R A,Lawson A M. Disorders of propionate and methylmalonate metabolism[M]//Organic acids in man. Dordrecht:Springer,1982:296-331.
[11]Carrozzo R,Dionisi-Vici C,Steuerwald U A,et al. SUCLA2 mutations are associated with mild methylmalonic aciduria,leigh-like encephalomyopathy,dystonia and deafness[J]. Brain,2007,130(3):862-874.
[12]Sakamoto O,Ohura T,Murayama K,et al. Neonatal lactic acidosis with methylmalonic aciduria due to novel mutations in the SUCLG1 gene[J]. Pediatrics International,2011,53(6):921-925.
[13]楊 帆,王瓊萍,何 侃,等. 丙酸通路基因多態性與豬肉質及胴體性狀的關聯分析[J]. 遺傳,2012,34(7):81-87.
[14]Geraert P A,Padilha J C F,Guillaumin S. Metabolic and endocrine changes induced by chronic heatexposure in broiler chickens:growth performance,body composition and energy retention[J]. British Journal of Nutrition,1996,75(2):195-204.
[15]Yalcin S,zkan S,Türkmut L,et al. Responses to heat stress in commercial and local broiler stocks. 1. Performance traits[J]. British Poultry Science,2001,42(2):149-152.
[16]Deeb N. Genetic architecture of growth and body composition in unique chicken populations[J]. Journal of Heredity,2002,93(2):107-118.
[17]Van Goor A,Bolek K J,Ashwell C M,et al. Identification of quantitative trait loci for body temperature,body weight,breast yield,and digestibility in an advanced intercross line of chickens under heat stress[J]. Genetics Selection Evolution,2015,47(1):96.
[18]Quinteiro-Filho W M,Ribeiro A,Ferraz-de-Paula V,et al. Heat stress impairs performance parameters,induces intestinal injury,and decreases macrophage activity in broiler chickens[J]. Poultry Science,2010,89(9):1905-1914.
[19]Zhang J,Schmidt C J,Lamont S J. Transcriptome analysis reveals potential mechanisms underlying differential heart development in fast-and slow-growing broilers under heat stress[J]. BMC Genomics,2017,18(1):295.
[20]van de Ven L J F,van Wagenberg A V,Decuypere E,et al. Perinatal broiler physiology between hatching and chick collection in 2 hatching systems[J]. Poultry Science,2013,92(4):1050-1061.

