蝦脊蘭原球莖誘導及植株高效再生體系研究
陳錦 楊侃侃 官迪


摘要:以野生蝦脊蘭(Calanthe discolor)未成熟蒴果為材料,MS為基本培養基,探討不同光照度、熱激和不同培養基配方對蝦脊蘭種子萌發、原球莖發生及植株再生的影響。結果表明,未完全成熟的種子在1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖+20 g/L馬鈴薯+1.0 g/L活性炭培養基中萌芽率最佳;在1 500 lx光照度條件下培養時種子萌發速率較快。通過黑暗條件下35 ℃熱激5 d有利于已萌動種子脫分化形成原球莖。使用MS+3.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖培養基誘導原球莖形成胚性愈傷組織效果最好。MS+0.5 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖+20 g/L馬鈴薯培養基分化形成植株分化率最高,1/2MS+0.2 mg/L IBA+7 g/L瓊脂+30 g/L蔗糖+0.1 g/L活性炭培養基則為最佳生根培養基,生根率100%,植株根系發達,長勢健壯。該研究建立了蝦脊蘭無菌快繁體系,為保護野生蝦脊蘭資源和種苗人工繁育提供了有效技術途徑,也為其遺傳轉化研究奠定基礎。
關鍵詞:蝦脊蘭;蒴果;原球莖;組織培養;植株再生
中圖分類號: Q813.1+2;S682.310.4+3 ?文獻標志碼: A ?文章編號:1002-1302(2019)13-0045-04
蝦脊蘭[1](Calanthe discolor L.)為蘭科蝦脊蘭屬多年生草本植物,全屬約150種,我國有51種,大部分為地生種,少數為附生種植物,其中包括21個特有種,在《中國極瀕危植物名錄》中已全部被列為瀕危或已瀕臨滅絕等級。野生蝦脊蘭主要分布在長江以南流域,生于山坡林下[2-3],是一種價值極高的觀花觀葉植物,也可作為良好的盆栽、地被材料[4]。同時,野生蝦脊蘭也具有一定的藥用價值,現有研究發現[5-6],蝦脊蘭提取物中含有二氫菲、吲哚苷以及一些具有生理活性的生物堿,使得其在傳統中藥中具有抗菌、消炎和抗毒素等功效。李丹平等經調查發現,蝦脊蘭的假莖、假鱗莖及根莖具有活血消結、解毒消腫、止痛等作用[7]。目前,對該物種的報道多限于一些基本生物學特征[8-9]、果實發育[10]、胚珠發育及種子形成[11]、遺傳多樣性[12~14]和天然產物開發[15-16]等方面,徐剛等通過顯微鏡測定蝦脊蘭屬9種類型的種子發現,其授粉后1個月形成種胚,5個月后種子才能完全成熟,且與其他難于無菌播種發芽的蘭科植物如扇脈杓蘭(Cypripedium japonicum)、大花杓蘭(C. macranthum)的種子一樣,胚占種子比例非常小,種胚可見胚皮[17]。為保護這種花藥兩用的珍稀植物,人工繁育研究工作已迫在眉睫。蝦脊蘭種子極小且發育不完全,在自然條件下萌發率極低,通常難以存活[18-19],而它的園藝觀賞性和藥用價值巨大,多年來一直遭到人們過度采挖,導致野生蝦脊蘭資源逐年減少,甚至多個野生資源分布區已經難覓蹤跡。現在蝦脊蘭屬全屬均被列為瀕危或已瀕臨滅絕等級植物,為保護和開發蝦脊蘭的種質資源并進行合理的運用,如何快速繁育出大量幼苗成為人們必須思考的問題。筆者所在的課題組于2015年10月在湘西壺瓶山區(110°15′E、30°02′N)進行湖南省作物資源普查時偶然發現1株帶有1顆蒴果的野生蝦脊蘭,為了保護野生資源,筆者所在的調查小組決定留下植株只取下未完全成熟的青色蒴果帶回實驗室。
本研究以野生蝦脊蘭未完全成熟蒴果為材料,探討不同培養基組分及環境條件刺激對蝦脊蘭原球莖形成的影響,并通過不同培養方式可使原球莖脫分化成為胚性愈傷組織或再分化形成再生植株,隨后誘導生根成苗。本試驗旨在研究促使蝦脊蘭種子形成原球莖的發生條件及培養基配方,探索一種適合未完全成熟蝦脊蘭種子進行組培快繁的技術體系,通過該方案可快速大量生產蝦脊蘭幼苗。既為蘭科植物原球莖發生條件探索和胚性愈傷組織誘導提供技術參考,也對該物種野生資源保護和擴繁提供技術支撐與借鑒。
1 材料與方法
1.1 材料
本研究以野生蝦脊蘭20周齡的未成熟蒴果為材料。
1.2 培養基成分與培養條件
1.2.1 材料處理 取蝦脊蘭蒴果經自來水沖洗30 min;再用75% C2H5OH+0.1% Tween 20消毒90 s;然后在0.1% HgCl2+0.1% Tween 20溶液中浸泡8~10 min,并輕輕振蕩;無菌水沖洗4~6次后在超凈工作臺上將種莢外表面水分風干,切開種莢,將種子均勻灑在萌發不同配方培養基上。
1.2.2 培養條件 培養室溫度控制為(22±2) ℃,弱光照度為1 500 lx,強光照度為4 500 lx,光照培養時長為12 h/d。
1.2.3 種子萌發 種子萌發1號培養基為1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖+20 g/L馬鈴薯+1.0 g/L 活性炭;種子萌發2號培養基為MS+1.0 mg/L 6-BA+0.1 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖+20 g/L馬鈴薯+1.0 g/L活性炭。種子接入培養基后先放入暗室培養1周待其適應培養基環境,再分別給予1 500、4 500 lx 2種不同光照度進行培養,觀察不同光照度條件對種子萌發的影響。
1.2.4 原球莖發生 種子撒入培養基后開始進入吸脹吸水階段,慢慢在培養基養分和植物激素作用下有活力的種子進入緩慢吸水階段,酶促反應與呼吸作用增強,貯藏物質開始分解,胚細胞的吸水力提高,打破種皮束縛,種子由淡黃色漸漸轉色成黃綠色并伴隨著體積膨大。此時即可說明其已經開始萌芽,將已萌動的種子轉入黑暗條件下35 ℃熱激培養5 d,方法參照文獻[20],而后繼續放入1 500 lx弱光下常溫培養,觀察種子發芽效率和原球莖發生情況。
1.2.5 原球莖脫分化 將蝦脊蘭原球莖轉接至3號培養基(MS+1.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖)、4號培養基(MS+2.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖)、5號培養基(MS+3.0 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊脂+30 g/L蔗糖)中,觀察不同6-BA濃度對原球莖誘導形成愈傷組織的效果和不定芽發生情況。
1.2.6 胚性愈傷組織與原球莖分化出芽 將帶有不定芽的愈傷組織和原球莖分別轉接至6號固體培養基(MS+0.5 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊 脂+30 g/L蔗糖+20 g/L馬鈴薯)、7號固體培養基(MS+0.5 mg/L 6-BA+0.5 mg/L NAA+7 g/L瓊脂+30 g/L蔗 糖+20 g/L椰子汁)、8號固體培養基(MS+0.5 mg/L 6-BA+0.5 mg/L NAA+5 g/L瓊脂+30 g/L蔗糖+20 g/L香蕉)上進行分化培養,觀察不同添加物對愈傷組織和原球莖分化形成再生苗及其生長發育的影響。
1.2.7 生根培養 將無根的再生植株轉接至不同濃度NAA和IBA的生根培養基進行生根培養,觀察不同激素濃度對再生植株生根的影響。
2 結果與分析
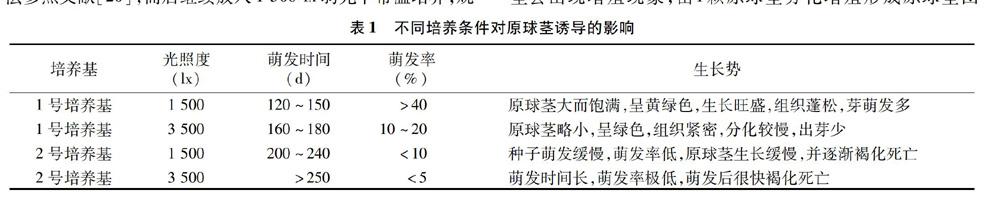
2.1 不同培養基和光照度對種子萌發的影響
蝦脊蘭種子的萌發通常需要較長時間,不同培養基組分對種子萌發效率影響很大。從表1可見,低濃度鹽分培養基和較弱光照條件下培養時最適合蝦脊蘭種子萌發,即使用1號培養基和1 500 lx光照度培養條件下種子的萌發效果較好。在培養120 d后該培養條件下的種子慢慢膨大,并漸漸露出黃綠色嫩芽,萌發率在40%以上。而高濃度鹽分和強光照度培養條件都不利于蝦脊蘭種子快速和高效率萌芽,種子萌發率會顯著降低,且萌發時間被延長。將已萌動種子放入35 ℃黑暗條件下熱激培養5 d后轉入常規培養條件,隨后種子逐漸膨大發育成圓潤飽滿的黃綠色小球——原球莖(如圖 1-A)。種子萌動后再經過熱激處理均能誘導出原球莖,但不同培養基配方和光照培養條件對種子萌動效率和原球莖誘導品質影響較大,若原球莖誘導質量不高,在后期進行再分化出芽培養時,其容易出現生長緩慢甚至褐化死亡的現象。
2.2 不同培養基對原球莖脫分化和增殖的影響
將長勢良好的原球莖轉接至含有不同濃度6-BA的培養基中培養45 d后發現,當6-BA濃度為3.0 mg/L時,愈傷組織誘導效果最好(圖1-B),愈傷組織結構緊密,生長速度較快,且分布多個不定芽,這有利于后期快速分化出芽,大量培育組培幼苗。當6-BA濃度為2.0 mg/L時,少量原球莖會出現增殖現象,由1顆原球莖分化增殖形成原球莖團(圖1-C),同時產生大量次生代謝物使培養基褐化。
2.3 不同培養基對愈傷組織和原球莖分化出芽的影響
將愈傷組織和原球莖分別轉接至含有不同天然成分的培養基中培養60 d后發現,幾種不同培養基配方都能促使愈傷組織和原球莖分化出芽并形成再生植株(圖1-D),但分化率和幼芽長勢有一定的差異。其中,原球莖含有馬鈴薯和香蕉成分的培養基分化率均較高,且芽苗健壯,含椰子汁的培養基也有較高分化率,但幼苗生長較為緩慢且植株長勢相對細弱。帶有不定芽的愈傷組織在3種培養基中均能分化形成再生植株,且生長速率差別不大,平均株高低于2 cm,較原球莖誘導的再生植株更為緩慢(表2)。
2.4 生根培養
將分化出幼芽的蝦脊蘭植株轉接至以1/2 MS+7 g/L瓊脂+30 g/L蔗糖+0.1 g/L活性炭為基本成分,同時添加不同濃度NAA和IBA的培養基中進行45 d生根培養。表3顯示,NAA和IBA 2種激素都能促使蝦脊蘭愈傷組織根分化,但根分化效率有較大差異。使用NAA生根培養基容易產生氣生根,在NAA濃度為0.5 mg/L時,植株生長旺盛且根系發達,具有較好的生根效果;當使用濃度達到1 mg/L時,會誘導根系畸形發育,形成圓球狀根,不利于養分吸收,從而導致植株生長緩慢。使用IBA生根效果更為理想,根系發達且白嫩、健壯,幼苗新葉數量更多,當IBA濃度為0.2 mg/L時,生根效果最佳。生根培養質量直接影響后期煉苗移栽成活率,較發達健壯的根系有利于移栽后植株快速生出新根汲取水分,減少組培瓶苗移栽后的脫水死亡率。
3 討論與結論
曾有學者發現,使用超聲波處理成熟的蝦脊蘭種子后,可大大提高其萌發率[21]。閔子揚等通過熱激培養南瓜未授粉子房可促使其出胚,并得到再生單倍體植株[20]。有研究發現,在蝴蝶蘭葉片外植體培養初期進行熱激處理可誘導抗氧化酶活性顯著提高,從而減輕培養過程中蝴蝶蘭褐變的發生[22]。而王懷宇早在研究中指出,蘭科植物因種類不同而萌發率差異巨大,還存在未成熟種子萌發率反而更高的現象[23]。故不能簡單認為,種子的成熟度與其萌發率呈正相關性,當種子成熟到一定程度后,不會再隨著成熟度增加而提高萌發率,甚至有可能會降低萌發率或延長萌發時間[24-25]。可見,通過不同物理刺激未成熟種子可能會改變其發育、分化過程,本研究受客觀條件限制所取材料為未成熟蒴果,而此情況在珍貴野生資源調查和保護工作中時常遇見,只能使用未完全成熟的種子進行播種并誘導萌發,通過環境刺激誘導萌動種子分化形成原球莖。研究發現,使用低濃度鹽分的培養基和較弱光照培養有利于蝦脊蘭種子萌發,當光照加強時,種子萌發率大大降低,甚至不萌發,可見是強光照不利于解除種子休眠。在乳白色種子解除休眠漸漸變綠后采用一定外界環境刺激,有利于促進不成熟種子繼續分化發育,膨大形成胚性組織。若無熱激刺激,而繼續暗光培養時間過長易引起種子褐化死亡。光照程度對蝦脊蘭的分化、發育過程有明顯影響,當萌芽和需要進行脫分化使之成為胚性組織時需要弱光甚至黑暗處理,弱光下有利于分化出蓬松的淡黃色愈傷組織,而當須要再分化出芽和植株生長時使用較強光照更加合適,強光照有利于誘導出更多叢生芽,植株長勢也更加粗壯,根系發達。種子萌動過程中會出現部分褐化死亡的現象,可能是培養基和培養條件不適合蝦脊蘭萌發,亦或是種子成熟度不夠造成萌動后的種子停止了進一步發育。蝦脊蘭種子萌動后肉眼可見其呈淡黃綠色,熱激5 d后萌芽種子可發育成原球莖而不繼續發生胚芽、胚軸和胚根。待原球莖長至肉眼清晰可辨約1 mm大小之后轉入含有不同濃度6-BA的培養基中分化培養,在高濃度6-BA且暗室培養條件下原球莖會不斷膨大形成淡黃色的瘤狀胚性愈傷組織,這些愈傷組織膨大后進入強光培養可以分化出大量不定芽,將這些不定芽分割開來并進行分化培養,可形成大量幼苗,比直接通過原球莖分化出苗的增殖效率更高,可做到真正意義上的通過組織培養進行無限制培育組培幼苗。但當6-BA使用濃度較低時,原球莖不會被誘導形成愈傷組織而是直接發育形成單棵無根植株。
蘭科植物在我國藥用植物資源中占有重要地位,種類繁多且資源豐富[26-27],但近年來的環境破壞和無節制私挖亂采已造成多數藥用蘭科植物頻臨滅絕,由于野生資源逐漸枯竭,人們開始研究如何人工栽培和繁育。本研究為未成熟蝦脊蘭種子組培快繁和蘭科植物原球莖誘導發生條件進行了一系列探索,為蝦脊蘭屬植物保護工作提供借鑒和理論支持,也為日后蝦脊蘭種苗繁育工作排除技術障礙。
參考文獻:
[1]黃衛昌,周翔宇,倪子軼,等. 基于標本和分布信息評估中國蝦脊蘭屬植物的瀕危狀況[J]. 生物多樣性,2015(4):493-498.
[2]林 兵,黃敏玲. 蝦脊蘭的栽培與利用(綜述)[J]. 亞熱帶植物科學,2012,41(1):79-82.
[3]蘇文君,龍波,劉飛虎. 蝦脊蘭屬植物研究現狀[J]. 北方園藝,2012(16):190-193.
[4]侯 鳴. 蝦脊蘭的觀賞與栽培[J]. 中國花卉園藝,2008(10):27-29.
[5]關 璟,王春蘭,肖培根,等. 地生型蘭科藥用植物化學成分及其藥理作用研究[J]. 中國中藥雜志,2005(14):1053-1061.
[6]伍小燕,田 輝,葉 晶,等. 壯藥萬筋藤的顯微特征研究[J]. 廣西醫學,2010,32(9):1134-1135.
[7]李丹平,陳雨潔,萬定榮,等. 鄂西土家族常用蘭科植物藥[J]. 中南民族大學學報(自然科學版),2009(1):48-50.
[8]王卜瓊,李枝林,劉國民,等. 幾種蘭花種子無菌萌發及胚胎發育過程的幾種途徑[J]. 云南植物研究,2006,28(4):399-402.
[9]連靜靜,錢 鑫,王彩霞,等. 中國特有植物無距蝦脊蘭生物學特性及花部形態觀察[J]. 植物資源與環境學報,2013(3):100-106.
[10]連靜靜,李全健,王彩霞,等. 無距蝦脊蘭果實發育及其解剖學特征[J]. 植物研究,2012(6):707-711.
[11]連靜靜,錢 鑫,王彩霞,等. 無距蝦脊蘭胚珠發育及種子形成研究[J]. 西北植物學報,2013,33(3):494-500.
[12]Sang H K,Lee J S,Lee G J. Analyses of genetic diversity and relationships in four Calanthe,taxa native to Korea using AFLP markers[J]. Horticulture,Environment,and Biotechnology,2013,54(2):148-155.
[13]黃寶華,鐘鳳林,劉添鋒,等. 15份蝦脊蘭屬植物的遺傳多樣性研究[J]. 西南大學學報(自然科學版),2011(12):72-76.
[14]朱根發,郭振飛. 重要觀賞蘭科植物的分子生物學研究進展[J]. 植物學通報,2004,21(4):471-477.
[15]Murakami T,Kishi A,Sakurama T,et al. Chemical constituents of two oriental orchids,calanthe discolor and C. liukiuensis:precursor indole glycoside of tryptanthrin and indirubin[J]. Heterocycles,2001,54(2):957-966.
[16]姜 祎,徐 虹,秦天福,等. GC-MS分析流蘇蝦脊蘭葉中揮發性化學成分[J]. 現代中醫藥,2015(4):56-58.
[17]徐 剛,汪一婷,牟豪杰,等. 蝦脊蘭無菌播種技術[J]. 中國花卉園藝,2003(8):26-27.
[18]曾碧玉,朱根發,劉海濤,等. 4種野生蘭花種子特征及離體培養初報[J]. 亞熱帶植物科學,2008,37(3):31-34.
[19]明興加,張笑逸,伍淳操,等. 蘭科植物種子的營養萌發[J]. 世界科學技術(中醫藥現代化),2012(5):2077-2081.
[20]閔子揚,李 涵,鄒 甜,等. 南瓜未授粉子房離體培養及植株再生[J]. 植物學報,2016,51(1):74-80.
[21]Miyoshi K,Mii M. Ultrasonic treatment for enhancing seed germination of terrestrial orchid,Calanthe discolor,in asymbiotic culture[J]. Scientia Horticulturae,1988,35(1/2):127-130.
[22]趙 瀅. 不同品種及熱激處理對蝴蝶蘭組培褐變的影響與生理機制[D]. 北京:中國農業科學院,2009.
[23]王懷宇. 蘭的種子形成過程與發芽的關系[J]. 廣東園林,1984(3):48-51.
[24]Kitsaki C K,Zygouraki S,Ziobora M,et al. In vitro germination,protocorm formation and plantlet development of mature versus immature seeds from several Ophrys species (Orchidaceae)[J]. Plant Cell Reports,2004,23(5):284-290.
[25]Udomdee W,Wen P J,Lee C Y,et al. Effect of sucrose concentration and seed maturity on in vitro germination of Dendrobium nobile hybrids[J]. Plant Growth Regulation,2014,72(3):249-255.
[26]張桂玲,冉 靚,羅緒強,等. 3種不同產地鐵皮石斛與鐵皮楓斗多糖、氨基酸及必需元素含量分析[J]. 江蘇農業科學,2017,45(14):146-149.
[27]陳 芳,谷曉平,梁 平,等. 不同栽培方式下鐵皮石斛有效成分和光合特性的變化[J]. 江蘇農業科學,2017,45(11):90-93.

