頭燈下經口直視的大鼠非暴露式氣管滴注法的建立
龍隆, 譚紅, 楊鴻波
(1. 中國鐵路成都局集團有限公司重慶疾病預防控制所, 重慶400014;2. 貴州省分析測試研究院, 貴陽550000)
呼吸暴露是外界物質進入人機體最主要途徑之一,氣管滴注法在呼吸系統相關研究中因其具有穩定和精準等特點得到廣泛應用[1,2], 雖然近年來自然吸入染毒法的應用呈上升趨勢, 但其成本較高,還存在暴露倉內濃度分布不均, 均一性和穩定性都難以滿足實驗要求等諸多問題,氣管滴注法在國內仍然擁有較高的使用率。由于大鼠聲門位置較高,插管時聲門暴露困難,迅速而準確行氣管滴注操作十分關鍵,暴露式氣管滴注方法雖然簡便快捷,但對動物機體損傷比較大,在慢性或亞慢性實驗中,往往需要反復多次滴注,組織反復損傷及術后感染都會對實驗動物的機體造成損傷。本研究在總結了既往國內外相關研究和探索改良的基礎上, 設計出一種兼顧安全和高效的非暴露式氣管滴注方法, 為今后相關實驗研究提供參考。
1 材料與方法
1.1 實驗動物與材料
SPF級雄性SD大鼠20只, 體質量200~350 g,購自北京維通利華實驗動物技術有限公司[SCXK(京)2012-0001],常規飼養于貴州健安德科技有限公司實驗動物中心屏障系統(IVC)中[SYXK(黔)2016-005]。12 h明暗晝夜交替, 設施溫度22~24 ℃,相對濕度50%~70%,正常飲食飲水。
將22G Y型靜脈留置針針芯的針尖磨平去掉約2 mm(以免插管時損傷氣管)后回插入留置針套管, 但不完全插入, 針尖與套管前端保留大約3 mm的距離,防止針尖對動物氣道造成損傷(圖1)。強光變焦頭燈(直徑65 mm,深度60 mm)(圖2)。其他材料包括棉簽、紗布、膠帶纏繞過的小夾子、解剖板、皮筋、絲線、1 mL注射器。
1.2 方法
1.2.1 麻醉與固定采用腹腔注射1%戊巴比妥鈉按30 mg/kg體質量進行麻醉,用絲線套住大鼠上切牙,仰臥吊于45~60°傾斜的解剖板上固定,用皮筋將大鼠四肢固定于解剖板,并在動物頸后部墊一塊紗布抬高氣管位置,便于后續插管。
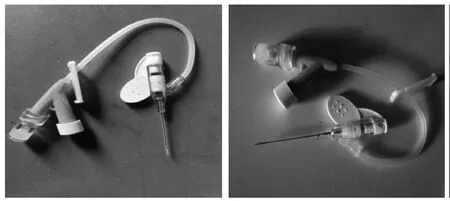
圖 1 自制滴注裝置

圖 2 強光變焦頭燈
1.2.2 氣管插管和滴注 實驗人員帶好頭燈,將臺燈發散的光源照進動物口腔,左手拇指和食指將動物舌體輕輕牽拉至一側后用包裹了膠帶的小夾子將舌體輕輕夾住,再用棉簽擦拭動物咽部分泌物的同時輕壓舌體并固定,左手中指用于調整動物體位,調整好操作手法以及頭燈角度后可以清晰看見咽部和忽明忽暗的聲門裂,右手持含有針芯的磨鈍的自制靜脈留置針套管在頭燈的輔助下迅速插入氣管口約3 cm,輕輕將針芯從套管中抽出,并用膠帶將套管固定,松開牽出的舌體,此時可以觀察到導管內有呼吸所致蒸氣貼壁現象,將細棉絲放置于套管的注射器接口,能夠看見細棉絲伴隨著大鼠呼吸而飄動,如若不然,則需重新插管。用1 mL注射器吸取0.1 mL生理鹽水后連接套管并緩慢注入,再注入同體積空氣。
1.2.3 滴注后操作 迅速拔出靜脈留置針套管, 關閉光源, 懸掛約半分鐘后平放于手術臺上旋轉, 模擬真實給藥染毒, 使生理鹽水在兩肺內均勻分布。
2 結果
本實驗采用隔日滴注,每只動物分7 d滴注4次,共進行40次大鼠氣管滴注操作,全部一次性成功,滴注操作大約3 min,每只實驗動物在操作過程中沒有出現呼吸急促等現象均能保持較平穩呼吸,沒有出現窒息或死亡,動物蘇醒后進食、飲水、活動等一般觀察均無異常,解剖后檢查也未見氣管損傷等情況。
3 討論
方法建立注意事項: ①掌握合適的麻醉深度是完成氣管插管的前提。麻醉過淺會導致實驗動物不能進入麻醉狀態或進入麻醉狀態較慢, 甚至在氣管滴注過程中出現強烈的應激反應, 從而影響動物生理狀態。麻醉劑量過大容易造成實驗動物發生呼吸抑制而死亡,這就要求我們需要協調麻醉速度與氣管滴注操作速度, 使其穩步有序。經過前期的預實驗和大量文獻的收集, 我們發現腹腔注射1%戊巴比妥鈉按30 mg/kg體質量進行麻醉能使動物較快、較好進入麻醉狀態, 并且用小鑷子輕夾大鼠的四趾腳趾, 大鼠無任何反應。②牽拉實驗動物舌體時手法要輕柔, 在保證撐開口腔的同時要避免損傷到動物。③行氣管滴注操作前要對套管插入深度進行解剖觀察,切勿盲插,減少對動物的損傷。④正式實驗前需進行滴注液體體積的測試。在預實驗中, 使用不同的靜脈留置針和注射器在行滴注操作過程時, 實際的滴注劑量有所偏差,并且滴注時使用的注射器底部容易殘留液體, 導致實際給藥往往小于理論給藥, 偏差大約在0.01 mL以內。因此在進行正式滴注染毒操作前需先測試其體積, 反復充盈整個滴注裝置, 觀察實際劑量與注射劑量的差值, 確保染毒劑量的精準。⑤滴注完畢后可以適當補氣, 防止動物窒息, 同時應注意控制補氣速度和補氣量。根據既往研究和預實驗,我們在滴注完畢后將1 mL空氣1.5 s內注入氣道,達到分散染毒物質以及避免動物窒息等問題。⑥整個滴注操作過程應盡量迅速, 筆者認為,滴注操作應控制在2 min以內為宜, 若滴注時間較長容易發生缺氧或窒息。同時動物在麻醉期間體溫容易下降,需要采取一定的保溫措施。
現階段與呼吸系統相關的研究呈逐年上升的趨勢,但自然吸入法受到多種條件的限制并未廣泛開展,目前國內外采用氣管滴注法還是比較常見,但操作方式并不一致[2-4]。本文介紹的氣管滴注法與既往的滴注法相比具有更安全、廉價和更快捷、高效等特點。
早在1980年代就有學者采用盲探插管法成功率高達90%[5],但插管耗時較長,同時還存在需反復試插,對動物咽喉部及氣道造成損傷的缺點,該法對實驗人員的技術要求較高,因此并未廣泛開展,高效而精準的氣管滴注法仍需借助其他設備。有學者[6,7]使用自制的光纖引入口腔內照明進行氣管插管,成功率較高,但成本高、過程較慢。Fuentes等[8]使用電子內鏡輔助操作,保證了成功率,但操作繁雜無法達到快速插管的缺點。有研究提出將顯微導絲應用于氣管滴注[9],但也存在上述問題。據報道,在透射燈以及額鏡下行氣管滴注效果較好[10]。
本研究通過總結國內外氣管滴注相關實驗研究, 探索出頭燈下經口直視氣管滴注法, 事先將動物分批麻醉, 然后使用頭燈行氣管滴注的操作, 不僅廉價安全而且可靠, 僅需一個實驗人員便能完成整個滴注操作, 與傳統滴注需要兩位實驗人員相比,效率進一步提高。綜上所述,應用頭燈行氣管滴注操作簡單,快速,安全,廉價,可重復性強,可廣泛應用于大鼠呼吸道給藥染毒等相關研究。

