例談?dòng)嘘P(guān)晶胞的計(jì)算類(lèi)型與方法
李宗來(lái) 李小娟
(江蘇省響水中學(xué) 224600)
作為選考《物質(zhì)結(jié)構(gòu)與性質(zhì)》的固定考點(diǎn)-有關(guān)晶胞的計(jì)算是學(xué)生感覺(jué)最為頭疼、棘手的一個(gè)難點(diǎn),它體現(xiàn)了高考考試說(shuō)明中提出的“將化學(xué)問(wèn)題抽象為數(shù)學(xué)問(wèn)題,利用數(shù)學(xué)工具,通過(guò)計(jì)算和推理解決化學(xué)問(wèn)題的能力”的要求,因此掌握融合化學(xué)晶體知識(shí)的數(shù)學(xué)推算方法與技巧,進(jìn)行重難點(diǎn)的有效突破是當(dāng)務(wù)之急,本文例析晶胞計(jì)算的基本類(lèi)型,回顧有關(guān)晶體的重要考點(diǎn),探尋命題的規(guī)律與方向,形成一定的解題思路、方法和技巧,同時(shí)也希望能夠消解同學(xué)們對(duì)此類(lèi)試題的畏懼心理,從而提高得分率.
一、有關(guān)晶胞中的微粒個(gè)數(shù)的計(jì)算
例1(2017江蘇卷)某FexNy的晶胞如圖1所示,Cu可以完全替代該晶體中a位置Fe或者b位置Fe,形成Cu替代型產(chǎn)物Fex-n)CunNy.FexNy轉(zhuǎn)化為兩種Cu替代型產(chǎn)物的能量變化如圖2所示,其中更穩(wěn)定的Cu替代型產(chǎn)物的化學(xué)式為_(kāi)___.
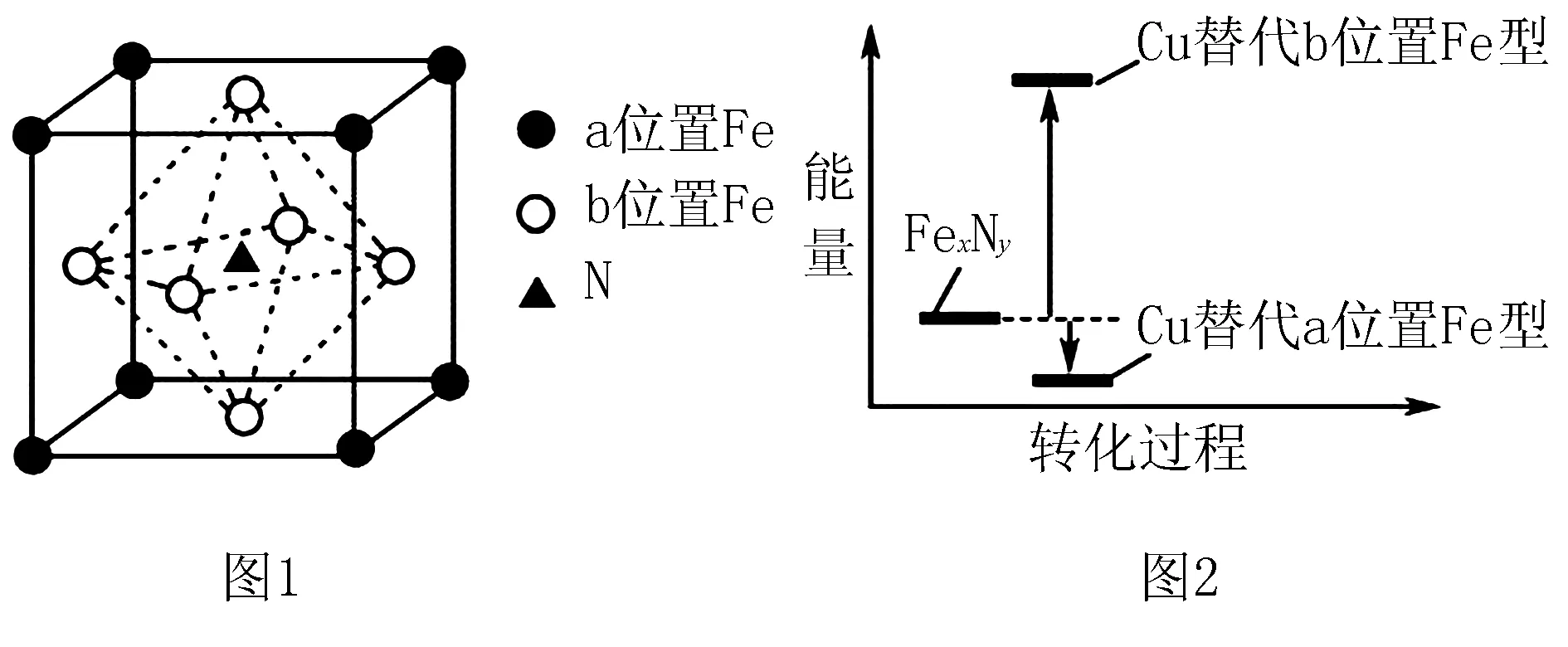
解析由圖2可知,Cu替代a位置的Fe時(shí)能量較低,更穩(wěn)定,則Cu位于頂點(diǎn),N(Cu)=8×1/8=1,F(xiàn)e位于面心,N(Fe)=6×1/2=3,N位于體心,則只有1個(gè)N,其化學(xué)式為Fe3CuN.
點(diǎn)評(píng)本題新穎之處將晶胞的微粒的計(jì)算與轉(zhuǎn)化過(guò)程中能量變化圖有機(jī)融合,考查考生對(duì)圖形圖像信息整合、吸收應(yīng)用的能力,解題時(shí)要精準(zhǔn)解讀題干信息,聯(lián)系并應(yīng)用相關(guān)化學(xué)知識(shí)原理、規(guī)律,如能量越低越穩(wěn)定、化合物的正負(fù)化合價(jià)的代數(shù)和為0等,復(fù)習(xí)時(shí)打通不同模塊間的界定,注重知識(shí)點(diǎn)間的融合貫通、發(fā)散延伸至關(guān)重要,這也是未來(lái)高考命題的一種趨勢(shì).
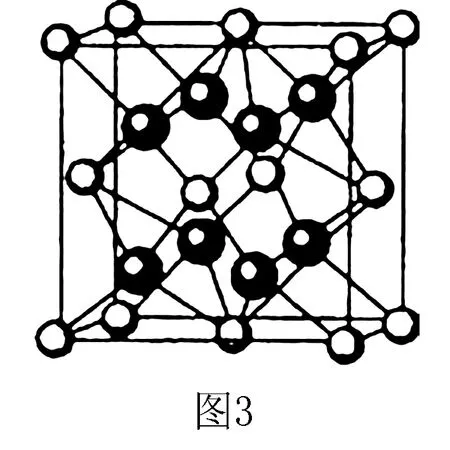
變式練習(xí):1.(2016四川卷)M、R為原子序數(shù)依次增大的短周期主族元素,M基態(tài)原子L層中p軌道電子數(shù)是s電子的2倍,R是同周期元素中最活潑的金屬元素,M和R所形成的一種離子化合物R2M晶體的晶胞如圖3所示,則圖中黑球代表的離子是____(填離子符號(hào)).
解析根據(jù)信息推斷出M基態(tài)原子電子排布為1s22s22p4,是O;R是Na,離子化合物為Na2O,通過(guò)晶胞計(jì)算白球=8×1/8+6×1/2=4,在晶胞內(nèi)部黑球=8,因此黑球代表Na+.

2. (2019泰州一模) 紅鎳礦是一種重要的含鎳礦物,其主要成分的晶胞如圖4所示,則每個(gè)Ni原子周?chē)c之緊鄰的As原子數(shù)為_(kāi)___.
解析根據(jù)晶胞圖可得N(Ni)=8×1/8+4×1/4=2,As在晶胞內(nèi)部N(As)=2,N(Ni)∶N(As)=1∶1,原子周?chē)o鄰原子的數(shù)目(配位數(shù))=晶胞內(nèi)原子的比值的反比,由圖可得As原子周?chē)c之緊鄰Ni原子為6,故每個(gè)Ni原子周?chē)c之緊鄰的As原子數(shù)也為6.
方法總結(jié)晶胞中粒子的計(jì)算應(yīng)用均攤法,立方體晶胞計(jì)算:頂點(diǎn)貢獻(xiàn)1/8、棱邊1/4、面心1/2、體心1;六棱柱晶胞計(jì)算頂點(diǎn)貢獻(xiàn)1/6、側(cè)棱邊1/3、其它棱邊1/4、面心1/2、體心1,三棱柱晶胞頂點(diǎn)貢獻(xiàn)1/12,側(cè)棱邊為1/6,上下棱上為1/4,面上的算為1/2,如果是分子簇團(tuán),就不能按照晶胞來(lái)計(jì)算,應(yīng)該作為一個(gè)整體進(jìn)行計(jì)數(shù),解題時(shí)仔細(xì)審題,看清每個(gè)粒子的所代表的圖形符號(hào)及在晶胞中所處的位置.有關(guān)晶胞中的微粒個(gè)數(shù)的計(jì)算考查設(shè)問(wèn)角度有:
(1)寫(xiě)化學(xué)式:要按照習(xí)慣要求來(lái)寫(xiě),金屬元素在前,非金屬在后,寫(xiě)出原子的最簡(jiǎn)整數(shù)比;
(2)根據(jù)化學(xué)式再結(jié)合化合價(jià)的代數(shù)和為0進(jìn)行簡(jiǎn)單推算;
(3)判斷晶胞圖中特定符號(hào)所代表的微粒及個(gè)數(shù);
(4)判斷晶胞中某粒子周?chē)o鄰且等距其它粒子數(shù)(配位數(shù)),要根據(jù)晶胞圖結(jié)合一定的空間拓展想象能力, NaCl型晶胞的配位數(shù)為6,CsCl型為8,六方最密堆積和面心立方最密堆積的配位數(shù)都是12,當(dāng)晶胞圖不好辨別時(shí),可以通過(guò)計(jì)算晶胞內(nèi)原子間的比值,原子間配位數(shù)的比值的與晶胞內(nèi)原子間的比值成反比,加以推算得出.
二、有關(guān)晶體的密度計(jì)算

例2 (2018年全國(guó)Ⅲ卷)金屬Zn晶體中的原子堆積方式如圖5所示,這種堆積方式稱(chēng)為_(kāi)___.六棱柱底邊邊長(zhǎng)為acm,高為ccm,阿伏加德羅常數(shù)的值為NA,Zn的密度為_(kāi)___g·cm-3(列出計(jì)算式).

點(diǎn)評(píng)有關(guān)晶體的密度計(jì)算是每年全國(guó)卷必考的內(nèi)容之一,契合了考試說(shuō)明中“能根據(jù)晶胞確定晶體的組成并進(jìn)行相關(guān)的計(jì)算”的要求,本題是在選考《物質(zhì)結(jié)構(gòu)與性質(zhì)》中比較常規(guī)的綜合習(xí)題,側(cè)重于核心重點(diǎn)知識(shí)的考查,本題的解答過(guò)程中選擇六棱柱作為計(jì)算單元是創(chuàng)新之舉,但要注意六棱柱并不是該晶體的晶胞(晶胞一定是平行六面體),但是作為一個(gè)計(jì)算晶體密度的單元是可以的.全國(guó)卷注重于晶體密度的計(jì)算的拓展延伸,如涉及不同類(lèi)型的晶體晶胞的計(jì)算、由密度求晶胞參數(shù)等設(shè)問(wèn)角度的也在不斷變換.
變式練習(xí):

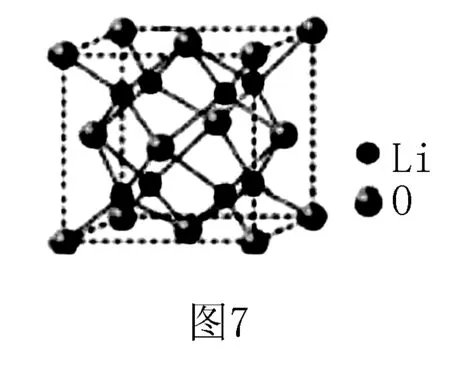
4.(2018全國(guó)Ⅰ卷)Li2O具有反螢石結(jié)構(gòu),晶胞如圖7所示.已知晶胞參數(shù)為0.4665 nm,阿伏加德羅常數(shù)的值為NA,則Li2O的密度為_(kāi)___g·cm-3(列出計(jì)算式).
5.(2017全國(guó)Ⅱ卷)R的晶體密度為dg·cm-3,其立方晶胞參數(shù)為anm,晶胞中含有y個(gè)[(N5)6(H3O)3(NH4)4Cl]單元,該單元的相對(duì)質(zhì)量為M,則y的計(jì)算表達(dá)式為_(kāi)___.
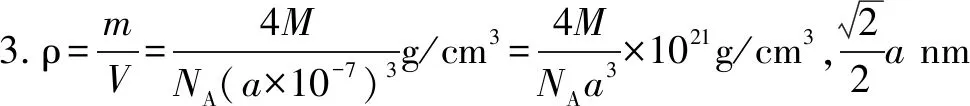
方法總結(jié)計(jì)算晶體密度的一般思維模型是:(1)求晶胞的質(zhì)量m,根據(jù)摩爾質(zhì)量(以g·mol-1為單位時(shí)在數(shù)值與相對(duì)分子質(zhì)量相同)除以阿伏伽德羅常數(shù)計(jì)算出每個(gè)微粒的質(zhì)量,再根據(jù)計(jì)算出晶胞中所含微粒的個(gè)數(shù),從而得出晶胞的總質(zhì)量=晶胞中所含粒子的個(gè)數(shù)×每個(gè)微粒的質(zhì)量;(2)求晶胞的體積V,應(yīng)用立體幾何知識(shí),根據(jù)提供的晶胞參數(shù)(邊長(zhǎng))求出晶胞的體積,如常見(jiàn)的立方晶胞、六棱柱、三棱柱晶體結(jié)構(gòu)單元的體積計(jì)算,注意單位的換算如1nm(納米)=1×10-9m=1×10-7cm,1pm(皮米)=1×10-12m=1×10-10cm;(3)再由ρ=m/V,得出其密度,因此晶胞中粒子計(jì)算是基礎(chǔ),晶胞體積的計(jì)算是關(guān)鍵,注意單位的換算是要留意的細(xì)節(jié),同時(shí)要注意密度、晶胞參數(shù)、晶胞中粒子個(gè)數(shù)的之間相互換算的考查,結(jié)合阿伏加德羅常數(shù)、晶胞體積、密度的計(jì)算,可以把微觀的晶胞結(jié)構(gòu)和宏觀物質(zhì)的密度、摩爾質(zhì)量等聯(lián)系起來(lái),體現(xiàn)高考中“宏觀辨識(shí)”與“微觀探析”的化學(xué)學(xué)科核心素養(yǎng)的要求,也貫徹了必備知識(shí)與關(guān)鍵能力的考查要求,因此要引起足夠的重視.
三、有關(guān)晶胞參數(shù)的計(jì)算
例3(2016全國(guó)Ⅱ卷)某鎳白銅合金的立方晶胞結(jié)構(gòu)如圖8所示.
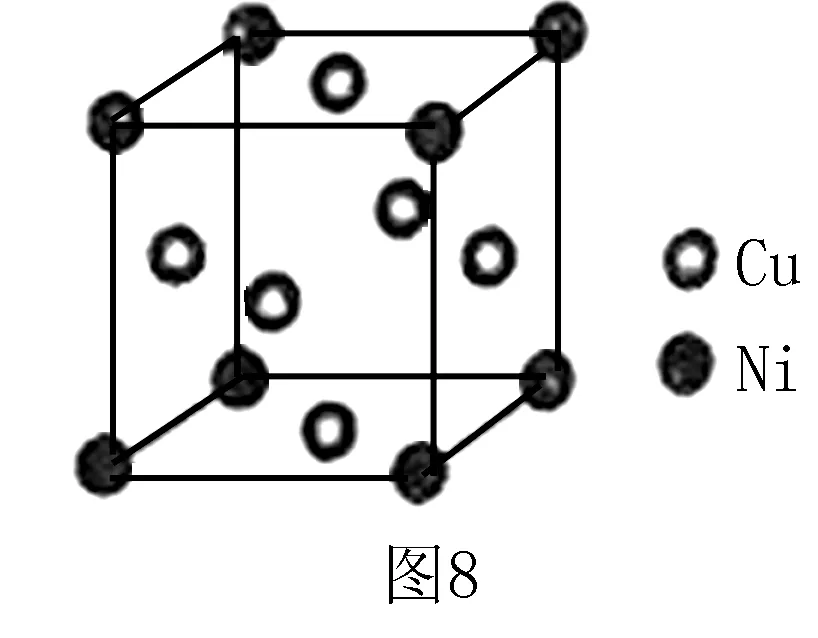
(1)晶胞中銅原子與鎳原子的數(shù)量比為_(kāi)___.
(2)若合金的密度為dg/cm3,晶胞參數(shù)a=____nm.
解析(1)應(yīng)用均攤法可得晶胞中含N(Cu) =6×1/2=3,N(Ni) =8×1/8=1,N(Cu)∶N(Ni)=3∶1,
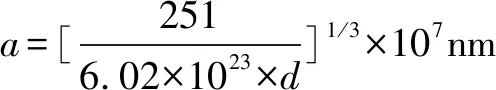
變式練習(xí):6.(2017全國(guó)Ⅰ卷)KIO3晶體是一種性能良好的非線性光學(xué)材料,具有鈣鈦礦型的立體結(jié)構(gòu),邊長(zhǎng)為a=0.446nm,晶胞中K、I、O分別處于頂角、體心、面心位置,如圖9所示.(1)K與O間的最短距離為_(kāi)___nm,與K緊鄰的O個(gè)數(shù)為_(kāi)___.
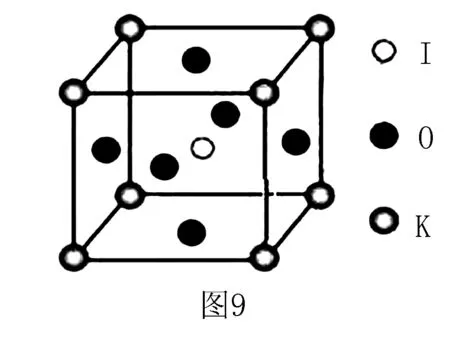
(2)在KIO3晶胞結(jié)構(gòu)的另一種表示中,I處于各頂角位置,則K處于____位置,O處于____位置.

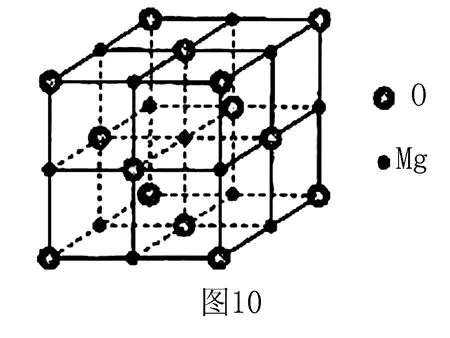
7.(2017全國(guó)Ⅲ卷)MgO具有NaCl型結(jié)構(gòu)(如圖10),其中陰離子采用面心立方最密堆積方式, X射線衍射實(shí)驗(yàn)測(cè)得MgO的晶胞參數(shù)為a=0.420nm,則r(O2-)為_(kāi)___nm.MnO也屬于NaCl型結(jié)構(gòu),晶胞參數(shù)為a′=0.448 nm,則r(Mn2+)為_(kāi)___nm.

8.(2016全國(guó)Ⅰ卷)晶胞有兩個(gè)基本要素:

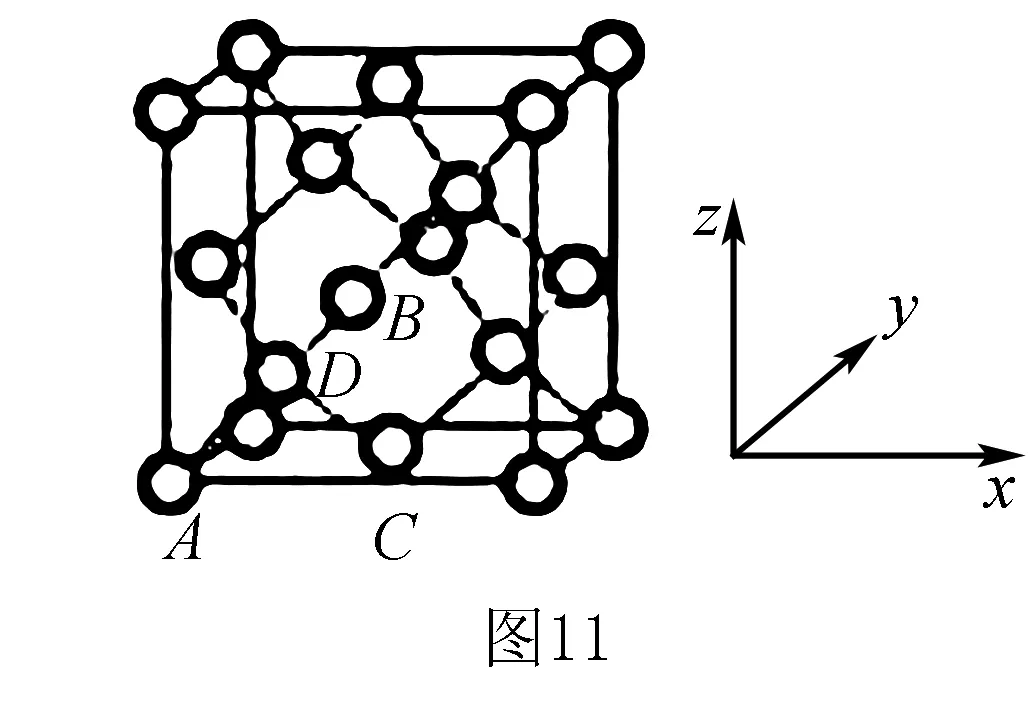
(2)晶胞參數(shù),描述晶胞的大小和形狀,已知Ge單晶的晶胞參數(shù)a=565.76 pm,其密度為_(kāi)___g·cm-3(列出計(jì)算式即可).
方法總結(jié)晶胞是能完整反映晶體內(nèi)部原子或離子在三維空間分布結(jié)構(gòu)特征的最小單元的平行六面體.用來(lái)表示晶胞的形狀和大小的6個(gè)特征參數(shù),簡(jiǎn)稱(chēng)晶胞參數(shù),包括晶胞的3組棱長(zhǎng)(即晶體的軸長(zhǎng))a、b、c和3組棱相互間的夾角(即晶體的軸角)α、β、γ.高考中晶胞參數(shù)a指的是正四面體的邊長(zhǎng),通過(guò)晶體密度求解晶胞參數(shù)a的基本思路是:通過(guò)摩爾質(zhì)量、阿伏伽德羅常數(shù)、晶胞所含微粒數(shù)計(jì)算出晶胞質(zhì)量,建立已經(jīng)密度與體積的關(guān)系,而體積可以通過(guò)晶胞參數(shù)a進(jìn)行求解,從而求出a值,同時(shí)注意晶胞參數(shù)的計(jì)算可以延伸到晶胞中原子坐標(biāo)、原子間距離、原子半徑的考查,因此這不僅僅是化學(xué)知識(shí)的簡(jiǎn)單考查,而是要具備利用數(shù)學(xué)工具,通過(guò)計(jì)算和推理解決化學(xué)問(wèn)題的能力要求,高考試題不僅是不同知識(shí)點(diǎn)的融合,更是跨越不同學(xué)科間的相互滲透.
四、有關(guān)晶胞中原子占體積百分率的計(jì)算
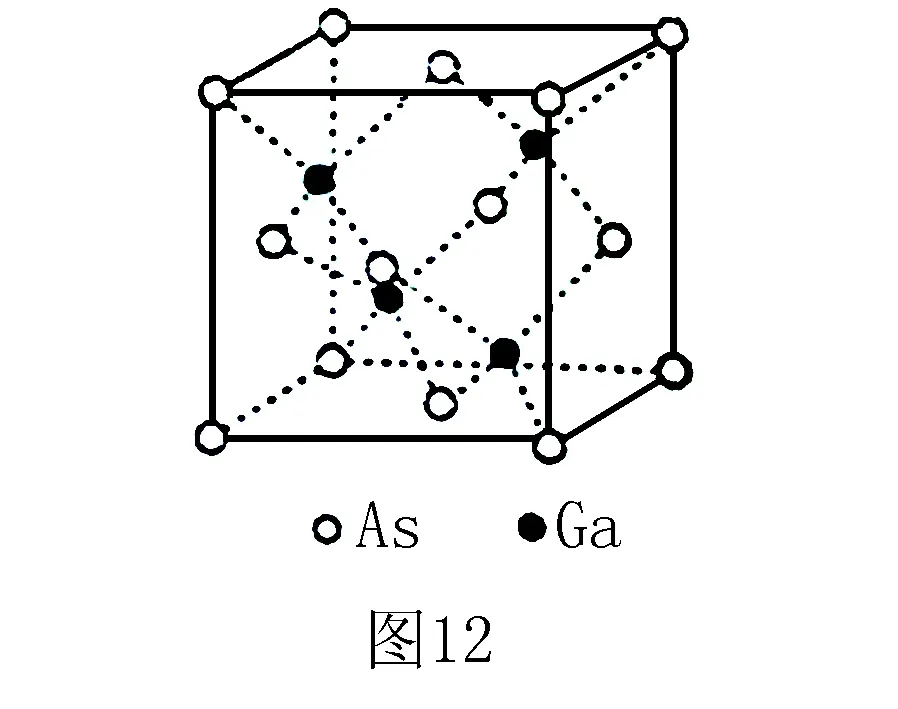
例4 (2016全國(guó)Ⅲ卷)GaAs(砷化鎵)的熔點(diǎn)為1238℃,密度為ρg·cm-3,其晶胞結(jié)構(gòu)如圖12所示.該晶體的類(lèi)型為_(kāi)___,Ga與As以____鍵鍵合.Ga和As的摩爾質(zhì)量分別為MGag·mol-1和MAsg·mol-1,原子半徑分別為rGapm和rAspm,阿伏加德羅常數(shù)值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為_(kāi)___.
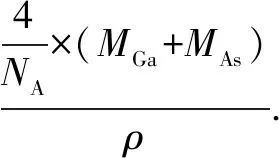
方法總結(jié)晶胞中原子的體積占晶胞體積的百分率也稱(chēng)為空間利用率,指構(gòu)成晶體的原子、離子或分子在整個(gè)晶體空間中所占有的體積百分比.晶胞都是平行六面體,整塊晶體可以看成是無(wú)數(shù)晶胞無(wú)隙并置而成的,空間利用率=晶胞中原子的體積之和÷晶胞的總體積×100%,因此計(jì)算的關(guān)鍵是:
(1)把原子當(dāng)成球體,根據(jù)原子半徑r計(jì)算體積為4/3πr3,計(jì)算出晶胞中原子的體積之和=晶胞中所含原子個(gè)數(shù)×4/3πr3;
(2)計(jì)算晶胞的總體積,可以通過(guò)晶胞參數(shù)a進(jìn)行求解,如立方晶胞時(shí)V=a3,其它晶體結(jié)構(gòu)單元結(jié)合幾何知識(shí)求解,也可以通過(guò)晶胞的質(zhì)量÷晶體密度求解.同時(shí)也要注意已知晶胞中原子的空間利用率,然后反推出原子的半徑或者晶胞參數(shù)的表達(dá)式.
綜上所述,涉及晶胞的相關(guān)計(jì)算,計(jì)算晶胞中粒子個(gè)數(shù)是基礎(chǔ),計(jì)算體積是關(guān)鍵,計(jì)算密度是高頻考點(diǎn),因此在備考中夯實(shí)基礎(chǔ)、總結(jié)規(guī)律、消除恐懼、樹(shù)立信心定會(huì)起到“事半功倍”的效果.

