一種高親和結合I型膠原蛋白的GST融合蛋白表達分析
董育紅, 李遂焰, 陳渝萍
(1. 西南交通大學 生命科學與工程學院, 成都 610031; 2. 西南交通大學 材料科學與工程學院, 成都 610031; 3. 南華大學 藥學與生命科學學院, 衡陽 421001)
當前臨床治療亟待解決的難題是如何提高藥物治療療效并降低乃至去除其毒副作用,藥物的靶向性研究越來越受到重視[1-2]。纖維化疾病(包括系統性硬化、肺纖維化、肝硬化、進展性腎病、骨髓纖維化等)病人的組織中異常沉積細胞外基質蛋白(ECM),使組織變硬、順應性降低,破壞組織器官的結構和功能,危害人們的健康乃至生命[3-7]。其中,I型膠原蛋白的增多極為顯著[8-12]。人類胎盤生長因子2(Placental Growth Factor,PlGF-2)的氨基酸123~144肽段(PlGF-2123-144)介導其對多種ECM蛋白尤其是對I型膠原蛋白的高親性[13]。這些研究結果啟發我們利用該短肽去修飾抗纖維化藥物,可使其獲得和I型膠原蛋白結合的能力,更易于為I型膠原蛋白豐富的纖維組織捕捉和留滯,進而提高其療效。本研究對人PlGF-2123-144的編碼DNA序列進行修改、構建了GST-PlGF-2123-144融合蛋白的原核表達質粒,采用E.coliBL21原核系統進行大量表達,親和純化獲得了具備和I型膠原蛋白高親性結合的GST-PlGF-2123-14融合蛋白,為進一步研發靶向治療各種纖維化疾病的藥物奠定了基礎。
1 材料與方法
1.1 材料
大腸桿菌DH5α和BL21購自北京擎科公司;pMD19-T連接試劑盒和1 kb DNA Marker購于大連寶生;PCR試劑盒,購自天根或NEB-北京;DNA內切酶和連接酶購自NEB-北京;質粒提取試劑盒購自北京莊盟;膠回收試劑盒購自Axygen, SDS-PAGE蛋白電泳試劑耗材膜和ECL化學發光試劑盒均購自BioRad。GST鼠單克隆抗體和HRP標記的羊抗鼠IgG分別來自Affinity Biosciences和Invitrogen;pGEX-4T-1質粒和Glutathione Sepharose 4B購自GE Healthcare,L-還原性谷胱甘肽來自TOCRIS;溶菌酶、I型膠原蛋白購自Sigma-Aldrich;引物由上海生工合成。其他國產化學試劑均為分析純。
1.2 方法
1.2.1PlGF-2123-144基因片段的獲得
采用“JCat”軟件對人PlGF-2第123~144位氨基酸所對應的DNA序列進行修改、融入大腸桿菌偏愛密碼子,設計出PlGF-2123-144序列。所用引物序列如下。 F:5′-GAATTCCGTCGTC GTCCGAAAGGTCGTGGTAAAC GTCGTCGTGAAAAACAG-3′和R:5′-GTCGACCAGGTGGCAGT CGGTCGGACGCTGTTTTTCACGACGACGTTTACC-3′。 以常規PCR反應擴增后將PCR產物與pMD19-T線性載體連接、轉化DH5α感受態細胞。陽性菌落經藍白篩選、克隆PCR和堿裂解法提取質粒并以Hind Ⅲ 單酶切和最后的陽性pMD19-PlGF-2123-144質粒測序鑒定。克隆PCR上游引物(5′-3′):ATGCAGAATTCCGTCGTCGT(畫線部分為EcoR I酶切位點);下游引物(5′-3′):ACGTACTCGAGCAGGTGGCAGTCG(畫線部分為XhoI酶切位點)。
1.2.2 GST-PlGF-2123-144重組表達載體的構建和鑒定
以pMD19-PlGF-2123-144為模板,采用上述克隆PCR引物擴增PlGF-2123-144基因片段。以EcoR I和XhoI分別對回收的PCR產物和pGEX-4T-1空質粒進行雙酶切、再分別以12% PAGE膠和0.8%瓊脂糖膠電泳分離和回收,T4DNA連接酶4 ℃連接過夜后轉化DH5α大腸桿菌。采用引物(上游引物(5′-3′):GGGCTGGCAAGCCACGTTTGGTG,下游引物(5′-3′):CCGGGAGCTGCATGTGTCAGAGG)進行菌落PCR篩選陽性細菌,最后經測序鑒定獲得GST-PlGF-2123-144融合蛋白表達質粒。分別將pGEX-4T-1質粒和重組pGEX4T1-PlGF-2123-144質粒轉化BL21大腸桿菌,獲得GST融合蛋白的工作菌種。
1.2.3 GST、GST-PlGF-2123-144蛋白的誘導表達和純化
BL21單菌落接種于Amp+/LB液體培養基中,37 ℃振搖過夜后,1∶1000稀釋到Amp+/2XYT培養基中,37 ℃振蕩培養至對數生長期OD550=0.8。加入IPTG于30 ℃、250 r/min繼續震蕩培養。對不同IPTG終濃度(0.1、0.5、1.0、2.0和4.0 mmol/L,誘導6 h)和不同誘導時間(2、4和6 h,1 mmol/L IPTG)的培養菌液進行收集、裂解和Western Blot分析檢測,對陽性條帶進行光密度掃描分析,確定最優表達條件。
使用最優條件大量誘導蛋白表達,收集細菌以溶菌酶裂解,離心取上清。上清(相當于20 mL菌液)中的目的蛋白經Glutathione Sepharose 4B膠泥親和吸附和10 mmol/L還原性谷胱甘肽(pH 8.0)洗脫。以考馬斯亮藍染色和Western Blot分析追蹤GST融合蛋白的純化情形。洗脫的目的蛋白以含10%甘油及0.01 mmol/L DTT的PBS溶液進行透析并以BCA方法定量。
1.2.4 融合蛋白對I型膠原蛋白的親和活性的ELISA實驗測定
按照圖1所示流程進行ELISA實驗。ELISA孔板首先用100 μL I型膠原蛋白包埋4℃ 過夜、干燥過夜,隨后脫脂牛奶進行封閉。孔板漂洗后再分別加入 GST融合蛋白和膠原蛋白共孵育。漂洗后加入GST一抗(1∶5000)4 ℃孵育過夜檢測滯留的GST蛋白。二抗孵育后,加入0.3% H2O2甲醇溶液封閉、進行常規顯色。讀取各孔450 nm處OD值并計算GST信號。

圖1 ELISA實驗流程示意圖
1.2.5 統計學分析
實驗數據均以平均值±標準差(x±s)表示。采用TTEST檢驗方法比較同等摩爾數的GST和GST-PlGF-2123-144蛋白的組間差異,P< 0.05表示組間有顯著性差異。
2 結果與分析
2.1 PlGF-2123-144基因片段的獲得
采用各含部分PlGF-2123-144DNA序列的兩段引物進行退火和PCR擴增,獲得含PlGF-2123-144序列的擴增產物(圖2-A);隨后與pMD19-T載體連接,轉化E.coliDH5α感受態細胞。挑選白色菌落進行菌落PCR,2%瓊脂糖凝膠電泳顯示100 bp處有一條特異性條帶,與PlGF-2123-144(88 bp)片段大小基本相符(圖2-B)。提取陽性細菌質粒,使用Hind Ⅲ 進行單酶切。圖2-C的0.8%瓊脂糖電泳結果顯示,1泳道1.9 kb 的未線性化質粒在單酶切后產生約2.7 kb的片段,和pMD19-PlGF-2123-1442770 bp的大小符合(2號泳道)。測序結果顯示PlGF-2123-144目的DNA序列成功克隆到pMD19質粒(圖2-D)。
2.2 重組表達載體的構建和鑒定
以pMD19-PlGF-2123-144為模板擴增PlGF-2123-144片段,酶切后插入pGEX4T1表達質粒。圖3-A是pGEX4T1-PlGF-2123-144質粒菌落PCR的瓊脂糖凝膠電泳檢測結果。與陰性對照對比,陽性重組質粒擴增結果產生了一條單一擴增條帶,位置非常接近229 bp目標片段。圖3-B的測序結果證實了PlGF-2123-144的DNA序列被成功克隆到pGEX4T1質粒。圖3-C和D分別是pGEX4T1和pGEX4T1-PlGF-2123-144轉化E.coliBL21后質粒酶切的鑒定結果:EcoR I單酶切產生的約5 kb單一片段在結合EcoR V進行雙酶切后,可被斷裂為2和3 kb大小的兩個片段,表明兩種pGEX4T1質粒均被成功導入E.coliBL21。

A:PlGF-2123-144序列的PCR擴增;B:pMD19-PlGF-2123-144菌落PCR;C:pMD19-PlGF-2123-144質粒單酶切;D:pMD19-PlGF-2123-144測序
圖2pMD19-PlGF-2123-144質粒構建和鑒定
Figure 2 Construction and characterization of pMD19-PlGF-2123-144plasmid

A:菌落PCR;B:測序結果;C:pGEX-4T-1轉化BL 21酶切結果;D:pGEX4T1-PlGF-2123-144轉化BL 21酶切鑒定結果
圖3重組質粒pGEX4T1-PlGF-2123-144質粒鑒定和轉化BL21鑒定結果
Figure 3 Identification and transformation of BL21 by recombinant plasmid pGEX4T1-PlGF-2123-144
2.3 GST和GST- PlGF-2123-144蛋白的誘導表達
以30 ℃為誘導溫度,探索IPTG誘導濃度(0.1~4 mmol/L)和誘導時間(1~4 h)對兩種GST蛋白誘導表達的影響。如圖4-A所示,1 mmol/L IPTG誘導6 h后,GST的蛋白產量和在細菌裂解上清中的所占比例都已達到較好水平。圖4-B的Western Blot分析結果則顯示了GST-PlGF-2123-144蛋白在不同條件下都有較好的誘導表達。進一步對目的蛋白陽性條帶進行光密度掃描定量分析,發現1 mmol/L IPTG時,不同誘導時間樣品的光密度分別為3734.95、5358.32、7231.04和7681.65,說明蛋白產量隨誘導時間延長而增多。當設定誘導時間6 h,不同IPTG濃度下樣品的光密度分別為8895.96、7990.42、7681.65、6246.76和8078.79,蛋白產量在0.1 mmol/L IPTG時最高,0.5和1 mmol/L時降低10%,2 mmol/L時則降了近30%,表明IPTG過高對GST-PlGF-2123-144蛋白產量有負面影響。進一步分析誘導6 h后目的蛋白在裂解上清和沉淀中的分配比例,發現在誘導IPTG濃度為0.1、0.5、1、2 和4 mmol/L時,目的蛋白的分配比例依次為1.21、1.07、1.08和1.00(其中4 mmol/L沉淀樣品不具備分析性未進行分析)。因此,在30 ℃、0.1 mmol/L IPTG和6 h的誘導條件下,可溶性GST-PlGF-2123-144蛋白產量可達最高。
通過對細菌總蛋白進行考馬斯亮藍染色,我們比較了GST和GST-PlGF-2123-144融合蛋白表達產量。圖5-B為來自相同誘導培養條件(1 mmol/L IPTG,6 h)下等量菌液中兩種蛋白的表達結果。占細菌總蛋白41%的是GST蛋白,GST-PlGF-2123-144蛋白所占比例有所下降,約為34%;而GST-PlGF-2123-144蛋白表達量約為GST蛋白的83%。
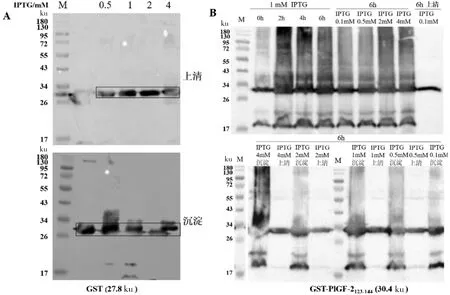
A:GST蛋白;B:GST-PlGF-2123-144蛋白
圖4GST和GST-PlGF-2123-144蛋白的最適誘導表達條件的WesternBlot分析
Figure 4 Western Blot assay for optimization of the induced GST and GST-PlGF-2123-144proteins
2.4 GST和GST- PlGF-2123-144蛋白的純化
大量誘導表達GST和GST-PlGF-2123-144蛋白后,采用Glutathione Sepharose 4B親和性膠泥純化可溶性目的蛋白,并在每個純化步驟完成后取少量樣品、進行了SDS-PAGE和Western Blot分析。圖5考馬斯亮藍染色定量分析,GST洗脫液的純度分別為96%、98%和99%。GST-PlGF-2123-144的純度從72%、86%到97%。Western Blot結果顯示,膠泥親和吸附的GST蛋白在3次洗脫后已經從膠泥上脫吸附,而GST-PlGF-2123-144則需要更多的洗脫操作來保證充分回收。通過Glutathione Sepharose 4B膠泥親和吸附,我們很好地純化兩種目的蛋白。

A:GST蛋白;B:GST- PlGF-2123-144蛋白
圖5純化的GST和GST-PlGF-2123-144蛋白的考馬斯亮藍染色和WesternBlot分析
Figure 5 Coomassie blue staining and Western Blot analysis of the prepared GST and GST-PlGF-2123-144
2.5 ELISA實驗測定GST- PlGF-2123-144融合蛋白對I型膠原蛋白的親和活性
往I型膠原蛋白充分包被的96孔ELISA孔板中分別加入摩爾數相同的GST和GST-PlGF-2123-144兩種蛋白與I型膠原蛋白孵育,檢測目的蛋白活性。如圖6所示,和膠原蛋白孵育的GST蛋白即使從0.5 μmol增加到了6 μmol,孔板中GST的ELISA信號強度沒有改變;而當GST-PlGF-2123-144加入量增加到3 μmol和6 μmol時,孔板中GST的ELISA信號強度高出同等摩爾數GST蛋白組5.1倍(P=0.0291)和5.75倍(P=0.0131)。這個結果證實,GST-PlGF-2123-144融合蛋白的確具有良好的和I型膠原蛋白結合的活性。

圖6 ELISA實驗測定GST-PlGF-2123-144融合蛋白對I型膠原蛋白的親和活性
3 討論
纖維化的組織中,轉化生長因子-β刺激纖維母細胞和炎癥細胞等[14]大量分泌I型膠原蛋白,同時產生基質金屬蛋白酶抑制劑抑制膠原蛋白酶,使得I型膠原蛋白大量沉積[7-12]。這一特點使得I型膠原蛋白可以作為一個很好的靶向纖維化組織的靶點。近來研究顯示,PlGF-2123-144肽段對多種ECM蛋白(尤其是I型膠原蛋白)具有很強的親和結合活性,可使與其融合的細胞因子在組織中滯留、富集,提高細胞因子功效。已有研究表明,與PlGF-2123-144肽段融合后的PDGF-BB和VEGF-A細胞因子在治療小鼠的體外創傷上顯示出更加明顯的療效[13]。最近有人將IFNα與PlGF-2123-144肽段進行融合,獲得了抗癌活性高的IFNα[15]。
因此將PlGF-2123-144肽段用于改造抗纖維化藥物可賦予它們與I型膠原蛋白的高親和性,可以提高藥物對纖維化組織的靶向、增加藥物的有效治療濃度,還有助于藥物的緩釋。本研究所獲得的蛋白擁有較好的產量和純度,并很好地維持了同I型膠原蛋白結合的高親性,為進一步研究PlGF-2123-144對抗纖維化藥物改性,尋找更有效、副作用更小的抗纖維化藥物奠定了基礎。

