斑馬魚hoxb7a基因在hox基因簇中的作用研究
孟祥麗, 白金尊, 張緒帥, 李偉明, 祖 堯
(1.上海海洋大學科技部海洋生物科學國際聯合研究中心, 上海 201306;2.上海海洋大學水產種質資源發掘與利用教育部重點實驗室, 上海 201306; 3.上海海洋大學水產科學國家級實驗教學示范中心, 上海 201306)
Hox基因(Homebox gene)是編碼具有同源框的一大類轉錄因子家族,全名同源異型基因,在動物身體形態構建過程中發揮重要作用[1]。Hox基因無論大小,其序列中均含有一段由180~183個堿基組成的保守序列,該序列編碼60~61個氨基酸所構成的多肽區域,稱為同源結構域( homeodomain,HD)[2]。Hox基因有在染色體上成簇排列的特點,并且最早Hox基因在果蠅中被發現,而果蠅中只含有一個基因簇[3]。大多數脊椎動物在進化過程中經歷了基因組加倍,Hox基因在這個過程中也發生了加倍。如無頜類的海七鰓鰻有兩個Hox基因簇[4];大多數有頜類,包括人在內的哺乳動物,經歷了兩次全基因組加倍,具有4個Hox基因簇,小鼠中Hox基因簇分別命名為HoxA、HoxB、HoxC和HoxD[5],總共有39個Hox基因[6-7]。大多數硬骨魚包括模式動物斑馬魚經歷了額外的一次基因組加倍,最終形成7~8個基因簇。在斑馬魚中含有7個hox基因簇,共有48個基因[8-9]。斑馬魚hoxb7a在hoxba基因簇的中間位置,并且其在第7旁系同源組的同源基因在進化過程中丟失,所以hoxb7a成為hox基因簇第7同源組中僅存的基因。因此,沒有因為基因組加倍而產生冗余基因影響的hoxb7a,是探索hox單基因在hox基因簇中作用很好的候選基因。
CRISPR/Cas9(clustered regularly interspaced short palindromic repects/CRISPR-associated proteins,成簇的規律性間隔的短回文重復序列及相關的核酸內切酶)系統是繼TALENs(transcription activator-like(TAL)effector nucleases)[10]、ZFN(zinc finger nuclease)之后更方便高效的基因編輯系統[11]。CRISPR/Cas9系統具有操作簡單、成本低等優勢,目前已經被廣泛應用于多種模式生物中[12]。斑馬魚(Danio rerio)是一種小型熱帶魚類,體長3~4 cm,具有易飼養,產卵量大,生殖周期短,胚胎體外發育,便于觀察等優勢,是研究基因功能的理想模式生物。
為了研究hoxb7a在hox基因簇中的作用,作者利用CRISPR/Cas9技術在斑馬魚中構建了hoxb7a基因的突變體。通過檢測其他hox基因在hoxb7a突變體中的表達量變化,初步探究了hoxb7a在整個hox基因簇中發揮的作用,期望為hoxb7a基因功能機制的研究提供參考。
1 材料與方法
1.1 材料
1.1.1 斑馬魚的來源與飼養
本實驗所用野生型斑馬魚均為AB品系,養殖水溫為28.5 ℃。本實驗室提供設備完善的斑馬魚魚房,且提供專門為斑馬魚產卵的產卵缸。斑馬魚生活在經過UV及曝氣處理過的循環系統,水溫為28.5 ℃。斑馬魚產卵后將魚卵收集后放于28.5 ℃的恒溫培養箱培養。對斑馬魚的所有處理均以科研為目的進行養殖和使用,且按照上海海洋大學動物倫理相關規定進行(IACUC 20171009)。
1.1.2 儀器及試劑
本實驗所用主要儀器包括常規PCR儀(Bio-Rad公司)、熒光定量PCR儀(羅氏公司)、凝膠成像系統(Bio-Rad公司)等。主要試劑包括Taq酶(全式金公司)、體外轉錄試劑盒(Life Technologies)、感受態細胞(天根公司)及熒光定量檢測試劑盒(羅氏公司)等。
1.1.3 質粒來源
實驗所用的體外合成Cas9 mRNA質粒由北京大學生命科學學院張博教授贈予。實驗所用的體外合成gRNA pUC19-scaffold plasmid由北京大學分子醫學研究所熊敬維教授實驗室贈予。
1.2 方法
1.2.1 設計敲除靶點及檢測引物
采用Ensembl網站(http://ensembl.org/Danio_rerio/Info/Index)中斑馬魚hoxb7a基因序列,通過Cas9靶點預測網站(http://zifit.partners.org/ZiFiT/CSquare9Nuclease.aspx)設計hoxb7a的gRNA靶位點為GGCTACGGCTCGGCTTCAAC。靶位點經NCBI網站檢測特異性后,設計檢測引物,上游引物為ATTGTATTATGCGAACGCGCTG;下游引物為TTGATGGTAGCCCCTCTGCT。
1.2.2 CRISPR/Cas9技術敲除斑馬魚hoxb7a基因
體外轉錄合成hoxb7agRNA 和Cas9 mRNA, 將Cas9 mRNA和gRNA按一定的比例配成混合液,Cas9 mRNA 300~600 pg,gRNA 80~100 pg,將混合液注射到斑馬魚一細胞期動物極中。48 hpf取胚胎進行T7E1酶切檢測。將酶切檢測為陽性的胚胎養至成魚為F0。
1.2.3 獲得hoxb7a純合突變斑馬魚
將F0養至成魚,與野生型斑馬魚外交篩選獲得可遺傳的F0。并將可遺傳的F0外交所得的F1養至成魚。F1內交篩選獲得F2純合突變體。
1.2.4 QPCR 檢測基因表達情況
收集 48 hpf的hoxb7a-/-和野生型斑馬魚各 30 尾,提取 RNA,反轉錄成 cDNA。每個樣品做3次技術重復,每個基因做3個生物學重復,采用表1中引物,進行QPCR檢測。
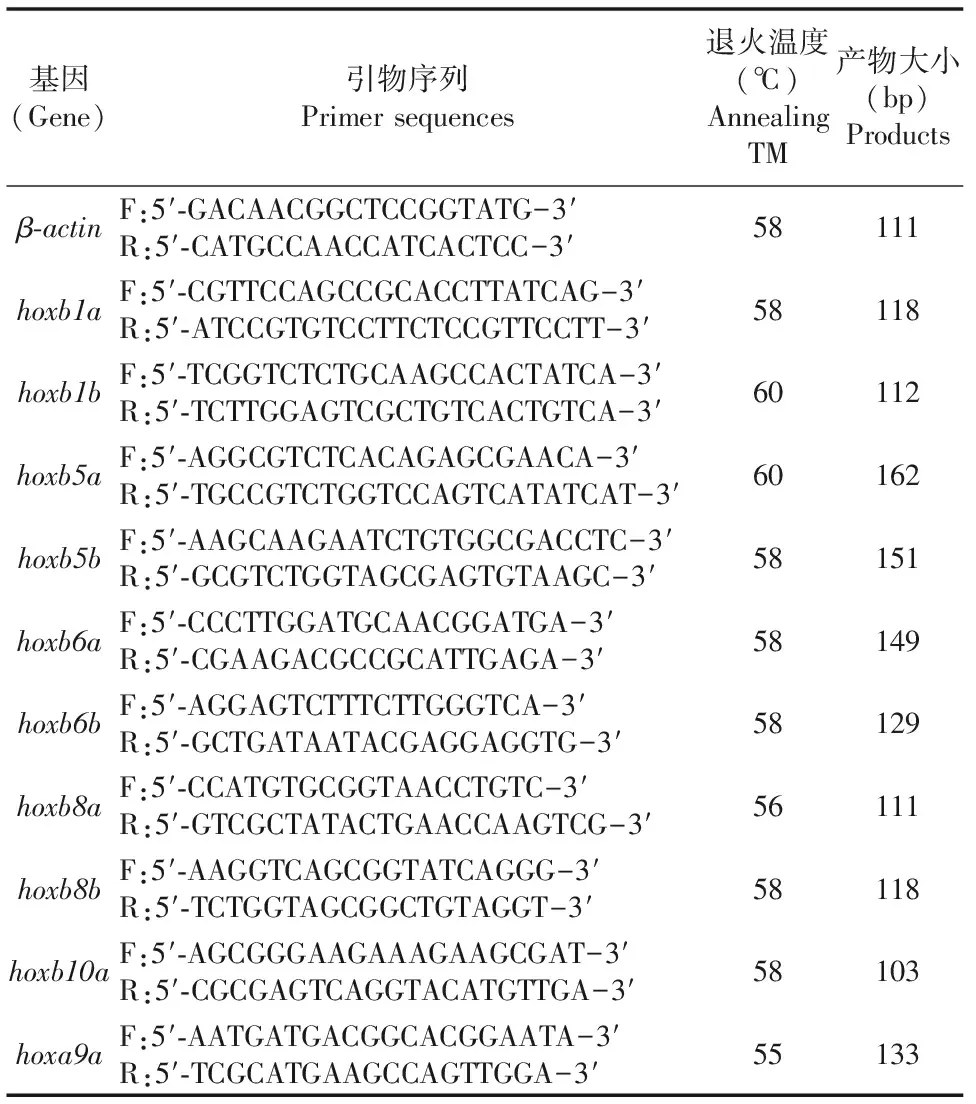
表1 QPCR引物序列
2 結果與分析
2.1 斑馬魚hoxb7a的進化地位
斑馬魚中含有7個hox基因簇,分別命名為:hoxaa、hoxab、hoxba、hoxbb、hoxca、hoxcb和hoxd(圖1-A)。斑馬魚hoxb7a基因是進化過程中第7旁系同源組中僅存的基因。人和小鼠中有HOXA7(Hoxa7)和HOXB7(Hoxb7),非洲爪蟾中有HoxB7A和HoxB7B。我們對斑馬魚hoxb7a基因和其他物種hoxB7基因進行了同源性比對,構建進化樹分析。結果顯示,斑馬魚hoxb7a與輻鰭魚綱金錢魚科金錢魚和硬骨魚綱鯉科魚類鯉魚hoxb7a聚為一支,有較高的同源性,同源性分別高達96%和94%(圖1-B)。而與哺乳類的人和小鼠,兩棲類的非洲爪蟾同源性較低。
2.2 利用CRISPR/Cas9技術成功編輯斑馬魚hoxb7a基因
斑馬魚hoxb7a共有2個外顯子,我們在斑馬魚hoxb7a第1個外顯子上設計Cas9敲除靶位點(圖2-A),將Cas9 mRNA和hoxb7agRNA共注射入斑馬魚一細胞期動物極中,48 hpf后提取基因組,PCR擴增出目的片段,利用T7E1酶切檢測敲除情況。結果顯示,hoxb7agRNA成功編輯靶位點,T7E1酶切成功(圖2-B)突變效率平均為43%。同時,我們將PCR產物進行測序驗證,測序峰圖也顯示在靶位點位置出現亂峰,表明對hoxb7a基因敲除成功(圖2-C)。

圖1 斑馬魚hoxb7a基因的進化地位
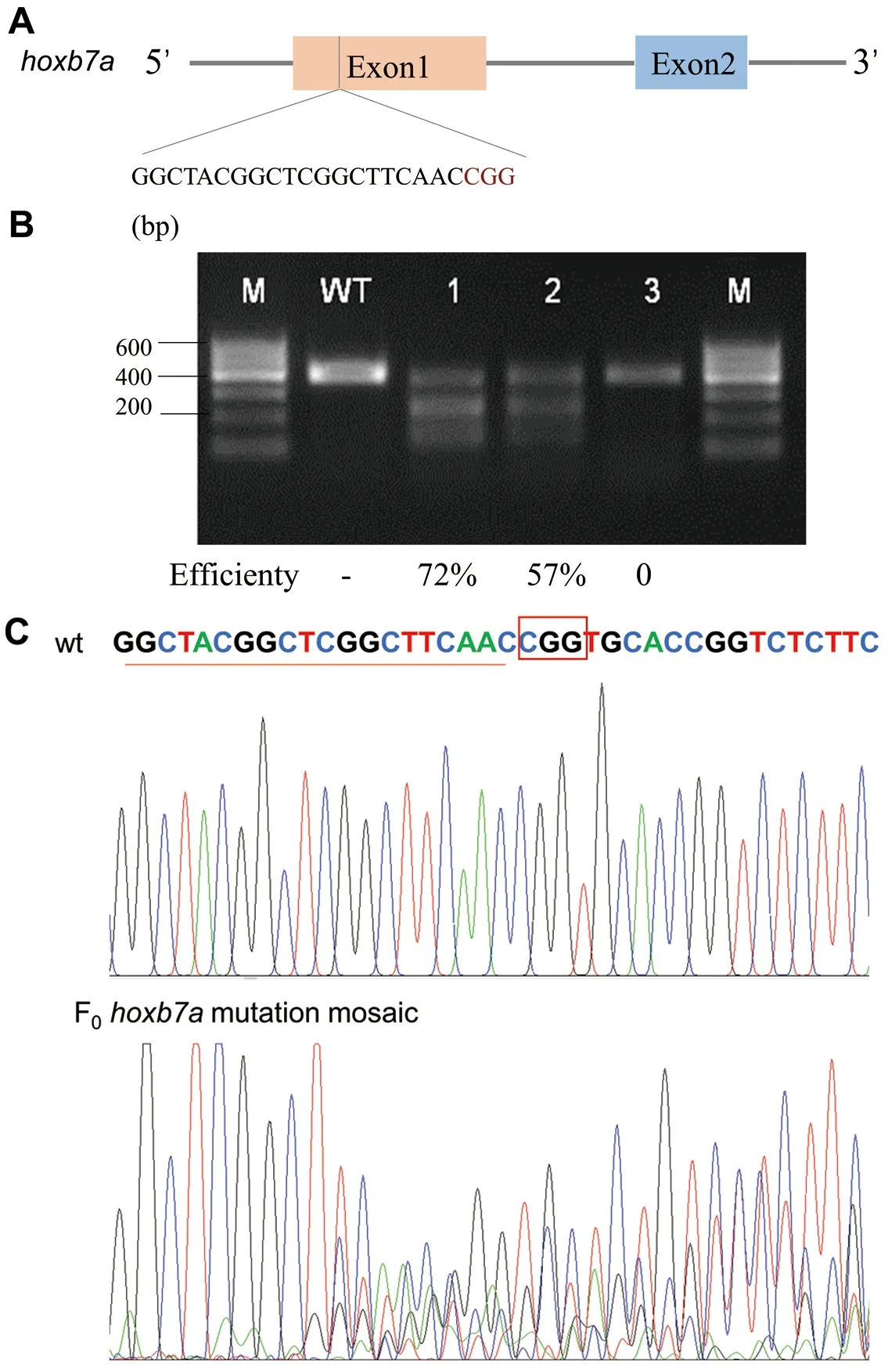
圖2 利用CRISPR/Cas9系統編輯斑馬魚hoxb7a基因
2.3 成功獲得斑馬魚hoxb7a純合突變體
我們將檢測hoxb7a敲除成功的斑馬魚胚胎養至成魚,進一步篩選敲除成功的斑馬魚從而獲得可遺傳的F0,將F0外交獲得F1雜合突變體。通過對F1hoxb7a+/-進行基因型鑒定,我們成功獲得兩種基因突變類型:hoxb7a+/-基因缺失 8 個堿基(Δ8 bp),圖3-A和缺失23 個堿基(Δ23 bp),圖3-B,并且兩種突變類型都出現了移碼突變,提前產生了終止密碼子。我們將hoxb7a+/-F1內交獲得F2,通過對F2剪尾進行基因型鑒定,成功檢測得到兩個等位基因同時突變的hoxb7a純合突變體。
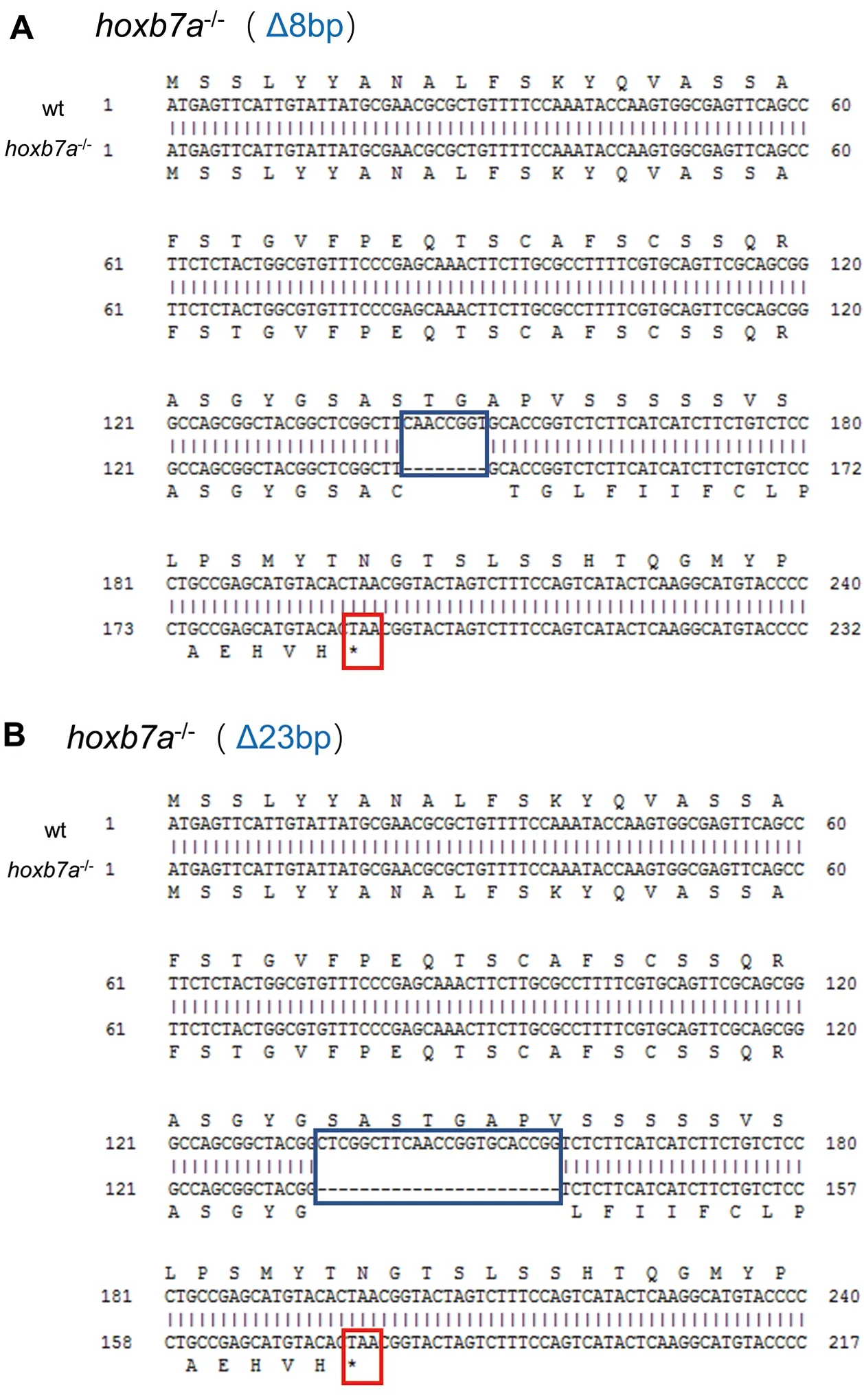
*代表出現終止密碼子
圖3斑馬魚hoxb7a兩種突變類型
Figure 3 The two mutant fish lines of zebrafishhoxb7a
2.4 斑馬魚hoxb7a基因缺失導致基因簇中相鄰hox基因表達量上調
斑馬魚基因組在進化過程中發生了加倍,而hox基因簇中第7旁系同源組基因在進化過程中產生了基因的丟失,最終在hox第7同源組基因中只保留了hoxb7a一個基因。本文探究hoxb7a缺失后hoxb基因簇的其他基因成員表達量是否受到影響。我們在斑馬魚胚胎發育48 hpf分別提取野生型和hoxb7a突變體RNA,并反轉錄成cDNA,利用QPCR檢測hoxb基因簇中其他基因的表達量變化。我們首先選擇了hoxba基因簇中距離hoxb7a較遠的hoxb1a和hoxb10a及hoxb7a兩側的hox基因進行了QPCR實驗。結果顯示距離hoxb7a較遠的hoxb1a和hoxb10a基因在hoxb7a突變體中表達量變化不明顯(P>0.05)。而在hoxb7a兩側的基因中除hoxb8a表達量出現了顯著性的升高外(P<0.001),其他幾個基因表達量變化同樣不明顯(P>0.05),圖4-A。這引起了我們的關注去進一步檢測hoxbb基因簇中相關hox基因的表達量變化。
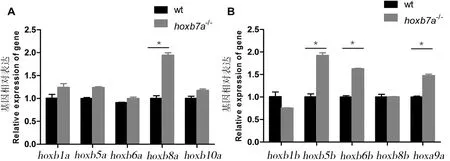
圖4 斑馬魚hoxb7a突變體中相關hox基因表達量變化
hoxbb基因簇是hoxb基因簇進化中加倍后產生的另一基因簇,我們選取了hoxbb基因簇中的基因進行了檢測。結果顯示,hoxb1b(P>0.01),hoxb8b(P>0.05)在hoxb7a突變體中表達量變化不明顯,hoxb5b和hoxb6b兩個基因表達量顯著升高(P<0.001)(圖4-B)。綜上,我們發現,在基因簇中距離hoxb7a較遠的基因hoxb1a、hoxb1b、hoxb10a受hoxb7a影響不明顯。而在基因組上靠近hoxb7a的基因hoxb5、hoxb6、hoxb8受到了hoxb7a的調控,并且進化過程中加倍的兩個基因中只有一個基因受到調控,分別是hoxb5b、hoxb6b、hoxb8a。
此外,我們還選擇了hoxa基因簇中的hoxa9a進行了檢測。QPCR結果顯示,hoxa9a基因在hoxb7a突變體中表達量上調(P<0.001),表明hoxb7a不僅作用于hoxb基因簇,和其他基因簇基因也具有一定的相互調控關系。
3 討論
Hox基因在進化過程中的加倍,使得加倍的基因在功能上分化更加精細,旁系同源基因之間相互作用共同調控機體發育。在小鼠中,Hoxa基因簇和Hoxb基因簇共同作用使得顱面存在多樣性,Hoxb基因簇缺失可以增強單個Hoxa基因簇缺失導致的缺陷表型[13]。此外,在心臟器官發育過程中,Hoxa和Hoxb基因簇也存在相互作用。2013年Soshnikova等人報道缺失單個Hoxa或Hoxb基因簇心臟未出現明顯表型。但當兩個基因簇同時缺失時,心臟環化明顯異常[14],這體現了加倍的Hox基因簇之間的相互作用。同樣單個Hox基因與其旁系同源基因間也存在相互作用,例如小鼠中Hoxa1和Hoxb1共同調控心臟流出道的發育[15-16],斑馬魚中hoxb1a和hoxb1b相互作用共同調控菱腦節的發育[17]。
斑馬魚hoxb7a在進化過程中其縱向旁系同源基因丟失,且位置處于基因簇的中間(圖1-A),這使得研究hoxb7a在基因簇中的作用變得尤為重要。本實驗利用CRISPR/Cas9技術將斑馬魚hox基因簇中比較特異的hoxb7a基因進行了敲除,并成功篩選獲得F2純合突變體。在hoxb7a純合突變體中我們檢測了hoxb基因簇其他hox基因成員mRNA水平的變化。QPCR結果表明:hoxb7a基因突變后僅引起鄰近旁系冗余hox基因(hoxb5b、hoxb5a、hoxb6a、hoxb6b、hoxb8a、hoxb8b)中的一個基因上調,例如在hoxb7a突變體中僅hoxb5b、hoxb6b、hoxb8a基因受到影響。這暗示在旁系同源組中僅存的hoxb7a基因調控功能比較重要,而加倍后的冗余hox基因功能出現分化。
關于hoxb7a的突變體,目前還沒有文獻報道。對于hoxb7a的基因功能已有一些初步的研究,2015年Rochtus等人報道hoxb7a敲降后斑馬魚發育遲緩,色素衰減。當過表達不同濃度hoxb7amRNA后,斑馬魚神經系統發生不同程度的紊亂,這說明hoxb7a基因在神經發育過程中發揮作用[18]。另外,也有文獻報道,hoxb7a和hoxa9a可以補救cdx4基因缺失導致的血管缺陷,這說明hoxb7a在血管發育過程中也發揮重要作用[19]。我們在hoxb7a突變體中檢測hoxa9a的表達量變化,發現hoxb7a缺失后,hoxa9a表達量顯著升高,這也初步顯示hoxb7a和hoxa9a基因之間存在著一定的相互調控關系。本研究成功構建了hoxb7a缺失突變體,為更好的研究hoxb7a的功能奠定了基礎。
4 結論
本研究利用CRISPR/Cas9技術成功構建斑馬魚hoxb7a基因突變體,發現hoxb7a在hox基因簇中可以調控多個hox基因的表達,尤其對基因組相鄰位置的hox基因影響顯著。

