近零磁場下灰飛虱轉錄表達分析穩(wěn)定性內(nèi)參基因篩選
劉凡奇,萬貴鈞,曾路影,李春緒,潘衛(wèi)東,陳法軍
近零磁場下灰飛虱轉錄表達分析穩(wěn)定性內(nèi)參基因篩選
劉凡奇1,萬貴鈞1,曾路影1,李春緒1,潘衛(wèi)東2,陳法軍1
(1南京農(nóng)業(yè)大學植物保護學院,南京 210095;2中國科學院電工研究所生物電磁學北京市重點實驗室,北京 100190)
地磁場(geomagnetic field,GMF)并不是穩(wěn)定不變的,其隨時間和空間時刻變化。目前,隨著對動物磁生物學研究的日益深入,基于實時熒光定量PCR (qRT-PCR)技術開展的磁響應基因轉錄表達譜研究有力促進了磁響應通路的鑒定和磁感受機制的揭示。【】篩選近零磁場(near-zero magnetic field,NZMF)下短翅型灰飛虱()穩(wěn)定表達的內(nèi)參基因,使對目的基因的定量分析更加準確。遷飛性昆蟲灰飛虱采自江蘇省農(nóng)業(yè)科學院試驗田并在室內(nèi)使用TN1三葉期稻苗進行擴繁(溫度:(25.0±1.0)℃,相對濕度:70%—90%,光周期:14L﹕10D)。采用亥姆霍茲線圈室內(nèi)模擬近零磁場(NZMF;<500 nT)和地磁場(GMF;~50 000 nT),人工模擬磁場強度有效處理空間為直徑30 cm的球形空間,試驗過程中嚴格控制除磁場強度外的環(huán)境因子(溫度:(25.0±1.0)℃,相對濕度:75%,光周期:14L﹕10D)并利用磁通門計每日對人工模擬磁場進行校準和監(jiān)測,灰飛虱連同TN1三葉期稻苗均置于試管中進行暴露處理,每隔兩日與對照磁場中稻苗對調(diào)以避免稻苗潛在磁響應對灰飛虱的影響。利用Trizol法分別提取初羽化灰飛虱雌、雄成蟲總RNA,檢測各生物學重復RNA質(zhì)量并調(diào)至含量一致,反轉錄為cDNA,利用qRT-PCR技術并結合常用內(nèi)參篩選分析軟件geNorm、NormFinder、BestKeeper以及在線綜合分析系統(tǒng)RefFinder對在NZMF和GMF兩種磁場強度下灰飛虱體內(nèi)的內(nèi)參基因穩(wěn)定性進行評估篩選,其中,待評估的11個常用內(nèi)參基因包括、(和)、()、()、()、()、()、()、()和()。不同磁場環(huán)境(NZMF vs. GMF)下,灰飛虱短翅雌成蟲和表達穩(wěn)定性在geNorm和NormFinder兩種評估方法中都居于前兩位,與BestKeeper軟件的結果略有差異,進而利用在線工具RefFinder對以上3種方法的評估結果進行穩(wěn)定性綜合排序,結果表明穩(wěn)定性最好,穩(wěn)定性次之;灰飛虱短翅雄成蟲中,基于geNorm、NormFinder和BestKeeper 3種評估方法,和表達穩(wěn)定性中均居于前兩位,而表達穩(wěn)定性雖在NormFinder和BestKeeper中處于前兩位,但其在geNorm中穩(wěn)定性較低,最后,通過在線工具RefFinder綜合分析表明,穩(wěn)定性最好,穩(wěn)定性次之。明確了不同磁場強度(NZMF vs. GMF)下適用于灰飛虱短翅雌、雄成蟲中穩(wěn)定表達的內(nèi)參基因,其中,若使用雙內(nèi)參系統(tǒng),雌成蟲中可使用和搭配,雄成蟲中可使用和搭配,為穩(wěn)定表達的內(nèi)參基因系統(tǒng)。此外,在灰飛虱短翅型雌、雄成蟲中均可作為穩(wěn)定的單一內(nèi)參基因使用。研究結果確保了對灰飛虱響應磁場強度變化研究中關鍵目的基因轉錄表達的準確定量,并為今后開展磁場強度變化下的轉錄表達譜分析提供了有力保障。
灰飛虱; 近零磁場; 磁場強度;實時熒光定量PCR;內(nèi)參基因篩選
0 引言
【研究意義】一個世紀前,人類首次提出“磁場地圖”的觀點[1]。地磁場(geomagnetic field,GMF)為包括昆蟲在內(nèi)的多種動物,如帝王蝶、海龜、龍蝦等,提供了定向和位置信息[2]。此外,磁場強度改變可對許多動物的生長發(fā)育及新陳代謝產(chǎn)生影響,這些不同強度的磁場可依據(jù)強度范圍劃分為弱磁場(<1 mT)、中等強度磁場(1 mT—1 T)和強磁場(>1 T)[3-7]。地磁場強度由赤道向兩極呈現(xiàn)由低到高的漸變態(tài)勢,其范圍從赤道附近的~25 μT到南北磁極的~65 μT[8]。遷飛昆蟲多可進行跨緯度長距離遷移[9],這必然涉及其遷出地與遷入地的地磁強度差異[10]。基因表達分析被廣泛應用于生命科學領域,在基于磁場強度變化的磁響應研究中發(fā)揮重要作用。實時熒光定量PCR(qRT-PCR)作為對基因進行轉錄水平表達分析的重要技術手段,具有特異性強、覆蓋范圍廣、操作方便、實時性等特點。qRT-PCR包括相對定量和絕對定量,其中相對定量應用更加廣泛,可在處理和對照組中均穩(wěn)定表達的內(nèi)參基因系統(tǒng)對定量結果的準確性和可重復性至關重要。常用的()、()等內(nèi)參基因是否可在磁場強度差異處理下的動物體內(nèi)穩(wěn)定表達,至今尚無驗證。因此,篩選出在磁場強度變化環(huán)境下能穩(wěn)定表達的內(nèi)參基因對于磁響應基因信號通路的準確鑒定具有重要意義,對生物磁感受機制的揭示具有積極促進作用。【前人研究進展】內(nèi)參基因是維持細胞生命活動所必需的,在所有細胞中均可表達的一類基因,此觀點在前基因組時代提出,研究發(fā)現(xiàn),傳統(tǒng)內(nèi)參基因在不同外界因子處理、生物的不同發(fā)育歷期、不同組織部位、不同生理條件下表達水平均可能存在差異。因此,科研人員需針對不同外界處理、不同研究對象尋找特異性穩(wěn)定表達的內(nèi)參基因(系統(tǒng))。目前已發(fā)表的基于磁場強度變化的磁響應研究中,曾選用[11]、[12]、[13]、()[14-15]、[16]、[17]等作為內(nèi)參基因。雖然曾有研究對強磁場下細胞系內(nèi)內(nèi)參基因穩(wěn)定性進行評估,但由于細胞系和活體動物內(nèi)細胞外環(huán)境存在較大差異,有必要對活體動物體內(nèi)內(nèi)參基因的穩(wěn)定性進行重新評估。另外,強磁場和弱磁場引起磁生物學效應的機制可能不同,前者可能類似于非特異性的脅迫效應,而近零磁場(near-zero magnetic field,NZMF)等弱磁場可能由與動物磁定向類似的磁感受機制介導[18-19],因此選擇與自然地磁場強度差異僅為地磁強度水平的近零磁場作為磁場強度變化處理,所評估出的穩(wěn)定內(nèi)參基因對后續(xù)特異性磁響應機制轉錄水平研究更具有普適性。目前,利用細胞系開展的生物對磁場強度變化磁響應研究表明,近零磁場處理將顯著影響肌動蛋白(Actin)的組裝[12],因此參與Actin蛋白表達調(diào)控的相關基因(如)可能受磁場強度變化的影響,從而無法作為不同磁場強度處理實驗中的內(nèi)參基因。【本研究切入點】灰飛虱()廣泛分布于東亞、東南亞、北非及歐洲等地區(qū)[20-21],其寄主范圍廣,具有翅的多型現(xiàn)象(長翅型和短翅型),并表現(xiàn)出趨光和遷飛特性[22]。近年來以稻飛虱為模式昆蟲開展的基于磁場強度變化的磁生物學效應研究進一步突出了稻飛虱在磁生物學研究領域的潛在模式作用[23-24]。NZMF與自然GMF的磁場強度差異僅為地磁強度水平,既可將其視為屏蔽地磁場的陰性對照,又可利用其探究地磁強度水平磁場強度變化對生物的潛在磁效應,且由于該磁場強度更能反映生物正常生理性磁響應,因此評估篩選可用于灰飛虱對NZMF(vs. GMF)磁響應研究中的穩(wěn)定內(nèi)參基因(系統(tǒng))將是本研究及后續(xù)磁感受機制研究的重要切入點。【擬解決的關鍵問題】利用人工磁場模擬磁場強度變化(NZMF vs. GMF),以灰飛虱初羽化1日齡短翅雌、雄成蟲作為研究對象,篩選可在近零磁場和對照地磁場中穩(wěn)定表達的內(nèi)參基因,為灰飛虱磁響應研究中關鍵目標基因的轉錄表達精確分析提供方法學依據(jù),提高后續(xù)動物特異性磁響應基因信號轉導通路鑒定的準確性。
1 材料與方法
試驗于2017年在南京農(nóng)業(yè)大學完成。
1.1 供試水稻與蟲源
所用灰飛虱蟲源采自江蘇省農(nóng)業(yè)科學院試驗田。用于繁殖灰飛虱種群的水稻品種為感蟲品種TN1,水稻盆栽(直徑×高度:7 cm×10 cm)置于人工氣候箱(型號:GXZ-500B;精度:±1.0℃;RH:±10%;光照強度:15 000 lx;生產(chǎn)廠家:寧波江南實驗儀器有限公司),日夜環(huán)境溫度為(25.0±1.0)℃,相對濕度為70%—90%,光周期為14L﹕10D。于水稻三葉期稻苗用于接種灰飛虱,以木村B營養(yǎng)液提供水稻苗營養(yǎng)。
1.2 近零磁場(NZMF)發(fā)生裝置
正常GMF的地磁強度范圍一般在25—65 μT[8]。本研究使用自主研發(fā)的直流電型亥姆霍茲線圈控制磁場強度裝置(發(fā)明專利授權號:ZL201310003381.4)模擬了NZMF處理組(<500 nT)和GMF對照組(~50 000 nT)兩種磁場,以篩選可在NZMF和GMF下均穩(wěn)定表達的內(nèi)參基因。人工模擬磁場強度的有效處理空間在直徑為30 cm的球形范圍內(nèi)。單頭灰飛虱飼養(yǎng)于生長單株三葉期TN1水稻苗的玻璃試管中,并一同置于NZMF處理組和GMF對照組中,每兩日對調(diào)處理和對照組中的稻苗以避免稻苗的潛在磁響應引起的試驗誤差,具體處理細節(jié)參照文獻[13]。試驗過程中使用溫濕度及光照控制裝置,控制條件為溫度(25.0±1.0)℃,相對濕度75%,光周期14L﹕10D。使用磁通門計(型號:191A;精度:±1 nT;廠家:中國青島中宇環(huán)泰科技有限公司)每日對人工磁場發(fā)生裝置內(nèi)的磁場強度進行監(jiān)測校準,以保證試驗處理所需的磁場強度的穩(wěn)定性和準確性。
1.3 試驗方法
用Trizol法提取分別來自于NZMF和GMF中的初羽化灰飛虱短翅雌、雄成蟲總RNA,每個樣品設置3個生物學重復和3個技術重復。由微量分光光度計(型號:NanoDrop 2000C,美國Thermo公司)檢測試驗樣本的RNA濃度和質(zhì)量,將樣本RNA統(tǒng)一調(diào)至100 ng,參照PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect real-time)試劑盒的說明書進行反轉錄得到cDNA,稀釋20倍后采用20 μL反應體系進行熒光定量PCR,參見SYBY Premix Ex Taq試劑盒:(1)反應體系(總體積20.0 μL):SYBR? Premix Ex TaqTM(Tli RNaseH Plus)10.0 μL,ddH2O 7.8 μL,F(xiàn)orward Primer(10 μmol·L-1)0.4 μL,Reverse Primer(10 μmol·L-1)0.4 μL,ROX Reference Dye II 0.4 μL,cDNA 1.0 μL;(2)反應條件:95℃ 30 s;95℃ 5 s,60℃ 34 s,40個循環(huán);熔解曲線:95℃ 15 s;60℃ 1 min,95℃ 15 s。引物和保守序列分別為()、(和)、()、()、()、()、()、()、()和()(表1)。
1.4 數(shù)據(jù)分析
目前,用于分析不同試驗條件下內(nèi)參基因穩(wěn)定性的軟件有多種,其中,基于Excel統(tǒng)計學分析方法主要有geNorm、NormFinder和BestKeeper以及在線分析軟件RefFinder等。
geNorm和NormFinder軟件在導入數(shù)據(jù)前需將原始數(shù)據(jù)CT值進行線性方程轉化,計算每個基因的相對表達量2-ΔCT值,輸入軟件后得到各個內(nèi)參基因的平均表達穩(wěn)定值(M),根據(jù)M值大小進行排序,M值越小,穩(wěn)定性越高。geNorm軟件通過標準化因子配對差異分析得到變異值(V),并以0.15作為差異分析的默認值,當Vn/Vn+1<0.15時,按照穩(wěn)定性排序確定合適內(nèi)參基因數(shù)目為n個。BestKeeper軟件是將原始CT值導入BestKeeper軟件中,在每個基因之間配對,產(chǎn)生相關系數(shù)及標準差等,根據(jù)相關系數(shù)和標準差的大小對內(nèi)參基因的穩(wěn)定性進行評價。相關系數(shù)越大,標準差越小,內(nèi)參基因穩(wěn)定性越好。RefFinder是一種在線分析軟件,通過以特定算法綜合分析上述軟件的不同分析結果并給出內(nèi)參基因穩(wěn)定性的綜合排序。本文中箱形圖中橫線示中位數(shù),上下尾須分別示意上四分位數(shù)(Q3)+1.5×四分位距(Q3-Q1)和下四分位數(shù)(Q1)-1.5×四分位距(Q3-Q1)。
2 結果
2.1 灰飛虱雌成蟲qRT-PCR內(nèi)參基因的篩選
提取灰飛虱短翅雌成蟲RNA,反轉錄成cDNA后進行qRT-PCR反應,得到11個內(nèi)參基因的CT值為19.96—28.03,由于CT代表基因表達量,CT值越小基因表達量越高,CT值越大基因表達量越低。因此,由圖1可見,表達量最高,表達量最低。其中,和表達豐度居于前兩位,平均CT值分別為20.29和20.74。對原始CT值做箱形圖分析后發(fā)現(xiàn),和表達量數(shù)據(jù)分布較為集中,而和表達量數(shù)據(jù)分布較為分散。利用geNorm、NormFinder和BestKeeper軟件對上述11個內(nèi)參基因的穩(wěn)定性進行評估,結果如表2所示,和表達穩(wěn)定性在geNorm和NormFinder兩種評估方法中都居于前兩位,與BestKeeper軟件的結果略有差異,可能是軟件算法不同造成的。因此。利用在線工具RefFinder對以上3種方法的評估結果進行穩(wěn)定性綜合排序,結果表明穩(wěn)定性最好,穩(wěn)定性次之(表2)。
為了確定合適數(shù)目的內(nèi)參基因,采用geNorm軟件進一步分析,geNorm通過標準化因子配對差異分析得出兩兩比較的變異值(V),并以0.15為默認值,當Vn/Vn+1<0.15時,說明無必要使用數(shù)量≥n+1的內(nèi)參基因為內(nèi)參,因此即可按照穩(wěn)定性排序確定合適內(nèi)參基因數(shù)目為n個。分析結果如圖2所示,V2/3=0.049<0.15,故不需要引入第3個內(nèi)參基因。因此,近零磁場下,灰飛虱短翅雌成蟲進行qRT-PCR反應時,穩(wěn)定性較高的EF-1和RPL9搭配使用即可為理想的內(nèi)參體系。
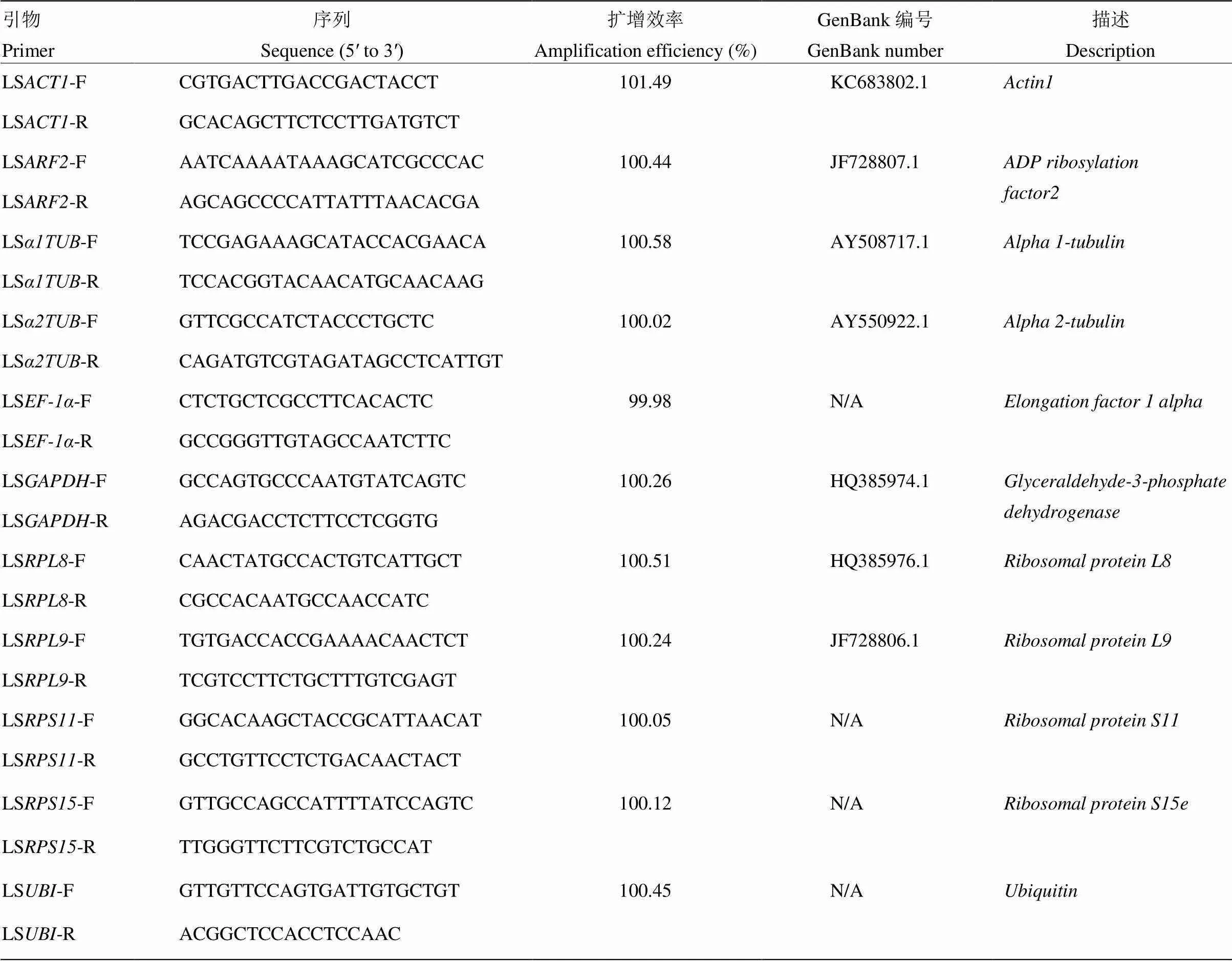
表1 內(nèi)參基因引物信息

圖1 11個候選內(nèi)參基因在灰飛虱短翅雌成蟲中的表達水平
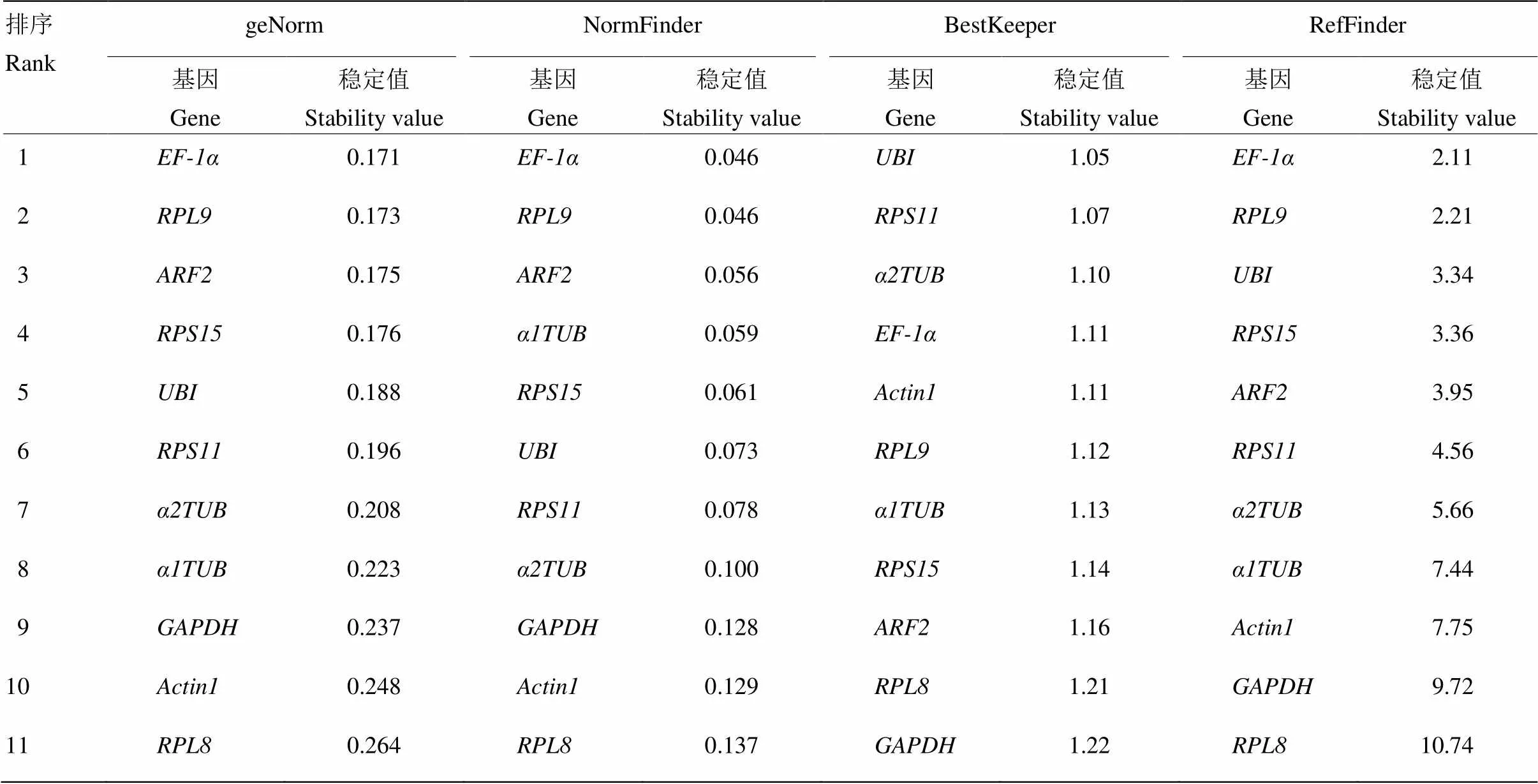
表2 利用geNorm、NormFinder、BestKeeper和RefFinder分析灰飛虱短翅雌成蟲中各內(nèi)參基因穩(wěn)定性
2.2 灰飛虱雄成蟲qRT-PCR內(nèi)參基因的篩選
提取灰飛虱短翅雄成蟲RNA,反轉錄成cDNA后進行qRT-PCR反應,得到11個內(nèi)參基因的CT值為17.21—32.24。由圖3中可見,表達量最高,表達量最低。其中,和表達豐度居于前兩位,平均CT值分別為17.53和20.80,豐度最高基因與雌蟲一致。對原始CT值分析后發(fā)現(xiàn),和表達量數(shù)據(jù)分布較為集中,而和表達量數(shù)據(jù)分布較為分散。利用geNorm、NormFinder和BestKeeper軟件對上述11個內(nèi)參基因的穩(wěn)定性進行評估,結果如表3所示,和表達穩(wěn)定性geNorm、NormFinder和BestKeeper 3種評估方法中都居于前3位,而表達穩(wěn)定性在NormFinder和BestKeeper中分別處于第2位和第1位,但在geNorm中穩(wěn)定性比較低。最后,通過在線工具RefFinder分析得出,穩(wěn)定性最好,穩(wěn)定性次之(表3)。

圖2 利用geNorm軟件分析候選內(nèi)參基因的配對差異值(雌成蟲)
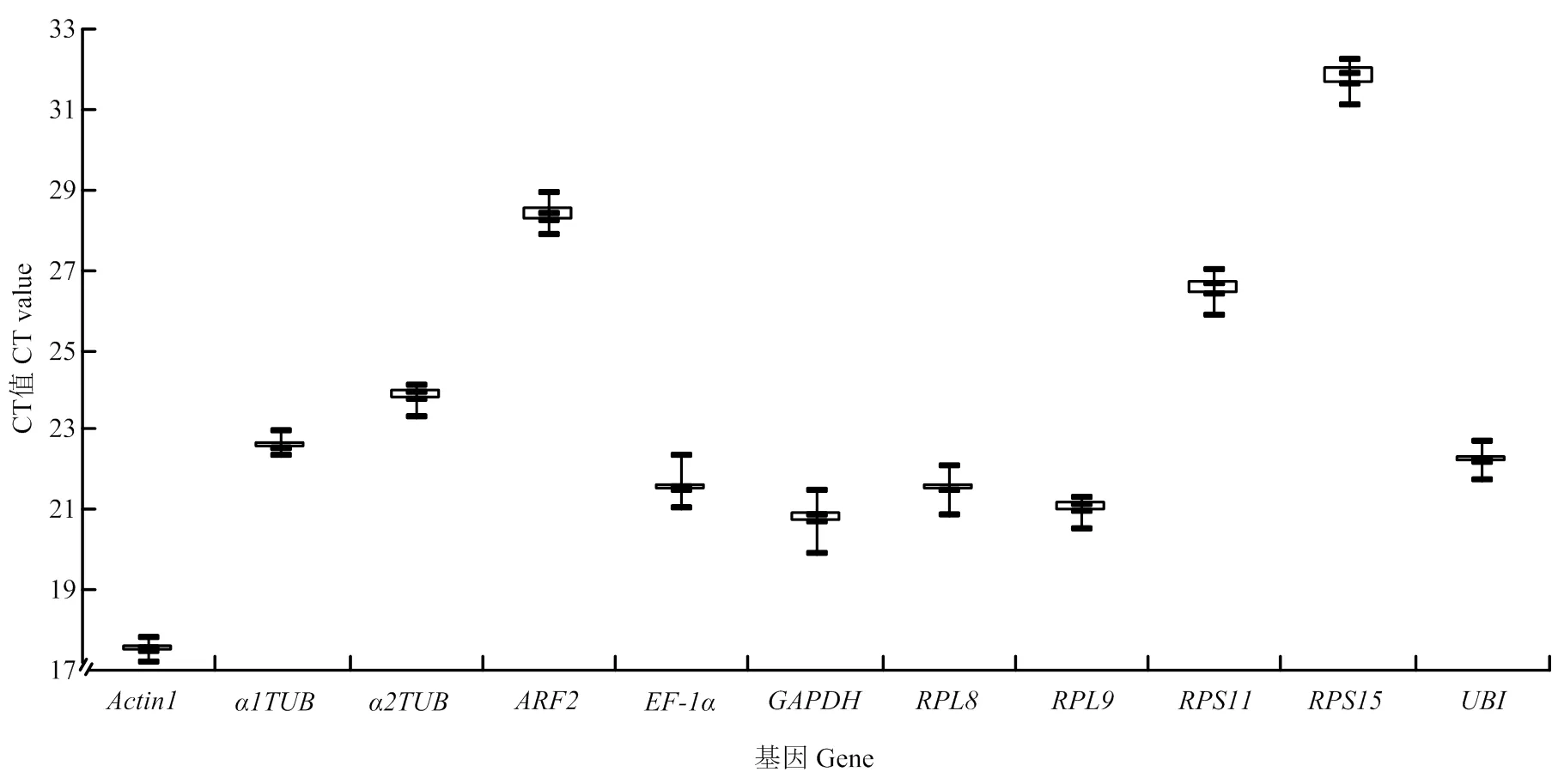
圖3 11個候選內(nèi)參基因在灰飛虱短翅雄成蟲中的表達水平

表3 利用geNorm、NormFinder、BestKeeper和RefFinder分析灰飛虱短翅雄成蟲中各內(nèi)參基因穩(wěn)定性
為了確定合適數(shù)目的內(nèi)參基因,采用geNorm軟件進一步分析。結果如圖4所示,V2/3=0.052<0.15,故不再引入第 3 個內(nèi)參基因。因此,近零磁場下,和結合使用即可作為灰飛虱短翅雄成蟲qRT-PCR反應中理想的內(nèi)參基因體系。

圖4 利用geNorm軟件分析候選內(nèi)參基因的配對差異值(雄成蟲)
3 討論
利用qRT-PCR技術進行試驗時,基因表達量受多種因素影響,如RNA質(zhì)量、反轉錄效率及下游處理步驟的多變性等[25-26],為減少試驗誤差,需引入內(nèi)參基因,對試驗結果進行標準化校正[27]。內(nèi)參基因多為維持細胞生命活動所必須且在所有細胞中均可表達的一類基因。理想的內(nèi)參基因應滿足以下條件:(1)在不同發(fā)育階段、不同細胞組織器官、不同環(huán)境中均可穩(wěn)定表達[28];(2)表達不受細胞周期控制,不受外源或內(nèi)源信號影響[29];(3)表達水平與目的基因表達水平一致[30]。內(nèi)參基因可提高結果準確性,但在多變的試驗條件下,內(nèi)參基因穩(wěn)定性受到影響,即使在一種環(huán)境條件下適用的內(nèi)參基因在其他環(huán)境下不一定能夠穩(wěn)定表達[31],且不同生物之間也存在一定差異。因此,選擇穩(wěn)定表達的內(nèi)參基因對于結果的準確性有重要作用[32-34]。Gutierrez等[35]研究發(fā)現(xiàn),使用未驗證的內(nèi)參基因測定目的基因表達量結果與正常結果存在較大偏差;Vandesompele等[36]研究表明,使用單個內(nèi)參基因進行試驗時,表達量差異較小的基因可能難以被發(fā)現(xiàn),甚至可能得到與預期不一致的試驗結果。因此,在基因表達量測定時,選擇穩(wěn)定表達的內(nèi)參基因作為參考標準,可減少測定過程中不確定因素的影響,保證結果的準確性和試驗的可重復性。
本研究發(fā)現(xiàn),近零磁場下,在灰飛虱短翅雌成蟲體內(nèi)穩(wěn)定表達,但在灰飛虱短翅雄成蟲體內(nèi)穩(wěn)定性極低;在灰飛虱短翅雄成蟲體內(nèi)表達穩(wěn)定,而在灰飛虱短翅雌成蟲體內(nèi)穩(wěn)定性一般。該結果表明,即使是同一種生物在相同發(fā)育歷期,其內(nèi)參基因表達的穩(wěn)定性可因性別而異,進一步證明內(nèi)參基因校正有利于提高基因表達分析結果的準確性。實際上,除了性別因素之外,還有多種因素會影響內(nèi)參基因的表達水平。對柑橘全爪螨()的研究發(fā)現(xiàn),和表達量受溫度脅迫影響較小,可作為熱生物學研究的內(nèi)參基因;和表達量受不同藥劑影響較小,可作為毒理學研究的理想內(nèi)參基因[37];表達水平在不同發(fā)育階段變化較小,可作為發(fā)育生物學研究的理想內(nèi)參基因。對小菜蛾()研究發(fā)現(xiàn),表達水平在不同發(fā)育階段變化較小,為理想的內(nèi)參基因;Bt毒素誘導下小菜蛾PCR結果表明,能穩(wěn)定表達,可作為這一條件下理想的內(nèi)參基因[38]。橘小實蠅()不同組織部位內(nèi)參基因穩(wěn)定性研究結果表明,和在中腸和馬氏管中表達水平穩(wěn)定;和在脂肪體中能穩(wěn)定表達,可作為相應組織基因表達量測定時的標準化內(nèi)參基因[39]。Lord等對赤擬谷盜()的基因表達水平研究發(fā)現(xiàn),能穩(wěn)定表達,為理想的內(nèi)參基因[40]。
此外,近零磁場下,不僅在灰飛虱短翅雌成蟲中穩(wěn)定表達,同時在灰飛虱短翅雄成蟲中也有較高的穩(wěn)定性。可參與翻譯的調(diào)控、GTP酶活性的調(diào)控等,在動物生長發(fā)育過程中發(fā)揮重要作用。基于的穩(wěn)定表達,該基因是近零磁場下灰飛虱短翅雌、雄成蟲進行qRT-PCR首選的內(nèi)參基因。但是,在灰飛虱處于其他磁場強度下能否作為內(nèi)參基因使用,仍需進一步驗證。
4 結論
不同磁場環(huán)境(NZMF vs. GMF)下,和在短翅雌成蟲體內(nèi)能穩(wěn)定表達,可作為理想的雙內(nèi)參基因體系;和在短翅雄成蟲體內(nèi)穩(wěn)定表達,可作為理想的雙內(nèi)參基因體系;在短翅型雌、雄成蟲對近零磁場的磁響應研究中,均表現(xiàn)出穩(wěn)定表達的特性,可作為單一內(nèi)參基因進行基因轉錄水平表達研究。研究結果明確了不同磁場強度下適用于灰飛虱短翅雌、雄成蟲中穩(wěn)定表達的內(nèi)參基因,確保了對灰飛虱響應磁場強度變化研究中關鍵目標基因轉錄表達水平的準確定量,可為今后開展磁場強度變化下的轉錄表達譜分析提供有力保障。
[1] WALLRAFF H G. The magnetic map of homing pigeons: an evergreen phantom., 1999, 197(2): 265-269.
[2] LOHMANN K J. Q & A: Animal behaviour: Magnetic-field perception., 2010, 464(7292): 1140-1142.
[3] ROSEN A D. Mechanism of action of moderate-intensity static magnetic fields on biological systems., 2003, 39(2): 163-173.
[4] SAVI? T, JANA? B, TODOROVI? D, PROLI? Z. The embryonic and post-embryonic development in twospecies exposed to the static magnetic field of 60 mT., 2011, 30(2): 108-114.
[5] WAN G J, JIANG S L, ZHAO M, ZHAO J Y, ZHANG Y C, PAN W D, SWORD G A, CHEN F J. Geomagnetic field absence influences adult body weight of a migratory insect, potentially through appetite regulation., 2019, doi:10.1101/737361.
[6] ZHANG Y C, WAN G J, WANG W H, LI Y, YU Y, ZHANG Y X, CHEN F J, PAN W D. Enhancement of the geomagnetic field reduces the phototaxis of rice brown planthopperassociated with frataxin down-regulation., 2019, doi:10.1111/ 1744-7917.12714.
[7] POLIDORI E, ZEPPA S, POTENZA L, MARTINELLI C, COLOMBO E, CASADEI L, AGOSTINI D, SESTILI P, STOCCHI V. Gene expression profile in cultured human umbilical vein endothelial cells exposed to a 300 mT static magnetic field., 2012, 33(1): 65-74.
[8] FINLAY C C, MAUS S, BEGGAN C D, BONDAR T N, CHAMBODUT A, CHERMOVA T A, CHULLIAT A, GOLOVKOV V P, HAMILTON B, HAMOUDI M,. International geomagnetic reference field: the eleventh generation., 2010, 183(3): 1216-1230.
[9] CHAPMAN J W, REYNOLDS D R, WILSON K. Long-range seasonal migration in insects: mechanisms, evolutionary drivers and ecological consequences., 2015, 18(3): 287-302.
[10] WAN G J, LIU R Y, LI C X, HE J L, PAN W D, SWORD G A, HU G, CHEN F J. Geomagnetic field intensity as a cue for the regulation of insect migration., 2019, doi:10.1101/733782.
[11] CUNHA C, PANSERI S, MARCACCI M, TAMPIERI A. Evaluation of the effects of a moderate intensity static magnetic field application on human osteoblast-like cells., 2012, 2(6): 263-268.
[12] Mo W C, Zhang Z J, WANG D L, LIU Y, BARTLETT P F, HE R Q. Shielding of the geomagnetic field alters actin assembly and inhibits cell motility in human neuroblastoma cells., 2016, 6: 22624.
[13] WAN G J, JIANG S L, ZHAO Z C, XU J J, TAO X R, SWORD G A, GAO Y B, PAN W D, CHEN F J. Bio-effects of near-zero magnetic fields on the growth, development and reproduction of small brown planthopper,and brown planthopper,., 2014, 68: 7-15.
[14] WAN G J, WANG W J, XU J J, YANG Q F, DAI M J, ZHANG F J, SWORD G A, PAN W D, CHEN F J. Cryptochromes and hormone signal transduction under near-zero magnetic fields: new clues to magnetoreception in a rice planthopper., 2015, 10(7): e0132966.
[15] WAN G J, YUAN R, WANG W J, FU K Y, ZHAO J Y, JIANG S L, PAN W D, SWORD G A, CHEN F J. Reduced geomagnetic field may affect positive phototaxis and flight capacity of a migratory rice planthopper., 2016, 121: 107-116.
[16] ALEMáN E I, MOREIRA R O, LIMA A A, SILVA S C, GONZáLEZ- OLMEDO J L, CHALFUN-JUNIOR A. Effects of 60 Hz sinusoidal magnetic field onestablishment, multiplication, and acclimatization phases ofseedlings., 2014, 35(6): 414-425.
[17] WALTHER M, MAYER F, KAFKA W, SCHUTZE N. Effects of weak, low-frequency pulsed electromagnetic fields (BEMER type) on gene expression of human mesenchymal stem cells and chondrocytes: anstudy., 2007, 26(3): 179-190.
[18] HORE P J, MOURITSEN H. The radical-pair mechanism of magnetoreception., 2016, 45: 299-344.
[19] BINHI V N, PRATO F S. Rotations of macromolecules affect nonspecific biological responses to magnetic fields., 2018, 8: 13495.
[20] KISIMOTO R. Flexible diapauses response to photoperiod of a laboratory selected line in the small brown planthopper,Fallén., 1989, 24(1): 157-159.
[21] OTUKA A, MATSUMURA M, SANADA-MORIMURA S, TAKEUCHI H, WATANABE T, OHTSU R, INOUE H. The 2008 overseas mass migration of the small brown planthopper,, and subsequent outbreak of rice stripe disease in western Japan., 2010, 45(2): 259-266.
[22] 程遐年, 陳若篪, 習學, 楊聯(lián)民, 朱子龍, 吳進才, 錢仁貴, 楊金生. 稻褐飛虱遷飛規(guī)律的研究. 昆蟲學報, 1979, 22(1): 1-21.
CHENG X N, CHEN R C, XI X, YANG L M, ZHU Z L, WU J C, QIAN R G, YANG J S. Studies on the migrations of brown planthopperstal, 1979, 22(1): 1-21. (in chinese)
[23] 賀靜斕, 張明, 劉瑞瑩, 萬貴鈞, 潘衛(wèi)東, 陳法軍. 近零磁場下干擾磁響應關鍵基因對褐飛虱壽命的影響. 中國農(nóng)業(yè)科學, 2019, 52(1): 45-55.
HE J L, ZHANG M, LIU R Y, WAN G J, PAN W D, CHEN F J. Effects of the interference of key magnetic response genes on the longevity of brown planthopper () under near-zero magnetic field., 2019, 52(1): 45-55. (in chinese)
[24] 張明, 劉瑞瑩, 賀靜瀾, 袁銳, 萬貴鈞, 潘衛(wèi)東, 陳法軍. 近零磁場下褐飛虱翅型分化及其長翅成蟲正趨光性和飛行能力研究. 昆蟲學報, 2019, 62(1): 82-90.
ZHANG M, LIU R Y, HE J L, YUAN R, WAN G J, PAN W D, CHEN F J. Wing-form differentiation, phototaxis and flight performance of the brown planthopper,(Hemiptera: Delphacidae) under near-zero magnetic fields., 2019, 62(1): 82-90. (in chinese)
[25] HUGGETT J, DHEDA K, BUSTIN S, ZUMLA A. Real-time RT-PCR normalisation; strategies and considerations., 2005, 6(4): 279-284.
[26] STEINAU M, RAJEEVAN M S, UNGER E R. DNA and RNA references for qRT-PCR assays in exfoliated cervical cells., 2006, 8(1): 113-118.
[27] SUZUKI T, HIGGINS P J, CRAWFORD D R. Control selection for RNA quantitation., 2000, 29(2): 332-337.
[28] BUSTIN S A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems., 2002, 29(1): 23-39.
[29] THELLIN O, ZORIZ W, LAKAYE B, DE BORMAN B, COUMANS B, HENNEN G, GRISAR T, LGOUT A, HEINEN E. Housekeeping genes as internal standards: use and limits., 1999, 75(2/3): 291-295.
[30] DHEDA K, HUGGETT J F, BUSTIN S A, JOHNSON M A, ROOK G, ZUMLA A. Validation of housekeeping genes for normalizing RNA expression in real-time PCR., 2004, 37(1): 112-119.
[31] VOLKOV R A, PANCHUK I I, SCH?FFL F. Heat-stress-dependency and developmental modulation of gene expression: the potential of house-keeping genes as internal standards in mRNA expression profiling using real-time RT-PCR., 2003, 54(391): 2343-2349.
[32] BUSTIN S A, BENES V, NOLAN T, PFAFFL M W. Quantitative real-time RT-PCR—a perspective., 2005, 34: 597-601.
[33] VANGUILDER H D, VRANA K E, FREEMAN W M. Twenty-five years of quantitative PCR for gene expression analysis., 2008, 44(5): 619-626.
[34] DERVEAUX S, VANDESOMPELE J, HELLEMANS J. How to do successful gene expression analysis using real-time PCR., 2010, 50(4): 227-230.
[35] GUTIERREZ L, MAURIAT M, GUéNIN S, PELLOUX J, LEFEBVRE J F, LOUVET R, RUSTERUCCI C, MORITZ T, GUERINEAU F, BELLINI C, VAN Wuytswinkel O. The lack of a systematic validation of reference genes: a serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT-PCR) analysis in plants., 2008, 6(6): 609-618.
[36] VANDESOMPELE J, PRETER K D, PATTYN F, POPPE B, VAN ROY N, DE PAEPE A, SPELEMAN F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multipleinte internal control genes., 2002, 3(7): research0034.1.
[37] NIU J Z, DOU W, DING T B, YANG L H, SHEN G M, WANG J J. Evaluation of suitable reference genes for quantitative RT-PCR during development and abiotic stress in(McGregor) (Acari: Tetranychidae)., 2012, 39(5): 5841-5849.
[38] 符偉, 謝文, 張卓, 吳青君, 王少麗, 張友軍. Bt毒素誘導下小菜蛾實時定量PCR內(nèi)參基因的篩選. 昆蟲學報, 2012, 55(12): 1406-1412.
FU W, XIE W, ZHANG Z, WU Q J, WANG S L, ZHANG Y J. Selection of valid reference genes for gene expression studies by quantitative real-time PCR in(Lepidoptera: Plutellidae) after exposure to Bt toxin., 2012, 55(12): 1406-1412. (in chinese)
[39] SHEN G M, JIANG H B, WANG X N, WANG J J. Evaluation of endogenous references for gene expression profiling in different tissues of the oriental fruit fly(Diptera: Tephritidae)., 2010, 11: 76.
[40] LORD J C, HARTZER K, TOUTGES M, OPPERT B. Evaluation of quantitative PCR reference genes for gene expression studies inafter fungal challenge., 2010, 80(2): 219-221.
Selection of Stable Internal Reference Genes for Transcript Expression Analyses inUnder Near-Zero Magnetic Field
LIU FanQi1, Wan GuiJun1, Zeng LuYing1, Li ChunXu1, Pan WeiDong2, Chen FaJun1
(1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095;2Beijing Key Laboratory of Bioelectromagetics, Institute of Electrical Engineering, Chinese Academy of Sciences, Beijing 100190)
【】The geomagnetic field (GMF) is not constant, it can change with time and space. At present, with the development of research on animal magnetic biology, the study on transcriptional profiling of magnetic response genes with quantitative real-time PCR (qRT-PCR) has greatly promoted the identification of magnetic response pathway and the uncovering of magnetoreception mechanism.【】The objective of this study is to screen the internal reference genes of the brachypterous small brown planthopper () under near-zero magnetic field (NZMF), and to make the quantification of target genes more accurate.【】The population of, a migratory insect, was collected from the experimental fields of Jiangsu Academy of Agricultural Sciences and expanded indoors using TN1 three-leaf rice seedlings (temperature: (25.0±1.0)℃, relative humidity: 70%-90%, photoperiod: 14L﹕10D). Helmholtz coils system was used to simulate the near-zero magnetic field (NZMF; <500 nT) vs. geomagnetic field (GMF; ~ 50 000 nT), the artificial simulated magnetic field intensity was homogeneous within a spherical space with a diameter of 30 cm. During the experiment, environmental factors other than the magnetic field intensity were strictly controlled (temperature: (25.0±1.0)℃, relative humidity: 75%, photoperiod: 14L﹕10D) and the artificial simulated magnetic field was calibrated and monitored daily using a fluxgate magnetometer. Theand TN1 three-leaf rice seedlings were placed in a test tube for exposure treatment. Every two days, the rice seedlings in control and treatment magnetic fields were swapped to avoid the influence triggered by the potential magnetic response of rice seedlings on. Trizol method was used to extract the total RNA of the female and male adults of, respectively. The quality of total RNA was inspected and adjusted to the same mass, and cDNA was then made by reverse transcription. using qRT-PCR technique and combined with the common internal reference selection software including geNorm, NormFinder, BestKeeper, and the online integrated analysis system RefFinder, the stability of internal reference genes inunder NZMF and GMF was evaluated and screened. Among them, 11 common candidate internal reference genes to be evaluated included,(and),(),(),(),(),(),(),(), and(). 【】For brachypterous female adults under different magnetic field environments (NZMF vs. GMF), the expression stability ofandranked as the top two in the two assessment software of geNorm and NormFinder, which was slightly different from the results of BestKeeper software. Furthermore, the stability of the above three methods was sorted by online tool RefFinder. The results showed that the stability of EF-1was the best,followed by. For brachypterousmale adults under different magnetic field environments (NZMF vs. GMF), based on the three evaluation methods of geNorm, NormFinder, and BestKeeper, the expression stability ofandranked as the top two. Although the expression stability ofwas in the top two in NormFinder and BestKeeper, its stability was low in geNorm. Finally, through the online tool RefFinder synthesis analysis, it was shown that the stability ofwas the best, followed by.【】Stably expressed reference genes in the brachypterous male and female adults ofwere clarified under different magnetic field intensities (NZMF vs. GMF). For a double reference gene system, thecombination ofand, and the combination ofandcan be used in the brachypterous female and male adults, respectively, which is a stable reference gene system. Also,can be used alone as a stable reference gene in both male and female brachypterous adults of. The results of this study ensure the accuratequantification of transcription expression of key target genes in response to changes in magnetic field intensity, and provide a strong guarantee for the future analysis of transcription expression profile under changes in magnetic field intensity.
; near-zero magnetic field; magnetic field intensity; quantitative real-time PCR (qRT-PCR); internal-reference gene selection
10.3864/j.issn.0578-1752.2019.19.006

2019-05-05;
2019-06-03
國家自然科學基金(31470454,31701787)、江蘇省自然科學基金青年基金(BK20160717)、中央高校基本科研業(yè)務費(KYZ201818,KJQN201820)、國家重點研發(fā)計劃(2017YFD0200400)、江蘇省“青藍工程”優(yōu)秀中青年學術帶頭人項目
劉凡奇,E-mail:fanqiliu2014@163.com。
陳法軍,E-mail:fajunchen@njau.edu.cn
(責任編輯 岳梅)

