臺灣假單胞菌的分離、鑒定及其對難溶性磷酸鹽的溶解特性
李凌凌, 楊 進, 孫妤婕, 楊欣月, 陳容彬, 左振宇,2, 楊忠華,2
(1.武漢科技大學化學與化工學院,湖北 武漢,430081;2.武漢科技大學煤轉化與新型炭材料湖北省重點實驗室,湖北 武漢,430081)
磷元素是植物生長過程中不可缺少的重要營養元素之一。目前農業上主要通過施用化學肥料來滿足植物對磷的需求,但由于土壤的固定作用,施入土壤中的可溶性磷肥會轉化為植物難以吸收利用的無效態磷,導致作物對磷肥的利用率有限[1]。此外,由于耕地長期施用磷肥,其大部分無法被農作物利用而在土壤中沉積,造成土壤板結、退化及水體污染,對生態環境帶來嚴重危害[2]。
溶磷微生物可以將土壤中富集的難溶性磷溶解為可供植物吸收的可溶性磷,從而促進植物生長發育,增加農作物產量,改良農田土質并減少化學磷肥的投入,而選育出高效且遺傳性能穩定的溶磷微生物是實現微生物肥料活化土壤磷素的前提條件。溶磷微生物的篩選及溶磷能力的提升、微生物肥料的制備及使用效果等一直是國內外學者的重要研究方向。目前,研究人員已篩選出大量的溶磷微生物[3-6],如溶磷細菌(芽孢桿菌屬、假單胞菌屬、土壤桿菌屬和歐文氏菌屬等)、溶磷放線菌(小單胞菌屬及鏈霉菌屬等)、溶磷真菌(根霉屬、枝孢霉屬、曲霉屬和青霉屬等)。
溶磷菌普遍散布的場合有植物根際、土壤、水體等,而且溶磷菌的分布表現出根際效應,在玉米、冬小麥等作物根際附近的溶磷菌數量要明顯高于非根際土壤中的數量[7],因此篩選溶磷微生物時,植物根際是一種潛在的溶磷菌優質種質資源庫。本試驗從武漢市園林科學研究所里的植物根際土壤樣品中分離出溶磷菌,進行鑒定并研究該菌對難溶性磷酸鹽的溶解能力,以期為有效利用土壤中的磷和降低農業生產成本提供理論依據和技術指導。
1 材料與方法
1.1 材料
1.1.1 培養基
NBRIP培養基:Ca3(PO4)25.0 g,葡萄糖10.0 g,(NH4)2SO40.15 g,KCl 0.2 g,MgCl2·6H2O 0.5 g,MgSO4·7H2O 0.25 g,加蒸餾水定容至1000 mL,pH值調至 7.0,用于培養溶磷細菌[8]。
LB培養基:用于觀察溶磷菌的菌落特征、液體培養特征、運動性及與氧氣的關系[9]。
1.1.2 酶和化學試劑
通用型柱式基因組DNA提取試劑盒、DNA Marker和2×ES Taq MasterMix(含染料)為康為世紀生物科技有限公司產品;PCR產物純化回收試劑盒(Cycle-pure kit)為美國OMEGA公司產品;引物合成和測序工作由武漢擎科創新生物科技有限公司完成。
1.2 方法
1.2.1 溶磷菌的篩選
取5 g由武漢市園林科學研究所的車前草根際處采集的土壤樣品(采集深度5~15 cm),加入到100 mL 的NBRIP液體培養基中,置于30 ℃、150 r/min的恒溫搖床中培養3~5 d。吸取稀釋度分別為10-4、10-5、10-6的富集培養液0.1 mL,涂布于NBRIP固體培養基中,置于30 ℃恒溫生化培養箱中,培養72 h后,從平板上挑選具有明顯溶磷圈的菌落,采用平板劃線分離法進行菌種純化。每次劃線純化時,用接種環在上次劃線的末端有較明顯溶磷圈的部分挑取出菌,在新的NBRIP固體培養基上劃線。如此重復3~4次,直至顯微鏡中觀察到形態、大小基本一致的細菌。
1.2.2 溶磷菌溶磷能力的測定
(1)增溶指數(solubilization index, SI)
純化好的溶磷菌稀釋涂布接種到NBRIP固體培養基中,于30 ℃培養箱中倒置培養5 d后測量菌株的溶磷圈直徑(D)和菌落直徑(d),根據SI=D/d計算細菌在NBRIP平板上的SI值[10]。
(2)培養液中可溶性磷含量
采用磷釩鉬黃比色法測定培養液中可溶磷的含量[11]。
1.2.3 溶磷菌的鑒定
(1)菌株的個體形態觀察
參照文獻[9]對溶磷菌進行革蘭氏染色。
(2)菌株的生理生化特征
各項生理生化指標的檢測均按文獻[9]進行操作。
(3)系統發育樹的構建
按照通用型柱式基因組DNA提取試劑盒說明書,提取所選菌株的基因組DNA。菌株的16S rDNA的PCR擴增、回收、測序和系統發育樹的構建參照文獻[12]進行。
1.2.4 溶磷菌對難溶性磷酸鹽的溶解條件優化
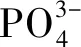
(1)
(2)
式中:m為磷酸根離子占難溶性磷酸鹽的質量比。
1.2.5 生長量、pH及磷溶出量的變化曲線繪制
分別取1 mL處于對數期的菌液接入100 mL的NBRIP液體培養基及優化后的NBRIP液體培養基中,設置3組平行實驗,放入30 ℃、150 r/min的恒溫搖床中培養。每隔一段時間取一次樣,測定pH值、OD420和OD600,據此繪制菌液的pH、磷的溶出量和生長量隨時間變化曲線。
1.2.6 菌株對不同難溶性磷酸鹽的溶解實驗
取1 mL處于對數期的菌液接入100 mL含5.0 g/L磷源(分別為Ca3(PO4)2、FePO4、AlPO4、CaHPO4、羥基磷灰石、磷礦粉)的優化后NBRIP液體培養基中,在30 ℃、150 r/min的恒溫搖床中培養,48 h取樣測定pH值和OD420,72 h取樣測定OD600。
1.2.7 培養液中的有機酸成分分析
菌株P2以Ca3(PO4)2、磷礦粉、羥基磷灰石和CaHPO4為磷源的培養液分別經離心收集(8000 r/min,15 min)及過濾(0.45 μm的濾膜)后獲得上清液,使用高效液相色譜儀(安捷倫1100)分析其中的有機酸成分,色譜柱采用的是SB-C18反相柱,流動相為3%甲醇-0.01 mol/L K2HPO4(調至pH=2.86),流速0.5 mL/min,柱溫30 ℃,檢測波長215 nm,進樣體積5 μL[12]。
1.2.8 菌株對土壤有效磷含量的影響
采集武漢科技大學校區邊的土壤,采樣深度5~20 cm,采集后除雜。將對數期的菌液P2(對照組為10 mL滅活菌液)按照10%的比例與供試土壤混合[13],自然條件下靜置,72 h后采用NaHCO3浸提-鉬銻抗比色法測定土壤中有效磷的含量。
2 結果與分析
2.1溶磷菌的篩選
以稀釋涂布的方式將分離純化的菌株接種于NBRIP固體培養基上,5 d后,測定菌落的直徑和溶磷圈直徑。根據溶磷圈大小篩選到3株具有溶磷能力的菌株,這些菌株在傳代過程中能夠穩定地保持溶磷性能。其中,菌株P2的菌落直徑d=2.3 mm,溶磷圈直徑D=4.8 mm(見圖1),計算得SI=2.08,為同一批次中的最大值,故選擇P2為本研究的出發菌株。
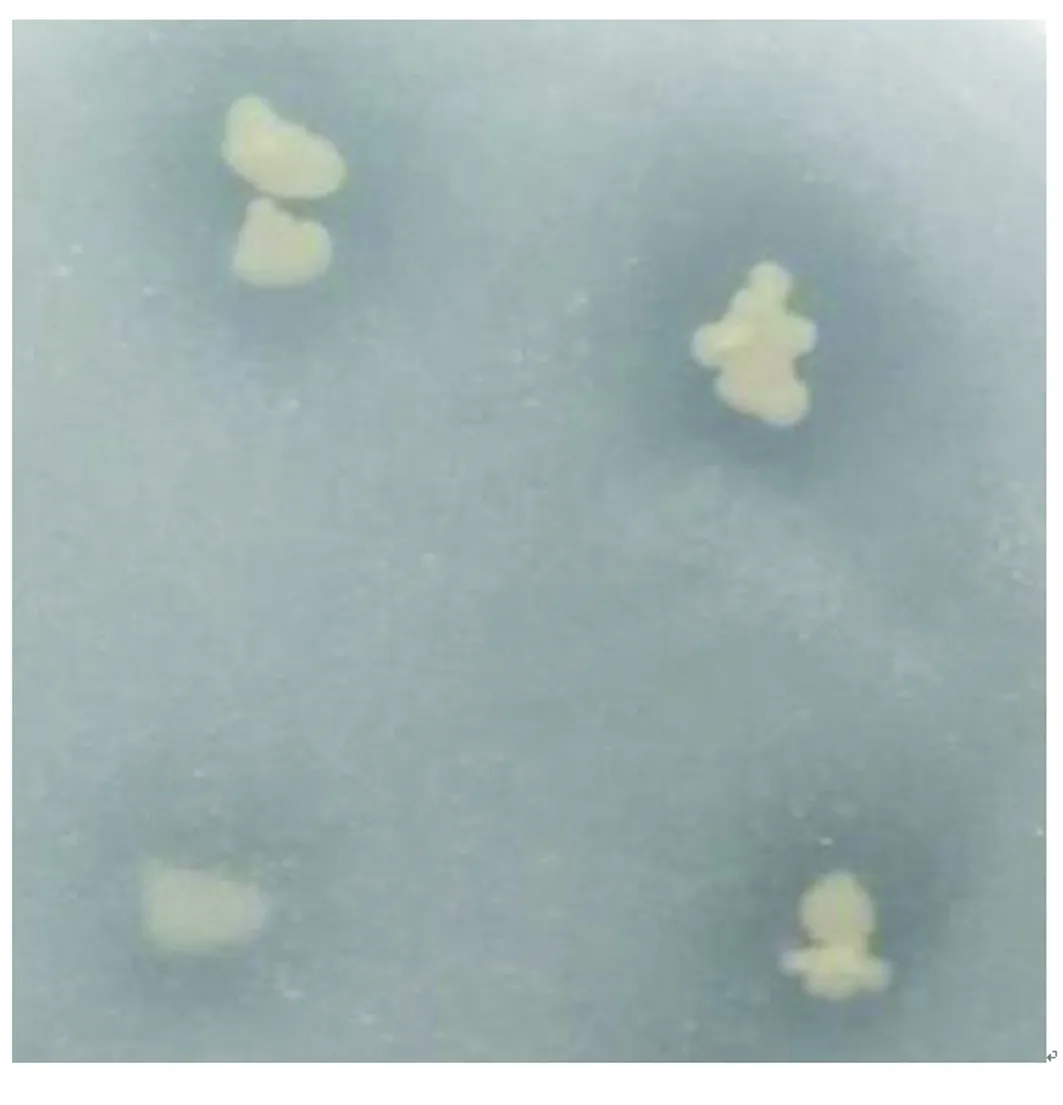
圖1 菌株P2的溶磷圈
2.2 溶磷菌P2的鑒定
2.2.1 菌株P2的個體形態特征
在光學顯微鏡下,菌株P2為可運動且不產芽孢的球桿狀細菌,其革蘭氏染色結果呈陰性,如圖2所示。
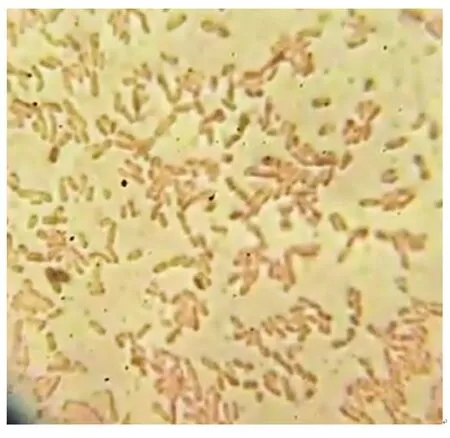
圖2 菌株P2的革蘭氏染色結果
2.2.2 菌株P2的菌落特征
菌株P2在LB固體培養基上培養2 d后,形成圓形的中心凸起、邊緣不規則、光滑且濕潤的菌落,顏色為乳黃色且不透明。在LB半固體培養基中的穿刺試驗結果顯示,菌株P2自上到下在穿刺部位的四周呈云霧狀均勻生長,由此可知P2菌兼性好氧,可運動。
2.2.3 菌株P2的生理生化特征
如表1所示,菌株P2的接觸酶、氧化酶及精氨酸雙解酶為陽性。菌株P2能產生胞外的淀粉酶和脂肪酶,但不能產生胞外的明膠酶及尿素酶。菌株P2可以水解培養基中的含硫氨基酸生成H2S,但不能還原硝酸鹽生成亞硝酸鹽。IMViC試驗結果顯示,菌株P2的檸檬酸試驗呈陽性反應,即可以利用檸檬酸鹽產生堿性碳酸鹽,使培養基pH值升高從而變成藍色;但伏普反應為陰性,即細菌不能發酵葡萄糖生成乙酰甲基甲醇,甲基紅反應呈陰性,且菌株P2也不能產生色氨酸酶分解色氨酸產生吲哚。在糖酵解試驗中,菌株P2可以發酵葡萄糖產酸但不產氣,不能利用蔗糖和乳糖產酸產氣。另外,在NBRIP液體培養基中,菌株P2在 30 ℃下生長狀況最好,40 ℃下可以生長,4 ℃條件下,在光學顯微鏡中未觀察到菌體P2生長的跡象。菌體P2最適生長的pH值為7.0,當pH<4.0和pH>10.0時,菌體P2未見生長。
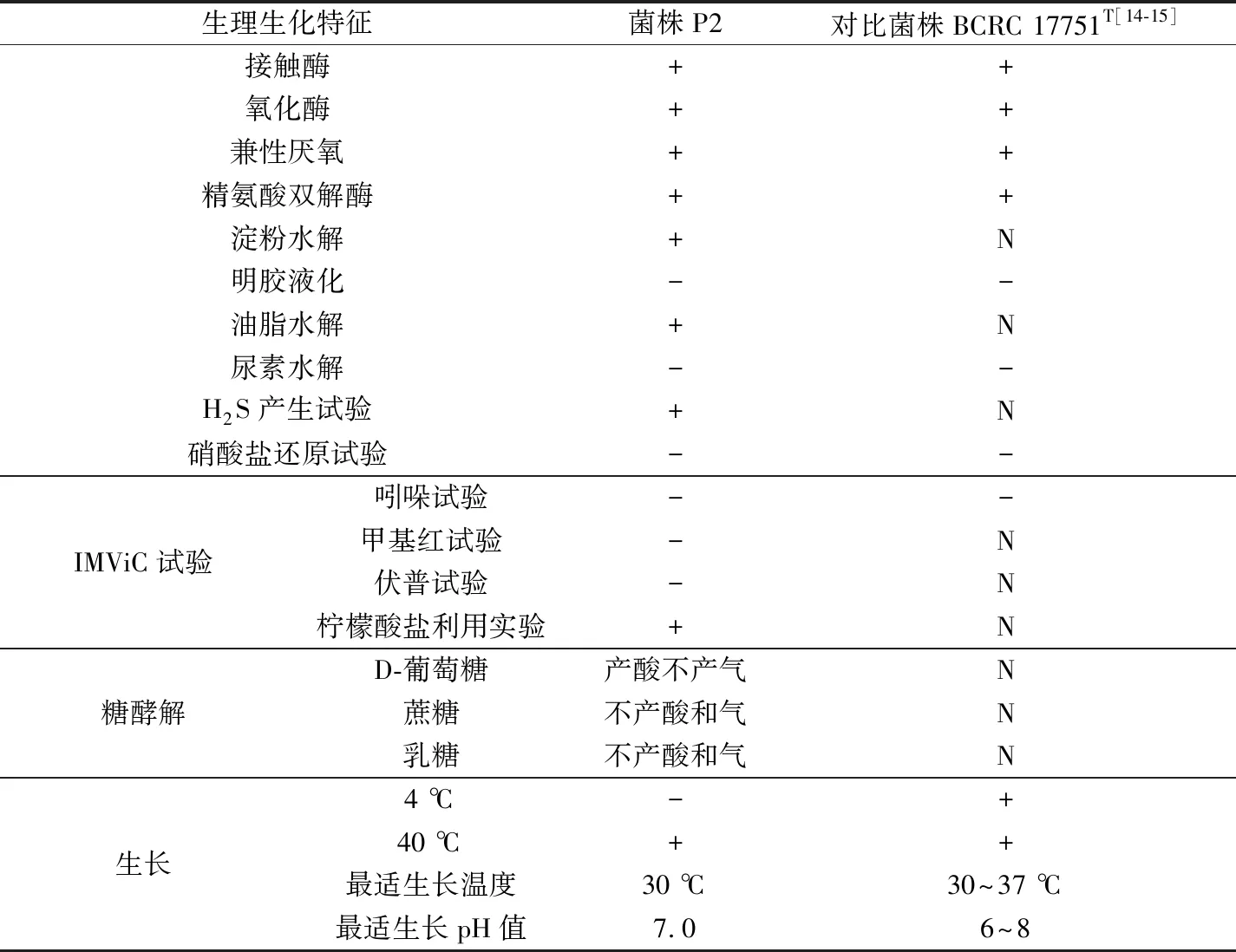
表1 菌株P2的生理生化特征
注:+代表陽性結果;-代表陰性結果;N代表未確定。
2.2.4 系統發育樹的構建
以菌株P2提取出的基因組DNA為模板,進行16S rDNA的PCR擴增,對獲得的PCR產物進行1.0%瓊脂糖凝膠電泳,結果如圖3(a)所示,可見PCR產物位于1000 bp和2000 bp之間,此點與目標序列長度大約為1500 bp相符。將PCR擴增產物切膠回收獲得的產物(電泳結果見圖3(b))送交武漢擎科創新生物科技有限公司進行測序,獲得一段長為1436 bp的核苷酸序列,將此序列提交至Genbank,獲得的登錄號為MK372541。利用NCBI數據庫提供的BlastN功能進行核苷酸比對,結果顯示菌株P2與Pseudomonasputida、Pseudomonasmonteilii及Pseudomonastaiwanensis的16S rDNA基因序列一致性均高達99%。根據16S rDNA序列的相似性,利用Clustal Omega和Mega 6軟件構建系統發育樹(如圖4所示),可見菌株P2在系統發育上最接近于臺灣假單胞菌(Pseudomonastaiwanesis)。
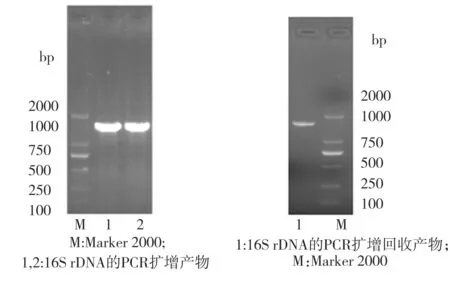
(a) 16S rDNA PCR擴增產物 (b) 回收產物
圖3 菌株P2的16S rDNA PCR擴增及回收產物的瓊脂糖凝膠電泳檢測結果
Fig.3 Electrophoretogram of 16S rDNA PCR amplification and purified product from Strain P2
臺灣假單胞菌[14-15]是球桿狀革蘭氏陰性菌,可以運動,但不能產生芽孢,在TSA培養基上可以長出濕潤的乳黃色圓形菌落。它們可以在5~42 ℃條件下生長,但是不能在更高的溫度(45~60 ℃)下生長,最適生長溫度為30~37 ℃。菌株可以在pH=4~9的條件下生長,最適生長pH值為6~8。菌株的接觸酶、氧化酶和精氨酸雙解酶檢測結果均為陽性,但明膠液化反應和脲酶檢測均為陰性。該菌不能產生吲哚,也不能將硝酸鹽還原成亞硝酸鹽及進行反硝化作用。文獻[14-15]中描述的臺灣假單胞菌菌株BCRC 17751T(即菌株CMST和DSM 21245T)的這些特征與菌株P2的形態學、生理生化特征都很接近。綜合16S rDNA鑒定結果,菌株P2歸屬于臺灣假單胞菌(P.taiwanensis)。
2.3 菌株P2生長及溶磷條件的單因素優化
2.3.1 碳源
溶磷菌P2在不同種類碳源中的生長量、菌液pH值和溶磷量如圖5(a)所示。以葡萄糖、甘露糖、淀粉、乙酸鈉、檸檬酸鈉、乙酸作為碳源時,溶磷菌P2的生長量超出對照組(不接種的相應培養基)二倍左右,生長狀況良好,其中以淀粉為碳源的生長狀況最好;菌株不能以酪氨酸、甘露醇為碳源生長。以葡萄糖、甘露糖、乙酸、草酸為碳源時,溶磷菌P2的溶磷率較高,其中以葡萄糖為碳源時溶磷量最高,為938.14 mg/L,此時對應的溶磷率為30.61%。當以最利于溶磷菌生長的淀粉作碳源時,卻并沒有達到預期的高溶磷率,推測是由于以淀粉為碳源時溶磷菌產酸量不高,這從圖5(a)中pH值可以看出。另外,由溶磷菌P2在不同種類碳源中的pH變化情況可知,溶磷率與pH值存在一定的負相關性。
2.3.2 氮源
溶磷菌P2在不同種類氮源中的生長量、菌液pH值和溶磷量如圖5(b)所示。以尿素為氮源時,溶磷菌P2的生長濃度最高,其次是以NH4Cl、(NH4)2SO4、草酸銨為氮源,而菌株P2在酵母抽提物中的生長濃度最低。以尿素、硝酸鉀、草酸銨、氯化銨、硝酸銨、硫酸銨為氮源時,溶磷菌P2的生長量超出對照組(不接種的相應培養基)二倍左右,生長狀況良好,但以蛋白胨和酵母抽提物為氮源時菌體的生長量較低。總體來說,與有機氮源比,菌體在無機氮源中的生長狀況較優。當以氯化銨為氮源時,菌株的溶磷量最高,達到1131.44 mg/L,對應的溶磷率為36.92%,其次為(NH4)2SO4、草酸銨,這與生長狀況基本吻合。但是,最適生長的尿素作氮源時的溶磷率不是很高,可能與尿素水解生成氨有關。對于所研究的幾種氮源,溶磷菌P2在氯化銨中pH值最低,且溶磷率與pH值存在負相關性。
2.3.3 碳源濃度
溶磷菌P2在初始碳源(葡萄糖)濃度分別為1、5、10、25、50 g/L條件下的生長量、菌液pH值和溶磷量如圖5(c)所示。當培養基中初始碳源濃度低于25 g/L時,隨著該濃度的增加,溶磷菌P2的生長量也逐漸增加。當初始碳源濃度超過25 g/L,達到50 g/L時,溶磷菌P2的生長量大幅下降。另外,不同初始碳源濃度下的溶磷量變化趨勢與生長狀況一致,最適溶磷的初始碳源濃度為25 g/L,此時溶磷量為1005.16 mg/L,對應的溶磷率為32.80%。培養基初始碳源濃度為25 g/L時的pH值最低,此時的溶磷率最高。

圖4 根據菌株P2的16S rDNA基因序列構建的系統發育樹
2.3.4 氮源濃度
溶磷菌P2在初始氮源(NH4Cl)濃度分別為
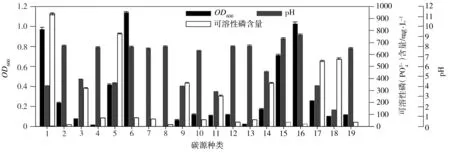
1—葡萄糖;2—蔗糖;3—木糖;4—麥芽糖;5—甘露糖;6—淀粉;7—酪氨酸;8—甘露醇;9—丁二酸;10—甘油;11—檸檬酸;12—山梨醇;13—肌醇;14—鼠李糖;15—乙酸鈉;16—檸檬酸鈉;17—乙酸;18—草酸;19—草酸銨;
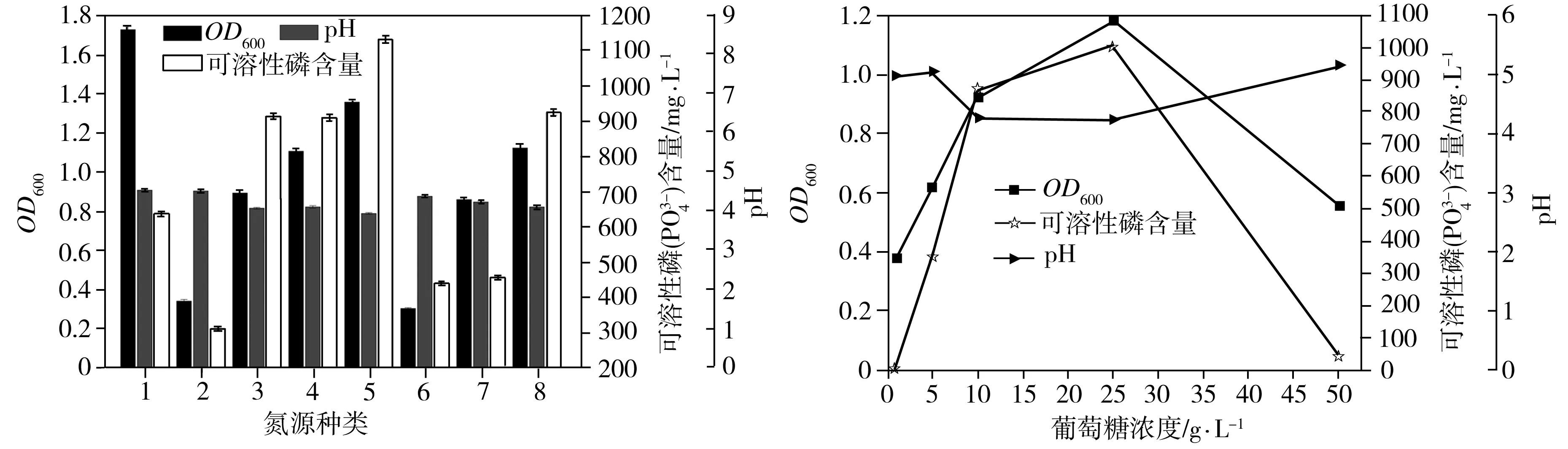
1—尿素;2—蛋白胨;3—KNO3;4—草酸銨;5—NH4Cl
(c)初始碳源(葡萄糖)濃度
6—酵母抽提物;7—NH4NO3;8—(NH4)2SO4
(b)氮源種類
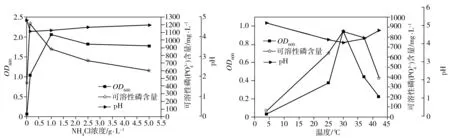
(d)初始氮源(氯化銨)濃度 (e)培養溫度
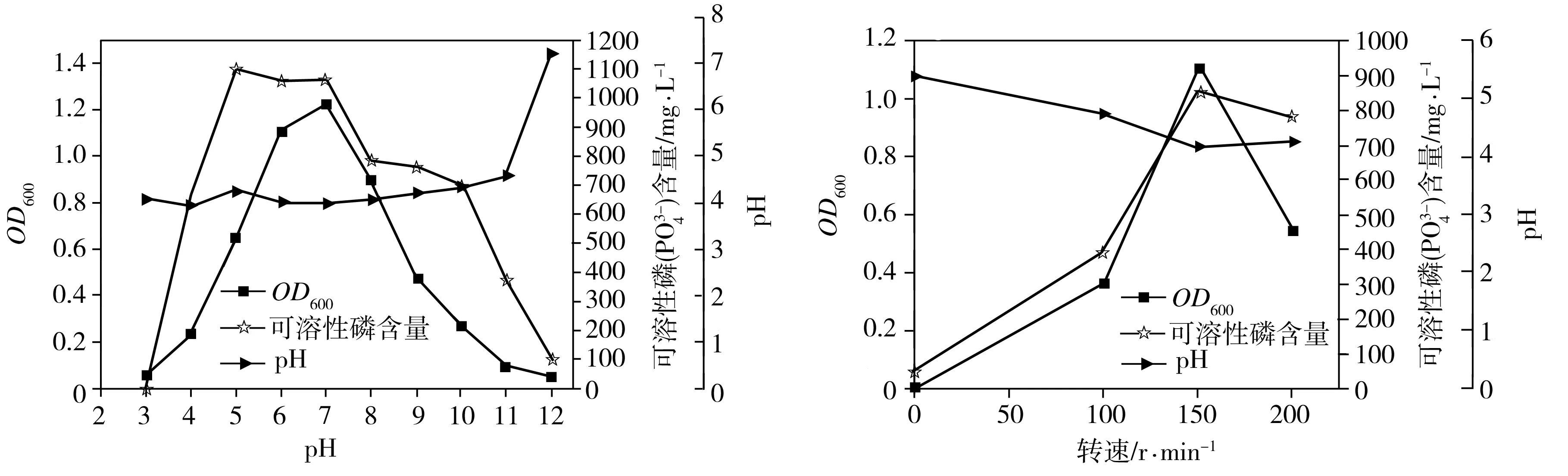
(f)培養基初始pH值 (g)恒溫搖床轉速
圖5 菌株P2的生長及溶磷條件的單因素優化實驗結果
Fig.5 Single-factor optimization results of growth and phosphorous-solubilizing conditions of Strain P2
2.3.5 培養溫度
溶磷菌P2在培養溫度分別為4、25、30、37、42 ℃條件下的生長量、菌液pH值和溶磷量如圖5(e)所示。溶磷菌P2的最適生長溫度為30 ℃。當培養溫度高于30 ℃時,隨著溫度升高,溶磷菌P2的生長量迅速降低。溶磷菌P2的最適溶磷溫度也是30 ℃,此時溶磷量為855.67 mg/L,對應的溶磷率為27.92%。當培養溫度為30 ℃時的pH值最低,同樣存在pH值與溶磷率的負相關性。
2.3.6 培養基初始pH值
溶磷菌P2在培養基初始pH值為 3~12時的生長量、菌液pH值和溶磷量如圖5(f)所示。培養基初始pH值過低不利于菌株P2的生長及溶磷,最適生長的初始pH值為7。但是,最適合P2溶解磷酸鈣的pH值為5,此時溶磷量為1092.78 mg/L,對應的溶磷率為35.66%。當培養基初始pH值高于10時,P2的溶磷率迅速降低(此時生長量也很低),這是因為溶磷作為一個耗酸過程,當P2產生的酸用來中和環境中的堿時,用于溶磷的酸量就會減少,從而導致溶磷率下降。另外,除初始pH值為12的菌液以外,其他菌液的最終pH值都在4左右,說明此菌種有一定的環境改造能力,可通過自身的代謝過程調節環境pH值。
2.3.7 恒溫搖床轉速
溶磷菌P2在恒溫搖床振蕩器速率為0、100、150、200 r/min條件下的生長量、菌液pH值和溶磷量如圖5(g)所示。隨著振蕩速率的升高,溶磷菌P2的生長量和溶磷量均先增大再減少。最適于P2菌生長和溶磷的搖床轉速均為150 r/min,此時溶磷量為855.67 mg/L,對應的溶磷率為27.92%。靜置時,菌體的生長停滯,未見pH值和溶磷率的明顯變化,可能是由于此時磷酸鈣沉降在瓶底,且假單胞菌為好氧微生物,靜置時菌體很難獲得足夠的氧氣和磷源生長。當振蕩速率較低時,培養液中的溶氧濃度不足,導致菌株的好氧生長受到抑制,而當振蕩速率較高時,磷酸鈣顆粒在振蕩過程中會對菌體產生較大的剪切力,從而影響溶磷率。
2.4 菌株P2的生長量及溶磷量隨時間的變化
經單因素優化實驗,得出最適合P2溶磷的條件為:碳源為葡萄糖、氮源為NH4Cl、初始碳源濃度25 g/L、初始氮源濃度0.15 g/L、培養溫度30 ℃、培養液初始pH=5、恒溫搖床轉速150 r/min。分別配制基礎NBRIP培養基和優化后的NBRIP培養基(Ca3(PO4)25.0 g/L,葡萄糖25.0 g/L,NH4Cl 0.15 g/L,KCl 0.2 g/L,MgCl2·6H2O 0.5 g/L,MgSO4·7H2O 0.25 g/L,pH值調至 5.0),再分別按照1%的接種量接入對數期的菌液到兩種培養基中,放入30 ℃、150 r/min的恒溫搖床中培養。每隔一段時間取樣,根據測量值繪制菌株P2在條件優化前后的生長量、菌液pH值和溶磷量隨著時間變化曲線(見圖6)。從圖6(a)可以看出,條件優化前和優化后,菌株P2的生長趨勢基本一致:0~18 h為延滯期,18~72 h為對數生長期,72 ~120 h為穩定期,其中在96 h后生長量達到頂峰,培養120 h后進入衰亡期。從圖6(b)可以看出,無論是條件優化前還是優化后,從接種開始,菌液的pH值均是逐漸下降,直到18 h后,菌液pH值開始穩定。推測是由于菌體溶解Ca3(PO4)2是一個耗酸的過程,同時菌體發酵葡萄糖產酸,在前18 h產酸量遠遠大于耗酸量,pH值迅速降低,但當菌體生長進入對數期后,產酸與耗酸達到平衡,pH值基本保持穩定。從圖6(c)中可以看出,無論是條件優化前還是優化后,菌株P2培養至48 h后,培養基中可溶性磷含量趨于穩定,優化前最大溶磷率為29.02%(對應的溶磷量為889.18 mg/L),優化后的最大溶磷率為41.37%(溶磷量為1267.89 mg/L),約為優化前的1.43倍。
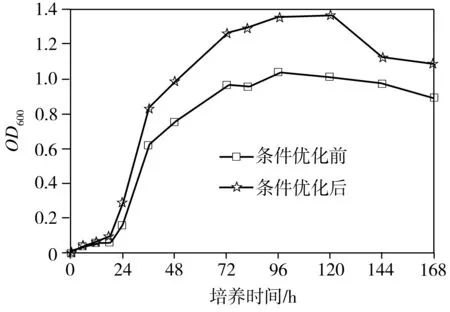
(a)生長量

(b)pH值
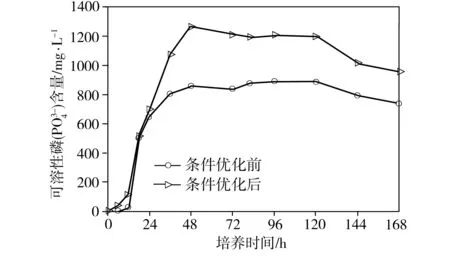
(c) 溶磷量
圖6 條件優化前后菌株P2的生長量、pH值及溶磷量隨時間變化曲線
Fig.6 Variations of growth, pH and phosphorous-solubilizing capacity of Strain P2 with time under optimized and non-optimized conditions
2.5 菌株P2對多種難溶性磷酸鹽的溶解
難溶性磷會在石灰性土壤中轉化為磷酸鈣,在酸性土壤中轉化成磷酸鐵和磷酸鋁,溶磷微生物可以將這些難溶性磷轉化成植物可以吸收利用的磷。為進一步了解菌株P2適合施加的土壤類型,本文考察了溶磷菌P2在不同種類磷源中的生長量和溶磷率變化情況,結果如表2所示。以CaHPO4、羥基磷灰石、磷礦粉、Ca3(PO4)2作為磷源時,P2的生長狀況較好,其中以CaHPO4為磷源的生長狀況最好;以AlPO4、FePO4為磷源時,菌體生長較差。以CaHPO4、Ca3(PO4)2、羥基磷灰石作磷源時,溶磷菌P2的溶磷率較高,而其對磷礦粉、AlPO4、FePO4的溶磷率較低。Bashan等[16]認為,在篩選適合酸性土壤的溶磷微生物時,應以Al-P和Fe-P化合物作為磷源,而篩選適合堿性土壤的溶磷微生物時,應添加Ca-P型磷源。溶磷菌P2對CaHPO4、Ca3(PO4)2、羥基磷灰石的溶磷效果要優于對AlPO4、FePO4的溶磷效果,表明其更適合于施加到偏堿性土壤中。
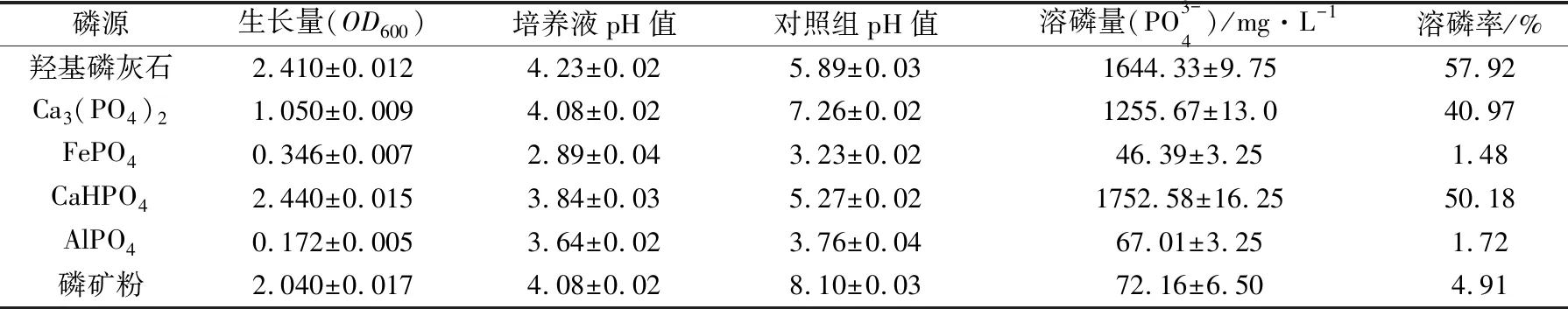
表2 菌株P2對不同難溶性磷酸鹽的溶解實驗結果
假單胞菌屬是土壤中篩選出的主要溶磷微生物之一,很多研究報道都顯示假單胞桿菌屬菌株對難溶性磷酸鹽具有較好的溶磷效果。孫珊等[17]篩選的一株假單胞菌屬菌株GJT-1對磷酸鈣和宜昌磷礦粉的溶磷量可分別達到224.51 mg/L和120.59 mg/L。劉輝等[18]篩選的一株熒光假單胞菌JW-JS1對磷酸鈣的溶磷量最高可達到708.34 mg/L。郭瑩等[19]研究的銅綠假單胞菌JM1對磷酸鈣和磷酸鋁的溶磷量分別為240.63 mg/L和92.73 mg/L。本研究篩選得到的臺灣假單胞菌P2對這些難溶性磷酸鹽的溶解能力與上述報道的數據相當,甚至更優。
2.6 菌株P2對難溶性磷酸鹽的溶出液中有機酸分析
溶磷微生物溶解土壤中難溶性磷酸鹽的機制與微生物分泌的有機酸有關。這些有機酸不僅可以降低環境的pH值,使得磷酸鈣、磷酸鋁、磷酸鐵等溶解,而且能與難溶性磷酸鹽中的鋁、鈣、鐵、鎂等金屬離子螯合,釋放出磷酸根離子[12,20-21]。通過高效液相色譜儀得出的菌株P2對難溶性磷酸鹽的溶出液中有機酸分析結果如圖7所示。比較以不同難溶性磷酸鹽為磷源的培養液中總有機酸濃度(見表3),按濃度高低排序如下:羥基磷灰石>磷酸氫鈣>磷酸鈣>磷礦粉。

(a) 磷酸氫鈣
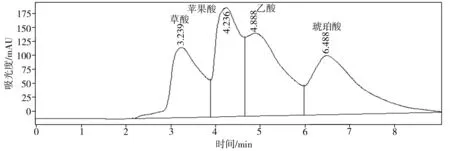
(b) 羥基磷灰石
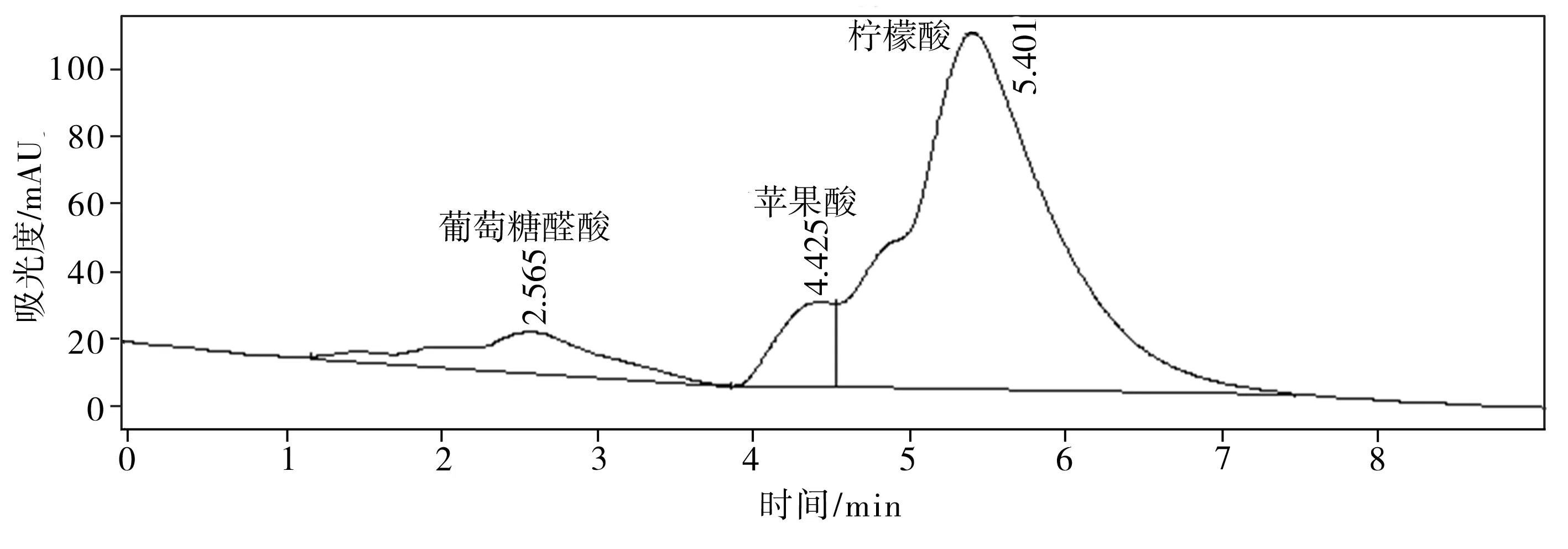
(c)磷酸鈣
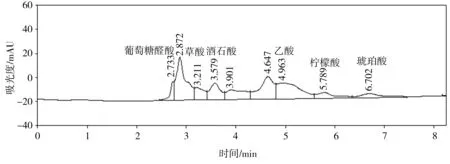
(d) 磷礦粉
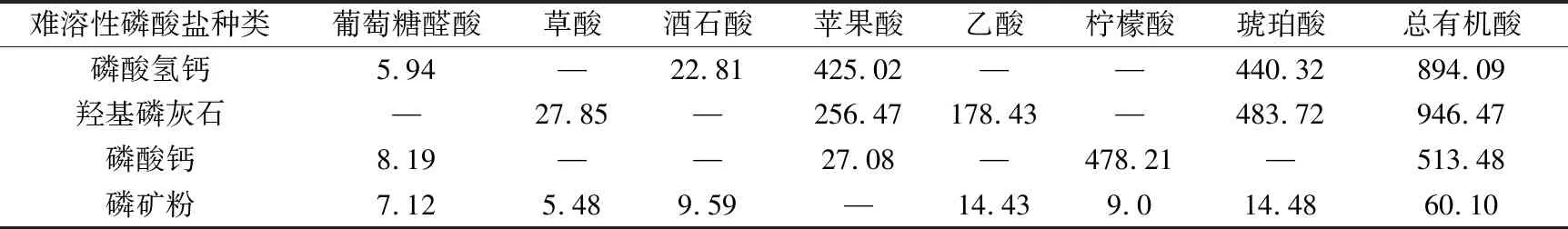
難溶性磷酸鹽種類葡萄糖醛酸草酸酒石酸蘋果酸乙酸檸檬酸琥珀酸總有機酸磷酸氫鈣5.94—22.81425.02——440.32894.09羥基磷灰石—27.85—256.47178.43—483.72946.47磷酸鈣8.19——27.08—478.21—513.48磷礦粉7.125.489.59—14.439.014.4860.10
對比表2和表3可知,磷的溶出率與總有機酸濃度之間總體存在正相關性,再次表明難溶性磷酸鹽的溶解是一個依賴于酸的過程。
2.7 菌株P2對土壤有效磷含量的影響
為了檢驗菌株P2是否能夠轉化土壤中難溶性磷酸鹽而改善土壤的供磷能力,將菌液按照10%的比例與供試土壤混合。經過3 d后,土壤中的有效磷含量從最初的8.63 mg/kg上升為12.66 mg/kg。由此可知,最初的土壤有效磷含量較低,屬于低能力供磷水平,而施加菌株P2后,土壤有效磷含量提高,達到中等供磷水平,表明菌株P2能夠改善土壤的供磷水平。
3 結論
(1)從武漢市園林科學研究所的車前草根際采集的土樣中分離得到了一株具有溶磷能力的臺灣假單胞菌P2。
(2)經單因素優化實驗,得出最適合P2溶磷的條件為:碳源為葡萄糖、氮源為NH4Cl、初始碳源濃度25 g/L、初始氮源濃度0.15 g/L、培養溫度30℃、培養液初始pH值為5、搖床轉速150 r/min。優化條件后菌株P2的溶磷率可以達到41.37%,約為優化前的1.43倍。
(3)溶磷菌P2對多種難溶性磷酸鹽均有一定的溶解能力,且對Ca3(PO4)2、CaHPO4、羥基磷灰石等Ca-P型磷源的溶磷效果要優于對AlPO4、FePO4的溶磷效果,即菌株P2適合于溶解石灰性土壤中的磷。
(4)磷的溶出是一個耗酸的過程,磷的溶出率與培養液中總有機酸濃度之間存在正相關性。
(5)菌株P2可以提高土壤的有效磷含量,明顯改善土壤的供磷水平,具有良好的微生物肥料應用前景。
Isolation,identificationofPseudomonastaiwanesisanditsbio-solubilizationofinsolublephosphates

