云南滇池海埂水域產毒藍藻產毒基因的多樣性研究
劉玉珊,汪 洋,李春筱,李寧浩,董書維,劉 麗
(昆明理工大學生命科學與技術學院,云南 昆明 650500)
富營養化水體中藍藻水華頻繁發生,由此產生的嚴重生態危害已成為備受關注的重大水環境問題。水華的發生使水體感官性狀惡化、自凈能力降低,并破壞自然人文景觀,其中產毒藍藻產生釋放的藻毒素,對生態環境造成危害并危及人類健康[1-3]。
藍藻毒素是產毒藍藻產生的次級代謝產物,毒素種類繁多,其中肝毒素(hepatotoxins)和神經毒素(neurotoxins)對人類危害最為嚴重[4]。微囊藻毒素(microcystin,MCs)是普遍存在于富營養化水體中的肝毒素,也是目前研究最為廣泛的毒素,主要由微囊藻屬(Microcystis)、浮絲藻屬(Planktothrix)和顫藻屬(Oscillatoria)等藻類產生[5];魚腥藻毒素(anatoxin,AnTX)是魚腥藻屬(Anabaena)和束絲藻屬(Aphanizomenon)等藻類產生的神經毒素;麻痹性貝類毒素(paralytic shellfish toxins, PSTs)是具有神經毒性的小分子生物堿,主要由亞歷山大藻屬(Alexandrium)、束絲藻屬和魚腥藻屬等藻類產生[6]。
藍藻毒素類型多樣,分離困難,微量多變,監測分析難度大,目前缺乏對藍藻水華及藍藻毒素危害的有效控制手段。常用的藍藻毒素檢測方法對樣品和檢測條件要求高,往往只能檢測水體中已產生并積累到一定濃度的毒素,無法對毒素產生、毒素種類和產毒藻種進行預判。隨著分子生物學技術的發展,對藻毒素合成酶基因的研究發現微囊藻毒素、魚腥藻毒素和麻痹性貝類毒素的生物合成分別受mcy(microcystin synthesis gene)基因簇、ana(anatoxin synthesis gene)基因簇和sxt(saxitoxin synthesis gene)基因簇的調控[7-9],這為針對性地開展產毒藍藻監測和研究提供了重要手段,通過相關毒素酶合成基因檢測產毒藻類的方法目前已成功應用于藍藻水華監測和研究中[10]。VALéRIO等[11]采用多重PCR和高效液相色譜法對124株環境樣品進行檢測,結果表明多重PCR檢測結果靈敏性為92.3%,特異性高達100%。TILLETT等[12]針對微囊藻毒素合成酶基因mcyA設計特異性引物,運用PCR技術檢測實驗室培養的37株微囊藻的產毒能力,結果表明有18株PCR結果呈陽性。LEGRAND等[13]采用巢式PCR方法擴增環境樣品中魚腥藻毒素基因anaC,結果表明該方法擴增效果顯著,并發現anaC基因廣泛分布在淡水湖泊中。BALLOT等[14]采用sxtA基因對德國東北部湖泊中分離到的14株產麻痹性貝類毒素的束絲藻進行PCR檢測,結果表明14株束絲藻樣本均呈陽性。分子生物學方法簡單快捷,靈敏度高,成本較低,能夠在藍藻毒素釋放之前對其進行定性檢測,可提升對環境水體中毒素的預警預測預防能力,具有廣闊應用前景。
云南滇池是云南高原地區面積最大的淡水湖泊,是我國富營養化最嚴重的湖泊之一[15],2017年滇池外海水質由Ⅴ類降為劣Ⅴ類[16],藍藻水華頻繁發生。基于常規PCR技術采用產毒藍藻特有的3種藻毒素合成酶基因mcyE、anaC和sxtA,檢測2017年3月—2018年2月云南滇池海埂水域產毒藍藻種類,并通過測序得到的序列構建進化樹分析產毒藍藻多樣性。研究富營養化湖泊產毒藍藻和藻毒素基因多樣性,能為科學評價富營養化湖泊產毒藍藻及其藻毒素生態環境危害提供理論依據,有助于建立有毒藻華預警方法,對降低藻華危害效應具有重要意義。
1 材料與方法
1.1 樣品采集和處理
于2017年3月—2018年2月每月中旬在滇池外海海埂水域3個采樣點(24°57′46″ N、102°39′58″ E,24°57′41″ N、102°39′26″ E,24°57′43″ N、102°39′08″ E)分別采集0.5 m深處表層和2 m深處底層水樣,同時測定樣點水溫、pH值和透明度。采集水樣后立即帶回實驗室,將表層和底層水樣混合后經0.45和0.22 μm孔徑纖維濾膜過濾收集藻細胞,濾膜于-40 ℃條件下保存。
1.2 藻細胞基因組DNA提取及PCR擴增
采用E.Z.N.A.?Water DNA Kit試劑盒(OMEGA)提取樣品藻類總DNA,并分別采用產毒藍藻特有的微囊藻毒素合成酶基因mcyE[17]、魚腥藻毒素合成酶基因anaC[18]和麻痹性貝類毒素合成酶基因sxtA[14]對DNA進行PCR檢測,引物序列見表1,擴增引物由昆明碩擎生物科技有限公司合成。PCR反應體系為Premix Taq (2×) (TaKaRa) 10.0 μL,正、反向引物各1 μL (10 μmol·L-1),模板DNA 3.0 μL和ddH2O 5.0 μL,總體積20 μL。反應條件為94 ℃預變性5 min,94 ℃變性30 s,退火30 s(表1),72 ℃延伸90 s,35個循環,72 ℃延伸7 min。
表1 使用的引物序列
Table 1 Primers used in the study

引物名稱序列(5′-3′)目的片段長度/ bp退火溫度/℃mcyE-F2GAAATTTGTGTAGAAGGTGC81256mcyE-R4AATTCTAAAGCCCAAAGACGanxgenFATGGTCAGAGGTTTTACAAG86152anxgenRCGACTCTTAATCATGCGATCsxtafGCGTACATCCAAGCTGGACTCG68355sxtarGTAGTCCAGCTAAGGCACTTGC
1.3 膠回收、TA克隆和序列測定
將擴增后的目的片段使用膠回收試劑盒(TIANGEN)進行純化,純化后采用pEASY?-T1 Cloning Kit (TransGen Biotech)連接與轉化產物,在培養過夜的LB平板上隨機挑取單克隆菌落(每個樣品20個)振蕩培養,對菌液陽性重組子菌落進行鑒定,陽性菌液由昆明碩擎生物科技有限公司進行測序。
1.4 系統進化分析
將測序得到的序列經NCBI BLAST(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)比對后,結合GenBank數據庫中mcyE、anaC和sxtA基因參考序列,采用ClustalX 1.83軟件將所有序列進行匹配排列,采用MEGA 6.0軟件中NJ法分別構建系統進化樹,bootstrap value設為1 000。
2 結果與分析
2.1 滇池海埂水域藻毒素基因PCR擴增及克隆測序
從滇池海埂水域樣品中提取藍藻DNA進行普通PCR擴增。如圖1所示,藻毒素合成基因mcyE、anaC和sxtA分別于812、861和683 bp處有明顯亮帶,這表明由滇池海埂水域水樣成功擴增出mcyE、anaC和sxtA基因,共獲得184條mcyE基因有效序列、142條anaC基因有效序列和195條sxtA基因有效序列。

圖1 藻毒素基因瓊脂糖凝膠電泳圖
2.2 滇池海埂水域藻毒素基因系統進化分析
2.2.1微囊藻毒素mcyE基因系統進化分析
研究區獲得的184條mcyE基因有效序列中,春(3—5月)、夏(6—8月)、秋(9—11月)、冬(12月—次年2月)樣品序列分別為55、50、40和39條,在持續1 a的不同季節均被檢出。將這184條微囊藻毒素mcyE基因樣本序列與代表性mcyE基因參考序列在核苷酸水平上構建系統進化樹。如圖2所示,所有序列在進化樹上可劃分為3個進化簇(Cluster I~Ⅲ)。Cluster I中包括微囊藻屬中銅綠微囊藻和綠色微囊藻mcyE基因參考序列(序列號為AB032549、AF183408、JQ290085和EU151892)以及筆者研究獲得的184條mcyE基因序列,表明滇池海埂水域微囊藻毒素可能主要由微囊藻屬藻類產生。Cluster Ⅱ包括席藻屬(Phormidium)(序列號為JQ771645和JQ771644)和浮絲藻屬(序列號為EU151891、AJ441056和AM990462)mcyE基因參考序列。Cluster Ⅲ則包括魚腥藻屬(序列號為AJ536156和EU151887)、費氏藻屬(Fischerella)(序列號為JQ771640、KX891213、KJ364645)、軟管藻屬(Hapalosiphon)(序列號為EU151886)、念珠藻屬(Nostoc)(序列號為KC699835)和節球藻屬(Nodularia)(序列號為AY382540~AY382542)mcyE基因參考序列。Cluster Ⅱ~Ⅲ均不含筆者研究樣本序列。由此推斷,滇池海埂水域mcyE基因遺傳多樣性較為單一,主要由微囊藻屬產毒藍藻產生,且全年不同季節均存在。
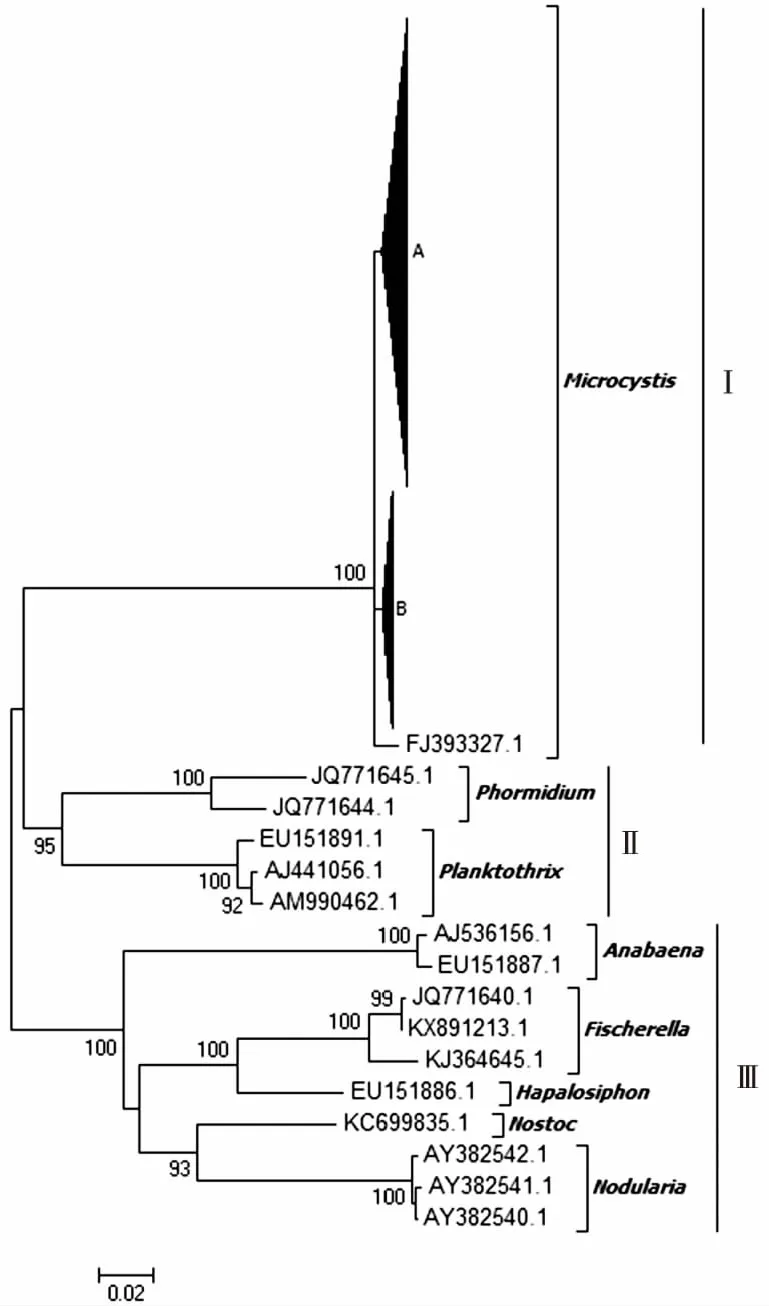
A包含微囊藻參考序列和該研究120條mcyE序列,B包含微囊藻參考序列和該研究64條mcyE序列。
2.2.2魚腥藻毒素anaC基因系統進化分析
研究區獲得的142條魚腥藻毒素anaC基因有效序列,其中春、夏、冬季樣品序列分別為53、44和45條,而秋季樣品未檢出。將這142條anaC基因序列與代表性anaC基因參考序列在核苷酸水平上構建系統進化樹。如圖3所示,所有序列在進化樹上可劃分為3個進化簇(Cluster I~Ⅲ)。Cluster I的克隆來自束絲藻屬anaC基因的參考序列和筆者研究獲得的全部142條anaC基因序列,形成兩個進化亞簇,其中筆者研究獲得的一部分anaC基因序列與未經培養的anaC基因參考序列形成一個進化亞簇A(序列號為KR813863、KR813865、KR813868和KR813869),且未經培養的藍藻序列與束絲藻屬anaC基因序列高度同源;另一部分anaC基因序列與束絲藻屬和矛絲藻屬的anaC基因參考序列位于另一個進化亞簇B(序列號為JF803655和KM245023~KM245025),矛絲藻屬是部分束絲藻歸類的新藻屬,其根源應屬于束絲藻[19]。Cluster Ⅱ包括魚腥藻屬anaC基因序列的參考序列(序列號為JF803645~JF803647和JF803657)。Cluster Ⅲ包括顫藻屬anaC基因序列的參考序列(序列號為JF803648、FJ477836、JF803651、JF803652和JF803656)。Cluster Ⅱ~Ⅲ均不含筆者研究樣本序列。這表明研究區anaC基因主要由束絲藻屬藍藻產生,且除秋季外其他季節均存在。

A包含束絲藻參考序列和該研究78條anaC序列,B包含束絲藻和矛絲藻參考序列以及該研究64條anaC序列。
2.2.3麻痹性貝類毒素sxtA基因系統進化分析
研究區獲得的195條麻痹性貝類毒素sxtA基因有效序列中春、夏、秋、冬季樣品序列分別為57、39、53和46條,全年不同季節均有檢出。將這195條sxtA基因序列與代表性sxtA基因參考序列在核苷酸水平上構建系統進化樹。如圖4所示,所有序列在進化樹上可劃分為4個進化簇(Cluster I~Ⅳ)。Cluster I包括筆者研究獲得的195條麻痹性貝類毒素sxtA基因序列和束絲藻屬sxtA基因參考序列(序列號為EU603710、EU629175和LT549446~LT549449),且同源性為99%。Cluster Ⅱ包括魚腥藻屬sxtA基因序列的參考序列(序列號為DQ787201、EU629176和EU629177)。Cluster Ⅲ包括擬柱胞藻屬sxtA基因序列的參考序列(序列號為DQ787200和EU629178)。Cluster Ⅳ包括鞘絲藻屬sxtA基因序列的參考序列(序列號為EU603711)。Cluster Ⅱ~Ⅳ均不含筆者研究樣本序列。由此推斷,研究區sxtA基因主要由束絲藻屬藍藻產生,且全年均存在。

A包含該研究161條sxtA序列。
3 討論
以微囊藻毒素合成酶基因mcyE、魚腥藻毒素合成酶基因anaC和麻痹性貝類毒素合成酶基因sxtA為靶標基因,采用PCR技術檢測云南滇池海埂水域產毒藍藻種類。結果表明,2017年3月—2018年2月滇池海埂水域均檢測到mcyE基因。系統進化分析結果顯示,獲得的mcyE基因序列與微囊藻屬中銅綠微囊藻和綠色微囊藻的序列同源性為99%,滇池海埂水域微囊藻毒素主要由微囊藻屬水華藍藻產生。鮑忠祥[20]采用高效液相色譜法(HPLC)檢測微囊藻毒素并結合顯微計數獲得的優勢種群發現,滇池中存在微囊藻毒素,并且其主要由微囊藻屬產生,筆者研究結果與之一致。滇池海埂水域光照、水溫、呈弱堿性的水體pH等環境因子都適合微囊藻生長。滇池藍藻水華以微囊藻水華為主,微囊藻已成為滇池藍藻水華的優勢種群[21],這可能導致mcyE基因多樣性較為單一,遺傳差異性不明顯。
魚腥藻毒素和麻痹性貝類毒素都屬于神經毒素,對動物及人類危害很大。目前對藻毒素的研究以微囊藻毒素為主,有關其他類型藻毒素研究較少。加強其他毒素的研究,建立較完善的藻毒素研究體系勢在必行。筆者研究中滇池海埂水域產麻痹性貝類毒素的有毒束絲藻和產魚腥藻毒素的有毒束絲藻均被檢出。研究區sxtA基因序列于2017年3月—2018年2月不同季節水樣中均被檢出,而anaC基因序列于2017年秋季(9—11月)沒有被檢出,其他時間均被檢出,這可能與水體中藻毒素降解、生物吸收和環境因子等因素有關[22-24],具體原因有待進一步研究。劉永梅等[25]通過小白鼠生物檢測發現滇池束絲藻水華可能產生麻痹性貝類毒素。筆者研究獲得的anaC和sxtA基因均屬于束絲藻屬,與參考序列同源性較高,遺傳差異性也不明顯,這表明這些anaC和sxtA基因可能由束絲藻屬藻類產生。萬能等[21]研究表明,滇池藍藻水華的優勢種群存在明顯的微囊藻—束絲藻季節性交替。研究區域anaC和sxtA基因多樣性較單一,這可能與束絲藻是滇池藍藻水華的優勢種群有關。
4 結論
藍藻毒素在湖泊中廣泛存在,迫切需要建立準確、快速、有效地預測水華尤其是有毒藍藻水華的方法,這需要檢測富營養化湖泊中產毒藍藻種類,分析藻毒素類型。滇池藍藻水華頻繁暴發,由此產生的藍藻毒素問題也不容小覷。筆者通過3種藻毒素合成酶基因檢測2017年3月—2018年2月滇池海埂水域藍藻產毒基因種類,發現研究區微囊藻毒素mcyE基因、魚腥藻毒素anaC基因和麻痹性貝類毒素sxtA基因均有檢出,且mcyE、anaC和sxtA基因多樣性均較為單一,遺傳差異性不明顯。筆者研究組采用16S rRNA和18S rRNA測序方法分別研究滇池海埂水域不同季節原核浮游生物和真核浮游生物,分析其藍藻群落結構,發現春、夏、秋和冬季研究區微囊藻屬占據優勢,束絲藻屬等其他藻屬也均有存在,為后續研究產毒藍藻分子檢測提供參考,也為產毒藍藻預警機制提供技術支持。湖泊不同區域環境條件不同,富營養化程度不同,藍藻優勢種群也不同,導致不同區域產毒藍藻種類可能存在差異,有必要進一步擴大研究范圍,以期更加全面深入了解滇池產毒藍藻多樣性。僅采用有毒藍藻產毒基因的分子生物學檢測方法難以有效反映水體藻毒素水平,在實際應用中可結合高效液相色譜法(HPLC)和酶聯免疫吸附試驗(ELISA)等具體毒素分析方法共同使用。

