由“黃金雨”實驗設計“沉淀溶解平衡”的主題式復習
馬潔
摘要:以“沉淀溶解平衡”為例設計“主題式復習”教學,以創設的情境為基礎,連貫地呈現“沉淀溶解平衡”知識間的豐富聯系,高度整合基礎知識和綜合應用能力,促進學生化學學科核心素養發展,也為如何提高高三化學復習效率提供新思路。
關鍵詞:主題式復習;黃金雨;沉淀溶解平衡
文章編號:1008-0546( 2019) 08-0044-04
中圖分類號:G633.8
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2019.08.014
“主題式復習”的基本模式是圍繞一個主題,教師將涉及到的知識以教學情境為載體逐漸呈現。學生從情境中提取知識、發現問題,通過探究實驗、交流討論、歸納總結等多樣化活動,建構完整的知識網絡,提升學習能力[1]。受江蘇高考模式影響,高三化學課時較少,“主題式復習”在復習課中具有應用優勢。本文以“沉淀溶解平衡”為例,通過教學設計與實施對高三化學主題式復習課進行探索。
一、實驗素材背景
“沉淀溶解平衡”是“溶液中的離子反應”的重要組成部分,是“化學平衡”的延續和發展,其教學價值重在幫助學生從微觀的角度認識物質在水溶液中的行為.發展微粒觀、平衡觀、定量觀。選擇“黃金雨”趣味實驗為背景,該實驗融合“沉淀溶解平衡”,宏觀可見、微觀可探,是高三化學復習的好素材。
“黃金雨”實驗的主角是碘化鉛(Pbl2),在含有可溶性鉛鹽溶液里滴入KI溶液,產生鮮艷的黃色沉淀Pbl2,由此引出課題——“沉淀溶解平衡”。PbI2除了本身的明黃色以外,還有一個顯著的特點,就是它在水中的溶解度在不同溫度下的變化比較明顯,20℃時溶解度僅0.069g,而80℃時可達0.294g,這是一個物質溶解度隨溫度變化的十分好的素材。再有,溫度影響溶解平衡的事實,可以與后面復習平衡移動相呼應。冷卻加熱所得淡黃色清液,金色小品體從各個角落均勻析出,閃閃發光、十分奪目。另外“黃金雨”實驗存在重金屬離子污染問題,以此演繹平衡移動,聚焦Pb2+處理,根據平衡移動原理指導實踐,討論實驗方案,體會化學學科價值。
二、教學設計思路
近年來,“沉淀溶解平衡”是高考的固定考點,題型穩定。考試說明要求:“理解難溶電解質的溶解平衡、能運用溶度積常數( Ksp)進行簡單計算”,主要考查學生對基本概念的理解和對Ksp的認識和應用,并能在此基礎上評價不同實驗方案。中學階段對這部分內容已十分控制難度,但“沉淀溶解平衡”作為教材內容的最后一個平衡體系,理論性強、概念抽象,許多學生存在較明顯的認知缺陷,知識片段式、零碎化。
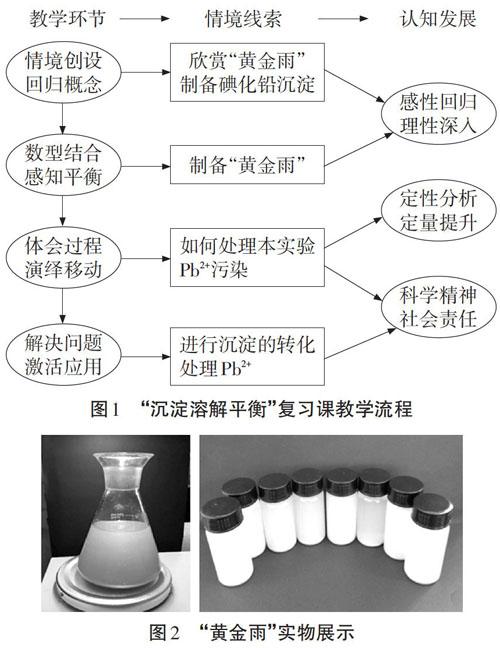
本節復習課以“黃金雨”實驗為情境載體,結合考綱展開教學設計,首先欣賞“黃金雨”,激發學生的研究熱情;隨即制備PbI2,喚醒記憶、回歸概念,討論試管中的離子反應及平衡體系,深度辨析概念、通過數型結合強化Ksp的應用;之后呼應主題,學生制作“黃金雨”,體會美麗化學;緊接著拋出Pb2+污染問題,引導學生利用沉淀轉化解決問題。通過復習喚醒、整合、內化、提升。在深度辨析概念的基礎上,引導學生進行定性分析、定量計算,輔以生動的實驗,夯實基本概念和基礎知識的同時,培養信息加工和解決實際問題的能力,發展化學服務于社會和諧發展的學科價值觀。相關教學流程見圖l。
三、教學過程設計
1.課題引入制備PbI2
課前在講臺上放置一臺磁力攪拌器,瓶內物質在攪拌下緩慢旋轉,在燈光照射下金光閃閃,并利用投影儀在屏幕播放。為加強體驗,每小組的實驗盒中也放置一小瓶黃金雨,讓學生振蕩后用電筒照射,近距離欣賞。
[學生實驗1]取5mL 0.2mol.L-1KI溶液于試管中,往其中加入2mL O.lmol.L-l( CH3C00)2Pb溶液,充分振蕩后靜置。提醒:注意I-過量!
[思考]這個體系中主要存在著怎樣的化學平衡?
[反饋]大量Pb2+與I一結合產生了黃色PbI2沉淀:Pb2++2I-=Pbl2↓。此體系中主要存在沉淀溶解平衡:Pbl2=Pb2+ +2I-。
[動畫]Pbl2固體在水中,一方面,在水分子的作用下,少量Pb2+和I一脫離Pbl2固體表面進入水中;同時,進入水中的Pb2+和I一又受正負離子的吸引,回到固體表面析出。當沉淀溶解速率和生成速率相等時,得到PbI2飽和溶液,建立沉淀溶解平衡。
[辨析] Pbl2=Pb2++2I-的含義。大部分像Pbl2這樣的難溶性鹽,又如BaSO4、AgCl等,都是強電解質。電離過程和溶解平衡過程各自存在、但各不相同,不能混為一談,我們要用規范的化學用語表示。這個表達式還可以標明狀態:PbI2(s)=Pb2+(aq)+21-(aq),區分電離過程。
[歸納]這里的宏觀現象、微觀探析、符號世界是物質的三重表征。微觀結構決定宏觀性質,符號作為中介,增強對物質的認識、概念的思辨,這是化學學科最具特色的思維方式。復習中同學們可以多加嘗試,定會事倍功半。
[設計意圖]蘇教版教材利用檢驗Pbl2上層清液中I-的實驗引出課題“沉淀溶解平衡”,其中Pbl2試劑是直接呈現的,且高中教材中Pbl2僅在此出現過一次,學生比較陌生。本節復習課利用復分解反應再現Pbl2,喚醒記憶,KI和(CH3C00)2Pb溶液混合制備Pbl2,且實驗時強調I一過量,為后續探究鋪路。從宏觀現象入手引出體系中的離子反應及主要存在的化學平衡,辨析離子反應、沉淀溶解平衡、電離方程式,在思辨中加深對“沉淀溶解平衡”的理解,強調“宏觀一微觀一符號”三重表征。
2.數型結合感知平衡
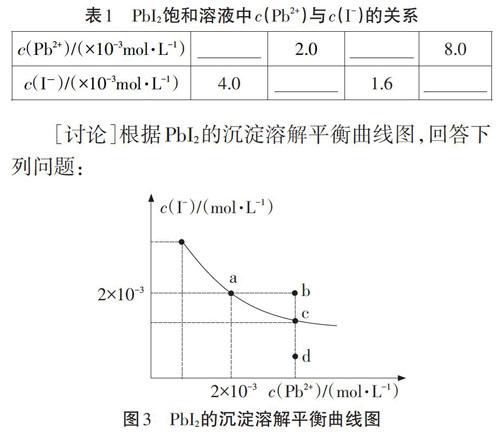
[活動]已知25℃,Ksp( Pbl2)=8.0×10-9,Pbl2飽和溶液中C(Pb2+)與c(I-)的關系如下表所示。完成表格,并根據表中數據在坐標系中畫出Pbl2在水中的沉淀溶解平衡曲線圖[2]。
[討論]根據Pbl2的沉淀溶解平衡曲線圖,回答下列問題:
①a點的含義是什么?
②d點有無沉淀?如何改變條件使之析出沉淀?
③通過蒸發能否將d點變到c點?
④加入(CH3C00)2Pb固體,能否使溶液由a點變到b點?
⑤b點是否有固體析出?
[反饋]一定溫度下,某難溶電解質的飽和溶液,依據溶度積表達式根據一種離子濃度求另一種離子濃度。學生板演Pbl2溶度積表達式:Ksp(Pbl2)=c( Pb2+).C2 (1-)。
[歸納]高考題中常有關于平衡曲線的考查,抓住平衡狀態,結合溶度積規則,很容易解決相關問題。小結溶度積規則:QspKsp:溶液過飽和,有沉淀析出。
[設計意圖]以Pbl2飽和溶液為例,依據Ksp計算、描點、作圖,感知沉淀溶解平衡狀態。不僅培養識圖能力,而且體會作圖的過程。知其然,更知其所以然。并根據圖像,設計系列追問,加深對Ksp的理解,歸納小結Ksp的應用,建構“沉淀溶解平衡”的認知模型。
3.制作“黃金雨”演繹平衡移動
[學生實驗2]將實驗1試管充分加熱至沉淀基本溶解,冷卻、靜置后逐漸有金黃色晶體析出。
[交流]欣賞親手制作的“黃金雨”,興奮不已。Pbl2黃色濁液隨著加熱逐漸變澄清,相比于許多白色難溶物的溶解要更加醒目。加熱過程中,黃色沉淀逐漸溶解,說明隨溫度升高,該溶解平衡正向進行,即溶解吸熱,AH>O。Pbl2晶體呈六棱柱型,擁有八個反光面,冷卻時小晶體從各個角落均勻析出。
[過渡]美麗背后存在重金屬離子污染的隱患。資料:“Pbl:是一種亮黃色重質粉末或六邊形鱗片狀結晶,熔沸點較高,有毒。Ksp(Pbl2) ≈8.Oxl0-9,溶解度S≈0.055g,屬于微溶物質。《國家生活飲用水衛生標準》鉛含量-1”。由此可見,我們八個實驗小組實驗產生的鉛污染是不容忽視的。如何降低本次實驗由于Pb2+造成的水污染?
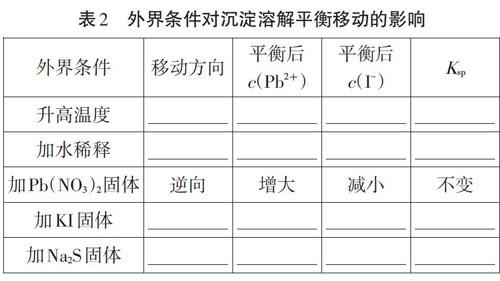
[復習]以Pbl2為例,回顧外界條件對沉淀溶解平衡移動的影響。
[討論]以上外界條件中哪些變化能夠降低C(Pb2+),其中哪種方法最適合處理污染問題?
[分析]結合數據:25℃,Ksp( PbCl2)=1.6xl0-5、Ksp( Pbl2)=8.Oxl0-9、Ksp( PbS)= 8.Oxl0-28。向Pbl2飽和溶液中加入少量Na2S固體或溶液,Pb2+與S2-結合生成更難溶的PbS,C(Pb2+)減少,促進Pbl的溶解,最終轉化成PbS,平衡移動實現沉淀的轉化。書寫離子方程式:Pbl2(s)+S2-(aq)=PbS (s)+21-(aq),計算反應平衡常數。
[設計意圖]引導學生在真實的實驗中挖掘隱含知識,認識到平衡的移動實現沉淀的轉化。通過Pb2+污染處理的討論,演繹平衡移動,并根據平衡移動原理指導實踐,聚焦C(Pb2+)減小,討論實驗方案。層層遞進,打通沉淀的產生、溶解、轉化。培養學生主動應用平衡移動原理解決實際問題的能力,體會化學學科價值、增強社會責任意識。
4.利用沉淀轉化,處理Pb2+污染
[學生實驗3]①將實驗2的懸濁液分為兩份,向其中一支試管中滴加0.4mol.L-1Na2S溶液,一支試管的懸濁液留做比較。②用鉛離子測試紙分別檢測兩支試管中的上層清液,并與比色卡對比,記錄相應數據范圍。
[設計意圖]水質問題是一個世界性問題,有效快速的水質檢測是當前的剛性需求。為了看見Pb2+減少,提供給學生一種便捷的檢測方法,利用Pb2+測試紙半定量檢驗處理效果。通過以上活動發展了對于沉淀溶解平衡的定量認識,培養了學生基于現象、基于數據的證據推理意識,又增強了學生的環保意識和社會責任。
[拓展1]若實驗1改為取SmL 0.2mol.L-1(CH3COO)2Pb溶液,往其中加入2mL O.lmol.L-1KI溶液,以下步驟不變。通過實驗3產生黑色沉淀能否說明溶解能力PbS
[拓展2]對比PbCl2、Pbl2、PbS的Ksp數據,難溶電解質溶度積越小,溶解度一定越小嗎?
[小結]I.與其他平衡常數一樣,一定溫度下,溶度積Ksp為一常數。
Ⅱ,一定溫度下,相同類型(AmBn)的難溶電解質,Ksp越小,溶解度也越小;不同類型的難溶電解質,需注意Ksp表達式中的指數。
Ⅲ.一般來說,溶解能力相對較強的物質易轉化為溶解能力相對較弱的物質。
[設計意圖]蘇教版《化學反應原理》教材中的“沉淀的轉化”實驗是AgCl轉化為Agl,Agl轉化為Ag2S,實驗第一步要求將AgN03溶液滴入NaCl溶液[3],以保證Ag+完全沉淀,只有Ag+完全沉淀,才能說明Agl是AgCl轉化而來,而不是過量的Ag+與I-結合,這個實驗環境許多學生會忽視。此處利用現有情境,引導學生思考實驗l中制備Pbl2時為何要I-過量,若顛倒試劑用量是否可行?激發認知沖突、評價實驗方案,提升對沉淀轉化本質的認識。
[結語]沉淀溶解平衡和電離平衡、水解平衡一樣都屬于水溶液中的化學平衡,可以用勒夏特列原理分析沉淀的生成、溶解、轉化。利用Ksp計算未知離子的濃度,判斷沉淀的先后等等(圖6)。
5.教學反思
高三化學復習課不能離開教材,復習不是簡單重復,不是機械做題,要想利用最精華的課堂時間達到最有效的復習效果,教師必須在備課上多下功夫,多研究考綱,多研究考題。本節課設計真實情境融合考點,培養學生在真實情境中獲取、分析、加工信息的能力,讓學生在分析和解決實際問題中不斷深化對核心概念本質的認識,領悟學科思想和方法。
相比于教材中較分散的實驗,本節高三化學主題式復習課,開發了“黃金雨”實驗中的有效教學資源,將抽象的知識情境化,有利于整合體系、建構模型。活動設計體現了直觀性、定量性和綜合性的特點,提升丁學生的證據推理意識,以及發展化學服務于社會的學科價值觀。另外,本節課缺乏學生討論碰撞交流,計算演練較匆忙,規范化訓練不夠,有待進一步改進。
參考文獻
[1]趙培培,高三主題化復習課的設計與實施[D].石家莊:河北師范大學,2018:1
[2]王飛,趙華.復習課應回歸教學原點——基于“沉淀溶解平衡”復習課設計的幾點思考[J].化學教育,2014(1):44- 47
[3]王祖浩主編,普通高中課程標準實驗教科書·化學反應原理[M].南京:江蘇教育出版社,2017:90-91

