鎘脅迫下轉基因水稻對根際土壤微生物的影響
李磊 韓成 王宵宵
摘要:為了探究鎘脅迫下轉基因水稻對根際土壤微生物的影響,以抗蟲轉基因水稻華恢1號(HH1)及其親本非轉基因水稻明恢63(MH63)為研究材料,設置不同Cd2+濃度(0、3.5、60.0、240.0 mg/kg)脅迫進行盆栽試驗。結果表明:與Cd0相比,Cd3.5處理對水稻農藝性狀無顯著影響;Cd240.0處理顯著降低了株高、產量;與Cd0處理相比,Cd60.0和Cd240.0處理下HH1水稻根際土壤細菌群落組成中Proteobacteria(變形菌門)、Acidobacteria(酸桿菌門)、Actinobacteria(放線菌門)的相對豐度顯著降低;MH63水稻中Acidobacteria的相對豐度顯著升高而Bacteroidetes(擬桿菌門)的相對豐度顯著降低。Cd脅迫顯著降低了水稻根際土壤細菌群落豐度及多樣性。環境因子分析顯示,Cd脅迫后水稻根際土壤pH值、總氮含量、銨態氮含量的變化是影響根際土壤細菌群落結構的主要原因。
關鍵詞:轉基因水稻;細菌群落;根際土壤;鎘脅迫
中圖分類號: S154.3;Q938.1 ?文獻標志碼: A ?文章編號:1002-1302(2019)14-0282-06
近年來,鎘(Cd)污染愈加嚴重,使得農業的可持續發展與人類的生態環境受到極大影響。Cd在土壤-植物系統中具有較強的遷移能力,可在作物中富集較高濃度的Cd,經食物鏈傳遞進入人體危害人類健康[1]。調查顯示,廣西巖溶地區自然地理環境下土壤中的Cd濃度高達20 mg/kg,遠高于國家標準,且我國西南地區土壤中Cd含量普遍較高[2]。水稻是我國重要的糧食作物,同時也是極易富集Cd的作物。近年來,轉基因作物迅猛發展,2017年全球轉基因作物種植面積高達1.9億hm2[3]。來源于蘇云金芽孢桿菌的Bt毒蛋白基因是目前應用最為廣泛的抗蟲基因。轉入Bt基因的抗蟲轉基因水稻,能夠殺死鱗翅類害蟲,大大降低化學殺蟲劑使用量[4]。在干旱、高鹽及重金屬等逆境脅迫下,與親本水稻相比,轉基因水稻具有生長優勢[5-8]。如在Cd及高溫脅迫下,轉基因水稻幼苗中抗氧化酶含量高于親本水稻[5-6];Li等研究發現,在高濃度臭氧脅迫下,抗蟲轉基因水稻的光合作用、產量均高于親本水稻[7],且能夠比親本水稻提前適應低氮環境[8]。我國受重金屬污染較嚴重地區土壤Cd污染的平均值達到3.5 mg/kg,轉基因水稻在該濃度Cd脅迫下是否能正常生長、是否富集Cd目前尚不清楚;而在高Cd濃度脅迫下,與親本水稻相比,轉基因水稻是否具有更高的抗Cd能力也有待研究。
土壤微生物是土壤生態系統中物質和能量循環的主要參與者,其活動是衡量生態系統各種功能是否正常的一個重要方面。土壤微生物群落與土壤重金屬污染之間的關系是國內外環境科學領域的一個研究熱點,重金屬污染能夠對土壤的微生物群落產生影響,如降低土壤微生物量、可培養細菌菌落數量等[9],同時重金屬污染能明顯改變土壤微生物群落結構[10]。轉基因作物能通過作物殘體、作物根系分泌物、作物花粉等方式改變根際土壤微環境,影響土壤生態系統。關于轉基因水稻對土壤微生物群落的影響,學者們展開了大量研究,但目前尚未有統一結論,有學者通過田間試驗監測了轉基因水稻與其親本的多樣性,發現轉基因水稻對土壤根際微生物多樣性無顯著影響[11],也有研究者比較了轉基因水稻和常規水稻根際細菌類群的數量和組成,發現轉基因水稻的根際土壤細菌數量少于非轉基因水稻,同時發現2個品種水稻土壤微生物群落結構不同[12]。根際土壤微生物是轉基因作物環境安全評價的重要指標之一,其群落豐度、組成易受根際微環境和水稻生長影響。但在Cd脅迫下,轉基因水稻對根際土壤微生物的研究尚未見報道。
本研究以轉基因水稻華恢1號(HH1)及其親本非轉基因水稻明恢63(MH63)為研究對象,研究不同Cd濃度脅迫下轉基因水稻對根際土壤微生物的影響,為Cd污染地區水稻生長及環境安全評價提供理論依據。
1 材料與方法
1.1 供試土壤與水稻種子
供試土壤為南京師范大學仙林校區(118°55′E、32°06′N)內未經人為干擾的自然生態系統土壤,去除表面植被、落葉及顆粒物后,采集0~15 cm深度土壤,室內自然風干后研磨過篩(2 mm),混勻后備用。土壤基本理化性質如下:pH值為7.77,總氮含量為0.41 g/kg,總有機碳含量為2.7 g/kg,有機質含量為4.65 g/kg,速效磷含量為3.53 mg/kg,銨態氮含量為0.28 mg/kg,該土壤中未檢測到Cd等重金屬污染。供試水稻為抗蟲轉基因水稻華恢1號(HH1)及其非轉基因親本水稻明恢63(MH63),水稻種子由華中農業大學植物科技學院提供。
1.2 盆栽試驗
盆栽試驗于2017年4—11月在南京師范大學地理科學學院玻璃溫室內進行。試驗選用高×直徑為15 cm×25 cm的聚氯乙烯(PVC)塑料桶作為水稻盆栽用桶,每桶稱取相當于5.0 kg干土質量的風干土壤,添加自來水使得盆栽桶中淹水4~5 cm,并添加不同Cd濃度對土壤進行為期30 d的預處理,盆栽桶口覆膜以減少水分揮發,膜上有孔以維持通氣狀態。設置Cd0、Cd3.5、Cd60.0和Cd240.0共4個Cd濃度脅迫處理,Cd添加量分別為0、3.5、60.0、240.0 mg/kg,其中Cd3.5為我國受重金屬污染較嚴重地區土壤Cd污染的平均值,本研究具有實際意義;而Cd60.0和Cd240.0為土壤污染的極端值,擬研究在該高Cd脅迫下轉基因水稻的抗Cd潛力。本研究中 Cd(Ⅱ) 的添加形態為CdCl2·2.5H2O,每個Cd濃度處理設置4個重復。重金屬預處理后,每桶施入N ∶ P ∶ K質量比為 1 ∶ 1 ∶ 1 的復合肥作基肥,添加量為1.0 g/kg。將培養20 d后的HH1和MH63水稻幼苗分別移栽至桶中,每桶3株。水稻生長期間盆內保持4~5 cm淹水層,于移栽后20 d追施尿素(0.05 g/kg),于移栽后30 d(水稻分蘗后期)進行曬田,其他管理措施與田間相同。成熟期破壞性采樣前,采用微電極分析儀(Unisense Microsensor Multimeter Version 2.01)測定各處理水稻盆栽水-土界面下3.8 cm處水稻根際土壤氧化還原電位值,測定方法參考文獻[13]。于移栽后112 d(水稻成熟期),對水稻植株進行破壞性采樣,并測定株高、生物量、籽粒重金屬含量等水稻農藝性狀。采集土樣時,根據土壤在植物根系表面抖落和黏著程度來區分根際土和非根際土,具體采用抖落法收集[14],將采集的水稻根際土壤的一部分立即裝入2 mL離心管中于 -80 ℃ 保存,用于微生物分子生態學分析;一部分根際土用于土壤理化性質分析。
1.3 分析方法
1.3.1 土壤理化指標的測定 土壤pH值的測定采用蒸餾水浸提法,以2.5 mL ∶ 1 g的水土比浸提,振蕩10 min并靜置30 min,采用臺式pH計(Mettler-Toledo)測定懸濁液pH值。植物樣品使用HNO3+HClO4消煮后,采用火焰原子吸收分光光度法測定,土壤有效Cd含量采用土壤養分狀況系統研究法(ASI法)浸提后,采用火焰原子吸收分光光度法測定;土壤總有機碳(total soil organic,簡稱TOC)含量采用日本島津TOC儀測定;土壤有效磷(AP)含量采用氟化銨-鹽酸提取-鉬銻抗比色法測定;總氮含量采用凱氏蒸餾法測定,無機氮采用2 mol/L KCl按體積比5 ∶ 1水土比浸提,在20 ℃、200 r/min 條件下振蕩1 h后過濾,濾液無機氮含量用流動分析儀(Skalar San Plus,Netherlands)測定。檢測方法參考鮑士旦的《土壤農化分析》[15]。
1.3.2 土壤總DNA的提取 土壤微生物群落與土壤微環境及營養水平密切相關,本研究發現,Cd3.5處理對根際土壤理化性質幾乎無影響,因此僅選取Cd60.0和Cd240.0處理根際土壤,作為水稻根際土壤微生物的研究材料,并以Cd0處理為對照。土壤微生物總DNA采用FastDNA SPIN Kit for Soil(MP,Biomedicals,USA)試劑盒提取。稱取于-80 ℃保存的新鮮土壤樣品0.5 g,按試劑盒的試驗步驟提取土壤微生物總DNA。DNA溶液的濃度和純度采用NanoDrop 2000(Thermo,USA)進行測定,提取好的DNA樣品稀釋10倍后保存于 -20 ℃[16]。
1.3.3 實時熒光定量PCR分析 采用基于SYBR Green染料法的實時熒光定量PCR技術測定土壤細菌16S rRNA基因豐度來表征細菌群落豐度。測定儀器為Biorad CFX96 Real-time PCR system(Biorad,USA),SYBR Green試劑選用2×SYBR Premix Ex Taq(TaKaRa,Japan),細菌16S rRNA基因擴增引物為515F(5′-GTGCCAGCMGCCGCGGTAA-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)。反應體系為20.0 μL,包括10.0 μL的2×SYBR Premix Ex Taq、上、下游引物(20 μmol/L)各0.3、1.0 μL樣品DNA模版(9.3~23.9 ng/μL)及8.4 μL滅菌超純水。反應程序如下:94 ℃預變性5 min; 94 ℃變性30 s,52 ℃退火30 s,72 ℃延伸30 s,40個循環,每個循環結束后采集熒光數據;采用溶解曲線分析擴增產物的特異性,分析程序如下:溫度從65 ℃上升到95 ℃,每上升0.5 ℃采集1次熒光數據。以含有細菌16S rRNA基因的重組質粒作為標準DNA模版,根據質粒濃度和阿伏伽德羅常數計算該基因的拷貝數,分別以10倍梯度稀釋各模板,制作標準曲線,其濃度范圍為9.61×102~9.61×108 copies/μL。每個樣品做3個技術重復,擴增效率為99.6%(R2為0.992)。每輪反應設置3個無模板陰性對照。
1.3.4 高通量測序分析 16S rRNA基因擴增與Illumina Hiseq高通量測序分析:16S rRNA基因擴增的引物采用515F/907R(V4~V5區)。高通量測序委托廣東美格基因有限公司執行,測序平臺為Illumina Hiseq 2500。測序數據處理:采用FLASH(v1.2.7,https://ccb.jhu.edu/software/FLASH/)軟件對每對PE reads進行拼接,將成對的reads拼成1條序列,最小的overlap(重疊)長度設置為10 bp,拼接序列的overlap區允許的最大錯配比率為0.1,過濾不符合的Tags(標簽),獲得原始的拼接序列。利用Mothur軟件對拼接后的序列進行質量控制及過濾,最終得到有效的拼接片段。利用USEARCH軟件(v8.0.1517,http://www.drive5.com/usearch/)對所有樣品的全部Clean Tags進行聚類,將相似度≥97%的序列歸為同一類操作單元(OTUs),利用Qiime(http://qiime.org/)從每個OTU所屬的序列中,選取OTU序列中排在第1位的序列作為OTU的代表序列,為避免測序深度不同導致的誤差,每個樣本隨機抽取17 998條序列參與統計分析,將代表序列與GreenGene數據庫進行對比完成對各OTU的注釋,得到每個OTU的分類學信息[17]。根據樣品中包含的物種信息,在門(Phylum)水平上將相對豐度<1%細菌類群以及無法分類的細菌類群合并在Others。
1.4 數據處理與統計分析
本研究采用SPSS 16.0(IBM,USA)對試驗數據進行統計分析,采用單因素方差分析法來比較不同Cd濃度脅迫處理間的差異性(P<0.05)。
2 結果與分析
2.1 Cd脅迫對土壤理化性質及水稻農藝性狀的影響
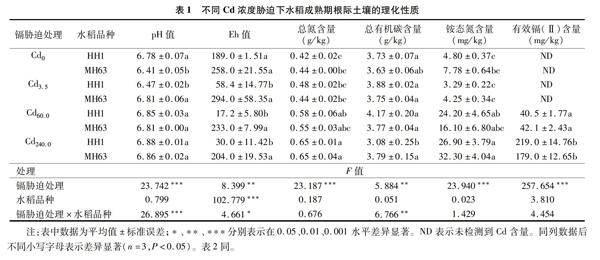
由表1可知,不同Cd濃度脅迫下HH1水稻根際土壤理化性質存在顯著不同。與Cd0處理相比,Cd3.5處理水稻根際土壤pH值、氧化還原電位(Eh)值顯著降低,Cd60.0處理Eh值顯著降低而總氮與銨態氮含量顯著升高,Cd240.0處理Eh值與總有機碳含量顯著降低而總氮與銨態氮含量顯著增加;與Cd3.5處理相比,Cd60.0與Cd240.0處理的pH值、銨態氮含量顯著增加,Cd240.0處理的總氮含量顯著增加,總有機碳含量顯著降低;與Cd60.0處理相比,Cd240.0處理下總有機碳含量顯著降低而有效鎘含量顯著增加。
不同Cd濃度脅迫下MH63水稻根際土壤理化性質也顯著不同。與Cd0處理相比,Cd3.5、Cd60.0處理水稻根際土壤的pH值顯著升高,Cd240.0處理水稻根際土壤的pH值、總氮含量、銨態氮含量均顯著升高;與Cd3.5處理相比,Cd240.0處理的總氮與銨態氮含量顯著增加;與Cd60.0處理相比,Cd240.0處理下有效鎘含量顯著升高。在Cd0處理下,HH1根際土壤pH值顯著高于MH63;在Cd3.5處理下,HH1根際土壤pH值、Eh值顯著低于MH63;在Cd60.0處理下,HH1的Eh值顯著低于MH63;在Cd240.0處理下,HH1的Eh值顯著低于MH63,總有機碳含量顯著低于MH63。雙因素方差分析顯示,水稻根際土壤Eh值顯著受Cd濃度脅迫及水稻品種的獨立影響及交互影響,而土壤pH值、總有機碳含量顯著受Cd濃度脅迫的獨立影響及Cd濃度與水稻品種的交互影響,水稻根際土壤總氮、銨態氮、有效鎘含量僅受Cd濃度脅迫影響。可見,Cd濃度增加了水稻根際土壤總氮、銨態氮、有效Cd含量而種植轉基因水稻降低了水稻根際土壤Eh值。
由表2可知,不同Cd濃度脅迫下HH1水稻成熟期農藝性狀顯著不同。與Cd0、Cd3.5處理相比,Cd60.0處理生物量顯著降低,Cd240.0處理株高、生物量、產量顯著降低;與Cd60.0處理相比,Cd240.0處理的株高與產量均顯著降低。不同Cd濃度脅迫下MH63水稻的農藝性狀也顯著不同。與Cd0處理相比,Cd3.5處理農藝性狀無顯著差異,Cd240.0處理下水稻株高、產量均顯著降低;與Cd3.5相比,Cd60.0處理株高與產量顯著降低;與Cd60.0處理相比,Cd240.0處理下水稻株高、產量均顯著降低。雙因素方差分析顯示,水稻株高、生物量顯著受Cd濃度脅迫及水稻品種的獨立影響及兩者的交互影響,水稻產量顯著受Cd脅迫獨立影響及Cd脅迫與水稻品種的交互影響。可見,水稻農藝性狀顯著受Cd脅迫抑制。
重金屬處理的成熟期水稻各器官中Cd顯著富集,無重金屬處理的各器官中未檢測到Cd。2個品種水稻根部Cd含量均隨Cd脅迫濃度增加而顯著上升。單因素方差分析結果顯示,在Cd3.5、Cd60、Cd240處理下,水稻根中的Cd含量在同一濃度的不同品種間無顯著差異,而同一品種的不同濃度處理間具有顯著差異;在Cd240處理下,HH1、MH63莖中的Cd含量具有顯著差異;在Cd60、Cd240處理下,水稻葉和谷粒中的Cd含量在同一濃度的不同品種間無顯著差異,而不同濃度的同一品種間具有顯著差異。雙因素方差分析顯示,水稻根、葉、谷粒Cd含量顯著受Cd濃度影響。可見,水稻根部比莖、葉、谷粒更易富集Cd。
2.2 Cd脅迫下轉基因水稻對根際土壤細菌群落豐度及Alpha多樣性的影響
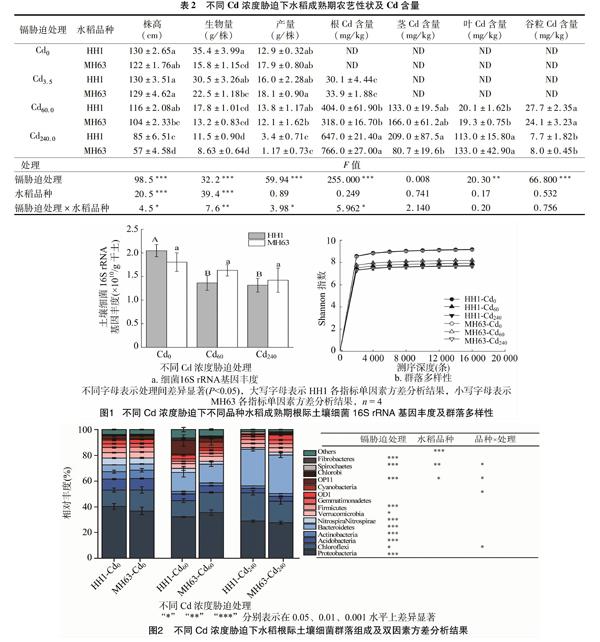
由圖1可知,土壤細菌16S rRNA基因數量可以反映土壤細菌群落豐度。隨著Cd濃度的增加,HH1和MH63水稻根際土壤細菌群落豐度呈下降趨勢。單因素方差分析顯示,部分Cd濃度脅迫下HH1水稻根際土壤細菌16S rRNA基因豐度顯著不同,與Cd0處理相比,Cd60.0與Cd240.0處理根際土壤細菌群落豐度顯著降低。MH63水稻根際土壤細菌群落豐度間無顯著差異。雙因素方差分析結果顯示,根際土壤細菌16S rRNA基因豐度僅受Cd濃度脅迫顯著影響和親本水稻根際土壤細菌群落多樣性。
土壤16S rRNA基因在分類水平上的相對豐度能反映土壤中的細菌群落結構和組成(圖2)。本研究中的3個處理共獲取16個相對豐度高于1%的門水平上的細菌類群。各處理中,Proteobacteria(變形菌門)、Chloroflexi(綠彎菌門)、Acidobacteria(酸桿菌門)、Actinobacteria(放線菌門)Bacteroidetes(擬桿菌門)共5個優勢細菌群落,占總細菌群落的70%以上。其中,Proteobacteria的相對豐度最高,占總細菌群落的28.72%~46.63%;Chloroflexi其次,占9.57%~24.72%。
單因素方差分析顯示,HH1水稻根際土壤細菌群落組成顯著不同,與Cd0處理相比,Cd60.0處理中Proteobacteria(變形菌門)、Acidobacteria、Actinobacteria、Firmicutes(厚壁菌門)的相對豐度顯著降低,Bacteroidetes、Fibrobacteres(纖維桿菌門)的相對豐度顯著升高;Cd240.0處理中Proteobacteria、Acidobacteria、Actinobacteria、Fibrobacteres、Nitrospirae(硝化螺旋菌門)的相對豐度顯著降低而Chloroflexi、Spirochaetes(螺旋體門)的相對豐度顯著升高;與Cd60.0處理相比,Cd240.0處理中Chloroflexi、Bacteroidetes的相對豐度顯著升高而OP11、Spirochaetes、Fibrobacteres的相對豐度顯著降低。單因素方差分析顯示,MH63水稻根際土壤細菌群落組成也顯著不同,與Cd0處理相比,Cd60.0處理中Acidobacteria、Firmicutes、Actinobacteria的相對豐度顯著升高而Fibrobacteres、Bacteroidetes、OP11的相對豐度顯著降低,Cd240.0處理中Proteobacteria、Acidobacteria、OP11、Nitrospirae、Actinobacteria、Fibrobacteres的相對豐度顯著升高而Bacteroidetes、Spirochaetes的相對豐度顯著降低;與Cd60.0處理相比,Cd240處理的Bacteroidetes、OD1的相對豐度顯著升高而Fibrobacteres、OP11的相對豐度顯著降低。雙因素方差分析顯示,水稻根際土壤中Acidobacteria、Actinobacteria、Chloroflexi等11個細菌門的相對豐度受Cd濃度脅迫影響,水稻根際土壤中Other、OP11、Spirochaetes的相對豐度受水稻品種影響,Chloroflexi、OD1、OP11、Spirochaetes的相對豐度受水稻品種和Cd濃度的影響。可見,Cd濃度脅迫和水稻品種能顯著影響水稻根際土壤細菌群落組成。
2.3 Cd脅迫對轉基因水稻根際土壤細菌群落結構及其與環境因子的影響
基于細菌OTU相對豐度的CCA分析結果顯示,各處理細菌群落結構發生顯著變化(圖3)。在各Cd濃度脅迫處理下,HH1和MH63根際土壤細菌群落分布明顯不同,ANOSIM相似度分析表明,各Cd濃度脅迫下根際土壤細菌群落結構存在顯著差異。但在相同Cd濃度脅迫處理下,HH1和MH63水稻根際土壤細菌群落結構無顯著差異。土壤環境因子分析顯示,根際土壤pH值、總氮含量、銨態氮含量、總有機碳含量和Eh值影響了根際土壤細菌群落結構(圖3),其中pH值、總氮含量和銨態氮含量顯著改變了水稻根際土壤細菌群落結構。
3 結論與討論
3.1 Cd脅迫對水稻生長及土壤微生物的影響
本研究結果顯示,Cd脅迫能對水稻生長及土壤微生物產生顯著影響。Cd60、Cd240與Cd0處理相比,MH63品種水稻的株高、生物量、產量隨著Cd濃度的增加而降低。余飛宇通過對水稻添加60、180 mg/kg 2個Cd濃度脅迫,以不添加Cd脅迫為對照,結果顯示,低濃度Cd脅迫下產量比對照增加了6.71%,高濃度條件下,產量比對照下降了9.52%,具有顯著差異[18]。王錦文等的研究顯示,Cd脅迫顯著抑制水稻幼苗芽和根的生長,對根的生長影響最為顯著[19]。而龍思斯等的研究結果顯示,3種不同污染源中,Cd含量對水稻株高以及稻谷的質量無顯著影響[20]。與本研究結果不一致,這可能與水稻品種、土壤理化性質及水稻生長條件有關。已有研究顯示,Cd在低濃度時對植物有積極的“刺激作用”,在高濃度時則抑制植物生長[21-22]。有研究者表示,在重金屬作用下,一方面植物應激產生保護作用,通過加速生理生化活動產生大量代謝物與重金屬締合以解毒;另一方面,激活的代謝系統也加速了重金屬的進入,進而抑制植物的代謝活動,對植物產生毒害作用[23]。
本研究結果顯示,隨著Cd濃度的增加,土壤細菌16S rRNA基因豐度沒有顯著變化,而不同Cd脅迫下MH63水稻根際土壤細菌Shannon指數顯著不同,與Cd0處理相比,Cd60.0與Cd240.0處理的Shannon指數顯著降低,與Cd60.0處理相比,Cd240.0處理的Shannon指數顯著降低,表明Cd濃度對土壤細菌群落多樣性有顯著影響。ANOSIM相似度分析表明,各Cd脅迫下根際土壤細菌群落結構存在顯著差異。研究發現,高濃度的Cd可減少土壤細菌、真菌和放線菌數量,Cd對土壤微生物三大菌的抑制效果是細菌>放線菌>真菌。王秀麗等研究發現,Cd對土壤微生物的毒害作用導致土壤微生物數量和種群減少,說明Cd的加入導致土壤微生物群落結構發生顯著變化[24]。本研究發現,Cd濃度是影響水稻株高、生物量、產量及根際土壤微生物群落組成、結構的主要因素,同時土壤pH值、總氮含量、銨態氮含量顯著影響了水稻根際土壤細菌群落結構。
3.2 轉基因作物對根際土壤微生物的影響
本研究發現,與親本水稻MH63相比,HH1水稻的根際土壤細菌群落豐度、多樣性、群落組成與結構均沒有顯著變化。而Dunfield等研究了在加拿大的4個不同田塊連續2年種植4種轉抗除草劑基因的油菜和4種常規油菜品種對根際微生物多樣性的影響,通過分析表明,轉基因油菜品種的根內和根際細菌群落與常規品種有差異[25]。Heuer等研究了轉T4溶菌酶馬鈴薯,指出T4溶菌酶表達的馬鈴薯與對照相比沒有發現根際群落有偏差[26]。劉明等在溫室試驗中發現,轉CryIAb基因玉米(NK4640Bt)和非轉基因玉米根際土壤中或添加玉米組織的土壤可培養細菌、放線菌和真菌數量沒有顯著差異[27-28]。此后,研究者通過SSCP(單鏈構象多態性)、CLPP(微生物群落生理代謝指紋)、PLFA(磷脂脂肪酸圖譜)技術均證實,轉Cry1Ab基因玉米系并未引起土壤微生物群落多樣性的顯著變化。Lin等研究發現,轉抗黃瓜花葉病毒的番茄和野生型番茄對土壤微生物數量的影響沒有顯著差異,而且取樣位置比轉基因番茄的影響更大[29]。還有研究者發現,影響因素可能是季節、天氣、土壤類型、地理位置等環境因子[30]。環境因子也是根際微生物群落變化的重要驅動力。本研究發現,外源基因的轉入不會影響水稻根際土壤細菌群落豐度、多樣性及群落組成與結構。同時Cd脅迫能顯著影響轉基因水稻的基因豐度、多樣性及群落組成與結構。同時,根際土壤pH值、總氮含量、銨態氮含量顯著影響了轉基因水稻根際土壤細菌群落結構。另外,研究者還發現植物根際土壤微生物的變化是復雜且長期的過程,因此評估轉基因作物對根際土壤微生物的影響時,應該同時監測轉基因作物、親本非轉基因作物的長期效應[31]。
綜上所述,本研究采用分子生態學技術研究Cd脅迫下轉基因水稻對根際土壤微生物的影響,發現Cd脅迫對轉基因水稻和親本水稻農藝性狀及根部Cd吸收富集有顯著影響,Cd60.0與Cd240.0脅迫能顯著降低轉基因水稻根際土壤群落豐度和多樣性,同時對土壤細菌群落組成及結構產生顯著影響,該結果可為轉基因水稻環境安全評價提供試驗數據。
參考文獻:
[1]Borah P,Singh P,Rangan L,et al. Mobility,bioavailability and ecological risk assessment of cadmium and chromium in soils contaminated by paper mill wastes[J]. Groundwater for Sustainable Development,2018,6:189-199.
[2]吳玉峰. 廣西典型高背景鎘地區的生態風險評價[D]. 南寧:廣西師范學院,2016.
[3]Applications A B. Global status of commercialized biotech/GM crops[EB/OL]. [2018-01-10]. http://www.isaaa.org/kc,2004.
[4]劉志誠,葉恭銀,胡 萃. 抗蟲轉基因水稻和化學殺蟲劑對稻田節肢動物群落的影響[J]. 應用生態學報,2004,15(12):2309-2314.
[5]Hu T Z,Zhu S S,Tan L L,et al. Overexpression of OsLEA4 enhances drought,high salt and heavy metal stress tolerance in transgenic rice (Oryza sativa L.)[J]. Environmental and Experimental Botany,2016,123:68-77.
[6]Zhao F Y,Wen L,Zhang S Y. Different responses of plant growth and antioxidant system to the combination of cadmium and heat stress in transgenic and non-transgenic rice[J]. Journal of Integrative Plant Biology,2009,51(10):942-950.
[7]Li C H,Zhu J G,Zeng Q,et al. Different responses of transgenic Bt rice and conventional rice to elevated ozone concentration[J]. Environmental Science and Pollution Research,2017,24(9):8352-8362.
[8]Liang Y,Liu F,Li J,et al. Coexistence of Bacillus thuringiensis (Bt)-transgenic and conventional rice affects insect abundance and plant fitness in fields[J]. Pest Management Science,2018,74(7):1646-1653.
[9]陳欣瑤,楊惠子,陳楸健,等. 重金屬脅迫下不同區域土壤的生態功能穩定性與其微生物群落結構的相關性[J]. 環境化學,2017,36(2):356-364.
[10]Liu B,Zeng Q,Yan F M,et al. Effects of transgenic plants on soil microorganisms[J]. Plant and Soil,2005,271(1/2):1-13.
[11]Liu W,Lu H H,Wu W X,et al. Transgenic Bt rice does not affect enzyme activities and microbial composition in the rhizosphere during crop development[J]. Soil Biology and Biochemistry,2008,40(2):475-486.
[12]陳 敏,應文荷. 轉Bt水稻與常規水稻根際土壤細菌類群的比較研究[J]. 杭州師范學院學報(自然科學版),2005,4(4):290-292.
[13]Wang Z J,Deng H,Chen L H,et al. In situ measurements of dissolved oxygen,pH and redox potential of biocathode microenvironments using microelectrodes[J]. Bioresource Technology,2013,132:387-390.
[14]陳 希. 茶園根際土壤與植物體養分對酸沉降的響應[D]. 南昌:南昌大學,2015.
[15]鮑士旦. 土壤農化分析[M]. 3版.北京:中國農業出版社,2000:232-248.
[16]薛銀剛,江曉棟,孫 萌,等. 基于高通量測序的冬季太湖竺山灣浮游細菌和沉積物細菌群落結構和多樣性研究[J]. 生態與農村環境學報,2017,33(11):992-1000.
[17]許艷蕊,方志軍,盧曉平,等. 基于高通量測序技術分析使它隆對玉米土壤細菌多樣性的影響[J]. 微生物學報,2017,57(7):985-993.
[18]余飛宇. 水稻幼苗對鎘脅迫的反應及其與全生育期鎘積累特性的關系[D]. 揚州:揚州大學,2008.
[19]王錦文,邊才苗,陳 珍. 鉛、鎘脅迫對水稻種子萌發、幼苗生長及生理指標的影響[J]. 江蘇農業科學,2009(4):77-79.
[20]龍思斯,宋正國,雷 鳴,等. 不同外源鎘對水稻生長和富集鎘的影響研究[J]. 農業環境科學學報,2016,35(3):419-424.
[21]宋 建,金鳳媚,薛 俊,等. 鎘脅迫對植物生長及生理生態效應的研究進展[J]. 天津農業科學,2014,20(12):19-22.
[22]劉小文,齊成媚,歐陽燦斌,等. Pb、Cd及其復合污染對紫莖澤蘭生長及吸收富集特征的影響[J]. 生態環境學報,2014,23(5):876-883.
[23]朱艷霞,魏幼璋,葉正錢,等. 有機酸在超積累植物重金屬解毒機制中的作用[J]. 西北農林科技大學學報(自然科學版),2006,34(7):121-126.
[24]王秀麗,徐建民,姚槐應,等. 重金屬銅、鋅、鎘、鉛復合污染對土壤環境微生物群落的影響[J]. 環境科學學報,2003,23(1):22-27.
[25]Dunfield K E,Germida J J. Diversity of bacterial communities in the rhizosphere and root interior of field-grown genetically modified Brassica napus[J]. FEMS Microbiology Ecology,2001,38(1):1-9.
[26]Heuer H,Kroppenstedt R M,Lottmann J,et al. Effects of T4 lysozyme release from transgenic potato roots on bacterial rhizosphere relative to communities are negligible natural factors[J]. Applied and Environmental Microbiology,2002,68(3):1325-1335.
[27]劉 明,聶 菁,劉紫君,等. 轉基因抗病玉米對土壤可培養細菌的影響[J]. 山西農業科學,2016,44(3):353-356.
[28]Griffiths B S,Caul S,Thompson J,et al. Soil microbial and faunal community responses to Bt maize and insecticide in two soils[J]. Journal of Environmental Quality,2006,35(3):734-741.
[29]Lin C H,Pan T M. PCR-denaturing gradient gel electrophoresis analysis to assess the effects of a genetically modified cucumber mosaic virus-resistant tomato plant on soil microbial communities[J]. Applied and Environmental Microbiology,2010,76(10):3370-3373.
[30]Marschner P,Crowley D,Yang C H. Development of specific rhizosphere bacterial communities in relation to plant species,nutrition and soil type[J]. Plant and Soil,2004,261(1/2):199-208.
[31]李孝剛,劉 標,徐文華,等. 轉Bt基因抗蟲棉對土壤微生物群落生物多樣性的影響[J]. 生態與農村環境學報,2011,27(1):17-22.

