莫海威芽孢桿菌產(chǎn)殼聚糖酶的分離純化及酶學性質(zhì)分析
劉進杰 呂娟娟 陳國忠

摘要:純化從煙臺海域沙質(zhì)土壤分離得到的莫海威芽孢桿菌菌株amyP216來源殼聚糖酶,并對其進行酶學性質(zhì)分析。以發(fā)酵液為原料,依次進行超聲波破碎菌體、20%~70%硫酸銨分級鹽析、纖維素DE-32陰離子交換層析、葡聚糖凝膠G-75過濾層析,得到殼聚糖酶。采用SDS-PAGE凝膠電泳測定分子量為30 ku,全波段掃描結(jié)果顯示在 324 nm 處出現(xiàn)最高峰。然后對殼聚糖酶的酶學性質(zhì)進行研究。結(jié)果表明,最適反應溫度為55 ℃,且在一定范圍內(nèi)溫度越低,其熱穩(wěn)定性越高;最適反應pH值為5.5,中性條件下酶活性最穩(wěn)定;在金屬離子中Mn2+對其激活作用最明顯,其他金屬離子對其有抑制作用;該酶具有相對較好的底物特異性。
關(guān)鍵詞:殼聚糖酶;莫海威芽孢桿菌;分離純化;酶學性質(zhì);底物特異性
中圖分類號: S188+.3 ?文獻標志碼: A ?文章編號:1002-1302(2019)14-0231-05
殼寡糖在食品、醫(yī)藥、農(nóng)業(yè)等行業(yè)都有著很高的應用價值,具有抗疲勞、調(diào)節(jié)免疫力和抗腫瘤的功效[1-4],可有效抑制肝損傷[5-6],還具有降血脂、降血糖的功能[6-9]。殼寡糖還可用于調(diào)節(jié)植物生長、延長果蔬保鮮等[10-13]。殼寡糖是由殼聚糖酶專一性地降解殼聚糖后生成的,因此尋求具備高效降解能力的殼聚糖酶,具有較高的工業(yè)應用價值。
殼聚糖酶是一類可催化氨基葡萄糖間的β-1,4-糖苷鍵斷裂的酶[14],其來源廣泛,廣泛存在于一些真菌、細菌、放線菌中,甚至在植物病原菌、病毒中也有存在[15-19]。由于殼聚糖酶來源不同,酶學性質(zhì)也就不同,酶解產(chǎn)物殼寡糖的聚合度也會有所不同[20]。因此,對不同微生物來源的殼聚糖酶進行分離純化,研究其酶學性質(zhì),已經(jīng)成為國內(nèi)外的研究熱點。
前期工作中,筆者在煙臺海域沙質(zhì)土壤中分離到1株殼聚糖酶產(chǎn)生菌株——莫海威芽孢桿菌(Bacillus mojavensis)amyP216,并對其發(fā)酵產(chǎn)生殼聚糖酶的條件進行了優(yōu)化[21]。在本研究中,對發(fā)酵液中的殼聚糖酶進行分離純化,探討其酶學性質(zhì),為該殼聚糖酶的更深入研究奠定理論基礎(chǔ),也為該酶的工業(yè)應用提供依據(jù)。
1 材料與方法
1.1 試驗材料與設(shè)備
1.1.1 菌株 莫海威芽孢桿菌(Bacillus mojavensis)菌株amyP216,由筆者所在實驗室從煙臺海岸帶沙質(zhì)土壤分離篩選獲得。
1.1.2 試劑 磷酸二氫鈉、磷酸氫二鈉、醋酸、乙酸鈉、3,5-二硝基水楊酸、氫氧化鈉、四水酒石酸鉀鈉、苯酚、無水亞硫酸鈉,均為國產(chǎn)分析純;葡聚糖凝膠G-75(Pharmacia)、纖維素DE-32,購自江蘇南京奧朵福尼生物科技有限公司;殼聚糖,購自山東濟南海得貝生物工程有限公司;標準蛋白marker,由中國科學院上海生物化學研究所監(jiān)制。
1.1.3 儀器設(shè)備 Ф3.5 cm×70 cm層析柱,購自上海華美實驗儀器廠;HL-2恒流泵,購自上海滬西儀器廠有限公司;SBS-100數(shù)控記滴自動部分收集器,購自上海青浦滬西儀器廠;Z-323-K高速冷凍離心機、TDL-60B低速臺式離心機,購自上海安亭科學儀器廠;WFJ7200可見光分光光度計,購自尤尼科(上海)儀器有限公司;MD34透析袋(美國Viskase);BS224S電子分析天平,購自北京賽多利斯儀器有限公司;KDS超聲波細胞粉碎機,購自浙江寧波新芝科技有限公司;HH-6水浴鍋,購自江蘇省金壇市雙捷實驗儀器廠。
1.2 菌株培養(yǎng)
1.2.1 培養(yǎng)基 LB斜面培養(yǎng)基:酵母浸粉5 g/L、蛋白胨 10 g/L、NaCl 2.5 g/L、瓊脂20 g/L,pH值7.0。
液體種子培養(yǎng)基:膠體殼聚糖10 g/L、酵母浸粉5 g/L、MgSO4 0.5 g/L、NaCl 2.5 g/L、KH2PO4 2 g/L,pH值6.5。
發(fā)酵培養(yǎng)基:殼聚糖20 g/L、酵母浸粉10 g/L、MgSO4 0.5 g/L、NaCl 2.5 g/L、KH2PO4 2 g/L、CaCl2 0.1 g/L,pH值6.5[21]。
1.2.2 培養(yǎng)方法 菌種活化:取甘油管保藏菌種劃線至LB斜面培養(yǎng)基,30 ℃培養(yǎng)24 h。
種子液:挑取單菌落接種至液體種子培養(yǎng)基,30 ℃、200 r/min 培養(yǎng)24 h。
搖瓶發(fā)酵:500 mL三角瓶裝50 mL發(fā)酵培養(yǎng)基,按5%接種量將種子液接入發(fā)酵培養(yǎng)基,30 ℃、220 r/min培養(yǎng)60 h。
發(fā)酵罐培養(yǎng):按5%接種量將種子液接入裝有3 L發(fā)酵培養(yǎng)基的5 L自控發(fā)酵罐中,轉(zhuǎn)速600 r/min,通氣量 2 L/(L·min),溫度30 ℃[21]。
1.3 殼聚糖酶的分離純化
取發(fā)酵罐培養(yǎng)的發(fā)酵液,4 ℃、8 000 r/min離心15 min后,收集菌體。超聲波破碎20 min后,4 ℃、6 000 r/min離心10 min,取上清液,加入硫酸銨至飽和度20%,4 ℃過夜,10 000 r/min 低溫離心30 min,取上清液,繼續(xù)加入硫酸銨固體至飽和度70%,4 ℃過夜,10 000 r/min低溫離心30 min,收集沉淀。將沉淀溶解于0.02 mol/L磷酸鹽緩沖液(pH值8,含1 mol/L NaCl)中,透析濃縮后得粗酶液[16,22]。
取粗酶液3 mL進行纖維素DE-32柱層析,并用 0.02 mol/L 磷酸鹽緩沖液(pH值8,含1 mol/L NaCl)進行洗脫,合并有酶活的部分并濃縮。然后采用葡聚糖凝膠G-75柱層析,并用0.02 mol/L磷酸鹽緩沖液(pH值8,含1 mol/L NaCl)作為洗脫液進行洗脫,合并有酶活的部分并進行濃縮[22-24]。
濃縮后的樣品采用SDS-PAGE凝膠電泳的方法進行酶蛋白的純度分析以及相對分子質(zhì)量的測定,分離膠的質(zhì)量分數(shù)為15%,濃縮膠質(zhì)量分數(shù)為5%[25]。
1.4 殼聚糖酶的酶學性質(zhì)研究
1.4.1 溫度及最適溫度的測定 將酶液與殼聚糖底物分別放于35、45、55、65、75、85 ℃水浴中反應15 min,以確定酶的最適反應溫度。將酶液在上述溫度中保溫120 min,以探討熱穩(wěn)定性。
1.4.2 pH值及最適pH值的測定 將酶液與殼聚糖底物放于pH值分別為4、5、6、7、8、9的磷酸緩沖液中反應30 min,測定酶活,以確定最適反應pH值。將酶液放于上述的緩沖液中,保溫2 h,測定酶活性,以探討pH值穩(wěn)定性。
1.4.3 金屬離子對酶活性的影響 等量酶液與底物混合,加入不同金屬離子,使離子濃度達到0.5 mmol/L。不同金屬離子分別為Mn2+(MnSO4)、Mg2+(MgSO4)、Ca2+(CaCL2)、Cu2+(CuSO4)、Fe3+[Fe2(SO4)3]、Ba2+(BaSO4)、Li+(Li2SO4)、Zn2+(ZnSO4),以不加金屬離子為對照,計算相對酶活性并作圖,以探討金屬離子對酶活性的影響。
1.4.4 底物特異性 分別取1%殼聚糖醋酸溶液、膠體殼聚糖、羧甲基殼聚糖、膠體甲殼素、羧甲基纖維素鈉作為底物反應,保溫15 min,以殼聚糖為底物作為對照,計算相對酶活性并作圖,以探討殼聚糖酶對底物的專一性。
1.5 檢測方法
1.5.1 殼聚糖酶活性測定 采用3,5-二硝基水楊酸(DNS)測定還原糖的方法測定殼聚糖酶的活性[16,24]。以氨基葡萄糖為標準繪制標準曲線,其回歸方程為y=0.083 93x+0.033 7。式中:y為吸光度D值;x為濃度,μmol/mL;r2=0.996 77。酶活性單位定義為1 mL發(fā)酵液 1 min 下釋放生成的微摩爾還原糖。
1.5.2 蛋白質(zhì)濃度測定 蛋白質(zhì)濃度采用Bradford法[25],以牛血清白蛋白(BSA)為標準繪制標準曲線,牛血清蛋白標準曲線的回歸方程為y=1.593 43x-0.042 12。式中:y為D值;x為濃度,μmol/mL;r2=0.999 26。
1.6 數(shù)據(jù)處理與分析
利用SPSS 19.0進行數(shù)據(jù)處理和誤差分析,用Origin 8繪圖軟件繪制圖形。每組試驗做3個平行試驗,以3組數(shù)據(jù)進行誤差分析以得到準確的試驗結(jié)論。
2 結(jié)果與分析
2.1 殼聚糖酶的分離純化
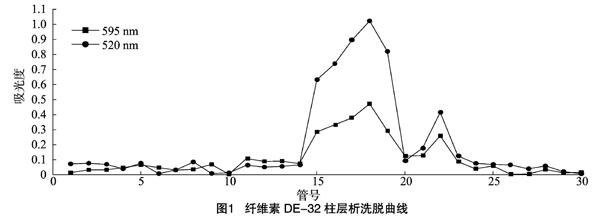
將破壁、鹽析、透析后殼聚糖酶粗酶液上樣于磷酸鹽緩沖液平衡好的DEAE層析柱,隨后用0.02 mol/L磷酸鹽緩沖液(pH值8,含1 mol/L NaCl)進行洗脫,洗脫結(jié)果如圖1所示。試驗共收集30管樣品,每管2.5 mL。在第18管處出現(xiàn)第1個酶活性和蛋白質(zhì)濃度最高峰,且酶活性峰值與蛋白濃度峰值基本重合;在第22管處出現(xiàn)第2個酶活性和蛋白質(zhì)濃度高峰,但其酶活性和蛋白質(zhì)含量明顯低于第1個峰。可見,殼聚糖酶的酶活性主要集中在第1個蛋白峰處。
把經(jīng)纖維素DE-32洗脫得到的第1個蛋白峰處的樣品收集、濃縮,上樣到葡聚糖凝膠G-75層析柱進一步分離純化,洗脫圖譜如圖2所示。試驗中共收集17管樣品,每管 4 mL,酶活性檢測發(fā)現(xiàn)第6管和第11管處的蛋白樣有明顯的殼聚糖酶活性,第6管酶活性較高。蛋白峰出現(xiàn)在第5管和第10管處,第5管處蛋白濃度略高。
由表1可知,經(jīng)過鹽析、纖維素DE-32交換層析和葡聚糖凝膠G-75層析等一系列純化后,殼聚糖酶比活力達到 8.01 mol/(min·mg),回收率為4.4%。
對葡聚糖凝膠G-75層析中第6管處樣品進行SDS-PAGE電泳檢測其分析純度和相對分子質(zhì)量,結(jié)果如圖3所示。樣品為單一條帶,說明所分離的殼聚糖酶純度較高,與標準蛋白marker比對,可以得出分子量約為30 ku,這與Shimosaka等(31.9 ku)[19]、孫菲等(30 ku)[23]、段妍等(30.5 ku)[24]所純化的殼聚糖酶相對分子質(zhì)量大致相當;但是與Gao等(41 ku)[26]、Muslim等(45 ku)[18]、韓寶芹等(66.2 ku)[27]、Wang等(21、18 ku)[28]、Shehata等(130 ku)[29]純化相差較大。可見,不同來源的殼聚糖酶的相對分子質(zhì)量有明顯的差異。
由圖4可知,殼聚糖酶在324 nm處有最大吸光度,數(shù)值為0.265,具有一般酶蛋白的紫外吸收特征。
2.2 殼聚糖酶酶學性質(zhì)研究
2.2.1 溫度及溫度穩(wěn)定性測定 由圖5可知,曲線呈現(xiàn)先上升后下降的趨勢,最高點出現(xiàn)在55 ℃處。55~65 ℃,曲線呈直線下降,當超過65 ℃時,酶活性降至很低,可能是因為溫度過高使殼聚糖酶變性失去活性。可見,殼聚糖酶反應的最適溫度在55 ℃,這與楊立紅等所純化的殼聚糖酶的最適溫度[16,22,30]相同,但是與Gao等(60 ℃)[26]、Wang等(50 ℃)[28]、Shehata等(40 ℃)[29]所純化的殼聚糖酶的最適溫度不同。
由圖6可見,在一定范圍內(nèi),溫度越低,對酶的穩(wěn)定性越好。所有曲線都呈現(xiàn)下降趨勢。在保溫60 min后50、60 ℃ 保溫條件下,酶活性均消失,在60 ℃下殼聚糖酶更快失去酶活;保溫90 min后,30、40 ℃也失去了酶活,40 ℃保溫條件下,相對酶活性下降得更快,即殼聚糖酶更容易失去酶活性。
2.2.2 pH值及pH值穩(wěn)定性測定 pH值對殼聚糖酶活性的影響如圖7所示,曲線呈先上升后下降的趨勢。在pH值5.5之前,酶活性隨pH值的升高而上升,當pH值達到6以后,酶活性急劇下降,在pH值5.5處出現(xiàn)最高峰,可見殼聚糖酶反應的最適pH值為5.5,這與Shehata等(40 ℃)[29]、隋斯光等[31]研究的殼聚糖酶的最適pH值相同。當pH值為 6.0 時,本試驗所純化得到的殼聚糖酶的活性大大降低,但是Gao等純化的殼聚糖酶的最適pH值卻是6.0[26,32]。這表明不同來源的殼聚糖酶的最適pH值差距較大,莫海威芽孢桿菌amyP216來源的殼聚糖酶的最適pH偏酸性。
pH值對酶活穩(wěn)定性的影響如圖8所示。時間越長,相對酶活性越小,在pH值為7即中性環(huán)境下,相對酶活性降低較慢,說明保溫時間對酶活性的影響最小;pH值6環(huán)境下,酶活性降低程度次之;pH值4和5對酶活性的穩(wěn)定性影響較大,pH值為4時相對酶活性下降最快,對酶活性穩(wěn)定性影響最大。由此可得,pH值7最適合殼聚糖酶的保存。
2.2.3 金屬離子對酶活性的檢測 金屬離子對殼聚糖酶的影響結(jié)果如圖9所示,本試驗所驗證的金屬離子中,正1價金屬離子Li+對酶活性有明顯的抑制作用,在濃度達到 0.5 mmol/L 時,其相對酶活性為76.7%。正2價金屬離子中,Mn2+對酶活性有激活作用,在金屬離子濃度為0.5 mmol/L時,其相對酶活性達到263.1%,其原因可能與酶的活性中心有關(guān)。Mg2+、Ca2+、Cu2+、Ba2+、Zn2+等都有一定的抑制作用,其中Ba2+的抑制作用最弱,相對酶活性為90.1%,Cu2+的抑制作用最強,相對酶活性達到39.7%。正3價金屬離子Fe3+對酶活性同樣有嚴重的抑制作用,是以上8種離子中抑制作用最強的,相對酶活性達到34.3%。
在本試驗所研究的金屬離子中,只有Mn2+對酶活性有激活作用,其他金屬對酶活性均有抑制作用。這與其他來源的殼聚糖酶的試驗結(jié)果也有所不同。Wang等研究發(fā)現(xiàn)Mn2+會抑制Serratia marcescens TKU011來源的殼聚糖酶[28],周念波等研究發(fā)現(xiàn)Zn2+、Ca2+對Bacillus sp. LS產(chǎn)的殼聚糖酶有一定的激活作用[22],這進一步表明不同微生物來源的殼聚糖酶的酶學性質(zhì)是有差異的。
2.2.4 底物特異性檢測 如表2所示,殼聚糖酶對殼聚糖的水解能力最強,對羧甲基纖維素鈉、DEAE纖維素和甲殼素也有一定的水解能力,其水解能力依次降低。可見,純化所得的殼聚糖酶底物特異性較好。
3 結(jié)論
殼聚糖酶是理想的制備殼寡糖的酶制劑,本研究以高產(chǎn)殼聚糖酶的莫海威芽孢桿菌(Bacillus mojavensis) amyP216發(fā)酵液為原料,經(jīng)過超聲波破壁處理、硫酸銨分級沉淀、纖維素DE-32陰離子交換柱層析、葡聚糖凝膠過濾層析等方法純化后,得到了電泳純殼聚糖酶,純化倍數(shù)達到25.21倍,相對酶活性為8.01 mol/(min·mg),回收率為4.4%。電泳法測定莫海威芽孢桿菌來源殼聚糖酶相對分子質(zhì)量為30 ku,全波段掃描結(jié)果顯示在324 nm處出現(xiàn)最高峰,峰值為0.265 Abs。
經(jīng)酶學性質(zhì)研究發(fā)現(xiàn),該殼聚糖酶的最適反應溫度為 55 ℃,在試驗范圍內(nèi),溫度越低,酶的穩(wěn)定性越好;最適反應pH值為5.5,在pH值7時酶的穩(wěn)定性較好;在試驗范圍內(nèi),金屬離子Mn2+對其激活作用最明顯,Mg2+、Ca2+、Cu2+、Ba2+、Zn2+等金屬離子對其有抑制作用;該酶具有相對較好的底物特異性。下一步研究將對該酶進行基因工程研究,以提高酶的表達量,為其產(chǎn)業(yè)化奠定基礎(chǔ)。
參考文獻:
[1]尹雨芳,林 強,曹建民,等. 殼寡糖抗運動疲勞及對運動性免疫抑制的影響[J]. 中國實驗方劑學雜志,2016,22(4):146-149.
[2]張 沛,韓寶芹,陳列歡,等. 用酶解法制備殼寡糖及其對機體免疫功能的調(diào)節(jié)作用[J]. 中國免疫學雜志,2013,29(2):191-196.
[3]楊歡歡,周艷芬,武金霞,等. 殼寡糖誘導肺癌細胞A549凋亡及其機制初探[J]. 時珍國醫(yī)國藥,2013,24(2):268-270.
[4]劉晶瑩,劉 洋,譚子強. 殼寡糖對S180肉瘤小鼠抗腫瘤作用的研究[J]. 國外醫(yī)藥(抗生素分冊),2015,36(1):23-24.
[5]許青松,宮德正,鄒 原,等. 兩種殼寡糖對急性肝損傷模型小鼠的保護作用[J]. 醫(yī)藥導報,2008,27(2):153-155.
[6]申 杰,葉希韻,沈 菊,等. 殼寡糖對高脂血癥小鼠降血脂及肝臟保護的作用[J]. 西北農(nóng)林科技大學學報(自然科學版),2007,35(9):35-38,44.
[7]劉 冰,秦貞奎,林祥梅,等. 殼寡糖及其衍生物對糖尿病大鼠血脂代謝紊亂的影響及對肝臟的保護作用[J]. 暨南大學學報(自然科學與醫(yī)學版),2009,30(4):388-394.
[8]王 斌,蘇謙俊,張思聰,等. 殼寡糖和殼聚糖對高脂膳食小鼠的降脂功能比較研究[J]. 天然產(chǎn)物研究與開發(fā),2017,29(6):1025-1029,1047.
[9]趙金山,張 燕,延 巖,等. 殼寡糖降血糖作用的臨床觀察研究[J]. 食品與藥品,2011,13(3):120-122.
[10]徐小菊,林玉平,金 偉,等. 殼寡糖對夏黑葡萄果實膨大和品質(zhì)的影響[J]. 中外葡萄與葡萄酒,2017(2):26-29.
[11]狄文偉. 不同分子量殼寡糖對黃瓜穴盤苗生長的影響[J]. 江蘇農(nóng)業(yè)科學,2016,44(4):196-198.
[12]閆佳琪,張憶楠,趙玉梅,等. 殼寡糖控制果蔬采后病害及誘導抗病性研究進展[J]. 食品科學,2015,36(21):268-272.
[13]鄧麗莉,尹保鳳,曾凱芳. 殼寡糖和殼聚糖處理對“乙烯褪綠蜜橘”果實品質(zhì)和抗病性的影響[J]. 現(xiàn)代食品科技,2017,33(2):167-175.
[14]季更生,陳愛春. 微生物殼聚糖酶的研究進展[J]. 食品科學,2010,31(3):297-301.
[15]史鳳玉,蔡愛軍,田 輝,等. 來自擬青霉屬真菌的殼聚糖酶的分離純化、理化性質(zhì)及降解產(chǎn)物的分析[J]. 菌物學報,2013,32(4):721-728.
[16]楊立紅,程仕偉,馮志彬,等. 鏈霉菌殼聚糖酶的純化及其酶學性質(zhì)[J]. 生物加工過程,2013,11(3):52-58.
[17]劉懷偉,鮑曉明. 腐皮鐮孢菌殼聚糖酶的酶學性質(zhì)研究及其在釀酒酵母工業(yè)菌株中的表達[J]. 微生物學報,2009,49(12):1607-1612.
[18]Muslim S N,Al-Kadmy I M,Hussein N H,et al. Chitosanase purified from bacterial isolate Bacillus licheniformis of ruined vegetables displays broad spectrum biofilm inhibition[J]. Microbial Pathogenesis,2016,100:257-262.
[19]Shimosaka M,Kumehara M,Zhang X Y,et al. Cloning and characterization of a chitosanase gene from the plant pathogenic fungus Fusarium solani[J]. Journal of Fermentation and Bioengineering,1996,82(5):426-431.
[20]Somashekar D,Joseph R. Chitosanases - properties and applications:a review[J]. Bioresource Technology,1996,55(1):35-45.
[21]馮志彬,薛 鈺,陳國忠,等. 1株產(chǎn)殼聚糖酶細菌的分離、鑒定和發(fā)酵條件優(yōu)化[J]. 食品科學,2016,37(19):171-176.
[22]周念波,李軼群,涂紹勇. Bacillus sp.LS 殼聚糖酶的分離純化及性質(zhì)研究[J]. 食品科技,2008,33(2):4-7.
[23]孫 菲,陳山嶺,李宜海,等. 殼聚糖酶高產(chǎn)菌株的篩選、產(chǎn)酶條件的優(yōu)化及殼聚糖酶的分離純化[J]. 現(xiàn)代食品科技,2006,22(3):21-23,20.
[24]段 妍,韓寶芹,董 文,等. 產(chǎn)殼聚糖酶菌株發(fā)酵條件優(yōu)化及殼聚糖酶的分離純化研究[J]. 海洋科學,2009,33(1):1-7.
[25]陳鈞輝,李 俊,張?zhí)剑? 生物化學實驗[M]. 4版.北京:科學出版社,2008.
[26]Gao X A,Ju W T,Jung W J,et al. Purification and characterization of chitosanase from Bacillus cereus D-11[J]. Carbohydrate Polymers,2008,72(3):513-520.
[27]韓寶芹,楊菊林,劉萬順,等. 殼聚糖酶的分離純化及性質(zhì)研究[J]. 中國海洋大學學報(自然科學版),2006(2):255-260.
[28]Wang S L,Peng J H,Liang T W,et al. Purification and characterization of a chitosanase from Serratia marcescens TKU011[J]. Carbohydrate Research,2008,343(8):1316-1323.
[29]Shehata A N,Abd El Aty A A,Darwish D A,et al. Purification,physicochemical and thermodynamic studies of antifungal chitinase with production of bioactive chitosan-oligosaccharide from newly isolated Aspergillus griseoaurantiacus KX010988[J]. International Journal of Biological Macromolecules,2017,107(Part A):990-999.
[30]王艷君,卓少玲,陳 盛,等. 產(chǎn)殼聚糖酶菌株的篩選、鑒定及酶學特性分析[J]. 微生物學通報,2012,39(12):1734-1745.
[31]隋斯光,方文建,鄭連英. 殼聚糖酶的分離提純及其酶學性質(zhì)研究[J]. 高校化學工程學報,2007(5):814-819.
[32]蔡婀娜,黃惠莉,黃雙燕. 海洋煙曲霉菌產(chǎn)殼聚糖酶的酶學性質(zhì)初探[J]. 暨南大學學報(自然科學與醫(yī)學版),2011,32(5):509-512.

