鹽類水解的應用
穆玉鵬
(山東省博興縣第一中學 256500)
一、判斷鹽溶液的酸堿性, 比較鹽溶液pH的大小
1.強酸弱堿鹽溶液顯酸性,強堿弱酸鹽溶液顯堿性.
2.相同物質的量濃度的強酸弱堿鹽溶液(或強堿弱酸鹽溶液),其對應的弱堿(或弱酸)的堿性(或酸性)越強,其酸性(或堿性)越弱.如下列物質的溶液按pH由大到小排列的順序是:Na2SiO3>Na2CO3>NaHCO3
例1(2001廣東)若pH=3的酸溶液和pH=11的堿溶液等體積混合后溶液呈酸性,其原因可能( ).
A.生成一種強酸弱堿鹽
B.弱酸溶液和強堿溶液
C.弱酸與弱堿溶液反應
D.一元強酸溶液與一元強堿溶液反應
解析若酸、堿均是強酸、強堿,則由pH知“酸溶液的c(H+)=堿溶液的c(OH-)”,故等體積混合時恰好中和生成強酸強堿鹽,該鹽不水解,溶液呈中性,與題意不符,故D選項錯誤;若酸是弱酸,堿是強堿,則等體積混合后,酸明顯剩余,其物質的量遠大于所生成的弱酸強堿鹽,因此,鹽水解導致的堿性遠小于酸電離產生的酸性,所以B項正確 .A項具有極強的干擾性,很多學生錯選了A,原因是只注意到了A項中明顯的“強酸弱堿鹽”水解產生的酸性,而忽視了該條件時弱堿過量對溶液性質的決定性影響.
答案:B
例2濃度為0.1 mol/L的8種溶液:
①HNO3②H2SO4③HCOOH ④Ba(OH)2⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl溶液,pH由小到大的順序是(填寫編號)____.
解析相同的物質的量濃度的各種電解溶液的pH大小比較有以下一般規律:
(1)同物質的量濃度的酸及水解呈酸性的鹽溶液,其pH的關系一般是:二元強酸<一元強酸<弱酸<水解顯酸性的鹽溶液.
(2)同物質的量濃度的堿及水解呈堿性的鹽溶液,其pH的關系一般是:二元強堿>一元強堿>弱堿>水解呈堿性的鹽溶液.
(3)強酸弱堿鹽,堿越弱,水溶液酸性越強;弱酸強堿鹽,酸越弱,溶液堿性越強.
(4)同物質的量濃度的多元弱酸及其鹽水溶液的pH關系是:以H2PO4為例:H3PO4 答案:②①③⑧⑦⑥⑤④. 如已知物質的量濃度相同的三種鹽溶液:NaX、NaY、NaZ,它們的pH依次為:8、9、10,則可知對應酸的酸性強弱順序為:HX>HY>HZ. 例125℃時某KCN溶液的pH=12,則可知該溶液中水電離出的c(OH-)=1×10-2mol/L.這是因為水解呈堿性的溶液中:c(OH-)水=c(OH-)堿. 例2 已知NH4I溶液中的c(H+)水=1×10-4mol/L,則可知該溶液的pH為4.這是因為水解呈酸性的溶液中:c(H+)水=c(H+)酸. A.NaHSO4B.KAl(SO4)2C.NaHCO3D.NaAc 答案:AD 由于某些弱酸弱堿鹽在水中強烈水解,因此這些弱酸弱堿鹽的制取不能通過溶液之間的反應而得到.如Al2S3的制取,若用含Al3+的物質與含S2-的物質在溶液中進行反應,則由于它們相互促進水解而生成Al(OH)3和H2S,得不到Al2S3. 再如MgCl2晶體的制備,MgCl2溶液在加熱蒸發時,HCl同時揮發,這樣最終只能得到Mg(OH)2.所以,在進行以上操作時,須通以HCl氣流,以抑制Mg2+的水解. 例4既可以通過單質與單質化合,也可以通過溶液中的復分解反應來制得的化合物是( ). A.FeCl3B.Al2S3C.CuS D.Fe2S3 提示A:FeCl3可由Fe與Cl2或用鹽酸與Fe(OH)3反應制得.B:Al2S3不能通過溶液中的反應得到.C:Cu與S反應得Cu2S.D:Fe與S反應得FeS.選A. 對于水解程度比較大的某些鹽溶液的配制,可事先在水中加入相應的酸或堿. 1.強酸弱堿鹽溶液的配制,如FeCl3溶液的配制,由于FeCl3溶于水后發生水解反應: 可先在水中加入稀鹽酸,抑制Fe3+水解,避免溶液變渾,然后再用水沖稀至所需濃度.CuSO4等溶液的配制亦是如此. 2.強堿弱酸鹽溶液的配制,如配制Na2S溶液時,應先在水中滴入幾滴NaOH溶液,再用水沖稀至所需濃度即可.在配制FeCl3、AlCl3、CuCl2、SnCl2等溶液時為防止水解,常先將鹽溶于少量相應的酸中,再加蒸餾水稀釋到所需濃度. 例5下列溶液不能用玻璃試劑瓶貯存的是( ). A.NaCl B.NH4F C.FeCl3D.溴水 提示NH4F水解可產生HF,氫氟酸可與玻璃中的SiO2反應.選B. 例6如何配制澄清透明的SnCl2溶液? 提示若把SnCl2晶體溶于蒸餾水中,溶液會出現白色渾濁,這是水解的緣故. 若加酸(H+)則可抑制水解.將適量SnCl2晶體溶于少量濃鹽酸中,再慢慢加入蒸餾水稀釋,即可得澄清透明的SnCl2溶液 如MgCl2溶液中含有雜質FeCl3時,可利用Mg2+、Fe3+水解程度的不同(MgCl2溶液的pH為5時還能穩定存在,而FeCl3溶液在pH大約為3.6時開始沉淀),加入MgO、Mg(OH)2或MgCO3來調節溶液的pH,使Fe3+變成Fe(OH)3沉淀下來. 例7已知pH=5的MgCl2溶液中含有雜質FeCl3,為除去雜質可加入的試劑是( ). A.MgO B.MgCO3C.NaOH D.NaHCO3 答案:AB 例8 在氯化銅(CuCl2·2H2O)中含有FeCl2雜質,為制得純凈氯化銅晶體,首先將其制成水溶液,然后按下圖所示的操作步驟進行提純. (1)為什么加入氧化劑X? 提示不能用加堿分離,因加堿Cu2+也得到沉淀.只有加入氧化劑,把Fe2+氧化為Fe3+,再利用Fe3+水解,并設法(如加CuO)使水解進行到底分離. (2)下列物質都可以作為氧化劑,其中最適合于本實驗的是( ). A.H2O2B.KMnO4C.NaClO D.K2Cr2O7 提示依據分離的原則之一,不得引入雜質,故選A. (3)物質Y是CuO;沉淀E是Fe(OH)3. 例9下列各種情況下能大量共存的離子組為( ). A. pH=7的溶液中:Fe3+、Cl-、Na+、NO3- 本題揭示了對有能水解的離子共存問題不僅要考慮離子間是否發生反應,更要注意水解離子所引起的溶液的酸堿性變化. 兩種鹽溶液反應時應分三個步驟分析考慮: (1)能否發生氧化還原反應; (2)能否發生雙水解互促反應; (3)以上兩反應均不發生,則考慮能否發生復分解反應. 例10 現有Al2(SO4)3、HAc、NaCl、BaCl2四種溶液,可以將它們區別開的一種試劑是( ). A.H2SO4B.AgNO3C.Na2CO3D.NaHCO3 答案:C 如水垢的主要成分是CaCO3和Mg(OH)2,基本上不含MgCO3,這是因為MgCO3微溶于水,長時間加熱,水解生成了更難溶的Mg(OH)2. 若用強堿滴定弱酸,反應達到終點時,因生成強堿弱酸鹽,溶液顯堿性,所以應選用在堿性變色的指示劑——酚酞. 若用強酸滴定弱堿,反應達到終點時,因生成強酸弱堿鹽,溶液顯酸性,所以應選用在酸性變色的指示劑——甲基橙. 1.加熱濃縮不水解的鹽溶液時一般得原物質. 2.加熱濃縮Na2CO3型的鹽溶液一般得原物質. 3.加熱濃縮FeCl3型的鹽溶液.最后得到FeCl3和Fe(OH)3的混合物,灼燒得Fe2O3. 4.加熱蒸干(NH4)2CO3或NH4HCO3型的鹽溶液時,得不到固體. 5.加熱蒸干Ca(HCO3)2型的鹽溶液時,最后得相應的正鹽. 6.加熱Mg(HCO3)2、MgCO3溶液最后得到Mg(OH)2固體. 例11(1996年全國高考題)把三氯化鐵溶液蒸干灼燒,最后得到的固體產物是( ). A.無水三氯化鐵 B.氫氧化鐵 C.氧化亞鐵 D.三氧化二鐵 但值得注意的是,并不是所有能水解的鹽,加熱溶液時都會出現這種情況,如加熱蒸干Fe2(SO4)3溶液,最終所得固體產物仍為Fe2(SO4)3.這是因為水解產物H2SO4在加熱時不能揮發,所以當蒸發至一定程度時,平衡會因中和反應起主導作用向左移動,最后得原溶質Fe2(SO4)3. 例12 ①碳酸鉀與水溶液蒸干得到固體物質是____原因是____.②KAl(SO4)2溶液蒸干得到的固體物質是____,原因是____.③碳酸氫鋇溶液蒸干得到的固體物質是____,原因是____.④亞硫酸鈉溶液蒸干得到的固體物質是____,原因是____.⑤氯化鋁溶液蒸干得到的固體物質是____,原因是____.⑥鹽酸與硫酸各1 mol/L的混合酸10 mL,加熱濃縮至1 mL,最后的溶液為____,原因是____. 解析本題涉及的知識范圍較廣,除了鹽的水解外,還應考慮到鹽的熱穩定性,還原性等. ①K2CO3,原因是盡管加熱過程促進水解,但生成的KHCO3和KOH反應后又生成K2CO3. ②KAl(SO4)2·2H2O,原因是盡管Al3+水解,但由于H2SO4為難揮發酸,最后仍然為結晶水合物.注意溫度過高,會脫去結晶水. ⑤Al(OH)3,加熱,使HCl揮發,促進水解進行到底. ⑥H2SO4溶液,HCl揮發. 如在NH4Cl溶液中加入Mg粉: 例13(1995年全國高考題)下列物質跟鎂反應并生成氫氣的是( ). A.甲酸溶液 B.氫氧化鈉溶液 C.氯化銨溶液 D.碳酸鈉溶液 答案:選A、C. 十四、NH4Cl除銹 例14普通泡沫滅火器的鐵筒里裝著一只小玻璃筒,玻璃筒內盛裝硫酸鋁溶液,鐵筒里盛裝碳酸氫鈉飽和溶液.使用時,倒置滅火器,兩種藥液相混合就會噴出含二氧化碳的白色泡沫. (1)產生此現象的離子方程式是____. (2)不能把硫酸鋁溶液裝在鐵筒里的主要原因是____. (3)一般不用碳酸鈉代替碳酸氫鈉,是因為____. (3)與酸反應速率NaHCO3>Na2CO3;產生等量CO2時,消耗Al3+量:Na2CO3>NaHCO3;等質量的NaCO3、Na2HCO3分別與足量Al3+反應,生成CO2量NaHCO3>Na2CO3. 2.草木灰不能與銨態氮肥混用. 例15同時對農作物施用含氮、磷、鉀的三種化肥,對給定的下列化肥:①K2CO3,②KCl,③Ca(H2PO4)2,④(NH4)2CO3,⑤氨水.最適當的組合是( ). A.①③④ B.②③④ C.①③⑤ D.②③⑤ 提示磷酸二氫鈣是可溶性酸式鹽,以電離為主,溶液呈酸性;K2CO3水解呈堿性;銨鹽水解顯酸性.選B. 原因:Fe3+、Al3+水解產生少量膠狀的Fe(OH)3、Al(OH)3,結構疏松、表面積大、吸附能力強,故它們能吸附水中懸浮的小顆粒而沉降,從而起到凈水的作用. 例16(1997年上海高考題)鐵酸鈉(Na2FeO4)是水處理過程中使用的一種新型凈水劑,它的氧化性比高錳酸鉀更強,本身在反應中被還原為Fe3+. (1) 配平制取鐵酸鈉的化學方程式: Fe(NO3)3+NaOH+Cl2——Na2FeO4+NaNO3+NaCl+H2O 反應中____元素被氧化,轉移電子總數為____. (2)鐵酸鈉之所以能凈水,除了能消毒殺菌外,另一個原因是____. 提示(1)用化合價升降法即可配平. (2)Fe3+水解生成Fe(OH)3膠體: 答案: (1)2,16,3,2,6,6,8;Fe(或鐵);6e-. (2)還原產物Fe3+發生水解生成Fe(OH)3膠體,能吸附雜質.二、依據鹽溶液pH的不同,判斷相應酸(堿)的酸性(堿性)強弱
三、依據鹽溶液的pH,可求出溶液中水電離出的c(H+)或c(OH-),反之亦然
四、對水電離度的影響,與鹽的水解有關

五、一些鹽[如Al2S3、Al2 (CO3)3、Al2(SO3)3、Al(HCO3)3等]的制取
六、某些鹽溶液的配制、保存

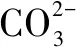

七、有些離子分離、除雜,應用水解知識
八、在溶液中離子能否大量共存
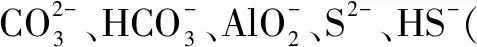
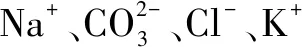

九、分析鹽與鹽反應時要考慮水解
十、判斷物質的成分
十一、中和滴定中確定終點時對指示劑的選擇
十二、判斷加熱蒸干某鹽溶液得到什么產物



十三、某些鹽溶液(強酸弱堿鹽,如CuSO4、NH4Cl等)與某些活潑金屬(如鎂)作用會產生氫氣



十五、FeCl3溶液止血

十六、泡沫滅火器內反應原理
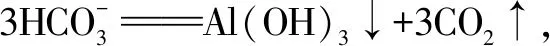
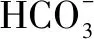

十七、制備膠體
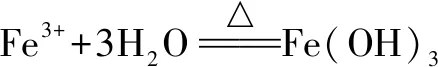
十八、化學肥料使用


十九、熱的純堿液去油污效果好
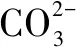
二十、某些鹽(如FeCl3、明礬等)作凈水劑的原理



