融合圖像和指標的阿爾茨海默病多分類診斷模型
鉏家歡 潘喬
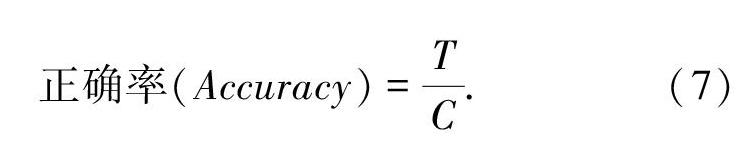

摘 要: 隨著人工智能的發(fā)展,計算機輔助診斷在阿爾茨海默病診斷中扮演著越來越重要的角色。本文提出了一種融合圖像和指標的新型多分類診斷模型,充分挖掘TOP-MRI圖像和臨床指標特征用于阿爾茨海默病的多分類診斷。首先,構建由3個VGGNet-16卷積神經網絡和1個單隱層網絡組成的TOP-CNN-NN模型提取大腦TOP-MRI圖像特征向量,利用CfsSubsetEval評估器來篩選臨床指標組成指標特征向量;然后,采用典型相關分析(CCA)方法將圖像特征向量和指標特征向量進行線性融合;最后,將融合特征向量輸入多分類分類器來區(qū)分阿爾茨海默病的3個階段,包括正常(CN)、輕度認知障礙(MCI)和阿爾茨海默病(AD)。通過ADNI公開數(shù)據(jù)集證明,本文提出方法在阿爾茨海默病多分類診斷上的正確率可達到86.7%,有較好的性能表現(xiàn)。
關鍵詞: 阿爾茨海默病;卷積神經網絡;典型相關分析;核磁共振圖像;生物標志物
文章編號:2095-2163(2019)04-0006-07?中圖分類號:TP391?文獻標志碼:A
0 引 言
阿爾茨海默病(Alzheimers disease, AD),又稱老年性癡呆。是一種神經系統(tǒng)退行性疾病,其特點是認知能力下降,不可逆轉的影響全部認知功能,最后導致日常活動嚴重受損和過早死亡[1]。目前,全球約有5.0×107例AD患者。僅2018年一年,預計有1.0×107例AD患者,每3秒將新增一名患者。約8%的65歲及以上老年人,35%的85歲及以上老年人受困于AD。臨床上主要將AD分為3個階段:正常(CN)、輕度認知障礙(MCI)和阿爾茨海默病(AD)。MCI是AD的前期表現(xiàn),是從CN到AD的過渡狀態(tài)。醫(yī)學上目前尚未發(fā)現(xiàn)AD的發(fā)病成因,也沒有找到準確診斷的有效方法。
隨著人工智能的發(fā)展,計算機輔助診斷在AD診斷中扮演著越來越重要的角色。在計算機輔助診斷相關研究中,磁共振成像(MRI)由于其出色的空間分辨率、高可及性和良好的對比度而常常被作為AD診斷的重要依據(jù)。常用的方法包括基于3D醫(yī)學影像特征的提取和分類,使用感興趣區(qū)域(ROI)來對AD進行診斷,利用圖像分割并測量海馬、內側顳葉形態(tài)的AD分類診斷等[2-5]。另外還有使用少量圖像的紋理特征,或者使用多元數(shù)據(jù)融合的方法[6-7]。
但這些方法仍舊存在許多問題,3D醫(yī)學影像由于其高維性、噪聲、稀疏性往往難以表示和建模,而使用感興趣區(qū)域和圖像分割需要一定的先驗知識,這也是一項具有挑戰(zhàn)性的任務。另外,對于AD的診斷,不僅要參考神經影像學,也要參考其它的臨床檢查。例如人口統(tǒng)計學信息,包括性別和年齡;神經心理學評估,包括簡易智力狀態(tài)檢查量表(MMSE)、臨床癡呆評估量表(CDR)、萊氏聽覺言語學習測試(RAVLT)和功能活動問卷(FAQ);生物學檢測,包括β淀粉樣蛋白、Tau蛋白、載脂蛋白E在內的多個生物標志物。
本文提出的融合TOP-MRI圖像和臨床指標的新型多分類診斷模型,可以充分挖掘TOP-MRI圖像和臨床指標的特征用于AD的多分類診斷。在本文提出的多分類診斷模型中,通過TOP-CNN-NN模型對三正交平面MRI圖像特征進行提取,雖然提取的特征向量可解釋性差,但是在提取過程中無需人工標注,減輕了需要先驗知帶來的挑戰(zhàn)。另外,使用3張MRI圖像建模可以有效避免圖像高維性帶來的過擬合問題,同時在一定程度上降低了提取的圖像特征向量的維度,有利于與較低維度的指標特征向量進行融合。最后,通過典型相關分析來融合圖像特征向量和由人口統(tǒng)計學信息、神經心理學評估、生物學檢測組成的指標特征向量,進一步提高了多分類的有效性。本文的主要貢獻如下:
(1)提出了一種基于典型相關分析的多元數(shù)據(jù)線性融合方法,融合了TOP-MRI圖像和多種臨床指標,在阿爾茨海默病多分類診斷上有較好的表現(xiàn)。
(2)建立了一種基于VGGNet-16和單隱層網絡的TOP-CNN-NN模型,用于對大腦三正交平面MRI圖像特征向量的提取。
1 具體方法
本文提出了融合TOP-MRI圖像和臨床指標的新型多分類診斷模型,模型總體框架如圖1所示。
框架主要包括4個部分:特征向量提取模塊、指標特征選擇模塊、特征向量融合模塊和疾病分類診斷模塊。在圖像特征提取模塊中,首先從大腦三正交平面(Three Orthogonal Planes, TOP)中選取3張不同平面的MRI圖像,對圖像進行變換幾何形狀、濾波降噪和數(shù)值標準化預處理,然后將預處理后的圖像輸入TOP-CNN-NN模型提取圖像特征向量。在指標特征選擇模塊中,通過CfsSubsetEval評估器來選擇臨床指標,組合形成指標特征向量。在向量線性融合模塊中,通過典型相關分析(Canonical Correlation Analysis, CCA)方法將圖像特征向量和指標特征向量進行線性融合。在疾病分類診斷模塊中,將融合特征向量輸入多分類分類器來區(qū)分阿爾茨海默病的3個階段,包括正常(CN)、輕度認知障礙(MCI)、阿爾茨海默病(AD)。
1.1 圖像特征提取
文本構建的TOP-CNN-NN圖像特征提取模型,充分發(fā)揮VGGNet-16卷機神經網絡和單隱層網絡各自的優(yōu)勢和特點。首先對TOP-MRI圖像進行預處理,然后利用VGGNet-16卷機神經網絡對預處理后的圖像進行初步特征向量提取,最后將3個初步特征向量經過投票加權后輸入單隱藏層網絡生成融合特征向量,模型框架如圖2所示。
1.1.1 TOP-MRI圖像預處理
本文選用三正交平面MRI圖像作為圖像特征提取模型輸入。三正交平面(TOP)是以大腦的空間幾何中心為中心,在3個方向上的切面,較為清晰地包含了用于AD診斷的重要信息,例如海馬體、內嗅皮質、杏仁核等形態(tài)信息,TOP示意圖如圖3所示。
特征提取之前需要對圖像進行預處理,有助于更好地提取特征并提升最終的分類效果。由于MRI圖像受檢測設備和檢查手法的影響,導致圖像出現(xiàn)不規(guī)整、噪聲高、明暗不一等問題。針對此類問題,本文利用3個步驟來對圖像進行預處理:
(1)變換幾何形狀。
(2)圖像濾波降噪。
(3)像素值標準化。
1.1.2 基于VGGNet-16的初步特征提取
卷積神經網絡(CNN)是一類包含卷積計算且具有深度結構的前饋神經網絡,已被廣泛用于圖像相關的領域[8]。在本文提出的模型中,使用VGGNet-16分別對大腦的3個正交平面:軸位(Axials)、弧狀位(Sagittal)、冠狀位(Coronal)平面圖像來訓練YX-CNN、XZ-CNN、YZ-CNN模型,3個CNN模型用于提取各自平面的初步特征向量。
VGGNet卷積神經網絡是由牛津大學計算機視覺組合和Google DeepMind公司研究員一起研發(fā)的深度卷積神經網絡[9]。其探索了卷積神經網絡的深度和其性能之間的關系,通過反復的堆疊3*3的小型卷積核和2*2的最大池化層,成功地構建了16~19層深的卷積神經網絡,本文選用的是VGGNet-16。
用MRIi表示 CNN第k層的特征圖,假設MRIi是卷積層,MRIi的產生過程可以描述為:
其中: Wi表示第i層卷積核的權值向量, 運算符號“×”代表卷積核與第i-1層圖像進行卷積操作,卷積的輸出與第i層的偏移向量bi相加,最終通過非線性的激勵函數(shù)f(x) 得到第i層的特征圖MRIi。VGGNet-16模型采用13層卷積層,低層卷積層提取一些低級的特征如緣、線條,高層卷積層將從低級特征中迭代提取更加復雜的特征。在每一組卷積層之后,添加了一個Max pooling池化層來獲得更加完整和重要的特征。假設MRIi是Max pooling層:
Max pooling對filter抽取到的若干圖像特征值,只保留最大的那個pooling層特征,可以減少模型參數(shù)數(shù)量,避免過擬合問題。最后,VGGNet-16使用3全連接層將提取到的特征綜合起來。全連接層中的每個神經元與其前一層的所有神經元進行全連接。全連接層可以整合卷積層或者池化層中具有類別區(qū)分性的局部信息。初步特征向量即為VGGNet-16中最后一層全連接層的輸出。
1.1.3 基于單隱層網絡的融合特征提取
CNN用于提取三正交平面中軸位(XY)、弧狀位(XZ)、冠狀位(YZ)3個平面圖像的初步特征向量,3個初步特征向量均輸出自CNN的最后一個全連接層,即XY-FC-1000、XZ-FC-1000和YZ-FC-1000。由于每個軸位圖像存在各自的特點,在CNN特征提取過程中所關注的點和表達的特征也存在差異,不利于直接進行融合。本文采用投票加權的方法,可以突出各自特征并降低特征差異帶來的向量融合問題,投票加權流程如圖4所示。
首先,通過綜合XY-CNN、XZ-CNN和YZ-CNN的分類結果,若存在相同的分類結果,則將此結果作為投票結果;如果三者的分類結果均不同,則將分類正確率較高的結果作為投票結果。每一種投票結果對應一種權重向量。將此權重向量與XY-FC-1000、XZ-FC-1000和YZ-FC-1000串行拼接的向量相乘, 最后,將投票加權特征向量輸入到單隱層神經網絡中。單隱層神經網絡的作用是融合3個正交平面的特征向量,輸出維度更低的融合特征向量,有利于下一步與臨床指標特征進行線性融合,同時又可避免過擬合問題。TOP-CNN-NN模型輸出的圖像特征向量即是單隱層網絡的隱藏層輸出。
1.2 指標特征選擇
ADNI公開數(shù)據(jù)集中包含每個受試者的臨床信息,包括人口統(tǒng)計學信息、神經心理學評估、生物學檢測、神經病理學、基因檢測等。本文通過CfsSubsetEval評估器和查閱醫(yī)學相關論文,選擇了其中11個指標作為臨床特征。其中包括2個人口統(tǒng)計學指標,4個神經心理學指標,5個生物學檢測指標。具體如下:
(1)簡易智力狀態(tài)檢查量表(MMSE)。MMSE是目前臨床上檢查智力最常見的量表,能全面、準確、迅速地反應被試患者智力狀態(tài)及認知功能缺損程度。通過量表總分值數(shù)反應患者的情況,其中與文化教育程度有關,進一步的測驗包括記憶力、執(zhí)行功能等各項認知功能的評估。
(2)臨床癡呆評估量表(CDR)。CDR是通過與患者及其家屬交談中獲得信息,加以提煉、完成對患者認知受損程度的評估,繼而快速評定患者病情的嚴重程度。評定的領域包括記憶、定向力、判斷與解決問題的能力、工作與社會交往能力、家庭生活和個人業(yè)余愛好、獨立生活自理能力。
(3)萊氏聽覺言語學習測試(RAVLT)。RAVLT即刻和延遲測試,該測試評估患者的語言記憶,是最敏感的記憶測試之一。測試通過給患者聽讀一定數(shù)量的內容,然后進行即刻和延時回憶,以此來判斷患者的情況。研究表明,RAVLT對于AD的區(qū)分均高于其它的神經心理學評估。
(4)精神活動功能問卷(FAQ)。FAQ問卷包含一些生活常見問題,用于測量有關日常事務的詳細信息。通過受試者對于這些信息的描述來判斷其認知能力。
(5)β淀粉樣蛋白。老年斑為AD神經病理學特征性表現(xiàn),其主要成分是β 淀粉樣蛋白(Amyloid β,Aβ)。生物體內的Aβ以多種形式存在,其中最主要的為Aβ40和Aβ42[10]。研究發(fā)現(xiàn),AD患者腦組織中β 淀粉樣蛋白明顯增多,通過檢測血漿中Aβ水平對于檢出AD有一定的幫助[14]。
(6)Tau蛋白和水溶性磷酸化Tau蛋白。Tau 蛋白是一種低相對分子質量的微管相關蛋 白,在發(fā)生異常磷酸化、糖基化后易形成配對螺 旋纖維 (paired helical filaments, PHFs),進一步組成 神經原纖維纏結,后者為 AD 的特征性病理表現(xiàn)[10]。 中重度AD患者腦脊液中 tau 蛋白水平較正常對照明顯升高,且這一指標的升高早于臨床癡呆癥狀的出 現(xiàn),提示其可用于 AD 的預測[11]。
(7)ApoE-載脂蛋白E。ApoE是中樞神經系統(tǒng)最主要的載脂蛋白之一,參與膽固醇的動員和重分布,也是神經系統(tǒng)發(fā)育和損傷后維持髓鞘和神經元細胞膜完整性的必要成分,其在血漿中的蛋白水平受ApoE基因型[10]。相關研究表明攜帶ApoE 基因型者由MCI進展至AD的風險較高,因此ApoE對于AD的診斷有一定的參考價值[12]。
1.3 特征向量融合
MRI圖像和臨床指標數(shù)據(jù)都有其特殊的優(yōu)勢和局限性,對多元數(shù)據(jù)特征向量進行融合,有利于提高阿爾茨海默病(AD)分類診斷的準確度。本文提出的模型將MRI圖像特征向量和臨床指標特征向量通過典型相關分析(CCA),來分析2個特征向量之間的相關關系并產生新的融合特征向量,輸入分類器進行分類診斷。
典型相關性分析是用來分析2個隨機向量彼此關系的統(tǒng)計方法之一。這種方法可以通過分析2個特征向量之間的相關關系產生新的融合特征向量,其不僅適用于信息融合,更適用于去除冗余信息。因此采用典型相關分析可以使得多源數(shù)據(jù)融合達到更好的效果[13]。
1.4 疾病分類診斷
疾病分類診斷主要通過多分類器分類實現(xiàn)。本文通過將圖像和指標的融合特征向量輸入分類器來診斷阿爾茨海默病的3個階段,包括正常(CN)、輕度認知障礙(MCI)和阿爾茨海默病(AD)。本文選擇的多分類器是決策樹。
2 實驗
2.1 數(shù)據(jù)集
本文采用的實驗數(shù)據(jù)均來自公開數(shù)據(jù)集ADNI。實驗數(shù)據(jù)集總共包含302例相關患者的MRI圖像和臨床指標。數(shù)據(jù)總共分為3個類別,其中正常(CN)為91例;輕度認知障礙(MCI)為141例;阿爾茨海默病(AD)為70例。
MRI圖像使用T1加權、三維磁化強度預備梯度回波序列獲得的3張正交平面切面圖像,具有較高的空間分辨率和時間分辨率,信噪比、偽影小,對大腦內部結構(如白質、灰質和腦脊液)的對比度良好,有利于顯示微小的腦部變化,對阿爾茨海默病的診斷具有重要價值。
臨床數(shù)據(jù)使用人口統(tǒng)計學信息、神經心理學評估和生物學檢測3種數(shù)據(jù)類型的11個臨床指標。
2.2 評價指標
本文使用正確率來評價多分類模型的性能,其計算方法如公式(3)所示,其中T為分類正確的樣本數(shù)量,C為參與分類的總數(shù)量。
實驗數(shù)據(jù)集以80比20的比例劃分,其中80%的數(shù)據(jù)用于訓練目的,剩余的20%用于測試目的。使用交叉驗證對模型進行訓練和驗證,以獲得有效的分類性能。
2.3 圖像特征提取模塊有效性評估
本文建立的TOP-CNN-NN模型用于提取MRI圖像特征向量,該模型由3個VGGNet-16卷積神經網絡和1個單隱層網絡組成。
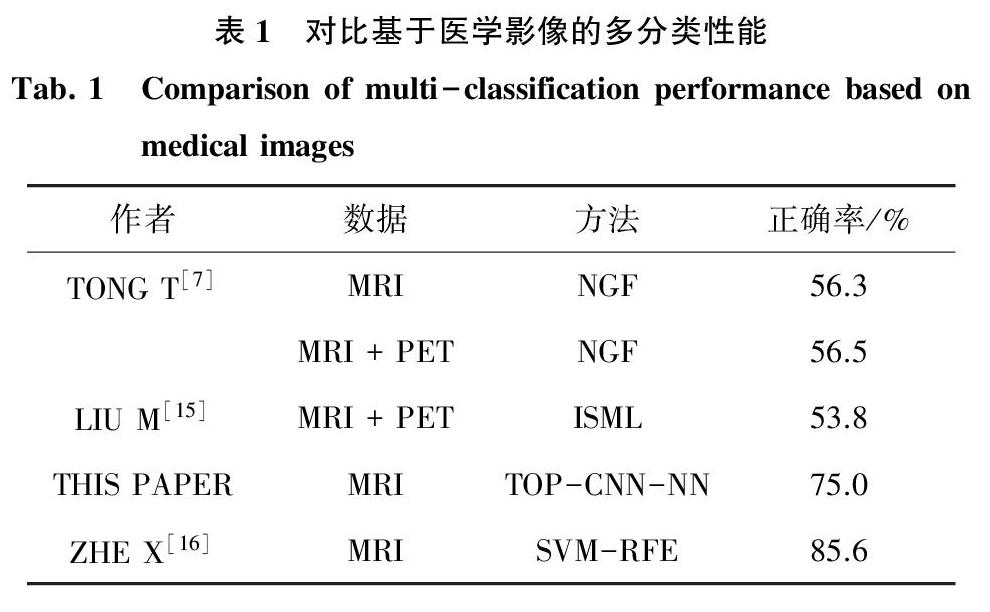
見表1,在基于醫(yī)學影像的多分類上,對比其它論文提出的多分類模型和本文建立的TOP-CNN-NN模型的性能。實驗結果顯示,與Tong T等人[7]使用非線性圖融合(NGF)的方法和Liu M等人[15]提出的基于結構的固有多視圖學習(ISML)方法相比,本文建立的模型的性能要優(yōu)于兩者。與Zhe X等人[16]提出的基于紋理分析組合(SVM-RFE)的方法相比,本文建立的模型雖然在分類性能上存在差距,但是在建模過程中無需先驗知識,無需臨床醫(yī)生參與。實驗結果證明了本文建立的TOP-CNN-NN模型在基于醫(yī)學影像的多分類上的有效性,進一步證明了該模型用于提取MRI圖像特征向量的有效性。
2.4 指標特征選擇模塊有效性評估
本文通過CfsSubsetEval評估器從ADNI數(shù)據(jù)集整理的28個指標中篩選出11個臨床指標,包含人口統(tǒng)計學信息、神經心理學評估和生物學檢測3種類型的指標。
見表2,對比不同類型臨床指標的多分類性能。實驗結果顯示,基于2個人口統(tǒng)計學信息指標(DEMOGRAPHIC-2)和5個生物學檢測指標(BIOLOGY-5)的多分類性能較差,基于4個神經心理學評估指標(NEUROPSYCHOLOGY-4)的多分類性能較好,基于11個不同類型臨床指標(MERGE-11)的多分類性能最好,且高于基于28個不同類型臨床指標(MERGE-28)的性能。實驗結果證明了本文通過CfsSubsetEval評估器篩選的11個臨床指標在多分類上的有效性。
2.5 特征向量融合模塊有效性評估
本文通過典型相關分析(CCA),分析圖像特征向量和指標特征向量之間的相關關系,并將其運用于生成融合特征向量。
見表3,對比基于TOP-MRI圖像和臨床指標的不同組合的多分類性能。實驗結果顯示,基于臨床指標的多分類性能要優(yōu)于基于TOP-MRI圖像的性能;將TOP-MRI圖像和臨床指標簡單拼接融合,雖然性能要略微優(yōu)于僅使用圖像,但與基于臨床指標相比,其性能有一定的下降;如果使用典型相關分析(CCA)將TOP-MRI圖像和臨床指標進行融合可以提高分類性能,并且略優(yōu)于僅使用臨床指標。實驗結果證明了本文提出的模型使用TOP-MRI圖像和臨床指標的合理性,同時也證明了典型相關分析用于多元數(shù)據(jù)融合的有效性。
2.6 疾病分類診斷模型的有效性評估
本文提出的融合TOP-MRI圖像和臨床指標的阿爾茨海默病多分類診斷模型(LF),用于區(qū)分阿爾茨海默病的3個階段:包括正常(CN)、輕度認知障礙(MCI)和阿爾茨海默病(AD)。
見表4,在阿爾茨海默病的多分類診斷上,對比其它論文提出的多分類診斷模型和本文提出的融合圖像和指標的多分類診斷模型的性能。實驗結果顯示,Tong T等人[7]提出了一種基于圖的非線性融合方式(NGF),將影像學檢查中的MRI圖像、PET圖像和臨床數(shù)據(jù)中的CSF、基因型融合用于多分類診斷,其正確率為53.8%。Zhu X等人[16]提出了一種稀疏鑒別特征選擇(SDFS)的方法,使用MRI和PET圖像作為實驗數(shù)據(jù),其分類正確率為61.1%。Altaf T等人[6]將MRI圖像和其它臨床數(shù)據(jù)的特征融合(FF),其全腦圖像和臨床數(shù)據(jù)融合取得的分類正確率為75%。與其它論文提出的阿爾茨海默病多分類診斷模型對比,本文提出的模型在多分類上的正確率可以達到86.7%。實驗結果證明了本文提出的阿爾茨海默病多分類診斷模型在多分類上的有效性。
3 結束語
本文提出了一種融合圖像和指標的新型多分類診斷模型,充分挖掘TOP-MRI圖像和臨床指標特征用于阿爾茨海默病的多分類診斷。本文采用ADNI公開數(shù)據(jù)集,通過多個實驗驗證了提出的阿爾茨海默病多分類診斷模型在多分類上的有效性。
由于模型性能的好壞受三正交平面MRI圖像提取位置的影響。另外,每種臨床指標對于區(qū)分正常(CN)、輕度認知障礙(MCI)和阿爾茨海默病(AD)的敏感性和特異性存在差異,可考慮將多分類任務轉換成多個二分類任務,每種二分類任務使用不同的臨床指標組合。
接下來的研究工作可以從這2個方面展開。首先,研究三正交平面的提取位置對于分類性能的影響。其次,研究不同的指標對于區(qū)分不同疾病類型的敏感性和特異性,更好地提高阿爾茨海默病分類的準確度。
參考文獻
[1] ????張靜爽,王蓉. 阿爾茨海默病發(fā)生機制的研究進展[J]. 首都醫(yī)科大學報,2014,35(6):721-724.
[2] KARASAWA H, LIU C L, OHWADA H . Deep 3D Convolutional Neural Network architectures for Alzheimers disease diagnosis[M]//NGUYEN N, HOANG D, HONG T P, et al. Intelligent information and database systems. ACIIDS 2018. Lecture Notes in Computer Science, ?Springer, Cham, 2018, 10751:287-296.
[3] Liu J, Li M, Lan W, et al. Classification of Alzheimer's Disease Using Whole Brain Hierarchical Network[J]. IEEE/ACM Transactions on Computational Biology & Bioinformatics, 2018,15(2):624-632.
[4] PLATERO C, TOBAR M C. Combining a patch-based approach with a non-rigid registration-based label fusion method for the Hippocampal segmentation in Alzheimers disease[J]. Neuroinformatics, 2017, 15(2):165-183.
[5] SARWINDA D, BUSTAMAM A. 3D-HOG features-based classification using MRI images to early diagnosis of Alzheimers disease[C]// 2018 IEEE/ACIS 17th International Conference on Computer and Information Science (ICIS). ?SINGAPORE:IEEE Computer Society, 2018,1:457-462.
[6] ALTAF T, ANWAR S M, GUL N, et al. Multi-class Alzheimers disease classification using image and clinical features[J]. Biomedical Signal Processing and Control, 2018, 43:64-74.
[7] TONG Tong, GRAY K, GAO Qinquan , et al. Multi-modal classification of Alzheimer's disease using nonlinear graph fusion[J]. Pattern Recognition, 2016, 63:171-181.
[8] GU Jiuxiang, WANG Zhenhua, KUEN J,et al. Recent advances in Convolutional Neural Networks[J]. arXiv preprint arXiv:1512.07108, 2015.
[9] SIMONYAN K, ZISSERMAN A.Very Deep Convolutional Networks for large-scale image recognition[J]. arXiv preprint arXiv:1409.1556,2014.
[10]陳逸,張寶榮. 阿爾茨海默病相關核心生物標志物研究進展[J].生命科學,2014,26(1):2-8.
[11]SCHRDER J,KAISER E,SCHNKNECHT P, et al.[CSF levels of total tau protein in patients with mild cognitive impairment and Alzheimer's disease][J]. Zeitschrift fur Gerontologie und Geriatrie,2008,41(6):497-501.
[12]HSIUNG G Y R, SADOVNICK A D, FELDMAN H . Apolipoprotein E epsilon4 genotype as a risk factor for cognitive decline and dementia: data from the Canadian Study of Health and Aging[J]. CMAJ, 2004, 171(8):863-867.
[13]孫權森, 曾生根, 王平安,等. 典型相關分析的理論及其在特征融合中的應用[J]. 計算機學報, 2005, 28(9):1524-1533.
[14]GLENNER M D G G, WONG C W. Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein [J]. Biochemical and Biophysical Research Communications, 1984,120(3):885-890.
[15]LIU M, ZHANG D, ADELI E , et al. Inherent Structure-Based Multiview Learning With Multitemplate Feature Representation for Alzheimer's Disease Diagnosis[J]. IEEE Transactions on Biomedical Engineering, 2016, 63(7):1473-1482.
[16]XIAOZhe,Ding Yi, LAN Tian , et al. Brain MR Image Classification for Alzheimers disease diagnosis based on multifeature fusion[J]. Computational and Mathematical Methods in Medicine, 2017, 2017:1-13.
[17]ZHU Xiaofeng, SUK H I, SHEN Dinggang. Sparse Discriminative Feature Selection for Multi-class Alzheimers disease classification[M]//WU G,et al. Machine Learning in Medical Imaging, LNCS 8679.Switzerland:Springer, 2014:157-164.

