可口革囊星蟲多糖酶法—堿梯次提取工藝優化及其抗氧化和抑菌性能分析
付滿 黃海 楊濘清 覃媚 石展嫻

摘要:【目的】優化可口革囊星蟲多糖酶法—堿梯次提取工藝,并分析兩階段提取多糖的體外抗氧化和抑菌活性,為可口革囊星蟲酶解產物及不溶性蟲體成分的梯次化加工利用提供參考依據。【方法】以新鮮可口革囊星蟲為材料、多糖提取率為考察指標,經木瓜蛋白酶和堿性蛋白酶處理,聯合酶解和濾渣堿提工藝,兩階段梯次化提取多糖,并測定可口革囊星蟲多糖對DPPH自由基和羥基自由基(·OH)的清除率,采用紙片法測定其抑菌性能。【結果】可口革囊星蟲多糖酶法—堿梯次提取最佳工藝為:復合酶(木瓜蛋白酶∶堿性蛋白酶=1∶2)添加量4.0%、酶解溫度55 ℃、酶解時間4 h、料液比1∶5(g/mL)、濾渣堿提時間2.0 h、氫氧化鈉濃度1.5%,在此條件下,獲得酶解多糖提取率為1.076%,濾渣堿提多糖提取率為0.171%,總多糖提取率為1.247%。酶提多糖和濾渣堿提多糖對·OH清除的半抑制濃度(IC50)分別為2.6和4.9 mg/mL,清除DPPH自由基的IC50分別為4.4和5.1 mg/mL。酶提多糖和堿提多糖在1.560 mg/mL以上對金黃色葡萄球菌、大腸埃希氏菌、銅綠假單胞菌和枯草芽孢桿菌均有一定的抑制作用。【結論】采用優化的酶法—堿梯次提取工藝可從可口革囊星蟲酶解液和濾渣中有效提取多糖,且兩種多糖均具有較強的抗氧化活性和抑菌作用。
關鍵詞: 可口革囊星蟲;多糖;酶法提取;濾渣堿提;抗氧化活性;抑菌性能
中圖分類號: S917.4 ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2019)05-1085-08
Abstract:【Objective】Extraction technology of enzymatic extraction of polysaccharides(EEP) and alkali extraction of polysaccharides from filter residues(AEPR) were studied by enzymolysis-alkali extraction from Phscolosoma esculenta. The antioxidant in vitro and antimicrobial activities of two-stage extraction of polysaccharides were tested. It provided reference for gradient processing of enzymatic hydrolysate and insoluble component of P. esculenta. 【Method】Taking fresh P. esculenta as material, the extraction rate of polysaccharides was used as index while two-stage extraction of polysaccharides were extracted by enzymatic process of papain and alkaline protease combining with alkaline process of enzymatic hydrolysis residue. The DPPH free radical scavenging rate and hydroxyl(·OH) scavenging rate were detected,the antimicrobial properties were determined by paper disc method. 【Result】The results showed that the optimum extraction process for enzymolysis-alkali echelon extraction of polysaccharides was: complex enzyme(papain∶alkaline protease=1∶2) adding amount was 4%, enzymolysis temperature was 55 ℃, enzymolysis time was 4 h, solid-liquid ratio was 1∶5(g/mL), residue alkaline extraction time was 2.0 h, concentration of alkali was 1.5%, the extraction rate of the EEP was 1.076%, the extraction rate of the AEPR was 0.171%, and the total polysaccharide was 1.247% . Half-inhibitory concentration( IC50) of EEP and AEPR on ·OH were 2.6 and 4.9 mg/mL, respectively, and the scavenging rate IC50 of DPPH free radical were 4.4 and 5.1 mg/mL. EEP and AEPR had certain inhibitory effects on Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa and Bacillus subtilis at the concentration of more than 1.560 mg/mL. 【Conclusion】The optimized enzymolysis-alkali echelon extraction of polysaccharides can extract polysaccharides from enzymatic hydrolysate and filter residue of P. esculenta, and the two polysaccharides have strong antioxidant activity and antimicrobial activity.
Key words: Phscolosoma esculenta; polysaccharide; enzyme extraction; filter residue alkali extraction; antioxidant activity; antimicrobial activity
0 引言
【研究意義】可口革囊星蟲(Phascolosoma esculenta)俗稱海泥蟲、海丁、泥蒜、泥丁、土筍等,屬星蟲動物門,是我國的特有種,也是我國星蟲中較龐大的種群,主要分布于福建、廣西、浙江、廣東等沿海灘涂區域(李鳳魯,1989;李永強,2011;王帥,2018),可規模化增值養殖(徐敏嫻等,2011),是一種具有開發前景的經濟動物資源。可口革囊星蟲對環境適應性強,在生長中可以抵抗灘涂復雜的微生物環境(王芳芳,2013;莫新,2017),其體內有益于這種防御作用的抗氧化和抑菌成分應被廣泛關注和研究。已有研究表明可口革囊星蟲多糖具有抗疲勞、抗氧化、增強免疫力、抗敗血癥等功效(吳雅清等,2015)。因此,系統研究可口革囊星蟲多糖的綜合提取工藝及抗氧化和抑菌性能,對其天然活性成分的開發利用具有重要意義。【前人研究進展】關于可口革囊星蟲成分及活性功效方面已有一些研究報道。黃島平等(2012)對北部灣可口革囊星蟲進行研究,發現其在氨基酸和礦物質風味及營養評價方面的食用價值不低于方格星蟲;牛榮麗和唐健紅(2012)研究發現可口革囊星蟲蟲體經組織勻漿后制成的凍干粉懸浮液對小鼠具有明顯的抗疲勞作用;孔帥(2014)研究發現可口革囊星蟲多糖主要由葡萄糖和半乳糖,以及少量甘露糖和阿拉伯糖組成,具有一定的抗氧化作用和增強小鼠免疫功能;孔帥等(2014)利用蛋白酶水解提取可口革囊星蟲多糖,其提取率為0.879%。部分動物多糖除了具有一定的抗氧化作用外,在抑菌性能方面也有一些研究報道,尤其是水產動物中由于其生存環境和特殊的機體結構,提取的結構多糖通常具有一定抑菌性能(丁侃,2018)。王沖(2005)研究認為蚯蚓體表粘多糖對大腸桿菌、金黃色葡萄球菌、植物病原菌等多種菌體具有一定的抑菌作用;董蘭芳等(2013)研究發現不同提取條件的方格星蟲多糖具有不同的抑菌性能;田振華等(2013)、張瑞娟等(2018)分別發現牡蠣多糖和鮑魚內臟多糖具有一定的抑菌特性;許翔等(2018)對可口革囊星蟲酶解液的抑菌性能進行了初步研究,但可口革囊星蟲多糖提取物是否具有抑菌性能至今尚無定論。【本研究切入點】目前尚未見同時研究可口革囊星蟲酶提多糖和濾渣堿提多糖工藝,并比較分析二者活性差異的文獻報道。【擬解決的關鍵問題】以新鮮可口革囊星蟲為試驗材料,優化酶法—堿梯次提取工藝,并對比酶提和堿提兩種多糖的抗氧化活性和抑菌性能,以期為可口革囊星蟲酶解產物及不溶性蟲體成分的梯次化加工利用提供研究基礎,從而獲得天然的抗氧化、抑菌多糖以應用于食品加工領域。
1 材料與方法
1. 1 試驗材料
新鮮可口革囊星蟲購自欽州市東風市場(欽州市犀牛角鎮捕獲)。木瓜蛋白酶(100000 U/g)和堿性蛋白酶(50000 U/g)購自南寧東恒華道生物科技有限責任公司;DPPH購自上海伊卡生物技術有限公司;葡萄糖標準品、無水乙醇、鄰苯三酚、三(羥甲基)氨基甲烷、苯酚、硫酸、水楊酸、過氧化氫和硫酸亞鐵均為分析純,購自國藥集團化學試劑有限公司;金黃色葡萄球菌(Staphylococcus aureus)CICC21600、大腸埃希氏菌(Escherichia coli)CICC10389、銅綠假單胞菌(Pseudomonas aeruginosa)CICC10419和枯草芽孢桿菌(Bacillus subtilis)CICC10275購自中國工業微生物菌種保藏管理中心。
主要儀器設備:ME204E電子天平[梅特勒—托利多儀器(上海)有限公司]、752紫外—可見分光光度計[島津儀器(蘇州)有限公司]、SCIENTZ-IID超聲波細胞粉碎機(寧波新芝生物科技股份有限公司)、HH-4水浴鍋(常州普天儀器制造有限公司)、SHZ-D(Ⅲ)循環水式真空泵(鞏義市予華儀器有限責任公司)、V-100旋轉蒸發儀(瑞士步琦有限公司)和H1850離心機(湖南湘儀實驗室儀器開發有限公司)。
1. 2 試驗方法
1. 2. 1 工藝流程 取新鮮可口革囊星蟲清洗瀝干水分后,勻漿至靡狀,按照一定料液比稀釋,加入復合酶50 ℃酶解一定時間,滅酶冷卻至室溫后,選擇250 W超聲波處理后過濾。取濾液經Sevage法沉淀蛋白,收集水層濃縮,加入4倍體積無水乙醇于4 ℃靜置過夜,沉淀析出后干燥即為酶提多糖(Enzyma-tic extraction of polysaccharides,EEP);取濾渣加入氫氧化鈉溶液50 ℃處理一定時間,上清液經Sevage法沉淀蛋白,收集水層濃縮,經乙醇沉淀過夜,干燥沉淀即為堿提多糖(Alkali extraction of polysaccharides from filter residues,AEPR)。
1. 2. 2 多糖測定
1. 2. 2. 1 標準曲線繪制 準確稱取經干燥至恒重的無水葡萄糖100 mg,加蒸餾水溶解,定容1000 mL,配制成質量濃度為0.1 g/mL的葡萄糖標準溶液。精確吸取標準溶液0、0.2、0.4、0.6、0.8和1.0 mL置于25 mL比色管中,加蒸餾水至1.0 mL,再分別快速加入2 g/L的蒽酮—硫酸試劑4.0 mL,搖勻,室溫放置10 min,于620 nm處測定吸光值。以蒸餾水作空白對照。以葡萄糖標準溶液質量濃度為橫坐標、吸光值為縱坐標,最小二乘法線性回歸,得回歸方程y=1.4986x-0.0051(R2=0.9953)。
1. 2. 2. 2 多糖提取率計算 按照標準曲線步驟利用蒽酮—硫酸法測定提取液中多糖,同時以相應含量酶溶液作空白。
多糖提取率(%)=C×V×10-3×n/m×100
式中,C為由回歸方程計算所得多糖質量濃度(mg/mL); V為可口革囊星蟲多糖溶液體積(mL),n為可口革囊星蟲多糖溶液稀釋倍數,m為新鮮可口革囊星蟲樣品質量(g)。
1. 2. 3 單因素試驗 基礎工藝:經料液比1∶4(g/mL,下同)、3.0%復合蛋白酶(木瓜蛋白酶∶堿性蛋白酶=1∶2)50 ℃充分酶解4 h,1%氫氧化鈉堿提1 h。
先以濾渣堿提多糖量為指標確定最適氫氧化鈉濃度和堿提時間,再結合基礎工藝依次改變料液比、酶添加量、酶解溫度和酶解時間,分析單因素試驗對酶提多糖和堿提多糖的影響。
1. 2. 4 正交試驗 在單因素試驗的基礎上,以多糖提取率為考察指標,選取酶添加量(A),酶解溫度(B)和酶解時間(C)3個因素進行L9(34)正交試驗。試驗因素與水平見表1。
1. 2. 5 可口革囊星蟲多糖抗氧化性測定
1. 2. 5. 1 可口革囊星蟲多糖溶液制備 按照正交試驗優化條件提取可口革囊星蟲酶解粗多糖和濾渣堿提粗多糖,獲得酶解粗多糖中多糖含量為61%,水中溶解度(25 ℃)為35 g/100 g, 1%溶液(以測定多糖含量計)黏度為18±4 cp;濾渣堿提粗多糖中多糖含量為43%,水中溶解度(25 ℃)為41 g/100 g,1%溶液(以測定多糖含量計)黏度為27±2 cp。以粗多糖中多糖測定含量為依據,配置不同質量濃度多糖溶液備用。
1. 2. 5. 2 羥基自由基(·OH)清除率測定 參照Wang等(2013)、董蘭芳等(2015)的方法,將干燥多糖按照1.2.5.1制成不同質量濃度多糖溶液,依次加入多糖溶液1.0 mL、8.0 mmol/L硫酸亞鐵1.0 mL和8.0 mmol/L水楊酸—乙醇溶液1.0 mL,混勻后加入8.0 mmol/L過氧化氫1.0 mL搖勻,37 ℃水浴30 min,以蒸餾水作參比,于510 nm處測其吸光值。重復操作3次取平均值。以相同質量濃度Vc溶液作對照。
·OH清除率(%)=(A0-Af)/A0×100
式中,A0為試劑空白液吸光值,Af為多糖溶液吸光值,以未反應樣品調零。
1. 2. 5. 3 DPPH自由基清除率測定 參照Alam等(2013)、孔帥(2014)的方法,分別取1.2.5.1制備的不同質量濃度樣品溶液2.0 mL和0.04 g/L DPPH溶液2.0 mL置于不同試管中,混勻,室溫下反應0.5 h,在517 nm處測定吸光值。以相同質量濃度Vc溶液作對照。
DPPH自由基清除率(%)=[1-(As-Ar)/A0]×100
式中,As為樣品組與2.0 mL DPPH的吸光值,A0為2.0 mL蒸餾水與2.0 mL DPPH的吸光值,Ar為2.0 mL待測樣品與2.0 mL無水乙醇的吸光值。
1. 2. 6 多糖抗菌活性測定 取兩種可口革囊星蟲粗多糖,按照1.2.5.1用生理鹽水配制成1.0、2.0、4.0和8.0 mg/mL多糖溶液備用。采用圓形紙片法(劉麗等,2016),分別將金黃色葡萄球菌、大腸埃希氏菌、銅綠假單胞菌和枯草芽孢桿菌活化培養24 h;刮取一接種環培養菌落置于10.0 mL生理鹽水中(菌數106~107 CFU/mL),振蕩搖勻得菌懸液,無菌操作吸取100 μL菌懸液至營養瓊脂平板培養基表面,迅速用涂布棒均勻;取已消毒的圓形濾紙(直徑6 mm)用移液槍緩慢注入多糖提取液20 μL,貼于培養基平板上并標記位置,以生理鹽水作對照。37 ℃培養24 h后測量抑菌圈環直徑(不含濾紙片直徑)。每個樣品設3個平行板,結果取平均值。
1. 3 統計分析
采用SPSS 17.0檢驗試驗數據差異性,Excel 2010制圖。
2 結果與分析
2. 1 單因素試驗結果
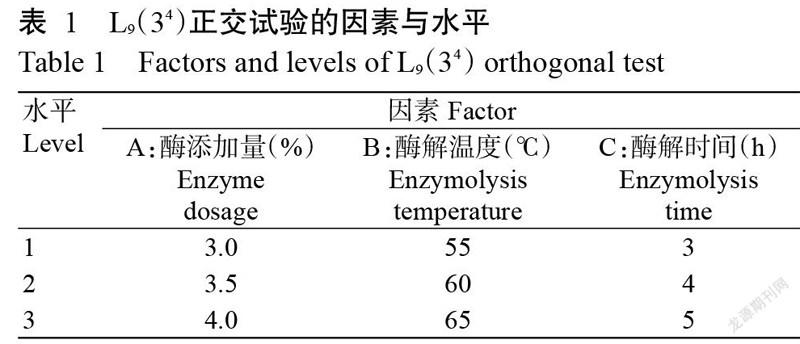
2. 1. 1 氫氧化鈉濃度對可口革囊星蟲堿提多糖提取率的影響 在3.0%復合蛋白酶酶解條件下,酶提多糖平均提取率為0.620%,相對標準偏差(RSD)=0.027%(n=15)。0.5%~3.0%氫氧化鈉濃度梯度堿提濾渣時,細胞質間與結構蛋白結合多糖在堿性作用下被釋放出來,可口革囊星蟲濾渣堿提多糖提取率呈先增后減的變化趨勢,1.5%時提取率最高,為0.227%,顯著高于其他堿濃度的多糖提取率(P<0.05,下同)(圖1)。說明堿有利于濾渣中多糖提取,但堿濃度過高可能會破壞雜多糖結構,尤其是蛋白糖等,使得多糖提取率減小(劉玉明等,2011)。因此,最佳堿濃度為1.5%,此時可口革囊星蟲總多糖提取率為0.847%。
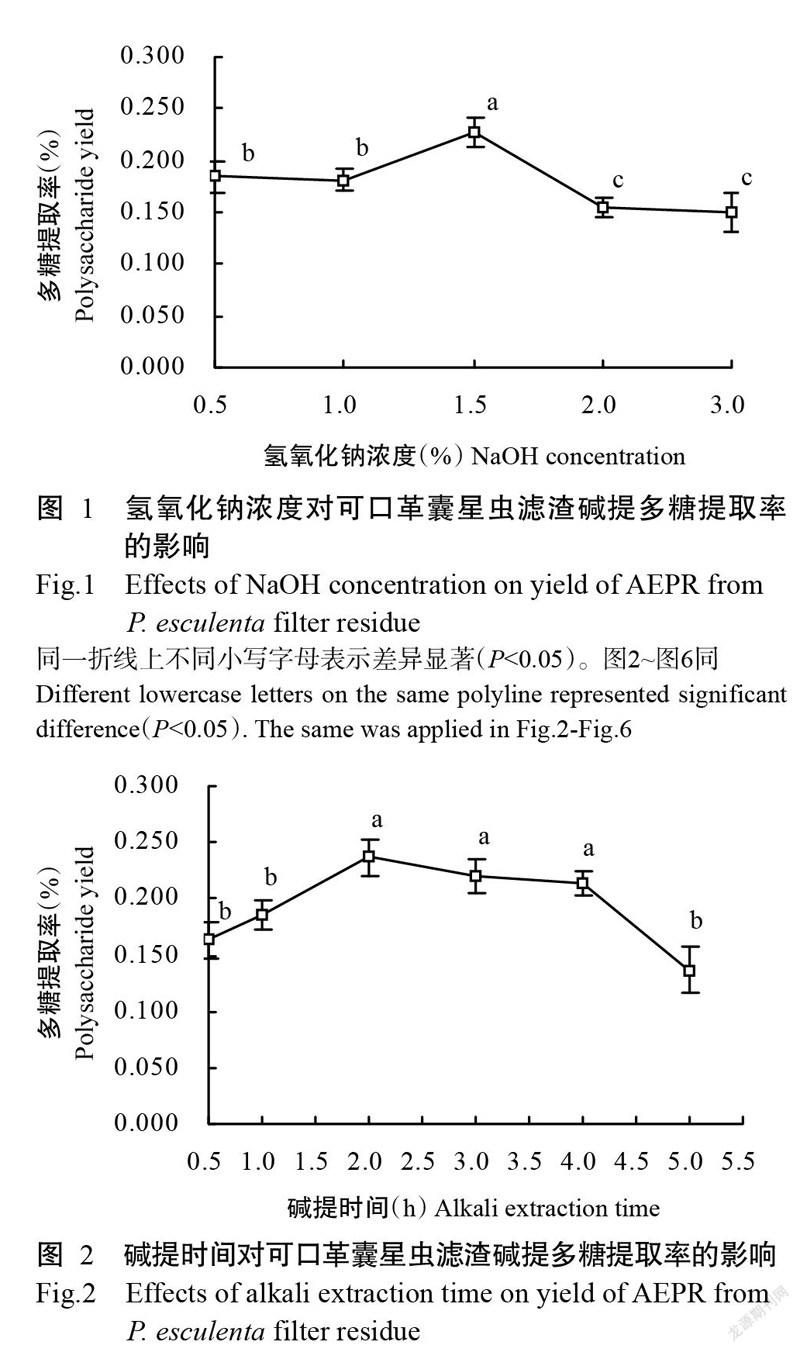
2. 1. 2 堿提時間對可口革囊星蟲堿提多糖提取率的影響 由圖2可知,在0.5~5.0 h范圍內,可口革囊星蟲濾渣堿提多糖提取率先增大后減小,堿提時間為2.0 h時,提取率達最大值(0.237%),顯著高于0.5、1.0和5.0 3個堿提時間的多糖提取率。說明在一定時間內堿溶液有助于多糖提取,但堿提時間過長,提取率直線下降,可能是堿溶液對多糖產生了降解作用(薛芳等,2008;Ballesteros et al.,2015)。因此,最佳堿提時間為2.0 h。此外,酶提多糖提取率為0.650%,可口革囊星蟲總多糖提取率為0.887%。
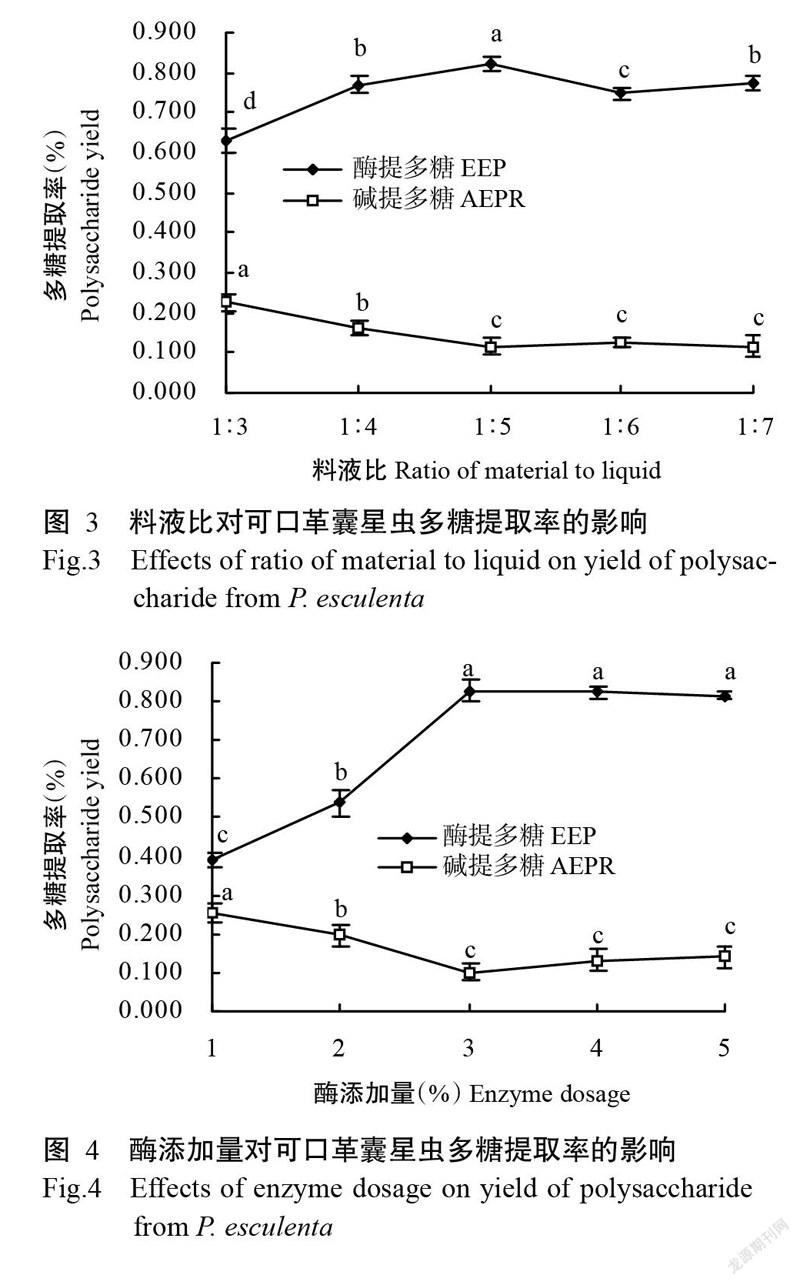
2. 1. 3 料液比對可口革囊星蟲多糖提取率的影響 從圖3可看出,料液比在1∶3~1∶7范圍內時,可口革囊星蟲酶提多糖提取率隨料液比的減小而呈先增后減的變化趨勢,料液比為1∶5的提取率最高(0.823%),可能是此時能最大限度增加底物與蛋白酶接觸,且已達水溶多糖擴散速率大于溶出速率的要求,而繼續增加溶液體積不僅對多糖總溶出量無貢獻,反而促使其他物質溶出,不利于多糖醇沉分離。對濾渣堿提多糖,其提取率隨料液比的減小逐漸下降,至料液比1∶5后趨于平穩。因此,最佳料液比為1∶5,此時的濾渣堿提多糖提取率為0.117%,可口革囊星蟲總多糖提取率為0.940%。
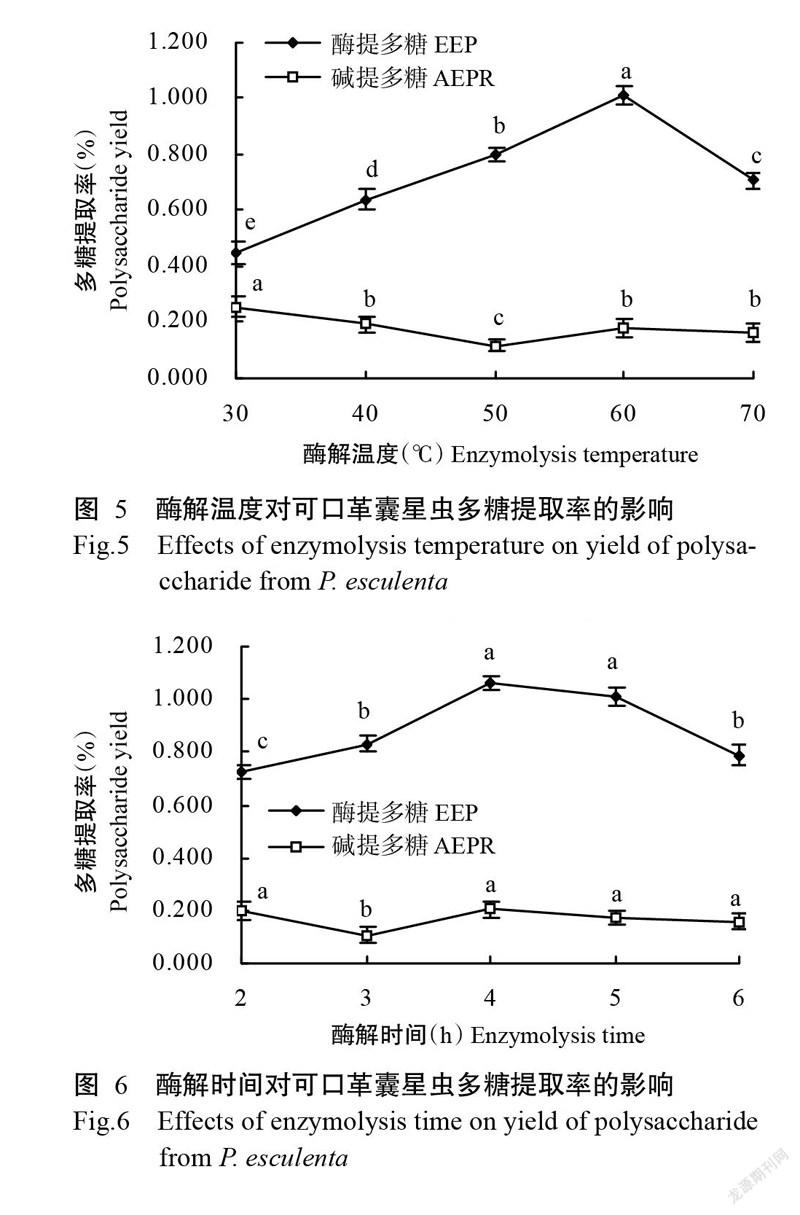
2. 1. 4 酶添加量對可口革囊星蟲多糖提取率的影響 從圖4可看出,復合蛋白酶添加量在1.0%~5.0%范圍內,可口革囊星蟲酶提多糖提取率先增大后趨于平穩。復合蛋白酶添加量為3.0%時,提取率達最大值(0.827%),之后保持穩定,表明蛋白酶對結構蛋白的解離有助于多糖溶出,且3.0%酶用量基本達到可接觸底物飽和濃度(Zhang et al.,2011)。濾渣堿提多糖提取率隨酶用量的增加呈遞減趨勢,但酶添加量達3.0%后又緩慢回升。考慮到過量的蛋白酶會增加其他干擾性雜質溶出,以及盡可能增加濾渣堿提多糖得率,選擇4.0%為適宜酶添加量。此時,濾渣堿提多糖提取率為0.133%,可口革囊星蟲總多糖提取率為0.960%。
2. 1. 5 酶解溫度對可口革囊星蟲多糖提取率的影響 從圖5可看出,酶解溫度對可口革囊星蟲酶提多糖提取率的影響有明顯峰值,60 ℃時達最大值(1.050%)。在60 ℃以下,酶提多糖提取率幾乎呈直線上升,表明復合蛋白酶對可口革囊星蟲組織多糖的釋放受溫度影響顯著,溫度過低,酶不能充分發揮其作用;溫度過高則酶失活(蘇偉等,2017)。結合圖4酶添加量的影響來看,濾渣堿提多糖在低酶解度時并未獲得高提取率,說明蛋白酶解對于可口革囊星蟲多糖提取率的影響遠大于堿液作用。因此,最佳酶解溫度為60 ℃,此時濾渣堿提多糖提取率為0.169%,可口革囊星蟲總多糖提取率為1.219%。
2. 1. 6 酶解時間對可口革囊星蟲多糖提取率的影響 由圖6可知,隨酶解時間的延長,可口革囊星蟲酶解多糖提取率呈先增后減的變化趨勢,酶解4 h時達最大值(1.059%)。酶解時間過長,糖苷鍵在蛋白酶的催化作用下會被裂解(蘇偉等,2017),同時會增加溶解蛋白、分子肽等含量,通過Sevage法脫出蛋白時需要的分離次數明顯增加,多糖損失隨之增加,故酶解時間超過4 h后酶提多糖提取率開始下降。酶解4 h后濾渣堿提多糖的提取率也達最大值(0.203%),因此最佳酶解時間為4 h,可口革囊星蟲總多糖提取率為1.262%。
2. 2 正交試驗結果
從正交試驗結果(表2)可看出,酶提多糖提取率最優組合為A2B1C2,濾渣堿提多糖提取率最優組合為A3B1C2。酶添加量(A)是影響濾渣堿提多糖提取率的主要因素,且對于酶提多糖在2水平和3水平具有相近的提取率,故選取A3B1C2作為兩種多糖提取酶解的最優組合,即可口革囊星蟲多糖酶法—堿梯次提取的最佳工藝條件為酶添加量4.0%、酶解溫度55 ℃、酶解時間4 h、料液比1∶5、濾渣堿提時間2.0 h、氫氧化鈉濃度1.5%。
采用最佳條件進行提取,經試驗驗證,酶解多糖提取率為1.076%,濾渣堿提多糖提取率為0.171%,總多糖提取率為1.247%(RSD=0.025%,n=5)。
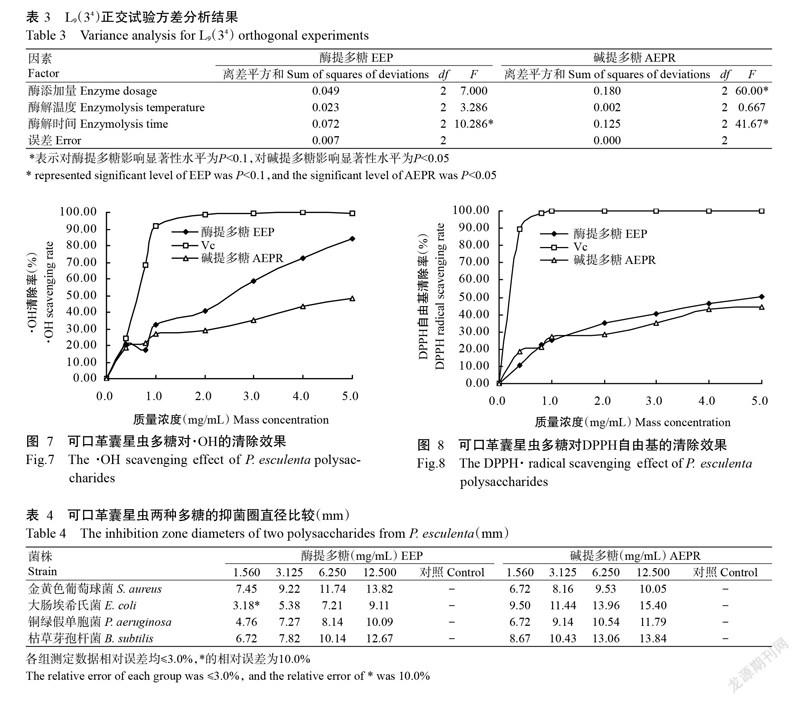
由表3可知,在正交試驗所選水平上對酶提多糖提取率影響顯著的僅有酶解時間(P<0.1),而酶添加量和酶解溫度的影響無顯著影響(P>0.1),說明這兩個因素的提取工藝參數比較穩定;而對濾渣堿提多糖提取率影響顯著的是酶解時間和酶添加量(P<0.05),說明濾渣堿提多糖的提取率受酶解工藝條件影響較大。
2. 3 多糖抗氧化活性測定結果
2. 3. 1 對·OH的清除效果 由圖7可知,在1.0~5.0 mg/mL的樣品質量濃度范圍內,可口革囊星蟲酶提多糖和濾渣堿提多糖對·OH的清除能力均隨質量濃度的增大而增強,具有一定的量效關系;酶提多糖清除·OH的半抑制濃度(IC50)為2.6 mg/mL,在5.0 mg/mL時的清除率達84.10%,而濾渣堿提多糖表現出較平緩的濃度效應關系,IC50為4.9 mg/mL,其對·OH的清除能力弱于酶提多糖。
2. 3. 2 對DPPH自由基的清除效果 由圖8可知,可口革囊星蟲酶提多糖和濾渣堿提多糖在一定質量濃度范圍內對DPPH自由基具有清除作用,且隨質量濃度增加,其清除效果逐漸增強。酶提多糖在5.0 mg/mL時的清除率為50.10%,IC50為4.4 mg/mL;而濾渣堿提多糖對DPPH自由基清除作用與酶提多糖無明顯差異,對應的IC50為5.1 mg/mL。
2. 4 多糖抑菌活性測定結果
從表4可看出,可口革囊星蟲酶提多糖和堿提多糖在1.560 mg/mL濃度以上對金黃色葡萄球菌、大腸埃希氏菌、銅綠假單胞菌和枯草芽孢桿菌均有一定的抑制作用。酶提多糖對金黃色葡萄球菌和枯草芽孢桿菌的抑菌圈明顯大于大腸埃希氏菌和銅綠假單胞菌;而堿提多糖在同等抑菌濃度下,表現出更明顯的抑菌效果,尤其是對大腸埃希氏菌的抑制能力明顯強于酶提多糖。兩種多糖均為粗多糖,可能存在糖蛋白或糖肽等,故其抑菌機制是多種途徑共存。
3 討論
本研究采用梯次化開發應用的提取思路,綜合考慮酶提多糖和濾渣堿提多糖提取率,發現蛋白酶酶解可口革囊星蟲可有效釋放其蟲體組織結構水溶性多糖,同時酶解程度與濾渣堿提多糖提取率同樣有著較顯著的影響關系,且這種影響主要集中在酶解時間和酶添加量兩個因素。目前已有的可口革囊星蟲多糖研究主要集中于體腔液多糖和蟲體水溶性多糖的提取和功能性研究(李妍妍等,2007;梁倩蓉等,2015),忽略了蟲體水提濾渣中多糖的研究。本研究優化得出最佳方案的總多糖提取率達1.247%,比孔帥等(2014)獲得的提取率(0.879%)提高了41.9%,除了增加濾渣堿提多糖之外,其原因可能是堿性蛋白酶比胰蛋白酶更適用于蟲體蛋白的酶解;此外,本研究采用超聲處理也是多糖提取率增加的一個原因。梯次化開發是綜合利用最大化的有效手段,目前可口革囊星蟲研究基本圍繞酶解工藝展開,梯次化提取可綜合考慮酶解溶出多糖、酶解肽和酶解濾渣的利用等,既能最大限度地提高功能多糖提取率,又可以得到酶解肽溶液。在工藝實施中只需調整蛋白沉降和多糖醇沉的工藝順序即可有目的地獲得不同純度酶解肽和多糖產品,在可口革囊星蟲高值化開發利用方面具有廣闊的應用前景。
本研究對梯次化提取兩種多糖的抗氧化性和抑菌性能進行系統比較,發現兩種多糖均具有抗氧化和抑菌活性,且濾渣堿提多糖表現出更強的抑菌性能。根據抑菌物和菌體細胞壁結合方式,多糖抑菌的方式有兩種:一是大分子多糖與細胞壁結合形成表面膜阻礙菌體營養吸收,或結合態多糖干擾菌體外質膜從而破壞菌體正常代謝(張雅利等,2008);二是小分子與小分子成分進入菌體細胞內,引起絮凝,從而影響生理因子功效,達到抑菌效果(No et al.,2002)。兩種多糖抑菌性能產生差異的原因可能是可口革囊星蟲酶解后,結構多糖被釋放出來,主要在細胞壁結構較厚的革蘭氏陽性菌表面形成表面膜,對其生理代謝產生阻隔作用;而濾渣堿提多糖由于堿液作用對部分多糖及結合態多糖具有降解作用,會形成相對較小分子的多糖及其他活性成分,從而可以進入革蘭氏陰性菌內部干擾菌體的生理活性,增強抑菌效果。本研究結果不僅為可口革囊星蟲多糖綜合利用提供了參考,還為可口革囊星蟲蟲體在抑菌性能方面的研究提供了新思路。
本研究因未對提取的多糖進行純化,故未進行最低抑菌濃度(MIC)分析,但從粗多糖的自由基清除能力和抑菌性能來看,在其復合食品加工利用中可有效減少抑菌劑和抗氧化劑的添加。但對于濾渣堿提多糖與酶提多糖的單糖組成間是否存在差異仍有待進一步研究;此外,可口革囊星蟲多糖與酶解肽的協同抑菌機制也是一個值得研究的課題。
4 結論
采用優化的酶法—堿梯次提取工藝可從可口革囊星蟲酶解液和濾渣中有效提取多糖,且兩種多糖均具有較強的抗氧化活性和抑菌作用,對可口革囊星蟲酶解后的加工處理工藝有較高的參考價值。
參考文獻:
丁侃. 2018. 中藥多糖結構與功能及其機制[M]. 北京:科學出版社. [Ding K. 2018. Structure,Function and Mechanism of Chinese Medicine Polysaccharides[M]. Beijing:Science Press.]
董蘭芳,張琴,童潼,許明珠. 2013. 方格星蟲多糖抗菌和抗氧化活性研究[J]. 廣西科學,20(4):289-293. [Dong L F,Zhang Q,Tong T,Xu M Z. 2013. Studies on the antimicrobial and antioxidant activities of polysaccharide from Sipunculus nudus[J]. Guangxi Sciences,20(4):289-293.]
董蘭芳,張琴,童潼,許明珠. 2015. 方格星蟲體腔液多糖的提取及體外抗氧化活性[J]. 食品研究與開發,36(11):46-49. [Dong L F,Zhang Q,Tong T,Xu M Z. 2015. Extraction and antioxidant activity of polysaccharides from Sipunculus nudus coelomic fluid[J]. Food Research and Development,36(11):46-49.]
黃島平,劉永強,林葵,黃文琦,陳秋虹,陳建紅,黃艷. 2012. 北部灣革囊星蟲和方格星蟲主要營養成分比較分析[J]. 大眾科技,14(8):172-173. [Huang D P,Liu Y Q,Lin K,Huang W Q,Chen Q H,Chen J H,Huang Y. 2012. Comparative analysis of main nutritive components on Phascolosoma esulenta and Sipunculus nudus in Beibu Gulf[J]. Popular Science & Technology,14(8):172-173.]
孔帥. 2014. 可口革囊星蟲多糖對小鼠免疫調節作用的研究[D]. 寧波:寧波大學. [Kong S. 2014. Immunomodulatory effects of polysaccharides from Phascolosoma esulenta on mice[D]. Ningbo:Ningbo University.]
孔帥,劉連亮,陸新江,史雨紅,陳炯. 2014. 響應面法優化可口革囊星蟲抗氧化多糖提取工藝研究[J]. 食品工業科技,35(11):233-237. [Kong S,Liu L L,Lu X J,Shi Y H,Chen J. 2014. Optimization of extraction process by response surface methodology of anti-oxidant polysaccharides from Phasolosma esculenta[J]. Science and Technology of Food Industry,35(11):233-237.]
李鳳魯. 1989. 中國沿海革囊星蟲屬(星蟲動物門)的研究[J]. 青島海洋大學學報,19(3):78-90. [Li F L. 1989. Studies on the genus Phascolosoma(Sipuncula) of the China coasts[J]. Journal of Ocean University of Qing-dao,19(3):78-90.]
李妍妍,徐巧云,鄭衛星,丁理發,陳才利,蘇秀榕. 2007. 可口革囊星蟲體腔液多糖的研究[C]//中國藥學會. 2007年全國生化與生物技術藥物學術年會論文集:527-528. [Li Y Y,Xu Q Y,Zheng W X,Ding L F,Chen C L,Su X R. 2007. Studies on polysaccharides from Phasolosma esculenta coelomic fluid[C]//Chinese Pharmaceutical Associa-tion. Papers Collection of 2007 National Annual Conferen-ce on Biochemical and Biotechnical Pharmaceuticals:527-528.]
李永強. 2011. 北部灣(廣西段)潮間帶大型底棲動物的調查研究[D]. 青島:青島理工大學. [Li Y Q. 2011. The macrozoobenthos of intertidal zone in Beibu Gulf(Guangxi)[D]. Qingdao:Qingdao University of Technology.]
梁倩蓉,于曙光,劉順,王國良,鄭曉葉,彭雪美惠,周素明. 2015. 可口革囊星蟲Phasolosma esculenta體腔液的抗菌活性研究[J]. 海洋學研究,33(2):70-75. [Liang Q R,Yu S G,Liu S,Wang G L,Zheng X Y,Peng X M H,Zhou S M. 2015. Antibacterial activity of the coelomic fluid from a marine worm,Phasolosma esculenta[J]. Journal of Marine Sciences,33(2):70-75.]
劉麗,徐春,李可,姜昆,吳鵬. 2016. 九資河茯苓多糖的超聲波提取工藝及抑菌性研究(英文)[J]. 農業科學與技術,17(12):2746-2750. [Liu L,Xu C,Li K,Jiang K,Wu P. 2016. Optimal ultrasonic extraction of pachyman from Jiu-zihe Poria cocos[J]. Agricultural Science & Technology,17(12):2746-2750.]
劉玉明,錢甜甜,何穎,蔣定文,沈先榮,江叔奇,楊進剛. 2011. 方格星蟲多糖不同提取工藝的比較研究[J]. 時珍國醫國藥,22(6):1454-1455. [Liu Y M,Qian T T,He Y,Jiang D W,Shen X R,Jiang S Q,Yang J G. 2011. Comparative study on polysaccharide from Sipunculus nudus by different extraction process[J]. Lishizhen Medicine and Materia Medica Research,22(6):1454-1455.]
莫新. 2017. 可口革囊星蟲高密度養殖技術[J]. 科學養魚,(1):47. [Mo X. 2017. High density breeding technology of the Phscolosoma esculenta[J]. Scientific Fish Farming,(1):47.]
牛榮麗,唐健紅. 2012. 可口革囊星蟲抗疲勞作用的研究[J]. 食品工業科技,33(24):389-391. [Niu R L,Tang J H. 2012. Research of anti-fatigue effect of Phascolosoma esculenta[J]. Science and Technology of Food Industry,33(24):389-391.]
蘇偉,宋玉,母應春,李澤秀,黎以欒. 2017. 響應面法優化木瓜蛋白酶提取紅稗多糖工藝[J]. 食品工業科技,38(7):256-261. [Su W,Song Y,Mu Y C,Li Z X,Li Y L. 2017. Optimization of extraction of polysaccharides from Baccage sedge using papain by response surface metho-dology[J]. Science and Technology of Food Industry,38(7):256-261.]
田振華,李永斌,李穎,楚華航,郝麗麗,宿婷婷,張莉 . 2013. 牡蠣多糖制備工藝優化及體外抑菌活性的探討[J]. 食品研究與開發,34(17):23-26. [Tian Z H,Li Y B,Li Y,Chu H H,Hao L L,Su T T,Zhang L. 2013. Optimization of preparation technology and antimicrobial activity of polysaccharide extracts from Rushan Bay oyster(Crassos-trea gigas) in China[J]. Food Research and Development,34(17):23-26.]
王沖. 2005. 蚯蚓(Eisenia fetida)生態免疫系統研究Ⅰ——體壁屏障系統及協同防御機理[D]. 北京:中國農業大學. [Wang C. 2005. Research of ecology immunity system in the Eisenia fetidaⅠ—Antibiotic barrier system and mecha-nism of joint prevention[D]. Beijing:Ocean University of China.]
王芳芳. 2013. 鹽堿地生態養殖可口革囊星蟲試驗[J]. 科學養魚,(5):73-74. [Wang F F. 2013. A study on the ecological culture of the Phscolosoma esculenta in saline-alkali soil[J]. Scientific Fish Farming,(5):73-74.]
王帥. 2018. 北部灣革囊星蟲屬資源初探及遺傳多樣性分析[D]. 南寧:廣西大學. [Wang S. 2018. The preliminary study on the resources of Phascolosoma in Beibu Gulf and its genetic diversity[D]. Nanning:Guangxi University.]
吳雅清,姜宏瑛,劉接卿,馬國興,劉嘉,許瑞安. 2015. 星蟲動物的化學成分及藥理作用研究進展[J]. 中國海洋藥物,34(5):86-92. [Wu Y Q,Jiang H Y,Liu J Q,Ma G X,Liu J,Xu R A. 2015. Advances of chemical components and pharmacological properties of Sipuncula[J]. Chinese Journal of Marine Drugs,34(5):86-92.]
徐敏嫻,丁理法,周敏華. 2011. 可口革囊星蟲人工繁育及增養殖技術的研究[J]. 中國水產,(11):39-41. [Xu M X,Ding L F,Zhou M H. 2011. Studies on artificial propagation and breeding techniques of the Phscolosoma esculenta[J]. China Fisheries,(11):39-41.]
許翔,蔡懷依,袁爽,李勇勇,婁永江,寧夢華. 2018. 酶解法制備可口革囊星蟲抗菌物質的研究[J]. 中國抗生素雜志,43(4):471-475. [Xu X,Cai H Y,Yuan S,Li Y Y,Lou Y J,Ning M H. 2018. Research on enzymatic hydrolysis production of the antibacterial substances from Phasolosma esculenta[J]. Chinese Journal of Antibiotics,43(4):471-475.]
薛芳,顏瑞,王承明. 2008. 超聲輔助堿提取花生多糖的研究[J]. 食品科學,29(8):158-163. [Xue F,Yan R,Wang C M. 2008. Study on ultrasonic assisted alkali extraction of peanut polysaccharides[J]. Food Science,29(8):158-163.]
張瑞娟,柯莉娜,鄭靜,石艷,王勤. 2018. 鮑魚內臟多糖的提取、純化及其抗氧化和抑菌活性[J]. 廈門大學學報(自然科學版),57(1):58-64. [Zhang R J,Ke L N,Zheng J,Shi Y,Wang Q. 2018. Extraction,purification and antioxidant and antibacterial activity analysis of polysaccharides from abalone viscera[J]. Journal of Xiamen University(Natural Science),57(1):58-64.]
張雅利,梁花香,曹娜. 2008. 提取方法對柿多糖提取率及生物活性的影響[J]. 食品與生物技術學報,27(6):18-22. [Zhang Y L,Liang H X,Cao N. 2008. Effect of extraction method on yield and bioactivities of polysaccharide from persimmon fruit[J]. Journal of Food Science and Biotechnology,27(6):18-22.]
Alam M N,Bristi N J,Rafiquzzaman M. 2013. Review on in vivo and in vitro methods evaluation of antioxidant activity[J]. Saudi Pharmaceutical Journal,21(2):143-152.
Ballesteros L F,Cerqueira M A,Teixeira J A,Mussatto S I. 2015. Characterization of polysaccharides extracted from spent coffee grounds by alkali pretreatment[J]. Carbohydrate Polymers,127:347-354.
No H K,Park N Y,Lee S H,Meyers S P. 2002. Antibacterial activity of chitosans and chitosan oligomers with diffe-rent molecular weights[J]. International Journal of Food Microbiology,74(1-2):65-72.
Wang S P,Dong X F,Tong J M. 2013. Optimization of enzyme-assisted extraction of polysaccharides from alfalfa and its antioxidant activity[J]. International Journal of Bio-logical Macromolecules,62(11):387-396.
Zhang J,Jia S Y,Liu Y,Wu S H,Ran J Y. 2011. Optimization of enzyme-assisted extraction of the Lycium barbarum polysaccharides using response surface methodology[J]. Carbohydrate Polymers,86(2):1089-1092.
(責任編輯 羅 麗)

