外源2,4-表油菜素內酯(EBR)對弱光脅迫下黃心菜生長和碳水化合物代謝的影響
李蒙 范高領 張燕 劉松虎 張琰
摘要:【目的】探討葉面噴施2,4-表油菜素內酯(EBR)對弱光脅迫下黃心菜生長及碳水化合物代謝的影響,為設施黃心菜抗逆優質高效栽培提供參考依據。【方法】以塑料大棚內礱糠灰基質栽培的弱光敏感型黃心菜品種淮南F1為試驗材料,測定分析弱光[190.0~260.0 μmol/(m2·s)]脅迫下噴施EBR后黃心菜的生長指標、光合參數、內源激素含量和碳水化合物代謝指標等。【結果】弱光脅迫可顯著降低黃心菜植株的株高、根長、葉面積、根體積及鮮重和干重(P<0.05,下同),而葉面噴施EBR可有效緩解弱光脅迫對其生長的抑制作用。噴施EBR后,弱光脅迫黃心菜葉片的凈光合速率(Pn)、氣孔導度(Gs)和蒸騰速率(Tr)分別顯著增加47.4%、121.0%和77.3%,吲哚-3-乙酸(IAA)、玉米核苷(ZR)和赤霉素(GA3)含量分別顯著提高16.1%、13.6%和11.4%,蔗糖磷酸合成酶(SPS)和蔗糖合酶(SS)活性顯著提高,酸性轉化酶(AI)活性顯著降低,可溶性總糖和蔗糖含量顯著降低。【結論】葉面噴施EBR能調控弱光下黃心菜葉片內源激素的變化和碳水化合物代謝,有效緩解弱光脅迫對黃心菜生長的抑制作用,促進植株生長及增強植株抗性。
關鍵詞: 黃心菜;2,4-表油菜素內酯(EBR);弱光脅迫;生長指標;碳水化合物代謝
中圖分類號: S634.1 ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2019)05-1028-07
Abstract:【Objective】Effects of spraying 2,4-epibrassinolide(EBR) on growth and carbohydrate metabolism of Bra-ssica pekinensis Lour. Rupr. under weak light stress were studied in order to provide theoretical basis for the high quality cultivation of B. pekinensis in the facility under stress. 【Method】With weak-light sensitive B. pekinensis variety Huainan F1 as the tested material,an experiment was conducted to investigate the effects of exogenous EBR on the growth,photosynthesis,endogenous hormone concentration and carbohydrate metabolism in leaves of B. pekinensis under weak light stress[190.0-260.0 μmol/(m2·s)] by rice chaff ash substrates culture in plastic greenhouse. 【Result】The stress of weak light significantly reduced plant growth,plant height,root length,leaf area,root volume,fresh and dry weight(P<0.05,the same below). Spraying EBR on leaf alleviated the inhibition of weak light on growth of plant. EBR significantly increased net photosynthetic rate(Pn),stomatal conductance(Gs) and transpiration rate(Tr) by 47.4%,121.0% and 77.3%,respectively. The indole-3-acetic acid(IAA),corn nucleoside(ZR) and gibberellin(GA3) concentration were increased by 16.1%,13.6% and 11.4%,respectively. Furthermore,EBR significantly increased the activities of sucrose phosphate synthetase(SPS) and sucrose synthase(SS) and decreased the acid invertase(AI) activity in leaves of B. pekinensis,and thus resul-ting in the notable decreases in total soluble sugar and sucrose contents. 【Conclusion】Appropriate exogenous EBR can regulate the endogenous hormone concentration and carbohydrate metabolism in leaves of B. pekinensis under weak light,and therefore alleviate the inhibition of plant growth and enhance the plant growth and resistance of B. pekinensis plants.
Key words: Brassica pekinensis Lour. Rupr.; 2,4-epibrassinolide(EBR); weak light stress; growth indicator; carbohydrate metabolism
0 引言
【研究意義】黃心菜(Brassica pekinensis Lour. Rupr.)又名卷心菜、冬白菜,屬十字花科不結球白菜的一個變種,也是河南省信陽市本地的特色蔬菜,因外形美觀、產量高、富含人體必需的多種微量元素及口感好而受到全國各地消費者青睞。設施園藝可實現蔬菜、瓜果等高品質園藝產品的周年生產和均衡供應,推動現代農業科技發展,是現代農業生產中最具活力的產業之一(郭世榮等,2012)。但由于設施結構不合理、覆蓋材料污染和老化及冬春季節不良氣候等因素的影響,設施內經常產生弱光逆境,嚴重限制了設施作物的生產。已有研究表明,弱光脅迫下作物的生長和光合產物積累受到抑制,落花落果現象增加(王秀芹等,2004;李雅潔等,2018)。對弱光逆境的調控除進行耗能較大的補光外,少有其他較好的緩解措施。2,4-表油菜素內酯(EBR)是一種新型甾醇類植物激素,廣泛參與植物生理代謝過程,并能增強植物對多種非生物脅迫的抗逆能力(Divi and Krishna,2009;Ahammed et al.,2017)。因此,探討葉面噴施EBR對弱光脅迫下黃心菜生長及碳水化合物代謝的影響,對設施黃心菜抗逆優質高效栽培具有重要意義。【前人研究進展】尹博等(2012)研究認為,外源EBR可顯著降低銅脅迫下番茄葉片和根系的銅含量,促進養分平衡供給,維持番茄正常生長代謝。吳雪霞等(2013)研究發現,EBR可提高高溫脅迫下茄子幼苗的抗氧化酶活性、抗氧化劑含量及滲透調節物質含量,從而緩解高溫脅迫對茄子幼苗生長的抑制作用。李杰等(2015)研究表明,EBR可調節辣椒根系形態和提高根系抗氧化酶活性,增強植株抗低溫脅迫能力。石瑜等(2015)研究認為,EBR可提高網紋甜瓜植株的光合速率,促進碳水化合物從葉片向果實轉運。李蒙等(2015)研究發現,EBR可通過調節光合酶活性以提高番茄葉片的光合作用能力,促進番茄生長發育,提高產量和品質。閆慧萍等(2016)研究表明,一定濃度的EBR浸種可激活植物細胞合成自由基清除酶的能力,從而緩解鹽和低溫對玉米的脅迫傷害。張小貝等(2017)研究表明,EBR通過提高甘薯葉中抗氧化酶活性及滲透調節物質含量減少細胞膜損傷,從而增強甘薯抵抗低溫脅迫能力。【本研究切入點】目前,關于EBR促進植物生長及緩解低溫、干旱和鹽脅迫傷害的研究較多,但針對基質栽培條件下利用EBR提高弱光脅迫蔬菜作物抗性的研究鮮見報道,利用EBR提高弱光脅迫下蔬菜作物抗性的具體機制尚有待進一步探究。【擬解決的關鍵問題】在前期試驗的基礎上,分析基質栽培條件下外源EBR對弱光脅迫黃心菜幼苗生長、內源激素含量和碳水化合物代謝的影響,為冬春季節設施黃心菜育苗和抗逆栽培提供參考依據。
1 材料與方法
1. 1 試驗材料
試驗在河南省信陽農林學院塑料大棚內進行。試驗前篩選獲得最適宜黃心菜栽培的基質配方為礱糠灰∶草炭:蛭石體積比為6∶3∶1(容重0.23 g/cm,總孔隙65.3%,pH 7.53,電導度0.67 ms/cm),3種基質均購自河南省信陽上天梯恒源礦業有限公司;供試黃心菜品種為弱光敏感型淮南F1,購自安徽省淮南蔬菜研究中心;EBR購自美國Phytotech Labs公司。
黃心菜種子經消毒、浸種、催芽后,播于盛有石英砂的網盤中,幼苗前期澆清水,2葉1心后澆1/2 Hoagland營養液(pH 6.3±0.1,EC 2.2~2.5 ms/cm),待幼苗長至4葉1心時挑選長勢較好且一致的植株移至營養缽(規格為5 cm×8 cm×10 cm)中進行基質栽培,每個營養缽中種植3株幼苗。
1. 2 試驗方法
1. 2. 1 試驗設計 于移栽次日開始進行試驗處理,設自然光照+EBR(CB)、弱光脅迫(遮光率75%的遮陽網遮光)(LL)、弱光脅迫+EBR(LB)和自然光照(對照,CK)4個處理,每處理24株黃心菜,單株等位取樣,重復3次,計算平均值。試驗期間溫室內晝夜溫度為26~30 ℃/15~18 ℃,自然光照強度830~980 μmol/(m2·s),弱光處理的光照強度為190~260 μmol/(m2·s)。CB和LB處理于每天16:00在葉片正反面噴施0.1 mg/L EBR;CK和LL處理噴施等量去離子水。處理8 d后進行生長指標和生理生化指標測定。黃心菜品種、EBR濃度及弱光處理光照強度均根據前期試驗篩選確定。
1. 2. 2 測定項目及方法
1. 2. 2. 1 生長指標 每處理隨機取3株幼苗,去離子水洗凈后用直尺測量株高和根長;用電子秤測定植株鮮重;105 ℃殺青15 min、75 ℃烘干至恒重后測定植株干重。用葉面積/根系掃描儀測定黃心菜植株葉面積和根體積,葉面積為從基部數往上第3片真葉的面積。
1. 2. 2. 2 光合參數 選取各處理黃心菜從基部算起往上第3片完全展開功能葉,用Li-6400便攜式光合儀于上午10:00測定植株的凈光合速率(Pn)、氣孔導度(Gs)、胞間CO2濃度(Ci)和蒸騰速率(Tr)。測定時使用開放氣路,光量子通量密度(PPFD)為500 μmol/(m2·s),葉室溫度控制在(25±1)℃,CO2濃度為380±10 μmol/mol,相對濕度(RH)60%,每處理測定3株,取平均值。
1. 2. 2. 3 內源激素含量 選取各處理黃心菜從基部算起往上第3片完全展開功能葉,采用酶聯免疫(ELISA)法(鐘顯,2006)測定內源激素[吲哚-3-乙酸(IAA)、玉米核苷(ZR)、赤霉素(GA3)和脫落酸(ABA)]含量,酶聯免疫試劑盒由河南農業大學提供。
1. 2. 2. 4 碳水化合物含量及關鍵酶活性 選取各處理黃心菜從基部算起往上第3片完全展開功能葉烘干,研磨后稱取0.1 g,參照Yuan等(2015)的方法測定可溶性總糖、蔗糖和淀粉含量。蔗糖磷酸合成酶(SPS)、蔗糖合酶(SS)和酸性轉化酶(AI)活性分別采用由河南農業大學提供的SPS、SS、AI試劑盒進行測定。
1. 3 統計分析
試驗數據采用SAS 8.0進行統計分析,以Excel 2010制圖。
2 結果與分析
2. 1 外源EBR對弱光脅迫下黃心菜植株生長的影響
由表1可知,LL處理黃心菜植株的株高、葉面積、單株鮮重、干重、根長和根體積均顯著低于CK(P<0.05,下同),降幅分別為25.5%、38.1%、43.0%、61.7%、25.6%和37.4%;CB處理黃心菜植株的生長指標與CK無顯著差異(P>0.05,下同),但CB處理黃心菜的各項生長指標均顯著高于LL處理;與LL處理相比,LB處理植株的株高、葉面積、單株鮮重和干重分別顯著增加26.8%、33.2%、56.2%和148.8%,但與CK相比,LB處理植株的株高、葉面積、根長和根體積顯著降低。說明弱光脅迫會顯著抑制黃心菜生長,而葉面噴施EBR能有效緩解弱光脅迫對黃心菜植株生長的抑制作用,促進其幼苗生長。
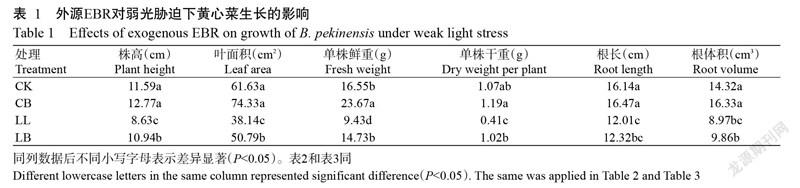
2. 2 外源EBR對弱光脅迫下黃心菜葉片光合參數的影響
從圖1可看出,CB處理黃心菜葉片的Pn、Gs、Ci和Tr分別為23.47 μmol/(m2·s)、0.43 mol/(m2·s)、116.67 μmol/mol和7.92 mmol/(m2·s),與CK相比均無顯著差異;LL處理葉片的Pn 、Gs和Tr分別為11.87 μmol/(m2·s)、 0.14 mol/(m2·s)和3.33 mmol/(m2·s),較CK顯著降低49.1%、69.1%和58.9%,而Ci為220.67 μmol/mol,較CK顯著升高79.1%;LL處理葉片的Pn、Gs和Tr均顯著低于CB處理,而Ci顯著高于CB處理;LB處理葉片的Pn 、Gs和Tr分別為17.4 μmol/(m2·s)、0.33 mol/(m2·s)和6.12 mmol/(m2·s),較LL處理顯著增加47.4%、121.0%和77.3%,但顯著低于CK,而Ci為180.67 μmol/mol,比LL處理降低18.1%。說明葉面噴施EBR能在一定程度上緩解弱光脅迫對黃心菜葉片光合作用的抑制作用。
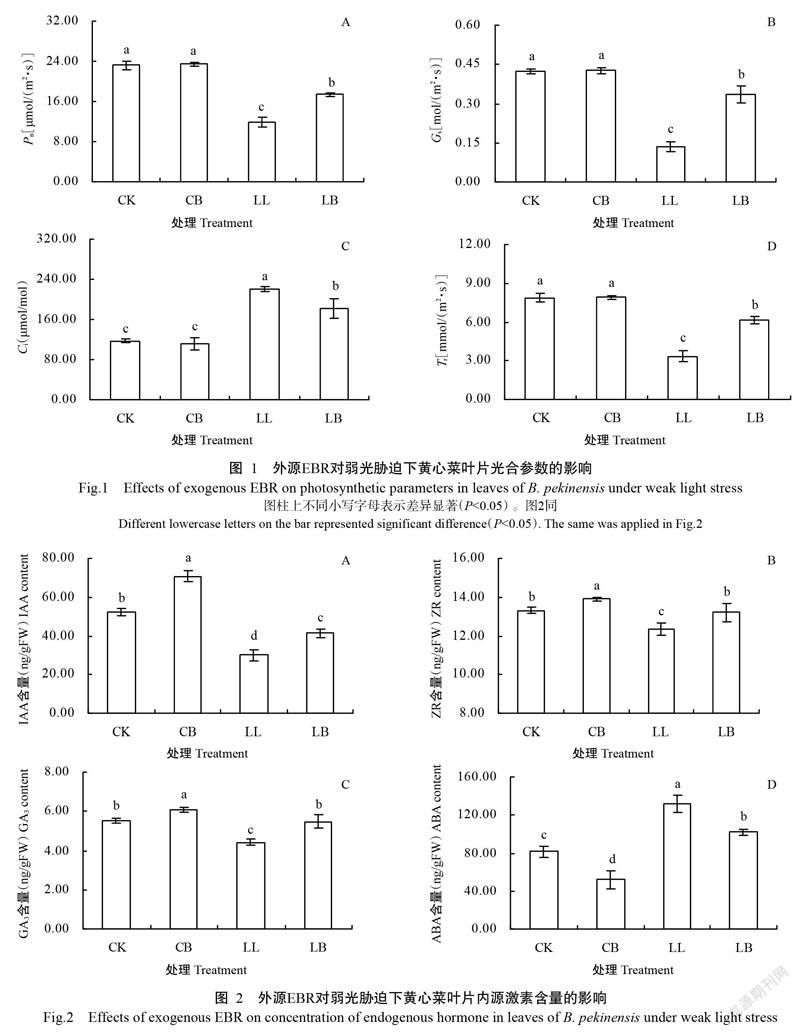
2. 3 外源EBR對弱光脅迫下黃心菜葉片內源激素含量的影響
從圖2可看出,CB處理黃心菜葉片的IAA、ZR和GA3含量分別為70.86、13.89和6.09 ng/gFW,顯著高于CK,ABA含量為51.97 ng/gFW,顯著低于CK;LL處理黃心菜葉片的IAA、ZR和GA3含量分別為30.05、12.32和4.43 ng/gFW,分別較CK顯著下降34.7%、9.2%和31.1%,而ABA含量為131.89 ng/gFW,比CK顯著升高63.1%;LL處理黃心菜葉片的IAA、ZR和GA3含量均顯著低于CB處理,而ABA含量顯著高于CB處理;LB處理黃心菜的IAA、ZR和GA3含量分別為41.33、13.21和5.48 ng/gFW,與LL處理相比分別顯著提高16.1%、13.6%和11.4%,而ABA含量為101.78 ng/gFW,比LL處理顯著降低24.7%。說明葉面噴施EBR能改變弱光脅迫下黃心菜植株葉片內源激素含量,從而調節其生理機能。
2. 4 外源EBR對弱光脅迫下黃心菜葉片碳水化合物代謝的影響
由表2可看出,CK與CB處理黃心菜葉片的碳水化合物含量及相關酶活性無顯著差異;LL處理黃心菜葉片的可溶性總糖含量、蔗糖含量和AI活性分別較CK顯著升高12.0%、62.9%和97.4%,而SS和SPS活性及淀粉含量分別顯著降低32.4%、44.3%和43.0%;CB處理黃心菜葉片的可溶性總糖、蔗糖含量和AI活性顯著低于LL處理,SS和SPS活性及淀粉含量則顯著高于LL處理;與LL處理相比,LB處理黃心菜葉片的可溶性總糖和蔗糖含量及AI活性顯著降低,淀粉含量及SPS和SS活性顯著提高。說明葉面噴施EBR可調控弱光脅迫下黃心菜葉片碳水化合物的代謝,從而維持黃心菜的正常生理機能。
2. 5 弱光脅迫下黃心菜生長指標與光合參數、內源激素含量及碳水化合物代謝指標的相關性
從表3可看出,黃心菜的主要生長指標與其葉片的光合特性和碳水化合物代謝水平存在不同程度的相關性。其中,葉面積和單株干重與Tr和淀粉含量呈顯著正相關,與Pn、Gs和SPS活性呈極顯著正相關(P<0.01,下同),與Ci、可溶性總糖含量、蔗糖含量和AI活性呈極顯著負相關;而各生長指標與內源激素含量無顯著相關性。說明弱光脅迫主要是通過改變黃心菜的光合特性和碳水化合物代謝過程影響植株的生物量積累。
3 討論
生物量是植物對脅迫響應的綜合體現,也是衡量脅迫耐性最可靠的指標之一(羅慶云等,2001)。本研究結果表明,弱光脅迫顯著降低黃心菜的株高、根長、干重和鮮重,而葉面噴施EBR能有效緩解弱光脅迫對黃心菜生長的抑制作用。
光照強度對植物光合作用具有顯著影響,光照較弱會引起植物Pn下降(Alyemeni and Al-Quwaiz,2016)。氣孔限制和非氣孔限制因素是導致光合作用下降的主要因素,當Gs與Ci同時下降則表明氣孔限制因素是光合作用能力下降的主要原因,否則非氣孔限制因素為引起光合作用能力下降的主要原因(付秋實等,2009)。本研究結果表明,弱光脅迫下黃心菜葉片的Pn和Gs顯著降低,而Ci顯著升高,說明非氣孔限制是引起黃心菜光合速率下降的主要因素;而噴施EBR可提高黃心菜植株的Gs,促進光系統Ⅱ在弱光脅迫下對CO2的吸收和利用,從而使植株的Pn增加。說明EBR可緩解弱光脅迫造成的非氣孔因素限制,使黃心菜維持較高的光合速率,與Ogweno等(2008)對番茄的研究結果一致。
IAA、GA3和ABA廣泛參與光合同化產物的運輸和分配過程(劉穎慧等,2006),ZR、IAA和GA3具有促進細胞分裂和擴大、促進側芽發育、延緩衰老等作用,這幾種激素含量通常被用作評價植物抗逆性的重要指標(周晏起和卜慶雁,2011)。在正常情況下,各種激素維持在一定的平衡狀態以保證植物正常新陳代謝和生長發育,一旦遭受外界不利環境脅迫,植物就會通過改變體內激素含量來調節自身的生理機能和生長節律。本研究結果表明,弱光脅迫下黃心菜葉片的ABA含量顯著高于CK,IAA、GA3和ZR含量顯著低于CK,這種變化是黃心菜幼苗增強抗逆性的一種適應性反應;而噴施EBR可使弱光脅迫黃心菜葉片的IAA、GA3和ZR含量提高,ABA含量顯著降低,從而使黃心菜葉片維持一定的氣孔開度,有利于提高黃心菜葉片在弱光條件下進行光合作用,積累較多干物質,進而提高植株抗性。
可溶性總糖、蔗糖和淀粉等碳水化合物是植物光合碳同化過程中形成的基礎代謝物質,在響應非生物脅迫和維持植物正常生理活動中發揮重要作用,其含量受SS、SPS和AI等關鍵酶活性的調節(陳麗芳等,2011)。本研究中,弱光脅迫下黃心菜葉片的可溶性總糖和蔗糖含量顯著升高,而淀粉含量顯著降低,是黃心菜植株對脅迫環境的應激響應,使弱光下光合同化產物總量減少而參與滲透調節作用的糖含量增加;而噴施EBR可使弱光脅迫黃心菜葉片的淀粉含量顯著升高,進一步證實了束勝等(2016)研究認為EBR處理下番茄植株的Pn提高及CO2固定能力增強的觀點;外源EBR可降低黃心菜葉片的SS和AI活性,減少蔗糖積累,促進弱光脅迫下碳水化合物的轉運和運輸,維持蔗糖含量穩定。可見,葉面噴施EBR可調節弱光脅迫條件下黃心菜葉片的相關酶活性,從而增強植株的抗性,與李寧等(2014)對番茄的研究結果一致。
4 結論
弱光脅迫下黃心菜葉片CO2同化受到抑制,引起植株光合效率降低,生長受到抑制。葉面噴施EBR能調節黃心菜葉片內源激素含量及碳水化合物代謝水平,緩解弱光脅迫造成的非氣孔限制因素,提高光合速率,促進植株生長及增強植株抗性。
參考文獻:
陳麗芳,陸巍,孫錦,郭世榮,張振興,陽燕娟. 2011. 外源亞精胺對鹽脅迫下黃瓜幼苗光合作用和根葉碳水化合物積累的影響[J]. 南京農業大學學報,34 (3):31-36. [Chen L F,Lu W,Sun J,Guo S R,Zhang Z X,Yang Y J. 2011. Effects of exogenous spermidine on photosynthesis and carbohydrate accumulation in roots and leaves of cucumber(Cucumis sativus L.) seedlings under salt stress[J]. Journal of Nanjing Agricultural University,34(3):31-36.]
付秋實,李紅嶺,崔健,趙冰,郭仰東. 2009. 水分脅迫對辣椒光合作用及相關生理特性的影響[J]. 中國農業科學,42(5):1859-1866. [Fu Q S,Li H L,Cui J,Zhao B,Guo Y D. 2009. Effects of water stress on photosynthesis and asso-ciated physiological characters of Capsicum annuum L.[J]. Scientia Agricultura Sinica,42(5):1859-1866.]
郭世榮,孫錦,束勝,李晶. 2012. 國外設施園藝發展概況、特點及趨勢分析[J]. 南京農業大學學報,35(5):43-52. [Guo S R,Sun J,Shu S,Li J. 2012. General situations,charactics and trends of protected horticulture in foreigns[J]. Journal of Nanjing Agricultural University,35(5):43-52.]
李杰,楊萍,頡建明,郁繼華. 2015. 2,4-表油菜素內酯對低溫脅迫下辣椒幼苗根系生長及抗氧化酶系統的影響[J]. 核農學報,29(5):1001-1008. [Li J,Yang P,Jie J M,Yu J H. 2015. Effects of 2,4-epibrassinolide on growth and antioxi-dant enzymes system in pepper roots under chilling stress[J]. Acta Agriculturae Nucleatae Sinica,29(5):1001-1008.]
李蒙,束勝,郭世榮,杜靜,王軍偉. 2015. 2,4-表油菜素內酯對櫻桃番茄光合特性和果實品質的影響[J]. 西北植物學報,35(1):138-145. [Li M,Shu S,Guo S R,Du J,Wang J W. 2015. Effect of 2,4-brassinolides on photosynthetic characteristics and fruit quality of cherry tomato[J]. Acta Botanica Boreali-Occidentalia Sinica,35(1):138-145.]
李寧,蘇曉瓊,孫錦,束勝,郭世榮. 2014. 外源2,4-表油菜素內酯對弱光脅迫下番茄葉片內源激素和碳水化合物代謝及果實的影響[J]. 南京農業大學學報,37(3):51-56. [Li N,Su X Q,Sun J,Shu S,Guo S R. 2014. Effects of exogenous 2,4-epibrassinolide on endogenous hormone,carbohydrate metabolism and fruits of tomato under weak light stress[J]. Journal of Nanjing Agricultural University,37(3):51-56.]
李雅潔,張其安,陸曉民. 2018. 不同外源物質對低溫弱光次生鹽漬化復合逆境下黃瓜幼苗生長、抗氧化系統及光合作用的影響[J]. 江蘇農業學報,34(2):404-410. [Li Y J,Zhang Q A,Lu X M. 2018. Effect of different exogenous substances on the growth,antioxidant system and photosynthesis of cucumber seedling under the adverse temperature,light,salt complex condition[J]. Jiangsu Journal of Agricultural Sciences,34(2):404-410.]
劉穎慧,賈海坤,高瓊. 2006. 植物同化物分配及其模型研究綜述[J]. 生態學報,26(6):1981-1992. [Liu Y H,Jia H K,Gao Q. 2006. Review on researches of photoassimilates partitioning and its models[J]. Acta Ecologica Sinica,26(6):1981-1992.]
羅慶云,於丙軍,劉友良. 2001. 大豆苗期耐鹽性鑒定指標的檢驗[J]. 大豆科學,20(3):177-182. [Luo Q Y,Yu B J,Liu Y L. 2001. Effect of NaCl on the growth,K+,Na+ and Cl- distribution in seedlings of 6 soybean cultivars(Glycine max L. Merrill)[J]. Soybean Science,20(3):177-182.]
石瑜,汪俏梅,葉紅霞,王翠,汪炳良. 2015. 2,4-表油菜素內酯對網紋甜瓜光合特性和果實品質的影響[J]. 核農學報,29(5):1009-1017. [Shi Y,Wang Q M,Ye H X,Wang C,Wang B L. 2015. 2,4-epibrassinolide’s effects on photosynthetic characteristics and fruit qualities of netted melon[J]. Acta Agriculturae Nucleatae Sinica,29(5):1009-1017.]
束勝,湯園園,羅佳音,孫錦,袁穎輝,鐘珉,郭世榮. 2016. 外源2,4-表油菜素內酯對亞低溫弱光脅迫下番茄葉片碳同化和抗氧化代謝的影響[J]. 植物生理學報,52(8):1295-1304. [Shu S,Tang Y Y,Luo J Y,Sun J,Yuan Y H,Zhong M,Guo S R. 2016. Effects of exogenous 2,4-epibrassinolide on carbon assimilation and antioxidant metabolism of tomato leaves under sub-weak temperatures and weak light stress[J]. Plant Physiology Communications,52(8):1295-1304.]
王秀芹,黃衛東,戰吉成. 2004. 水楊酸對弱光下‘大久保’桃果實庫強的影響[J]. 中國農學通報,20(3):169-178. [Wang X Q,Huang W D,Zhan J C. 2004. The effects of salicylic acid on the sink strength of fruits of ‘Da Jiu Bao’ peach[Prunus persica(L.) Batsch] under weak light intensity[J]. Chinese Agricultural Science Bulletin,20(3):169-178.]
吳雪霞,查丁石,朱宗文,許爽. 2013. 外源2,4-表油菜素內酯對高溫脅迫下茄子幼苗生長和抗氧化系統的影響[J]. 植物生理學報,49(9):929-934. [Wu X X,Zha D S,Zhu Z W,Xu S. 2013. Effects of exogenous 2,4-epibrassinolide on plant growth and antioxidant system in eggplant seedlings under high temperature stress[J]. Plant Physio-logy Journal,49(9):929-934.]
閆慧萍,彭云玲,趙小強,呂玉燕. 2016. 外源2,4-表油菜素內酯對逆境脅迫下玉米種子萌發和幼苗生長的影響[J]. 核農學報,30(5):988-996. [Yan H P,Peng Y L,Zhao X Q,Lü Y Y. 2016. Effect of exogenous 2,4-epibrassinolide on seed germination and seedling growth of maize under different stress[J]. Acta Agriculturae Nucleatae Sinica,30(5):988-996.]
尹博,王秀峰,姜春輝,李曉云,崔秀敏. 2012. 外源油菜素內酯對番茄銅脅迫的緩解效應[J]. 植物營養與肥料學報,18(1):162-168. [Yin B,Wang X F,Jiang C H,Li X Y,Cui X M. 2012. Exogenous EBR on alleviating copper stress in tomato seedlings[J]. Journal of Plant Nutrition and Fertilizers,18(1):162-168.]
張小貝,祝志欣,南文卓,孫言博,朱國鵬. 2017. 2,4-表油菜素內酯(EBR)對菜用甘薯抗寒生理生化的影響[J]. 安徽農業大學學報,44(3):525-529. [Zhang X B,Zhu Z X,Nan W Z,Sun Y B,Zhu G P. 2017. Effects of 2,4-epibrassinolide(EBR) on cold resistance-related physiological-biochemical indexes of vegetable sweet potato[J]. Journal of Anhui Agricultural University,44(3):525-529.]
張彥娟,姚建龍. 2003. 無土基質處理對大棚秋番茄生長與產量的影響[J]. 浙江農業科學,(5):7-9. [Zhang Y J,Yao J L. 2003. Effect of soilless substrate treatment on growth and yield of autumn tomato in greenhouse[J]. Zhejiang Agricultural Science,(5):7-9.]
鐘顯. 2006. 月季切花內源激素含量ELISA測定方法的建立[J]. 河南林業科技,26(2):6-9. [Zhong X. 2006. The determination method of enzyme-linked immunosorbent assays application on the endogenous hormone content of in cut rose[J]. Journal of Henan Forestry Science and Technology,26(2):6-9.]
周晏起,卜慶雁. 2011. 干旱脅迫下果樹內源激素變化規律研究進展[J]. 北方果樹,(3):1-4. [Zhou Y Q,Bu Q Y. 2011. Advances in research on endogenous hormone variations in fruit trees under drought stress[J]. Northern Fruit,(3):1-4.]
Ahmad H,Hayat S,Ali M,Ghani M L,Cheng Z H. 2017. Regulation of growth and physiological traits of cucumber(Cucumis sativus L.) through various levels of 28-Homobrassinolide under salt stress conditions[J]. Canadian Journal of Plant Science,98(1):132-140.
Alyemeni M N,Al-Quwaiz S M. 2016. Effect of 28-homobrassinolide on the performance of sensitive and resistant varieties of Vigna radiata[J]. Saudi Journal of Biological Sciences,23(6):698-705.
Divi U K,Krishna P. 2009. Brassinosteroid:A biotechnological target for enhancing crop yield and stress tolerance[J]. New Biotechnol,26(3-4):131-136.
Ogweno J O,Song X S,Shi K,Hu W H,Mao W H,Zhou Y H,Yu J Q. 2008. Brassinosteroids alleviate heat-induced inhibition of photosynthesis by increasing carboxylation efficiency and enhancing antioxidant systems in Lycopersicon esculentum[J]. Journal of Plant Growth Regulation,27(1):49-57.
Yuan Y H,Zhong M,Shu S,Sun J,Guo S R. 2015. Effects of exogenous putrescine on leaf anatomy and carbohydrate metabolism in cucumber(Cucumis sativus L.) under salt stress[J]. Journal of Plant Growth Regulation,34(3):451-464.
(責任編輯 思利華)

