玉米小斑病抗病鑒定接種體培養技術探討
蒙成 梁慶平 黃艷花 吳地 蔣益敏 吳烈


摘要:【目的】研究不同谷物粒培養基配方及其培養條件對玉米小斑病菌產孢量的影響,為玉米小斑病大面積抗病鑒定工作提供保障。【方法】以玉米小斑病菌野生型菌株HX5為試材,探索18種植物組織培養基、9個溫度梯度、9個培養時間段、7種高低溫誘導和5種不同光照等條件對玉米小斑病菌分生孢子產量的影響。【結果】培養基的成分組合對玉米小斑病菌分生孢子產生起決定性作用,配方為高粱粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g的7號培養基產孢量最多,為16.8×104 個/g;24 ℃條件下培養產孢量最多;在20和24 ℃黑暗條件下,培養35 d時的產孢量最多;35 ℃高溫、4 ℃低溫誘導對玉米小斑病菌產孢量均有一定的促進作用,但經高、低溫誘導后產生的部分分生孢子一端連接1節分生孢子梗;光暗交替各12 h、光照強度為2000 lx的產孢量最多,為4.6×105個/g。【結論】高粱粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g為玉米小斑病菌產孢最佳培養基,該培養基可顯著促進病菌產生分生孢子;在24 ℃、光照強度2000 lx光暗交替各12 h的培養條件下,病菌的產孢量最多;在35 d內培養病菌,培養時間與產孢量成正比;35 ℃高溫和4 ℃低溫誘導對產孢量均有一定的促進作用。
關鍵詞: 玉米;小斑病菌;接種體;產孢技術
中圖分類號: S432.4 ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2019)05-1001-06
Abstract:【Objective】The aim was to investigate the effects of different grain medium formulations and culture conditions on sporulation of Bipolaria maydis, and provide a guarantee for large-scale identification of resistance to southern corn leaf blight. 【Method】The effects of eighteen plant tissue-based media, nine temperature gradients, nine culture times, seven high and lowtemperature inductions and five different light intensities on conidium formation of wild-type strain HX5 of B. maydis were studied. 【Result】Component combinations of media played a decisive role in conidium formation. Medium No.7 containing 100 g sorghum grains + 15 g corn leaves + 0.2 g MgSO4 + 0.2 g Na3PO4 showed the highest sporulation(16.8×104 spore/g). Under 24 ℃, the sporulation was the highest. Under darkness at 20 and 24 ℃, sporulation reached the peak on day 35. Induction at 35 and 4 ℃ promoted sporulation of B. maydis to a certain extent. However, after high and lowtemperature induction, one end of partial formed conidia connected to a conidial peduncle. Under light-dark 12 h alternation and light intensity of 2000 lx, sporulation was the highest(4.6×105 spore/g). 【Conclusion】The optimal medium for sporulation of B. maydis is 100 g sorghum grains+15 g corn leaves+0.2 g MgSO4+0.2 g Na3PO4, which can significantly promote the conidium formation of B. maydis. Under 24 ℃, light intensity of 2000 lx and light-dark 12 h alternation, the sporulation is the highest. Within 35 d, the culture time is proportional to sporulation. Induction at 35 and 4 ℃ promote sporulation of B. maydis to a certain extent.
Key words: corn; Bipolaria maydis; inoculums; sporulation technology
0 引言
【研究意義】玉米小斑病(Southern corn leaf blight,SCLB)是世界玉米主產區的重要病害(陳利峰,2002),是我國溫暖潮濕玉米產區的主要葉部病害(趙聚瑩等,2010),在玉米全生育期均可發生,發病高峰期在植株抽雄后。自20世紀60年代以來,隨著我國感病玉米雜交品種的推廣應用,玉米小斑病危害日趨嚴重,感病品種在一般發病年份可減產10%以上,嚴重發生年份減產20%~30%(龔現麗,2010)。因此,選育抗病自交系和雜交種是防治玉米小斑病最經濟有效的措施(李洪連和徐敬友,2001;董懷玉等,2005;艾堂順等,2018)。在選育與利用抗病品種過程中,開展玉米小斑病抗病性鑒定是常規工作,其常用方法是將培養好的帶菌接種體植入玉米喇叭口中或用病菌孢子懸浮液對玉米植株進行噴霧。因此,進行大田抗病性鑒定接種需要大量的接種體,而獲得帶大量分生孢子的接種體或獲得大量分生孢子是順利開展玉米小斑病抗病性接種鑒定的基礎條件。【前人研究進展】在不同營養及培養環境條件下,病菌分生孢子產孢效果存在明顯差異。陳穎等(2003)采用燕麥、玉米、查理、彼查、PDA及PDA+宿主葉片、PDA+VB1等7種固體培養基培養玉米小斑病菌C小種,結果表明,PDA+VB1和PDA+宿主葉片2種培養基培養的菌株,其菌絲生長速度、產孢量和致病力均顯著高于其他培養基。謝紅輝(2010)研究不同培養溫度、不同培養pH和不同營養條件對玉米小斑病病菌菌絲生長量及產孢量的影響,結果表明,以PDA+VB1為固體培養基培養的菌絲生長速率及產孢量最大,在30 ℃下培養菌絲生長速率快且產孢量大,在25 ℃下培養病菌孢子萌發速度最快,病菌菌絲在pH為8的條件下生長速度最快且生長量最大。楊麗敏(2012)采用不同保存方法測定玉米小斑病菌產孢量、菌絲生長速度及對菌株致病力的影響,結果表明,保存玉米小斑病菌菌株時,用大麥作固體培養基,濕度為10%左右,置于5 ℃冰箱短時間(1個月)或長時間(7個月)保存,菌絲生長速度和產孢量最佳,均優于玉米培養基和小麥培養基,且菌株致病力得到較好地保持。代玉立等(2016)以福建省建甌、沙縣和福州地區的3株玉米小斑病菌菌株為對象,研究溫度、濕度、pH、光照、營養對病菌菌絲生長、產孢量和孢子萌發的影響,結果表明,菌絲生長最適溫度和pH為30 ℃和pH 6、產孢最適溫度和pH為25 ℃和pH 6~7、孢子萌發最適溫度和pH為25~28 ℃和pH 6,光照能顯著抑制病菌產孢,在相對濕度為85%和95%條件下或在水瓊脂培養基表面上,孢子萌發率分別為50%、88%和90%;葡萄糖、乳糖、甘露醇、可溶性淀粉適宜病菌菌絲生長和產孢,而尿素、硫酸銨、硝酸銨和氯化銨能顯著抑制菌絲生長、產孢和孢子萌發;菌絲體的致死溫度為65 ℃ 10 min或60 ℃ 30 min,分生孢子的致死溫度為60 ℃ 10 min或55 ℃ 30 min;3株菌株的產孢特性、菌絲致死溫度和致病力均存在明顯差異。以高粱粒為主料配制成的固體培養基是目前玉米小斑病菌繁殖常用的培養基(王曉鳴等,2010)。馮勝澤等(2017)用高粱粒外的其他固體培養基進行病菌產孢試驗,結果發現產孢量最大的培養條件為玉米葉葡萄糖瓊脂培養基,碳源為乳糖,培養溫度25 ℃、pH 8、光照強度6000 lx、光照條件光暗交替各12 h;此外,發現在培養基中添加 KNO3可顯著提高產孢量。楊秀娟等(2018)發明“一種玉米小斑病菌產孢培養基及其制備方法和應用”專利,該方法利用馬鈴薯、甘露醇、瓊脂粉和水為固體培養基進行產孢試驗,其病菌產孢量是等量PDA培養基產孢量的1.2~3.6倍。【本研究切入點】前人開展玉米小斑病接種鑒定時,接種體繁殖通常采用固體培養基進行培養,操作過程繁瑣,不能直接用帶病菌的接種體進行接種;同時,開展大面積抗病性鑒定時工作量大,操作過程制備的接種體通常存在污染率高、滋長小昆蟲、制備慢且產孢效果不理想等缺點。目前,利用谷物粒培養基培養玉米小斑病菌及產孢因素的研究報道較少。【擬解決的關鍵問題】以高粱粒、小麥粒和玉米粒為主要材料,以玉米葉、甘露醇(C6H14O6)、碳酸鉀(K2CO2)、硫酸鎂(MgSO4)和磷酸鈉(Na3PO4)等為配料,單因素組配18種培養基為供試培養基,同時對培養時間、溫度、光照、高低溫誘導等影響玉米小斑病菌產孢因素進行探討,明確影響玉米小斑病菌產孢最佳谷物粒培養基配方及其培養方法,為玉米小斑病抗病性鑒定工作的簡化性、時效性、準確性提供保障。
1 材料與方法
1. 1 試驗材料
1. 1. 1 供試菌株 玉米小斑病菌野生型菌株HX5采集于廣西農業職業技術學院作物研究所玉米試驗地感病病株并分離獲得,采用常規方法進行病原菌分離與培養,用單細胞進行純化,參照柯赫氏法則進行病菌驗證,最終獲得純化菌株(方中達,1998)。
1. 1. 2 供試培養基 以玉米粒、小麥粒和高粱粒為主料,以玉米葉、C6H14O6、K2CO2、MgSO4、Na3PO4等為配料,單因素組配18種培養基為供試培養基(表1)。制作方法步驟:(1)挑選大小一致、無病蟲的玉米粒、小麥粒和高粱粒。(2)玉米粒浸泡12~15 h,大火煮沸溫火熬制1 h,水洗瀝干備用;小麥粒浸泡20 min,大火煮沸再溫火煮15 min,水洗瀝干備用;高粱粒大火煮沸再溫火煮25 min,水洗瀝干備用;新鮮玉米葉切成約1 cm2大小備用。(3)按配方稱取原料并混勻,濕度以培養基濕潤手握無滴水為度。(4)用300 mL三角瓶分裝配好的培養基,每瓶定量分裝100 g。(5)將制作好的培養瓶121 Pa高壓滅菌45 min。
1. 2 不同培養條件對產孢量的影響
1. 2. 1 培養基對產孢量的影響 供試培養基為單因素組配的18種培養基,每種培養基配方為一個處理,3次重復。供試菌種在培養皿(直徑9 cm)中的馬鈴薯葡萄糖瓊脂培養基(PDA)上繁殖,待菌絲長滿培養皿后,用鑷子把帶菌絲的培養基割成小粒,每皿菌種平均分別接種到2份供試培養基上(下同)。接種并搖均后的培養瓶置于全黑暗、24 ℃恒溫人工氣候箱中培養11 d,測定產孢量。
1. 2. 2 培養溫度對產孢量的影響 供試培養基為7號培養基(高粱粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g),設9個溫度梯度(12、16、20、24、26、28、32、36和40 ℃),黑暗培養11 d(劉靜等,2014),3次重復。設A、B兩個因素:A因素為接種后帶培養基瓶直接分別放入各溫度培養11 d后測定產孢量;B因素為接種后帶培養基瓶放入26 ℃全黑暗下培養5 d,菌絲長滿培養基后轉入各溫度中繼續培養,6 d后測定產孢量。
1. 2. 3 培養時間對產孢量的影響 供試培養基為7號培養基,接種處理后的培養瓶分別置于20和24 ℃黑暗條件培養箱中培養,依次于第5、7、9、11、15、20、25、30和35 d 9個培養時間段測定產孢量,3次重復。
1. 2. 4 高、低溫誘導對產孢量的影響 供試培養基為7號培養基,把接種后的培養基瓶放入26 ℃全黑暗下培養5 d,菌絲長滿培養基后轉入各高、低溫進行誘導處理,處理結束后置于24 ℃黑暗條件,誘導時間加繼續培養共11 d,測定產孢量。設7個處理:4 ℃ 12 h、4 ℃ 24 h、4 ℃ 48 h、35 ℃ 12 h、35 ℃ 24 h、35 ℃ 48 h和對照(26 ℃全黑暗下培養5 d后直接轉入24 ℃黑暗培養6 d)(張立杰等,2015),3次重復。
1. 2. 5 光照對產孢量的影響 供試培養基為7號培養基,設5種不同光照處理,分別為:24 h光照(光照強度3000 lx)、12 h光照(3種不同光照強度梯度1500、2000和3000 lx )12 h黑暗和24 h黑暗,病菌在不同光照處理下24 ℃恒溫培養11 d(馮勝澤等,2017)。
1. 3 產孢量測定方法
各處理隨機取帶病菌接種體2 g,置于50 mL的燒杯中,加無菌水10 mL,為確保帶病菌接種體所產生的分生孢子脫落水里,用堅固勺子連續攪拌約100次,紗布過濾即得到玉米小斑病菌孢子懸浮液,用血球計數法測定孢子懸浮液濃度,計算產孢量,每個培養瓶取樣3次,每個樣本讀數3次,取平均值進行比較。
1. 4 統計分析
試驗數據用Excel 2007和DPS 7.55進行整理與分析。
2 結果與分析
2. 1 培養基對玉米小斑病菌產孢量的影響
由圖1可知,除17、16和5號培養基產胞量低于1號培養基(CK)外,其余培養基的產胞量均顯著高于CK(P<0.05,下同),其中,7號培養基(高粱粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g)的產孢量最多,為16.8×104個/g;9號培養基(玉米粒100 g+玉米葉15 g+MgSO4 0.2 g+ Na3PO4 0.2 g)次之,產孢量為10.8×104個/g;其后依次為13、11、14、2、6、3、4、8、15、18、12和10號培養基;常用高粱粒培養基(CK)的產孢量為6.8×103個/g,17號培養基的產孢量與CK相當,差異不顯著(P>0.05,下同),而16和5號培養基的產孢量顯著少于CK,分別為2.2×103和5.4×102個/g。可見,玉米小斑病菌在7號培養基上培養產孢量最多。
2. 2 培養溫度對玉米小斑病菌產孢量的影響
由圖2可知,不同培養溫度對玉米小斑病菌產孢量具有明顯影響,過高或過低均不利于玉米小斑病菌分生孢子的產生,其中,A因素多集中于20~26 ℃產孢,24 ℃時產孢量最多,且顯著多于其他溫度處理,≤12 ℃或≥32 ℃均不產孢;B因素在溫度為12~40 ℃下均可產生分生孢子,26 ℃時產孢量顯著高于其他溫度處理,24 ℃時的產孢量次之。可見,玉米小斑病菌分生孢子產生的最適宜溫度為24 ℃,最佳方法是將接種后的培養瓶直接置于24 ℃下培養。
2. 3 培養時間對玉米小斑病菌產孢量的影響
從圖3可看出,培養時間對玉米小斑病菌產孢具有明顯影響。玉米小斑病菌在20 ℃黑暗條件下培養11 d開始產孢,在11~35 d內,產孢量隨培養時間的延長而顯著增加;在24 ℃黑暗條件培養9 d開始產孢,在9~35 d內,產孢量隨培養時間的延長而顯著增加。可見,在20和24 ℃黑暗條件下培養,培養時間與產孢量成正比,該病菌連續培養35 d產孢量最多。
2. 4 高、低溫誘導對玉米小斑病菌產孢量的影響
由圖4可知,4 ℃冷凍24 h處理的產孢量顯著高于其他處理,為4.2×105個/g;35 ℃熱激24 h處理的效果次之,產孢量為3.5×105個/g;35 ℃熱激48 h和4 ℃冷凍12 h處理的產孢量與35 ℃熱激24 h處理的產孢量相當,差異不顯著;4 ℃冷凍48 h和35 ℃熱激12 h處理的產孢量與對照差異不顯著。試驗還發現,經高、低溫誘導后產生的部分分生孢子一端有連接1節分生孢子梗現象。
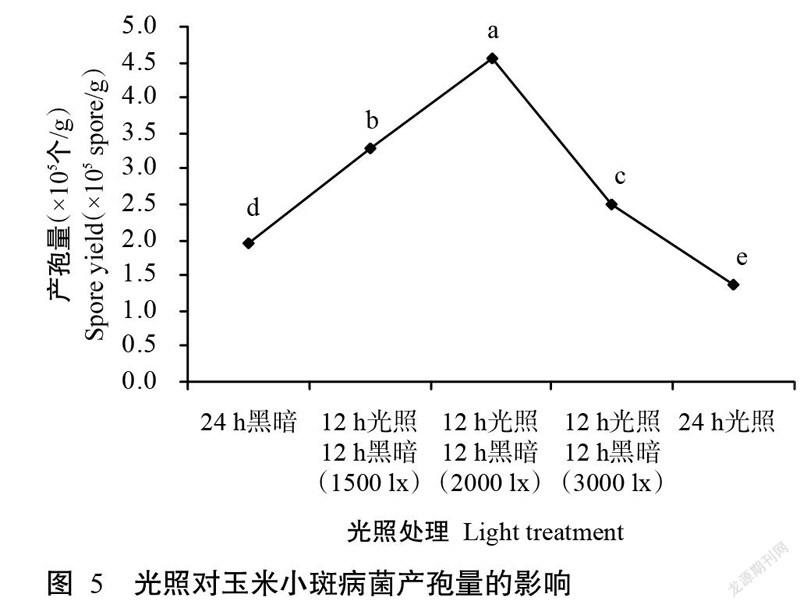
2. 5 光照對玉米小斑病菌產孢量的影響
從圖5可看出,適量光照對玉米小斑病菌產孢具有促進作用,過暗或過亮均不利于該病菌產孢。其中,高強度光照即連續24 h光照最不利于產孢,產孢量僅為1.4×105個/g;連續24 h黑暗亦不利于產孢,產孢量為1.9×105個/g;12 h光照(光照強度2000 lx)12 h黑暗條件下的產孢量最多,為4.6×105個/g;12 h光照(光照強度1500 lx)12 h黑暗條件下的產孢量次之,為3.3×105個/g;12 h光照(光照強度3000 lx)12 h黑暗條件會抑制病菌分生孢子產孢,產孢量為2.5×105個/g。
3 討論
方中達(1998)認為培養基是影響病菌產孢的最重要因素,促進分生孢子產生的最主要途徑是采用不同培養基或改變培養基成分;劉麗麗等(2014)認為培養基不同會明顯影響多數茄鏈格孢產孢量。為此,前人開展了大量有關培養基促進產孢量的研究工作。莊義慶等(2008)研究表明,促進蕉斑鐮刀菌液體搖瓶產孢的最佳培養液為綠豆湯培養液,該培養液在適宜條件下的產孢量達1×106個/mL;趙紅等(2012)研究發現,蘋果腐爛病菌在加蜂蜜水和蛋白胨的帶殼大麥上能大量產孢;蘭成忠等(2013)認為胡蘿卜培養基是促進辣椒疫霉菌產生孢子囊數量最多的培養基。本研究通過18種不同配方的谷物粒培養基對玉米小斑病菌進行產孢誘導篩選,結果表明,產孢量最多的培養基是配方為高粱粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g的7號培養基,產孢量為16.8×104個/g,其次是配方為玉米粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g的9號培養基,產孢量為10.8×104 個/g,說明7和9號培養基配方適宜玉米小斑病菌產孢。王曉梅等(2007)研究表明,玉米小斑病菌產孢適宜溫度為20~30 ℃,最適溫度為26 ℃,5 ℃以下或35 ℃以上均不能產孢;代玉立等(2016)研究表明,玉米小斑病菌產孢最適溫度為25 ℃。本研究發現,在12 ℃以下或32 ℃以上時玉米小斑病病原菌菌絲體生長緩慢,不能產孢;16~28 ℃時病原菌菌絲生長速度快,能產孢;20~26 ℃時病原菌產孢量迅速增加,24 ℃下產孢量最多;長菌絲后的培養基轉入各溫度中進行繼續培養均可產孢,26 ℃產孢量最高,24 ℃次之。說明玉米小斑病菌的菌絲生長溫度條件高于分生孢子產生的條件,菌絲一但生成,在較高和較低溫度條件下均能產生分生孢子,可能是玉米小斑病菌能在全世界玉米產區發生的重要原因。
本研究發現,培養時間對玉米小斑病菌產孢量具有明顯影響,在7號培養基上,病菌在20和24 ℃黑暗條件下的產孢量與培養時間成正比,該病菌連續培養35 d時產孢量最多。玉米小斑病菌在其余配方的培養基上培養,培養時間與產孢量是否也成正比尚有待進一步研究。此外,本研究發現培養35 d后容易滋生雜菌,因此未繼續培養。這是否與培養時間過長或生長環境等因素有關,尚有待進一步探究。
本研究發現35 ℃高溫和4 ℃低溫誘導對玉米小斑病菌產孢量均有一定的促進作用,但經過高、低溫誘導后產生的部分分生孢子一端連接1節分生孢子梗,對分生孢子的活性是否產生影響也有待進一步探究。此外,適量光照對玉米小斑病菌產孢具有促進作用,過暗或過亮均不利于該病菌產孢。7號培養基在12 h光照12 h黑暗交替且光照強度為2000 lx時的產孢量最多,與前人研究認為光照能顯著抑制病菌產孢的結果(陳利峰,2002)存在差異,需進一步通過試驗驗證。
4 結論
玉米小斑病菌產孢的最佳組織培養基配方為高粱粒100 g+玉米葉15 g+MgSO4 0.2 g+Na3PO4 0.2 g,該培養基可顯著促進病菌產生分生孢子;該培養基在24 ℃、光照強度2000 lx光暗交替各12 h時產孢量最多;在35 d內培養病菌,培養時間與產孢量成正比;35 ℃高溫、4 ℃低溫誘導對病菌產孢量均有一定的促進作用,但誘導后產生的部分分生孢子形態發生改變。
參考文獻:
艾堂順 ,田志強,李會敏,鄧策,丁俊強,張學林,劉海富,朱偉嶺,李志敏. 2018. 玉米南方銹病抗病QTL鑒定和效應分析[J]. 河南農業大學學報,52(4):514-518. [Ai T S,Tian Z Q,Li H M,Deng C, Ding J Q,Zhang X L,Liu H F,Zhu W L,Li Z M. 2018. Mapping and effectiveness analysis for resistance genes of southern corn rust in maize[J]. Journal of Henan Agricultural University,52(4):514-518.]
陳利峰. 2002. 農業植物病理學[M]. 北京:中國農業出版社:189. [Chen L F. 2002. Agricultural Phytopathology[M]. Beijing: China Agriculture Industry Press:189.]
陳穎,郝麗梅,王立安. 2003. 不同培養基對玉米小斑病菌生長繁殖及致病力的影響[J]. 河北師范大學學報(自然科學版),27(2):192-194. [Chen Y,Hao L M,Wang L A. 2003. Effects of different media on the growth reproduction
and pathogenicity of Bipolaris maydis race C[J]. Journal of
Hebei Normal University(Natural Science Edition),27(2):
192-194.]
代玉立,甘林,阮宏椿,廖蕾,石妞妞,杜宜新,陳福如,楊秀娟. 2016. 福建省玉米小斑病菌的生物學特性研究[J]. 中國農學通報,32(31):131-137. [Dai Y L,Gan L,Ruan H C,Liao L,Shi N N,Du Y X,Chen F R,Yang X J. 2016. Biological characteristics of Bipolaris maydis in Fujian Province[J]. Chinese Agricultural Science Bulletin,32(31):131-137.]
董懷玉,姜鈺,王麗娟,徐秀德. 2005. 玉米種質資源抗灰斑病鑒定與評價[J]. 植物遺傳資源學報,6(4):441-443. [Dong H Y,Jiang Y,Wang L J,Xu X D. 2005. Evaluation on maize germplasm resources for resistanceto gray leaf spot[J]. Journal on Plant Genetic Resources,6(4):441-443.]
方中達. 1998. 植病研究法[M]. 第3版. 北京:中國農業出版社. [Fang Z D. 1998. Plant Disease Study[M]. The 3rd Edition. Beijing: China Agriculture Press.]
馮勝澤,劉星晨,王海祥,趙潔,趙立卿,鄭亞男,鞏校東,韓建民,谷守芹,董金皋. 2017. 玉米大斑病菌分生孢子形成的影響因素及GATA轉錄因子家族的表達分析[J]. 中國農業科學,50(7):1234-1241. [Feng S Z,Liu X C,Wang H X,Zhao J,Zhao L Q,Zheng Y N,Gong X D,Han J M,Gu S Q,Dong J G. 2017. Influencing factors of conidiospore and expression analysis of GATA transcription factor gene family in Setosphaeria turcica[J]. Scientia Agricultura Sinica,50(7):1234-1241.]
龔現麗. 2010. 夏玉米小斑病的發生與防治[J]. 河南農業,(17):19. [Gong X L. 2010. Occurrence and prevention of small spot disease in summer maize[J]. Agriculture of Henan,(17):19.]
蘭成忠,劉裴清,李本金,陳慶河,翁啟勇. 2013. 辣椒疫霉菌產孢培養基及誘導方法篩選[J]. 熱帶作物學報,34(9):1776-1780. [Lan C Z,Liu P Q,Li B J,Chen Q H,Weng Q Y. 2013. Screening of medium and induction method for sporangia production of Phytophthora capsici[J]. Chinese Journal of Tropical Crops,34(9):1776-1780.]
李洪連,徐敬友. 2001. 農業植物病理學實驗實習指導[M]. 北京: 中國農業出版社. [Li H L,Xu J Y. 2001. Agricultural Plant Pathology Experiment Practice Guidance[M]. Beijing: China Agriculture Press.]
劉靜,李國華,周明,許麗月,肖春云. 2014. 橡膠樹白粉菌分生孢子萌發條件及存活時間的研究[J]. 西南農業學報,27(1):151-155. [Lui J,Li G H,Zhou M,Xu L Y,Xiao C Y. 2014. Study on conditions of conidial germination and survival time of Oidium heveae[J]. Southwest China Jour-nal of Agricultural Sciences,27(1):151-155.]
劉麗麗,朱杰華,崔亞婧,楊志輝,徐進,路文雅. 2014. 培養條件對茄鏈格孢產孢的影響[J]. 菌物學報,33(3): 659-667. [Lui L L,Zhu J H,Cui Y J,Yang Z H,Xu J,Lu W Y. 2014. Effects of culture conditions on sporulation of Alternorio soloni[J]. Mycosystema,33(3): 659-667.]
王曉梅,呂平香,李莉莉,見德寶,楊信東. 2007. 玉米小斑病重要流行環節的初步定量研究Ⅱ病斑產孢、孢子飛散、殺菌劑篩選[J]. 吉林農業大學學報,29(2):128-132. [Wang X M,Lü P X,Li L L,Jian D B,Yang X D. 2007. ?Preliminary quantitative studies on important epidemic links of
Bipolaris maydis Ⅱ. lesion spomlation,spore dispersion
and fungicide screening[J]. Journal of Jilin Agricultural U-
niversity,29(2):128-132.]
王曉鳴,石潔,晉齊鳴,李曉,孫世賢. 2010. 玉米病蟲害田間手冊:病蟲害鑒別與抗性鑒定[M]. 北京:中國農業科技出版社. [Wang X M,Shi J,Jin Q M,Li X,Sun S X. 2010. Field Manual of Maize Diseases and Insect Pests: Identification of Pests and Diseases and Identification of Resistance[M]. Beijing: China Agricultural Science and Technology Press.]
謝紅輝. 2010. 玉米小斑病菌生物學特性研究[J]. 廣西熱帶農業,(6):1-4. [Xie H H. 2010. Study on the biological cha-racteristics of Bipolaris maydis[J]. Guangxi Tropical Agriculture,(6):1-4.]
楊麗敏. 2012. 影響玉米小斑病抗性鑒定的因子分析及病菌生物學特性研究[D]. 合肥:安微農業大學. [Yang L M. 2012. Impact factor of resistance identification to slb and the biological characteristics of pathogenic fungi[D]. Hefei:Anhui Agricultural University.]
楊秀娟,陳福如,甘林,阮宏椿,杜宜新,石妞妞. 2018. 一種玉米小斑病菌產孢培養基及其制備方法和應用:中國,104962510B[P]. 2018-04-24. [Yang X J,Chen F R,Gan L,Ruan H C,Du Y X,Shi N N. 2018. The invention relates to a spore-producing culture medium of corn-spot bacteria and its preparation method and application:China,104962510B[P]. 2018-04-24.]
張立杰,張慧玲,哈礦武,王建設. 2015. 甜瓜蔓枯病病原菌分離與分生孢子的產孢誘導[J]. 寧夏大學學報(自然科學版),36(4):382-385. [Zhang L J,Zhang H L,Ha K W,Wang J S. 2015. Isolation and identification of pathogen of didymellabryoniae and spore production induction of condium[J]. Journal of Ningxia University(Natural Science Edition),36(4):382-385.]
趙紅,王彩霞,陳曉忍,王海艷,李保華. 2012. 蘋果腐爛病菌誘導產孢方法[J]. 中國農學通報,28(10): 151-154.[Zhao H,Wang C X,Chen X R,Wang H Y,Li B H. 2012. Methods of promoting sporulation of Valsa ceratosperma[J]. Chinese Agricultural Science Bulletin,28(10):151-154.]
趙聚瑩,屈振剛,賈海民,陳丹,李術臣. 2010. 不同玉米品種對小斑病強致病力菌的抗病性檢測[J]. 河北農業科學,14(9):66-67. [Zhao J Y,Qu Z G,Jia H M,Chen D,Li S C. 2010. Detection of resistance of maize varieties to virulent strain of southern leaf blight[J]. Journal of Hebei Agricultural Sciences,14(9):66-67.]
莊義慶,喬廣行,王源超,何東兵,鄭小波. 2008. 蕉斑鐮刀菌3-26菌株產孢條件研究[J]. 南京農業大學學報,31(4):77-81. [Zhuang Y Q,Qiao G X,Wang Y C,He D B,Zheng X B. 2008. Conditions for mass production of Fusarium stoveri isolate 3-26 spore in liquid and solid culture[J]. Journal of Nanjing Agricultural University,31(4):77-81.]
(責任編輯 麻小燕)

