熱應激前后湖羊下丘腦差異表達新基因的篩選與注釋
李隱俠 馮小品 張莉 張俊 錢勇 孟春花 王慧利 仲躋峰 曹少先




摘要:湖羊是中國南方唯一的綿羊品種,耐濕熱是其重要的特色性狀之一。但目前關于其耐濕熱機制尚不清楚。本研究以湖羊為研究對象,通過轉錄組測序技術鑒定熱應激前后下丘腦組織中的新基因及其差異表達,并通過不同數據庫比對和分析,進行新基因功能注釋。結果表明,熱應激前后在湖羊下丘腦組織中共檢測到1990個新轉錄本,通過功能注釋,發現1344個新基因。在熱應激組和對照組湖羊中,差異表達新基因186個,其中130個新基因表達上調,56個新基因表達下調,通過比對發現這些基因分別與細胞免疫、繁殖、生長代謝及相關信號通路相關。Real-time PCR驗證試驗結果表明,10個熱應激前后表達差異基因中有9個與轉錄組測序結果一致。這些結果為綿羊基因組的進一步完善及基因功能的挖掘提供了一定的數據基礎,為全面解析綿羊熱應激的分子機制提供更多的依據。
關鍵詞:湖羊;熱應激;下丘腦;轉錄組測序;real-time PCR
中圖分類號:Q781
文獻標識碼:A
文章編號:1000-4440(2019)02-0363-07
熱應激是指高溫環境下,動物機體對熱環境刺激產生的非特異性生理反應的總稱。研究結果表明,影響家畜生產性能的主要環境因素有溫度、濕度、太陽輻射和風速[2],在以高太陽輻射和高溫著稱的熱帶地區,熱應激是一個限制動物發育和生產的主要因素[3]。研究結果表明,急性熱應激使雞生長性能下降,營養成分重分配,脂肪沉積增加[4-5];高溫環境破壞蛋雞內分泌系統進而妨礙生殖活動[6];熱應激影響綿羊的產奶量和繁殖性能[7-8]。
熱應激原因很簡單,但其影響和調控機制到目前為止尚不清楚。通過垂體將神經系統和內分泌系統連接起來的下丘腦組織是一個調節體溫的關鍵中樞[9]。眾所周知,下丘腦的前視區(POA)和前下丘腦區(AH)是體溫調節中心,下丘腦區域如室旁下丘腦核(PVN)、視神經核(SO)和外側下丘腦在熱應激狀態下被激活。熱應激狀態下,下丘腦通過下丘腦-垂體-腎上腺軸、交感神經系統和其他神經內分泌途徑保存或者消散熱量,從而調節動物體溫[10]。
湖羊是中國南方主要的綿羊品種,具有非常重要的優良特性,在中國低繁殖力綿羊品種遺傳改良和新品系培育中做出了一定的貢獻,其中耐濕熱是眾多優良特性之一。本研究以湖羊下丘腦組織為研究對象,在熱應激狀態和非熱應激狀態下,通過轉錄組測序技術、參考基因組比對技術挖掘湖羊新轉錄本,解析調控湖羊熱應激的差異表達新基因,并進行功能注釋,為進一步解析熱應激調控的分子機制提供一定的理論依據。
1 材料與方法
1.1 試驗動物與試驗設計
一周歲健康、體質量[(33.00+1.58)kg]相近的湖羊母羊6只,急性熱應激組和對照組各3只,自由采食和飲水。急性熱應激組溫度42℃ 左右4 h,熱應激模型和溫度參照文獻[11];對照組溫度22℃ 左右。基礎飼料組成及營養水平見文獻[12]。
1.2 樣品采集及RNA提取
熱應激組和對照組湖羊處理后立即屠宰,取完整的下丘腦組織置于液氮中貯存。在液氮中將整個下丘腦組織研磨完全,用Trizol 法提取總RNA,并分別采用Nanodrop、Qubit 2.0和Agilent 2100方法檢測RNA樣品的純度、濃度和完整度等,符合測序要求的RNA送往北京百邁客生物科技有限公司進行轉錄組測序。
1.3 cDNA文庫構建和測序
使用NEBNext UltraTM RNA文庫試劑盒(NEB,美國),按照其說明書進行文庫構建,具體步驟參照文獻[13]。應用llumina Hiseq 2500高通量測序平臺對構建的eDNA文庫進行測序,測序讀取長度為125 bp(雙末端測序)。
1.4 RNA-seq分析
將原始數據進行數據過濾獲得高質量的Cleandata,利用TopHat2將Clean reads 與參考基因組進行序列比對,并統計比對效率。使用Cufflinks軟件對新轉錄本和新基因的表達水平進行定量。同時對差異表達基因(DEG)進行統計,以差異倍數(FC)≥2且錯誤發現率(FDR)<0.01為標準。
1.5 功能注釋
使用BLAST軟件將差異表達新基因與Nr、Swiss-Prot、GO、COG、KOG、KEGG數據庫進行序列比對,使用KOBAS2.0得到新基因的KEGG orthology結果,預測完新基因編碼的蛋白質氨基酸序列后使用HMMER軟件與Pfam數據庫比對,獲得新基因的注釋信息。
1.6 Real-time PCR
以轉錄組測序相對應的RNA為模板,用逆轉錄試劑盒(TaKaRa,大連)逆轉錄為cDNA。Real-time PCR反應體系為2.0 μleDNA模板,10 U的上下游引物各0.4 μl,2 ChamQ SYBR qPCR Master Mix10.0 μl。反應程序為95℃ 預變性30s;95℃ 10s,60℃ 30s,40個循環;95℃ 15s,60℃ 60s,95℃ 15s。每個樣本重復3次。
2 結果與分析
2.1 測序數據結果
完成6只湖羊下丘腦組織的轉錄組分析,共獲得48.66 Gb Clean data,Q30堿基百分比在89.79%以上,得到大量高質量原始數據。分別將各樣本的Cleanreads與綿羊參考基因組進行序列比對,比對效率從65.05%到71.20%不等。
2.2 新基因預測及數據庫注釋
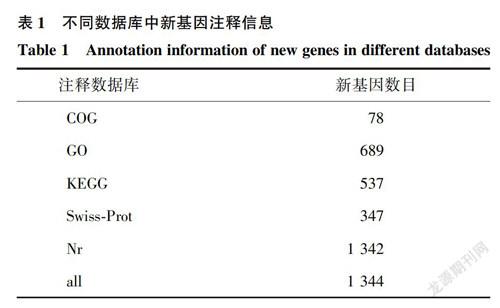
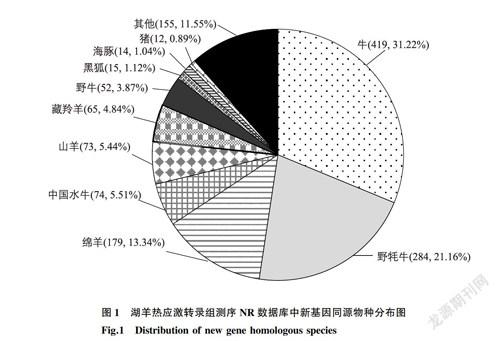
通過與綿羊參考基因組(Oar_v4.0)進行序列比對,在2組湖羊下丘腦組織中共檢測到1990個新基因,其中綿羊以外數據庫被注釋的新基因為1344個。新基因在不同數據庫中進行注釋,結果發現Nr數據庫新基因數量最多,達1342個,而COG數據庫注釋的新基因數量最少,為78個(表1)。Nr數據庫中新基因同源物種分布結果顯示約99.98%新轉錄本注釋到最高的10個物種(圖1),即牛(Bostaurus)(31.22%)、野牦牛(Bos mutus)(21.16%)、綿羊(Ovisaries)(13.34%)、中國水牛(Bubalus bubalis)(5.51%)、山羊(Capra hircus)(5.44%)、藏羚羊(Pantholops hodgsonii)(4.84%)、野牛(Bison bison)(3.87%)、黑狐(Pteropus alecto)(1.12%)、海豚(Tursiops truncatus)(1.04%)和豬(Sus scrofa)(0.89%)。
2.3 新基因GO分類
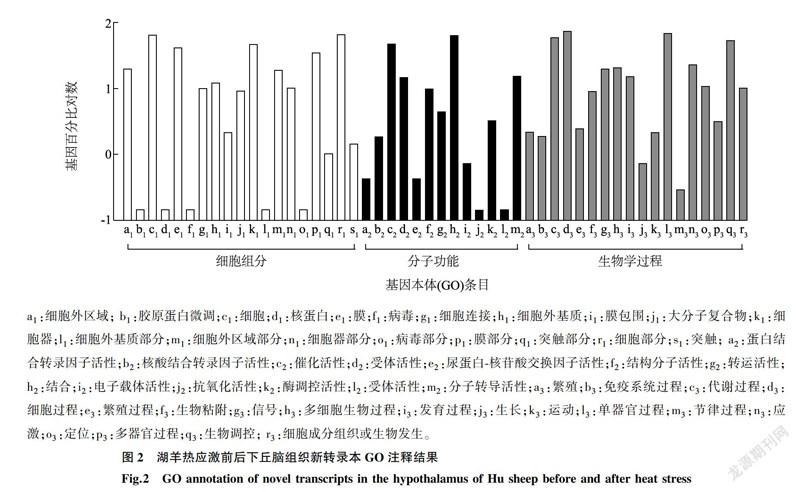
GO分類發現690個新基因分別分類到50個基因本體(GO)條目中,細胞組分19個、分子功能13個和生物學過程18個(圖2),其中動物生長、繁殖、免疫系統、代謝及信號通路等生物學過程新基因所占比例最大,細胞組分次之,分子功能最少。
2.4 熱應激前后差異表達新基因的篩選和注釋
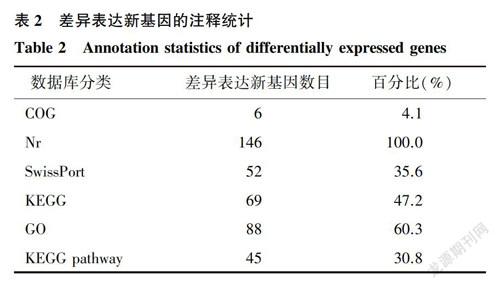
對熱應激和對照組湖羊的下丘腦組織差異表達新基因進行篩選。結果表明,兩組間共有186個新基因表達差異顯著,其中上調基因130個,下調基因56個。186個新基因只有146個在不同數據庫中被注釋,其中在Nr數據庫中被注釋的差異表達新基因數目最多(146個),在COG數據庫中最少(6個)(表2)。
45個差異表達新基因參與到65個信號通路,包含氧化磷酸化、MAPK信號通路、鈣信號通路、代謝通路等。根據GO分類注釋信息發現,其中參與湖羊生長調控的新基因有4個,參與繁殖調控的新基因有1個,參與免疫調控的新基因有2個,參與代謝調控的新基因有9個,參與氧化應激調控的新基因有21個,對應新基因編號及參與功能見表3。
2.5 熱應激前后差異表達新基因的Real-time PCR驗證
為了進一步確認轉錄組測序得到的差異表達新基因在熱應激前后表達量差異,設計12對引物(表4),以熱應激前后湖羊下丘腦組織cDNA為模板,Real-time PCR驗證熱應激前后基因表達差異。結果發現在10個表達有差異的新基因組中,9個基因的驗證結果都與轉錄組測序的結果一致,Ovis_aries_newGene_12971基因轉錄組測序結果顯示熱應激后該基因表達量顯著下降,而Real-time PCR結果顯示該基因熱應激后表達量下降,但是未達到顯著水平(圖3)。轉錄組測序熱應激前后基因表達差異與Real-time PCR驗證熱應激前后基因表達差異比較見表5。
3 討論
Marai等[13]根據溫濕指數(THI)將熱應激劃分為不同的等級:22.2~23.3是普通熱應激、23.4~25.6為嚴重熱應激>25.6屬于極嚴重熱應激。研究結果表明不同動物誘發熱應激的溫度不同,對于羊而言,通常認為羊的臨界溫度為25~30℃ ,當綿羊暴露于超過30℃時被認為發生熱應激[14]。Srikandakumar等[15]在溫度為35.5~43.9℃ 時發現白毛澳大利亞美利奴產生熱應激,呼吸頻率上升到每1min128次。DaCosta等在溫度為24~45℃ 的氣候室中觀察32只Polwarth母羊在不同級別熱應激條件下飲食、反芻情況[11]。本研究根據Srikandaku-mar[15]和DaCosta[11]的研究模型選擇熱應激時間和溫度對湖羊進行熱應激研究。通過對對照組和熱應激組湖羊下丘腦組織進行轉錄組測序,與之前的綿羊參考基因組序列相比,共檢測到1990個新轉錄本,其中有數據庫注釋的基因1344個。這些新轉錄本比對到GO、Nr、Swiss-Prot、KEGG數據庫的數量分別為689、1344、347和537,與這些數據庫的成功比對為進一步證實這些新基因的存在提供了理論依據。同源物種比對分析發現,與牛的相似基因最多(31.22%),與綿羊的相似基因為13.34%,此結果一方面表明同為反芻動物的牛和羊在基因組序列中的高度保守性[1617],同時也表明現有的綿羊參考基因組的不完整性,本研究鑒定的綿羊新基因對進一步完善綿羊參考基因組具有非常重要的意義。
研究結果表明,當動物經歷熱應激后,動物體溫上升,從而觸發進化保守的能調控多個細胞活性的熱應激轉錄組反應調節基因,包括蛋白折疊、蛋白講解轉運、代謝、DNA修復和復制等變化[1819],調控相關基因通路的變化,進而調控機體的氧化應激[20]、生長[21]、繁殖[22]、代謝[23].免疫[24]等。本研究結果經過與KEGG數據庫比對發現,在熱應激前后差異表達的新基因中有45個新基因參與到65個信號通路,包含氧化磷酸化、MAPK信號通路,鈣信號通路、代謝通路等。研究發現熱應激能激活MAPK信號通路,進而阻斷細胞生長和引發凋亡[25],同時發現其參與熱應激誘導的精子損傷[26],進而調控動物的繁殖。根據GO分類注釋信息,發現參與湖羊生長調控的新基因有4個,參與繁殖調控的新基因有1個,參與免疫調控的新基因有2個,參與代謝調控的新基因有9個,參與氧化應激調控的新基因有21個。該結果表明,存在潛在的新基因,其在湖羊熱應激后參與調控湖羊生長、繁殖、免疫、代謝和氧化應激等功能。
本試驗對湖羊熱應激前后下丘腦組織差異表達新基因進行GO功能分類和信號通路分析,有助于進一步解析調控湖羊熱應激的分子機制,為盡早挖掘出完備的湖羊耐濕熱特性的分子機理提供依據。
參考文獻:
[1]黃艷,周阿容,池文文,等.果蠅熱應激生理機制研究進展[J].南方農業學報,2018,49(5):912-921.
[2]HULME P E.Adapting to climate change:is there scope for ecological management in the face of a global threat[J].Journal ofApplied Ecology,2005,42:784-294.
[3]MCMANUS C,HERMUCHE P,PAIVA S R,et al.Geographical distribution of sheep breeds in brazil and their relationship with climatic and environmental factors as risk classification for conservation[J].Brazilian Journal Science and Technology,2014,1:1-15.
[4]劉梅.急性熱應激對肉仔雞生長性能及脂肪代謝的影響[J].動物營養學報,2011,23(5):862-868.
[5]唐姣玉,謝宇潔,劉兆輝,等.大蒜素對熱應激湘黃雞生產性能及營養物質代謝的影響[J].江蘇農業學報,2017,33(3):638-641.
[6]TU W L,CHENGC Y,WANGS H,et al.Profiling of differential gene expression in the hypothalamus of broiler-type Taiwan country chickens in response to acute heat stress[J].Theriogenology,2016,85(3):483-494.
[7]MARAI I F M,EI-DARAWANY A A,FADIEL A,et al.Physiological traits as affected by heat stress in sheep-a review[J].Small Ruminant Research,2007,71:1-12.
[8]FINOCCHIARO R,VAN KAAMJ BC H M,PORTOLANOB,et al.Effect of heat stress on production of Mediterranean dairy sheep[J].Journal of Dairy Science,2005,88:1855-1864.
[9]HAMMEL H T,JACKSON D C,STOLWIJKJ A,et al.Temperature regulation by hypothalamic proportional control with an adjust-able set point[J].Journal of Applied Physiology,1963,18:1146-1154.
[10]MILLER D B,O'CALLAGHAN J P.Neuroendocrine aspects of the response to stress[J].Metabolism,2002,51:5-10.
[11]DA COSTA MJ,DA SOLVA RG,DE SOUZA R C. Effect of air temperature and humidity on ingestive behavior of sheep[J].International Journal of Biometeorology,1992,36(4):218-222.
[12]李隱俠,王慧利,鄧唯,等.高溫環境下湖羊直腸溫度和血液生化指標的監測[J].中國畜牧獸醫,2018,45(1):271-277.
[13]MARAIIF M,AYYAT MS,ABD EI-MONEM U M.Growth performance and reproductive traits at first parity of New Zealand White female rabbits as affected by heat stress and its alleviation,under Egyptian conditions[J].Tropical Animal Health and Production,2001,33:451-462.
[14]FUQUAY J W.Heat stress as it affects animal production[J].Journal of Animal Science,1981,52(1):164-174.
[15]SRIKANDAKUMAR A,JOHNSON E H,MAHGOUB O.Efect of heat stress on respiratory rate,rectal temperature and blood chemistry in Omani and Australian Merino sheep[J].Small RuminantResearch,2003,49:193-198.
[16]李隱俠,張俊,錢勇,等.烏骨綿羊NR5A2基因編碼區序列克隆及特征分析[J].江蘇農業學報,2014,30(6):1375-1382.
[17]張春香,張國林,郭麗娜,等.基于高通量轉錄組測序的山羊睪丸和附睪頭差異表達基因分析[J].畜牧獸醫學報,2014,45(3):391-401.
[18]FEDER M E,HOFMANN G E.Heat-shock proteins,molecular chaperones,and the stress response:evolutionary and ecological physiology[J].Anual Review of Physiology,1999,61:243-282.
[19]KREGEL K C.Heat shock proteins:modifying factors in physiological stress responses and acquired thermotolerance[J].Jourmal of Applied Physiology,2002,92(5):2177-2186.
[20]ALEMUT W,PANDEY H O,SALILEW WONDIM D,et al.Oxidative and endoplasmic reticulum stress defense mechanisms of bovine granulosa cells exposed to heat stress[J].Theriogenology,2018,110:130-141.
[21]PRAGNA P,SEJIAN V,BAGATH M,et al.Comparative assessment of growth performance of three different indigenous goatbreeds exposed to summer heat stress[J].Journal of Animal Physiology and Animal Nutrition (Berl),2018,102(4):825-836.
[22]RAHMAN M B,SCHELLANDER K,LUCENO N L,et al.Heat stress responses in spermatozoa:Mechanisms and consequences forcattlefertility[J].Theriogenology,2018,113:102-112.
[23]GANESAN S,SUMMERS C M,PEARCE S C,et al.Short-term heat stress altered metabolism and insulin signaling in skeletalmuscle[J].Journal of Animal Science,2018,96(1):154-167.
[24]SAEED-ZIDANE M,LINDEN L,SALILEW-WONDIM D,et al.Cellular and exosome mediated molecular defense mechanism inbovine granulosa cells exposed to oxidative stress[J].PLoS ONE,2017,12(11):e0187569.
[25]WADA T,PENNINGER J M.Mitogen-activated protein kinases in apoptosis regulation[J].Oncogene,2004,23(16):2838-2849.
[26]RAHMAN M B,VANDAELE L,RIJSSELAERE T,et al.Bovine spermatozoa react to in vitro heat stress by activating the mitogen-activated protein kinase 14 signaling pathway[J].ReproductionFertility and Development,2014,26(2):245-257.

