煙草炭疽病原研究及拮抗鏈霉菌鑒定
李繼業,王璟晶,楊 露,彭麗娟
(1.貴州大學 農學院,貴州 貴陽 550025; 2.貴州省煙草品質研究重點實驗室,貴州 貴陽 550025; 3.貴州大學 煙草學院,貴州 貴陽 550025)
煙草炭疽病是煙草主要苗期病害之一,由炭疽菌屬(Colletotrichum)引起,在煙草的整個生育期均可發生[1]。發病省份遍布我國各個煙區,西南煙區發病尤甚。近些年,隨著煙草育苗方式的改變,大田育苗改為漂浮育苗,且育苗管理措施更為完備,一部分煙草苗期病害得到控制,煙草炭疽病的發生情況也得到改變。2002年以前煙草炭疽病在中國平均發病率為30%~40%,發病嚴重的地區可達80%,且病情指數較高,嚴重影響煙草生產[2]。李昊[3]在2016年河南襄城縣一現代化煙草育苗基地調查苗期病害,306株幼苗發病嚴重的有26株,有149株輕微發病,發病率較高,病情指數不高。臺蓮梅等[4]于黑龍江省綏化、肇州和賓縣3個煙區調查苗期病害,煙草炭疽病平均發病率為5%。譚海文[5]調查了廣西省10個縣的苗期發病情況,煙草炭疽病僅在羅城及南丹縣發生,發病率為2%~5%,病情指數僅為0.27~0.57。
一些研究發現,煙草炭疽病病原為毀滅炭疽菌(Colletotrichumdestructivum)[6-8]。Shen等[9]在加拿大發現,瓜類炭疽菌(Colletotrichumorbiculare)能引起煙草屬的炭疽病。任文清等[10]在四川通過形態學鑒定了1株煙草炭疽菌(Colletotrichumnicotianae)。苗圃[11]在河南省分別報道了膠胞炭疽菌(Colletotrichumgloeosporioides)引起煙草炭疽病。筆者于貴州省綏陽縣采集煙草炭疽病病株,分離病原菌,編號為SY-TJ,用柯赫氏法則驗證其致病性,并通過形態學和系統發育分析明確其分類地位。此外還對其進行了生物學特性的研究和生防鏈霉菌的篩選及鑒定,以期為該病害的預防及防治提供可靠的依據。
1 材料與方法
1.1 材料
煙草炭疽病標本,于2017年8月3日采自貴州省綏陽縣,品種為云煙87;致病性測定采用成苗期烤煙幼苗,品種為云煙87;鏈霉菌分離土樣采自貴州省湄潭縣(N 27°58′55.47″ E 107°54′34.64″)烤煙根際土壤,以及采自貴州省貴陽市花溪區(N 26°29′34.75″ E 106°40′15.86″)林地中微生物含量豐富的地表土。
1.2 方法
1.2.1 病原菌分離
采用組織分離法[12]。用滅好菌的濾紙片吸干組織表面水分以減少細菌生長,置于添加硫酸鏈霉素(0.1 mg·mL-1)和氨芐青霉素鈉(0.05 mg·mL-1)的PDA平板上,25 ℃條件下培養3~5 d。將生長出來的菌絲體接種到PDA平板進行純化。
1.2.2 柯赫氏法則驗證其致病性
待菌絲布滿整個平板,用無菌水沖洗平板制備孢子懸浮液(濃度為1×103mL-1),采用有傷和無傷2種接種方法。無傷接種直接將孢子懸浮液0.1 mL涂勻在幼苗葉片上;有傷接種采用2.5 mL注射器針頭(直徑0.55~0.60 mm)刺破幼苗葉片,將孢子懸浮液0.1 mL均勻涂抹在葉片傷口周圍。置于25 ℃、濕度50%的光照培養箱中,對照組刺破葉片后采用清水處理。待葉片發病,從發病葉片分離病原,并與綏陽縣致病病原在顯微鏡下進行形態學對比,確定其是否為同一種病原[13]。
1.2.3 病原菌的形態鑒定和系統發育分析
形態鑒定取15 d的病原培養平板。于顯微鏡下觀察分生孢子和附著胞的形態,測量大小,進行形態學的比較[14-17]。
系統發育分析:將綏陽縣分離的煙草炭疽菌序列與目前已報道的病原及近似種(包含模式種和部分模式菌株的DNA片段)進行多基因系統發育分析。多基因系統發育樹包含ITS(核糖體內轉錄間隔區序列)[14]、GAPDH(3-磷酸甘油醛脫氫酶基因)[15]、CHS-1(查爾酮合酶基因)[16]、ACT(肌動蛋白基因)4個基因[17],選用基因與序列號見表1。系統發育分析利用MEGA6.0軟件通過最大似然法(ML)構件系統發育樹[11]。
1.2.4 生物學特性研究
將供試菌株在PDA培養基平板上培養,用打孔器(直徑7 mm)在菌落外緣相同半徑的圓周上打孔,制成菌餅待用。生物學特性測定所用平板直徑均為9 cm,每處理均重復3次。用十字交叉法測定菌落直徑,2 d后開始測量菌落直徑,每隔2 d觀察1次。測定其對碳氮源的利用以及pH、光照、溫度對其生長的影響[18]。
碳源利用試驗以查氏培養基為基礎培養基(查氏培養基配方中碳源為蔗糖),分別加入與蔗糖等量的碳源(甘露醇C1、乳糖C2、麥芽糖C3、淀粉C4、果糖C5和葡萄糖C6)配制成不同的培養基。取菌餅于各處理培養基平板中央,置于25 ℃培養箱中光照黑暗各12 h交替培養。
氮源利用試驗以查氏培養基為基礎培養基(查氏培養基配方中氮源為硝酸鈉),分別加入與硝酸鈉等量的氮源(尿素N1、草氨酸N2、硫酸銨N3、硝酸鉀N4、氯化銨N5、甘氨酸N6和蛋白胨N7),配制成不同的培養基。取菌餅分別接于不同氮源的培養基平板中央,置于25℃恒溫培養箱中光暗交替培養。
表1 本研究中選擇的4種基因和序列號
Table 1 Four genes and the accession numbers chosen in this study

種名Name菌株號Accession numberITSGAPDHCHS-1ACTC. asianumHKUCC∶10862JX010194JX010021JX009787JX009465CBS∶124960JX010193JX010017JX009871JX009546C. destructivumCBS 114801KM105219 KM105574KM105359KM105429 CBS 128509KM105214KM105569KM105354KM105424 C. fructicolaICMP∶12568JX010166JX009946JX009762JX009529ICMP∶17787JX010164JX009958JX009807JX009439C. gloeosporioidesIMI 356878 EU371022JX010056JX009818JX009531CBS953.97KM105214KM105569KM105284KM105424C. lentis CBS 127605KM105241KM105598KM105381KM105451 CBS 127604JQ005766 KM105597JQ005808JQ005829 C. orbiculareCBS 570.97NR152271KF178490KF178515KF178563CBS 173.59 KF178463KF178487KF178512KF178560C. tabacumCBS 124249KM105206KM105560 KM105346 KM105416CBS 161.53JQ005763KM105559 JQ005805JQ005826 C. utrechtenseCBS 135827KM105202KM105555 KM105342KM105412 CBS 135828KM105203 KM105556KM105343KM105413C. vignaeIMI 334960KM105182 KM105533 KM105252KM105392 C. pisicolaCBS 501.97CBS 724.97KM105183KM105172KM105534KM105522KM105253 KM105242KM105393KM105382
以上數據使用IBM SPSS軟件分析處理間差異的顯著性。
1.2.5 生防鏈霉菌的篩選
土壤中的鏈霉菌,按照梯度稀釋分離法,土樣預先在50~60 ℃烘干處理1 h抑制細菌的生長[19],分離鏈霉菌菌株。將分離得到的鏈霉菌與煙草炭疽病病原菌進行室內平板對峙。選取效果較好的菌株進行復篩,25 ℃下培養,觀察是否產生抑菌(溶菌)圈,定期測量抑菌(溶菌)圈的大小[20-21]。
1.2.6 生防鏈霉菌的分子鑒定
基于16S rRNA基因序列使用最大似然法(ML)構建系統發育樹[19]。系統發育樹基因選擇NCBI中通過比對相似度較高的菌株序列。
1.2.7 生防鏈霉菌的生理生化指標的測定
生理生化指標的測定包含碳源利用、氮源利用、明膠液化、淀粉水解、纖維素水解、硫化氫產生、氧化酶產生、過氧化氫酶產生[22]。方法采用部分阮繼生等[23]以及Evangelista-Martínez[19]所使用鏈霉菌生理生化實驗改良方法。
2 結果與分析
2.1 致病性測定
接種病原SY-TJ后3 d,葉片產生發病癥狀,回接試驗部分結果見圖1。無傷接種的處理未見發病,有傷接種后發病較明顯。接種病原菌后引起針刺部位周圍葉片變黑,出現水漬狀病斑,壞死部分為淺灰色,導致傷口擴大,說明該病原菌對烤煙品種云煙87有致病性。

A,刺破后不接種病原菌的處理;B,刺破后接種病原菌的處理;C,幼苗接種病原菌水漬狀病斑放大圖;D,接種后傷口擴大壞死病斑放大圖;E,不接種病原菌葉片刺破傷口放大圖。A, Non-inoculation of pathogeny after puncture; B, The treatment of inoculation of pathogeny after puncture; C, Water soaking spot; D, An enlarged picture of necrotic lesions after inoculation; E, An enlarged picture of punctures on leaf of non-inoculated pathogeny.圖1 部分回接試驗結果Fig.1 Results of pathogeny inoculation test
2.2 形態鑒定和系統發育分析
菌株SY-TJ菌落顏色為淺粉色,背面深黃色。分生孢子無色、單胞,整個孢子呈圓柱狀,兩端平滑鈍圓,測量了30個分生孢子,計算了其平均數和標準差,長度為(13.5±2.3)μm,寬度為(6.1±1.7)μm。菌絲體附著胞深褐色,橢圓形,測量10個附著胞長(8.0±1.1)μm,寬(5.9±0.9)μm(圖2)。
系統發育分析結果顯示,SY-TJ與瓜類炭疽菌聚合在同一個進化分支(圖3)。Shen等[9]的結果中,瓜類炭疽(C.orbiculare)分生孢子長(13.1±1.6)μm,寬(5.4±0.7)μm;菌絲體附著胞長(7.3±1.3)μm,寬(5.2±0.9)μm。結合形態學特征,將SY-TJ鑒定為瓜類炭疽(C.orbiculare)。
2.3 生物學特性
2.3.1 不同碳源對病原菌生長的影響
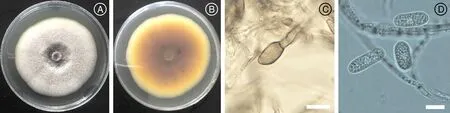
A與B分別為菌落正面與反面;C為附著胞形態;D為分生孢子形態。標尺=10 μm。The picture A and B were the front and the back of the pathogeny culture; The picture C was the morphology of appressorium; The picture D was the morphology of conidium. Bars=10 μm.圖2 SY-TJ培養特征及其形態學Fig.2 Culture characteristics and morphology of SY-TJ

以最大似然法(ML)構建系統發育樹,外群為C. pisicola。The phylogram was generated of ML analysis. The tree was rooted with C. pisicola.圖3 基于部分ITS、GAPDH、CHS-1和ACT基因的序列Fig.3 Phylogram analysis based on combined ITS, GAPDH, CHS-1 and ACT sequences
SY-TJ可利用全部6種碳源;最適生長的碳源為淀粉,最不適宜的碳源為乳糖。12 d菌落直徑見圖4。
2.3.2 不同氮源對病原菌生長的影響
SY-TJ無法利用草氨酸(接種初始菌餅直徑為0.7 cm);最適生長的氮源為硝酸鈉、蛋白胨和硝酸鉀,最不適宜生長的氮源為草氨酸。12 d菌落直徑見圖5。
2.3.3 不同溫度、pH、光照對病原菌生長的影響
SY-TJ的pH適應范圍非常廣,pH=3時菌絲不生長,其余均有生長,在pH=5時菌落直徑最大。最適生長溫度為25 ℃;40 ℃時,其菌絲不生長。光照對其菌落直徑沒有明顯的影響,但黑暗條件會導致菌絲顏色變深,全光照條件下菌絲顏色為淺粉色,12 d菌落直徑見圖6。
2.4 拮抗菌篩選
將分離得到的67株鏈霉菌與SY-TJ進行了拮抗菌初篩,復篩表現良好的有4株,其中2株抑菌帶超過1 cm,具有良好的生防潛力。F18和F35效果較好,抑菌帶直徑分別為1.1 cm和1.0 cm,F22為0.6 cm,F58為0.75 cm,F23為沒有拮抗作用的菌株,CK為同期接種病原菌的生長情況(圖7)。
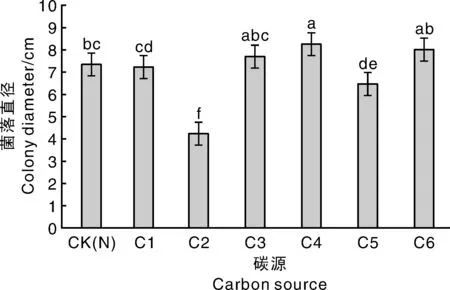
不同處理間沒有相同字母表示差異顯著(PThe bars without the same letters showed the significant difference(P圖4 不同碳源對菌落直徑的影響Fig.4 Effect of different carbon sources on colony diameter
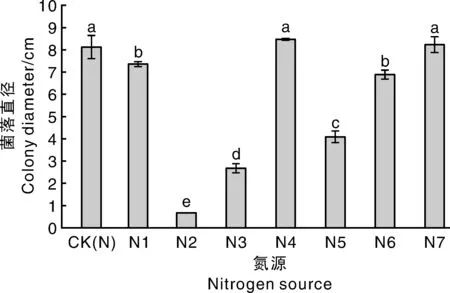
圖5 不同氮源對菌落直徑的影響Fig.5 Effect of different nitrogen sources on colony diameter
2.5 拮抗菌的生理生化鑒定和系統發育分析
系統發育分析見圖8,生理生化指標見表2。通過生理生化鑒定和系統發育分析,初步將F18鑒定為白長鏈霉菌(Streptomycesalbolongus),F35鑒定為抗鉛鏈霉菌(Streptomycesplumbiresistens)[24]。
3 結論與討論
本實驗驗證了病原SY-TJ的致病性,通過形態學和系統發育分析,將其鑒定為瓜類炭疽菌(C.orbiculare)。生物學特性結果顯示:該菌可以利用的最佳碳源為淀粉,最佳氮源為硝酸鈉、蛋白胨和硝酸鉀,不能利用草氨酸。其最適宜生長溫度為25~30 ℃。光照和pH值對其菌落直徑影響不大,在pH 4~11時其均能生長。光照不影響其生長,但會影響其色素的形成。篩選得到2株具有良好拮抗效果的生防鏈霉菌菌株F18和F35。根據生理生化指標和系統發育分析,初步將F18鑒定為白長鏈霉菌(S.albolongus),F35鑒定為抗鉛鏈霉菌(S.plumbiresistens)。

圖6 不同溫度、pH、光照對菌落直徑的影響Fig.6 Effect of different temperature, pH and illumination on colony diameter

圖7 平板對峙試驗結果Fig.7 Result of agar antagonistic tests
表2 2株鏈霉菌的生理生化指標
Table 2 Biochemical characterization of twoStreptomyceteisolates
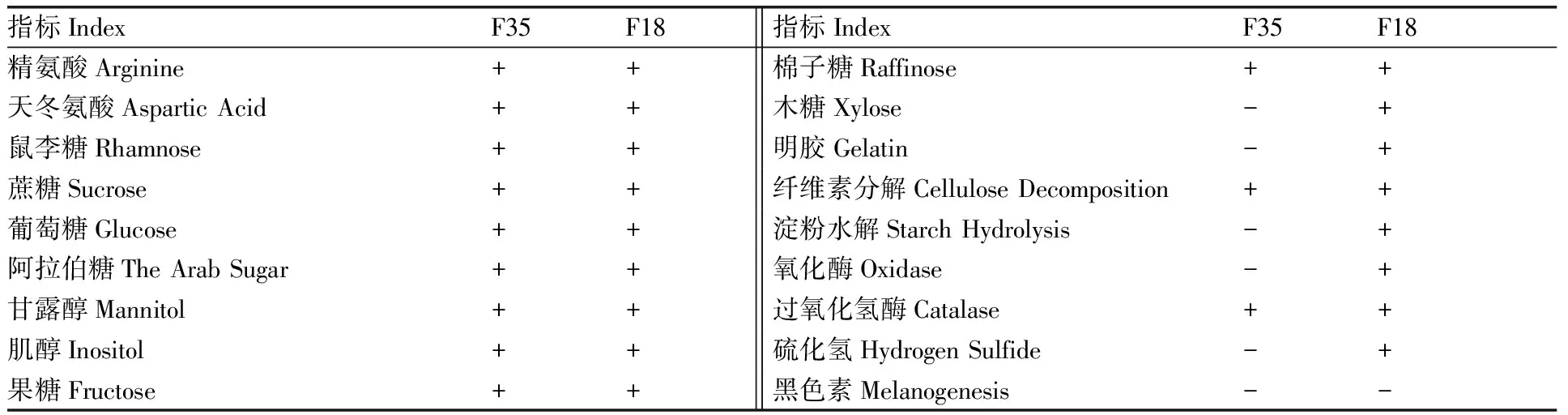
指標IndexF35F18指標IndexF35F18精氨酸Arginine++棉子糖Raffinose++天冬氨酸Aspartic Acid++木糖Xylose-+鼠李糖Rhamnose++明膠Gelatin-+蔗糖Sucrose++纖維素分解Cellulose Decomposition++葡萄糖Glucose++淀粉水解Starch Hydrolysis-+阿拉伯糖The Arab Sugar++氧化酶Oxidase-+甘露醇Mannitol++過氧化氫酶Catalase++肌醇Inositol++硫化氫Hydrogen Sulfide-+果糖Fructose++黑色素Melanogenesis--

圖8 基于2株拮抗鏈霉菌全部16SrRNA序列以最大似然法(ML)構建的系統發育樹Fig.8 Phylogram generated of ML analysis based on whole 16SrRNA sequences of two antagonistic Streptomyces strain
最初煙草炭疽病病原曾有多個種的報道。分類學家曾在1922年和1932年按照寄主植物的類別分別將其命名為煙草炭疽菌(C.niocotianae和C.tabacum),目前國外研究普遍認為煙草炭疽病的病原菌主要為毀滅炭疽菌(C.destructivum)。Shen等[9]發現瓜類炭疽菌(C.orbiculare)可致煙草屬發病,后來逐漸被廣泛承認。Wang等[25]報道了在中國貴州鑒定到煙草炭疽的新病原果生炭疽菌(C.fructicola)。苗圃[11]和柴欣等[26]報道貴州和河南的煙草炭疽病病原鑒定為膠胞炭疽菌(C.gloeosporioides),柴欣等[26]的研究中煙草炭疽(C.niocotianae)與膠胞炭疽(C.gloeosporioides)聚合到一個進化分支。將以上致病種的序列與本研究分離到的SY-TJ菌株進行系統發育分析,驗證它們之間的關系。系統發育分析結果顯示(圖3),系統發育樹形成了2個良好的進化分支,毀滅炭疽菌(C.destructivum)和煙草炭疽菌(C.tabacum)處在進化支1,膠胞炭疽菌(C.gloeosporioides)、果生炭疽菌(C.fructicola)和瓜類炭疽菌(C.orbiculare)處在進化支2,進化支內的菌株具有較近的親緣關系。SY-TJ與瓜類炭疽菌(C.orbiculare)親緣關系最近,處于同一個進化單系。
本實驗篩選得到了2株在室內對煙草炭疽病病原菌具有良好拮抗作用的鏈霉菌菌株,有著潛在的生物學價值,可以結合大田試驗來驗證其是否對該病有著良好的生防效果;也可以對其次生代謝產物進行探究,以此開發新型的農藥產品[19]。目前于國內并無瓜類炭疽菌(C.orbiculare)引起煙草炭疽病的報道,Shen等[9]的研究顯示,瓜類炭疽菌(C.orbiculare)能引起煙草屬植物炭疽病,瓜類炭疽菌(C.orbiculare)與毀滅炭疽(C.destructivum)是目前被廣泛認可的兩種煙草炭疽病原。本次研究從田間發現1株感染煙草炭疽病的病株,并且在實驗室中對云煙87有一定程度的致病性(有傷接種),說明該種有引起煙草炭疽病的潛力。該種對于煙草不同品種的致病性,以及該種引發煙草炭疽病是否具有普遍性尚需進一步田間調查來驗證。

