黃顙魚溶血性腹水病初探
楊移斌,艾曉輝,宋 懌,董 靖,胥 寧,姜 蘭
(1.中國水產科學研究院 珠江水產研究所,廣東 廣州 510380; 2.中國水產科學研究院 長江水產研究所,湖北 武漢 430223; 3.農業農村部水產品質量安全控制重點實驗室,北京 100141)
黃顙魚(Pelteobagrusfulvidraco),俗稱黃臘丁、嘎牙子等,隸屬于鲇形目(Siluriformes)、鲿科(Bagridae)、黃顙魚屬(Pelteobagrus)[1],是一種經濟價值較高的特色淡水經濟養殖品種[2]。目前黃顙魚主要細菌性病原包括:遲鈍愛德華氏菌(Edwardsiellatarda)[3-4]、鮰愛德華氏菌(Edwardsiellaictaluri)[5]、蠟狀芽孢桿菌(Bacilluscereus)[6]、維氏氣單胞菌(Aeromonasveronii)[7]、溫和氣單胞菌(Aeromonassobria)[8]、柱狀黃桿菌(Flavobacteriumcolumnare)[9]、類志賀鄰單胞菌(Plesimonasshigelloides)[10]、海豚鏈球菌(Streptococcusiniae)[11]、擬態弧菌(Vibriomimicus)[12]等。隨著病原呈現多元性發展,種類不斷增多,而防控手段發展較慢,導致疾病暴發時難以及時有效控制,給養殖戶帶來經濟損失的同時也成為黃顙魚產業發展的一大瓶頸。
2017年6—7月,湖北省荊州某養殖場暴發黃顙魚大規模腹水病,發病率50%左右,死亡率高,導致了重大經濟損失。筆者經現場調查、取樣,病樣經液氮保存后帶回實驗室分析,根據試驗結果,確定此次黃顙魚發病是由細菌引起的,并進行病原相關研究及藥敏特性分析,為黃顙魚腹水病的防控提供了理論支撐。
1 材料與方法
1.1 材料
1.1.1 供試魚
6尾有典型腹水癥狀的黃顙魚取自湖北荊州某養殖場,魚腹部膨大,肛門有出血潰爛狀,鰓部正常,體表無明顯傷痕。感染用黃顙魚(10±0.5)g購于武漢江夏某苗種場,無明顯外傷,健壯活力強,在實驗室飼養7 d后無異常,用于試驗。
1.1.2 主要試劑
營養肉湯、營養瓊脂、MH瓊脂、革蘭氏染色液、藥敏紙片及細菌生化微量鑒定管均購自杭州微生物試劑有限公司;谷氨酸鹽淀粉酚紅瓊脂(GSP瓊脂)購自國藥集團;2×Taq PCR Mix、引物由上海生工提供。
1.2 方法
1.2.1 臨床調查
對荊州某黃顙魚養殖場及周邊環境、黃顙魚腹的病發病史及用藥情況進行調查。
1.2.2 病原菌多樣性分析
在無菌條件下,取6條典型患病黃顙魚置于操作臺上,使用已滅菌剪刀在黃顙魚肚皮上輕輕戳破,分別將腹水裝入10 mL離心管中。取5 mL腹水樣品,加入20%甘油,混勻后置于-80 ℃冰箱保存待用;另取5 mL樣品,送至上海美吉生物醫藥科技有限公司抽提DNA,并在Illumina Mi-Seq平臺上進行高通量測序。
1.2.3 病原菌分離
基于病原菌多樣性測序結果,可知此次暴發腹水病黃顙魚的腹水中氣單胞菌屬種類占據極大優勢。用接種環蘸取保存的腹水劃線于平板上,置于28 ℃培養24 h后,挑取單菌落進一步純化,純化后的細菌加入20%甘油保存于-20 ℃備用。分離菌株暫命名HS01。
1.2.4 人工感染及LD50測定
將HS01接種于營養瓊脂上,置于28 ℃恒溫培養24 h,用槍頭吸取PBS洗下菌苔至無菌離心管中,參照麥氏比濁法調整菌液濃度分別為5.0×108、5.0×107、5.0×106、5.0×105、5.0×104CFU·mL-1。
將健康黃顙魚分為6組(A—F),每組30尾。其中A—E組黃顙魚分別腹腔注射5.0×109、5.0×108、5.0×107、5.0×106與5.0×105CFU·mL-1菌液,每尾0.1 mL,對照組(F)注射等量PBS。試驗期間不投喂,溶氧保持在7.5~8.5,水溫24~26 ℃,使用充分曝氣的自來水進行養殖。每5 h觀察黃顙魚動態,尤其注意其游泳姿態、速度及體表可能出現的癥狀,及時對發病臨死黃顙魚進行解剖觀察,并進行細菌再分離。記錄發病死亡數,并用概率單位圖解法[13]計算半致死劑量(LD50)。
1.2.5 分離株HS01的理化特性測定
將分離株HS01接種于營養瓊脂平板上,置于28 ℃恒溫培養24 h后,并進行革蘭氏染色,采用細菌微量生化鑒定管參照《常見細菌系統鑒定手冊》[14]測定分離株的理化指標。
1.2.6 分離株的16S rRNA和gyrB基因序列分析及系統發育樹的構建
將分離株HS01接種于營養瓊脂平板上,置于恒溫28 ℃培養24 h,挑取單菌落溶于10 μL無菌水中,即可作為菌液PCR的模板。擴增通用引物為27F: 5′-AGAGTTTGATC(C/A)TGGCTCAG-3′;1492R: 5′-GGTTACCTTGTTACGACTT-3′。反應體系:2×Taq PCR Mix 50 μL,雙蒸水47 μL、上下游引物各1 μL,DNA模板1 μL,共100 μL。反應條件:98 ℃ 1 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 1 min,共35個循環;72 ℃ 10 min。gyrB基因引物參照Yamamoto等[15]為UP1: 5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′;UP2: 5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′。PCR反應體系:2×Taq PCR Mix 50 μL,雙蒸水 47 μL,上下游引物各1 μL,DNA模板1 μL,共100 μL。PCR 反應條件:98 ℃ 1 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 1 min,共35個循環;72 ℃ 10 min。16S rDNA和gryB基因擴增產物經1%瓊脂糖凝膠電泳驗證為目的片段后送生工生物工程(上海)股份有限公司純化及序列測定。
將分離株HS01的16S rRNA及gryB基因序列放到NCBI里面進行比對,根據比對結果選取同源性較高的病原菌序列,以及水產重要病原菌序列,采用Clustal X軟件進行多序列匹配分析,通過MEGA6.0軟件Neighbor-Joining法構建系統進化樹,1 000次Bootstrap檢驗置信度。
1.2.7 分離株細菌毒力與耐藥基因分析
以分離菌株的DNA為模板,對毒力基因溶血素基因(hlyA)[16]、氣溶素基因(aerA)[17]、熱不穩定性腸毒素(Alt)[18],以及絲氨酸蛋白酶(aphA)[19]進行PCR擴增;同時對耐藥基因Sul1[20]、qnrA[21]、ant(3’)-Ia[21]及tetA[21]進行PCR擴增。引物序列、退火溫度和片段大小見表1,擴增產物經1%瓊脂糖凝膠電泳檢測驗證為目的片段后送生工生物工程(上海)股份有限公司進行純化與測序。
1.2.8 藥敏特性分析
參照美國臨床和實驗室標準協會(clinic and laboratory standards institute, NCCLS)抗微生物藥物敏感性實驗執行標準,采用紙片擴散法進行分離株HS01的藥敏特性分析[22]。
1.2.9 病理學分析
取帶有典型腹水癥狀的黃顙魚鰓、肝臟、腎臟、脾臟、肌肉及腸道,用10%的中性福爾馬林固定液固定,酒精梯度脫水,二甲苯透明,石蠟包埋、切片(厚度4 μm),蘇木精-伊紅(HE)染色,中性樹脂膠封片后,顯微鏡觀察并拍照。
2 結果與分析
2.1 臨床調查
此次發病黃顙魚養殖場位于湖北荊州,養殖水面約13.33 hm2,發病率約50%,死亡率近70%。黃顙魚腹水病發病期較長,但死亡時間集中,死亡量大,病死魚規格都在50 g上下,經濟損失較大。經調查發現,養殖戶曾經使用調水產品及殺蟲藥物,但未進行淤泥清除及底泥改良,養殖水質符合漁業水質指標要求水平,但有機物濃度較高,有富營養化傾向,水溫24~28 ℃。
表1 基因引物序列
Table 1 Sequence information of primers

引物名稱Primer name序列Sequences(5’-3’)退火溫度Annealing temperature/℃擴增長度Length/bphlyA-FGGCCGGTGGCCCGAAGATACGGG66592hlyA-RGGCGGCGCCGGACGAGACGGGGaerA-FCAAGAACAAGTTCAAGTGGCCA55309aerA-RACGAAGGTGTGGTTCCAGTAlt-FTGACCCAGTCCTGGCACGGC55442Alt-RGGTGATCGATCACCACCAGCaphA-FATTGGATCCCTGCCTATCGCTTCAGTTCA55911aphA-RGCTAAGCTTGCATCCGTGCCGTATTCCSul1-FFCATTGCCTGGTTGCTTCAT62433Sul1-RATCCGACTCGCAGCATTTqnrA-FATTTCTCACGCCAGGATTTG55516qnrA-RGATCGGCAAAGGTCAGGTCAant(3’)-Ia-FATCTGGCTATCTTGCTGACA55284ant(3’)-Ia-RTATGACGGGCTGATACTGGtetA-FGCTACATCCTGCTTGCCTTC55915tetA-RGCATAGATCGCCGTGAAGAG
2.2 細菌分離與致病性分析
根據黃顙魚腹水中細菌16S rRNA高通量測序結果,在屬水平上對腹水中細菌優勢屬進行統計分析,氣單胞菌占明顯優勢。采用氣單胞菌選擇培養基谷氨酸鹽淀粉酚紅瓊脂從黃顙魚腹水中選擇性分離氣單胞菌,從而分離純化HS01菌株。經人工感染試驗,黃顙魚注射不同濃度的HS01菌懸液后,出現不同程度的死亡(表2)。
感染發病死亡黃顙魚出現腹部膨大、滿腔腹水及肛門紅腫潰爛的癥狀,與自然發病癥狀相似(圖1),并且分離到形態及理化特性與HS01一致的菌株,由此表明分離株HS01是本次黃顙魚腹水病的病原。參照表2建立死亡率(%)與細菌劑量對數[lg(CFU)]的關系曲線:y=25.33x-112.14(R2=0.95),分離株HS01對黃顙魚半數致死劑量為2.51×105CFU·g-1。
2.3 細菌鑒定
分離株HS01革蘭氏染色為紅色,表明其為陰性菌。生理生化指標見表3,初步判斷HS01為嗜水氣單胞菌(Aeromonashydrophila)。HS01的16S rRNA及gyrB基因的片段大小分別在1 500、1 000左右(圖2),符合預期。將分離菌株HS01 16S rRNA及gyrB基因序列與NCBI中已有序列進行比對,結果顯示,HS01與嗜水氣單胞菌(Aeromonashydrophila)同源性最高。選取同源性較高氣單胞菌種類及水產重要病原菌種類的16S rRNA及gyrB基因序列,分別構建基于16S rRNA及gyrB基因序列發育樹(圖3、4),結果顯示,分離株均跟嗜水氣單胞菌(Aeromonashydrophila)聚為一支。因此綜合分離株HS01的理化特性與基因分析結果,判定分離株HS01是嗜水氣單胞菌(Aeromonashydrophila)。
表2 分離株對黃顙魚LD50試驗結果
Table 2 Results of LD50of isolation strain inPelteobagrusfulvidraco

組別Group注射劑量Injected dose/CFU·g-1實驗魚數量Fish number死亡數量Amount ofdeath死亡率Mortality/%A5.0×1073030100.00B5.0×106302790.00C5.0×105302066.67D5.0×10430723.33E5.0×1033026.67F03000
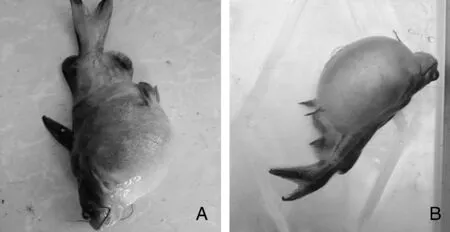
圖1 自然發病(A)和人工感染(B)黃顙魚Fig.1 Image for natural infected (A) and artificial infected (B) Pelteobagrus fulvidraco
2.4 藥敏特性
藥敏試驗結果表明,分離株HS01對β-內酰胺類藥物全部耐藥,對氨基糖疳類及大環內酯類部分耐藥,對酰胺醇類、四環素類及喹諾酮類全部高度敏感,對頭孢類及磺胺類中度或高度敏感(表4)。
參照嗜水氣單胞菌毒力基因Alt、hlyA、aphA及aerA擴增的特異性引物進行合成,PCR特異性擴增只獲得Alt及hly目的片段,大小分別為592、309 bp(圖5);參照文獻合成耐藥基因引物,對耐藥基因進行特異PCR擴增,未獲得目的條帶(圖6)。

M,DL 2 000 maker;a,16S rRNA基因擴增產物;b,gyrB基因擴增產物。M, DL 2 000 maker; a, PCR product of 16S rRNA;b,PCR product of gyrB.圖2 16S rRNA及gyrB基因的PCR擴增結果Fig.2 The PCR amplification results of 16S rRNA and gyrB gene
表3 HS01菌株生理生化特征
Table 3 Physiological and biochemical characteristics of HS01
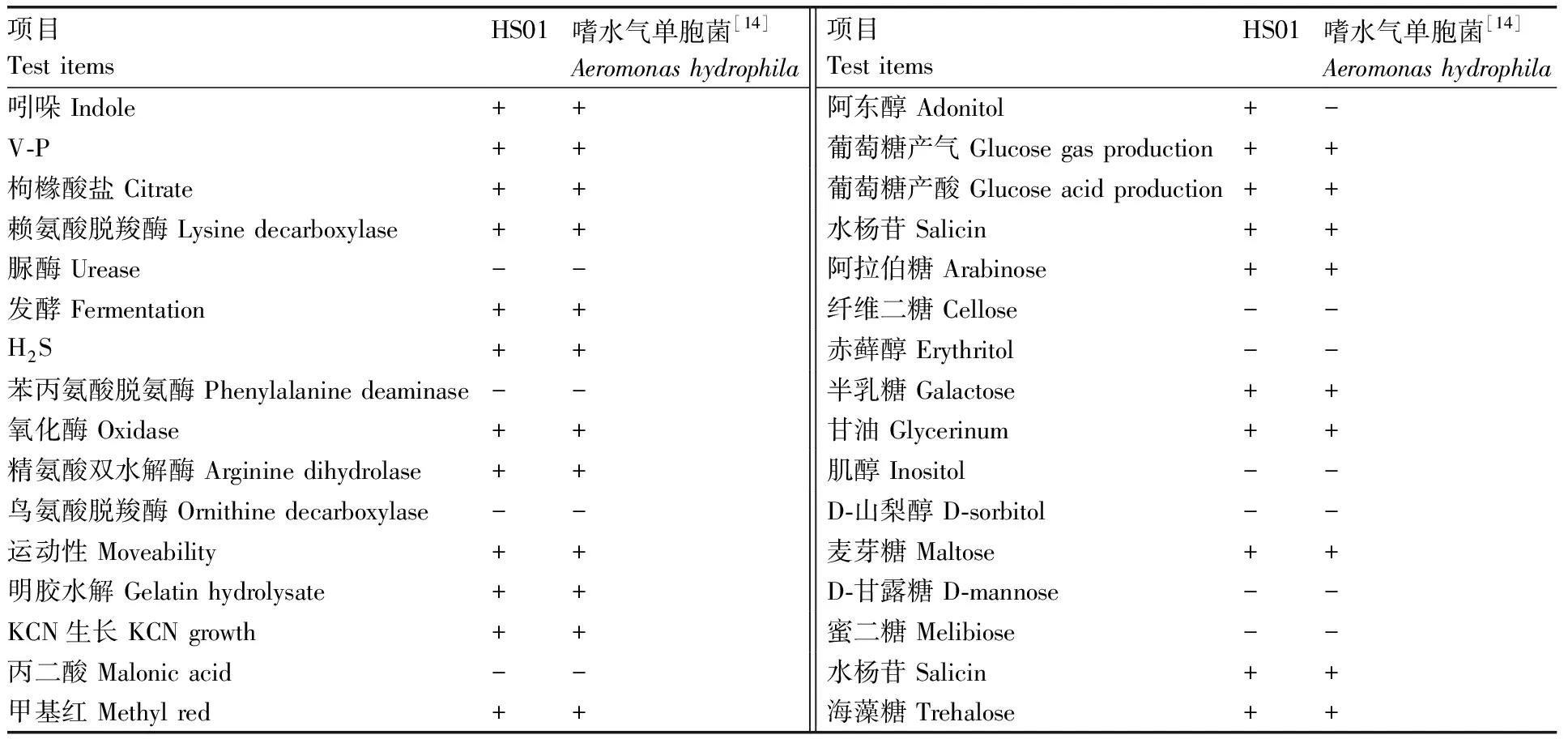
項目Test itemsHS01嗜水氣單胞菌[14]Aeromonas hydrophila項目Test itemsHS01嗜水氣單胞菌[14]Aeromonas hydrophila吲哚 Indole++阿東醇 Adonitol+-V-P++葡萄糖產氣 Glucose gas production++枸櫞酸鹽 Citrate++葡萄糖產酸 Glucose acid production++賴氨酸脫羧酶 Lysine decarboxylase++水楊苷 Salicin++脲酶 Urease--阿拉伯糖 Arabinose++發酵 Fermentation++纖維二糖 Cellose--H2S++赤蘚醇 Erythritol--苯丙氨酸脫氨酶 Phenylalanine deaminase--半乳糖 Galactose++氧化酶 Oxidase++甘油 Glycerinum++精氨酸雙水解酶 Arginine dihydrolase++肌醇 Inositol--鳥氨酸脫羧酶 Ornithine decarboxylase--D-山梨醇 D-sorbitol--運動性 Moveability++麥芽糖 Maltose++明膠水解 Gelatin hydrolysate++D-甘露糖 D-mannose--KCN生長 KCN growth++蜜二糖 Melibiose--丙二酸 Malonic acid--水楊苷 Salicin++甲基紅 Methyl red++海藻糖 Trehalose++
“+”,陽性;“-”,陰性。
“+”, positive; “-”, negative.

圖3 HS01 16S rRNA 基因序列與相關菌株的系統發育樹Fig.3 Phylogenetic tree based on 16S rRNA gene sequence of HS01 strain and its relatives
2.5 病理學變化
如圖7所示,患病黃顙魚大量腸上皮細胞脫落,腸上皮細胞中可見大小不一的圓形脂滴,腸黏膜中可見多量淋巴細胞浸潤(圖7-A);部分肝細胞發生脂肪變性,細胞內可見大小不一的圓形空泡,少量肝竇輕度淤血(圖7-B);肌肉中多量肌纖維損傷,肌原纖維數量減少,排列雜亂(圖7-C);脾組織中紅細胞和淋巴細胞數量較少,脾竇擴張(圖7-D);鰓絲局部失血,鰓小片中紅細胞數量減少,組織中可見淋巴細胞浸潤(圖7-E);腎臟腎小球毛細血管邊可見均勻紅染物質,腎小球外可見結締組織包囊,腎小管上皮細胞水泡變性,胞體腫脹,胞漿淡染,可見局灶性黑色素沉積(圖7-F)。
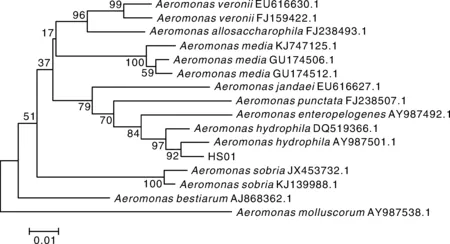
圖4 HS01 gyrB基因序列系統進化樹Fig.4 Phylogenetic tree based on gyrB gene sequence of strain HS01
表4 HS01藥敏試驗結果
Table 4 Antibiotic sensitivity test of strain HS01

藥物Drugs抑菌圈直徑判斷標準Standard of inhibition zone diameter/mm不敏感Resistant中度敏感Medium sensitivity高度敏感Highly sensitive藥物含量Dose/(g·disc-1)抑菌圈直徑Zonediameter/mm敏感性Sensitivityβ-內酰胺類青霉素 Penicillin≤1718~20≥2110 U0Rβ-lactam阿莫西林 Amoxicillin≤1314~17≥18200R頭孢類Cephalosporin頭孢唑肟 Cefazolin oxime≤1415~19≥203035S頭孢拉定 Cefradine≤1415~17≥183016I頭孢噻肟 Cefotaxime≤1415~22≥233024S氨基糖疳類慶大霉素 Gentamicin≤1213~14≥151013IAminoglycosides鏈霉素 Streptomycin≤1112~14≥151014I奈替米星 Netilmicin≤1213~14≥153020S卡那霉素 Kanamycin≤1314~17≥183016I妥布霉素 Tobramycin≤1213~14≥151010R新霉素 Neomycin≤1213~16≥173014I大環內酯類Macrolides阿奇霉素 Azithromycin≤1314~17≥181520S紅霉素 Erythromycin≤1314~22≥231510R四環素類Tetracyclines四環素 Tetracycline≤1819~22≥233030S強力霉素 Doxycycline≤1213~15≥163025S喹諾酮類Quinolones依諾沙星 Enoxacin≤1415~17≥181030S諾氟沙星 Norfloxacin≤1213~16≥171028S酰胺醇類Amphenicols氯霉素 Chloramphenicol≤1213~17≥1830035S氟苯尼考 Florfenicol≤1213~17≥187522S磺胺類Sulfonamides磺胺異噁唑 Sulfamisoxazole≤1213~16≥1730013I
S,高度敏感;R,耐藥;U,青霉素的含量以單位計。
S, highly sensitive; R, resistant; U, penicillin content measured in unit.
3 討論
16S rRNA高通量測序技術是基于細菌16S rRNA基因在功能上的高度保守性及一定程度的高變性來檢測細菌種類[23-24]。本試驗根據16S rRNA高通量測序結果,利用選擇性培養基培養氣單胞菌,在患腹水病瀕死黃顙魚腹水內分離到一株致病菌HS01,經人工感染試驗,確定為本次黃顙魚腹水病病原,通過理化特性測定及保守基因分型,確定分離株HS01為嗜水氣單胞菌,從而確定本次黃顙魚暴發溶血性腹水病的病原是嗜水氣單胞菌。16S rRNA高通量測序技術的引入使得本結果更加可信,也解決傳統水生動物細菌性病原確定缺點,是對傳統方法的補充與完善。

M,DL 2 000 maker;a、b、c、d分別為Alt、hlyA、aphA、aerA基因擴增產物。M, DL 2 000 maker; a, b, c, d represented PCR product of Alt, hlyA, aphA, aerA genes.圖5 分離株HS01的毒力基因PCR擴增結果Fig.5 Results of PCR amplification of virulence gene of HS01 strain

M,DL 2 000 maker;a、b、c、d分別為Sul1、qnrA、ant (3’)-Ia、tet A基因擴增產物。M, DL 2 000 maker; a, b, c, d represented PCR product of Sul1, qnrA, ant (3’)-Ia, tet A genes.圖6 分離株HS01的耐藥基因PCR擴增結果Fig.6 Results of PCR amplification of drug-resistant of HS01 strain

A,腸;B,肝;C,肌肉;D,脾;E,鰓;F,腎。A, Intestines; B, Liver; C, Muscle; D, Spleen; E, Gill; F, Kidney.圖7 病理學觀察Fig.7 Pathological observation
腹水病是水生動物養殖過程中常見及危害較大的一種疾病,可分為溶血性與非溶血性腹水,溶血性腹水病是由細菌性病原引起,而非溶血性腹水病多是由營養代謝障礙引起的。目前已報道的可發生腹水病的種類有異育銀鯽[25]、中華鱉[26]、鰱鳙[27]、烏鱧[28]、日本鰻鱺[29]與牛蛙[30]等,大多數是溶血性腹水病。本研究中,患病黃顙魚主要癥狀表現為腹部膨大,肛門紅腫潰爛,腹腔有大量腹水,而腹水離體幾分鐘后即形成膠體狀,肝腎脾有充血腫大,肝發黃,腸道無食物,與孫其煥等[25]研究比對可知,本次黃顙魚疾病是典型的溶血性腹水病。
嗜水氣單胞菌是典型的人-畜-魚共患病病原菌,可導致水生動物發生溶血性腹水病[25-30]。本試驗從患病瀕死黃顙魚腹水中分離到的HS01株具有強毒力,含有溶血素及氣溶素基因,氣溶素可以使全身臟器廣泛出血,并破壞宿主細胞膜,導致細胞死亡[31],溶血素是基因組DNA編碼的毒力因子,形成共聚后插入細胞膜上,形成管道,導致溶血[32]。對黃顙魚腹水病病理學研究,進一步佐證了嗜水氣單胞菌對黃顙魚可以產生較大危害,影響其健康生長,并能導致大規模死亡。
雖然現代水生動物防控技術發展日新月異,但藥物仍是治療患病動物的主要手段。本研究中,分離株HS01對β-內酰胺類全部耐藥,對氨基糖疳類及大環內酯類部分耐藥,對酰胺醇類、四環素類及喹諾酮類高度敏感,對頭孢類及磺胺類中度或高度敏感。經特異性PCR擴增細菌磺胺類、喹諾酮類、氨基糖苷類及四環素類耐藥基因,并未獲得相應片段,表明耐藥的表型與基因型存在一定差異。根據試驗測得的分離株藥敏特性,在實際生產中可選擇水產上允許使用的而病原菌對其又高度敏感的藥物進行治療。值得一提的是,我國幅員遼闊,水產養殖區域跨度大,因而養殖環境、品種及方式差異較大,病原的藥敏特性可能會存在一定的差距。在水生動物疾病防控時,一定要開展藥物敏感性試驗,從而確保治療效果,避免藥物濫用。

