利用全自動凱氏定氮儀測定大豆粗蛋白含量的條件研究
游思亮 王青

摘要 [目的]研究多種因素對大豆粗蛋白含量測定的影響,以期獲得最優化的試驗條件。[方法]利用全自動凱氏定氮儀比較不同稱樣量、催化劑比例、硫酸用量、消化時間、消化溫度條件下測定的大豆粗蛋白含量。[結果]當只改變某一種試驗條件的水平時,大豆粗蛋白含量測定結果之間差異較大,有的甚至達到極顯著水平。針對大豆樣本,較優化的試驗條件是稱樣量0.5 g、催化劑用量比例K2SO4/CuSO4·5H2O為6/0.2(g/g)、硫酸用量為8 mL、消化時間105 min、消化溫度420 ℃。儀器測定硫酸銨的回收率為100.26%,符合定量的要求。[結論]該研究為其他相關研究提供方法借鑒。
關鍵詞 全自動凱氏定氮儀;大豆;粗蛋白含量
中圖分類號 TS207.3文獻標識碼 A
文章編號 0517-6611(2019)14-0213-03
doi:10.3969/j.issn.0517-6611.2019.14.063
開放科學(資源服務)標識碼(OSID):
Abstract [Objective]The research aimed to study the effects of various factors on the determination of soybean crude protein content in order to obtain optimal experimental conditions.[Method]Soybean crude protein content was measured by using automatic kjeldahl analyzer under different conditions, which include sample amount, ratio of catalyst, sulfuric acid amount, digesting time and digesting temperature. [Result]When only the level of a certain test condition was changed, the difference between the determination results of the soybean crude protein content was large, and some even reached a very significant level.For the soybean samples, the optimized experimental conditions were 0.5 g soybean sample, the ratio of catalyst to K2SO4/CuSO4·5H2O was 6 g/0.2 g, the amount of sulfuric acid was 8 mL, the digestion time was 105 min, and the digestion temperature was 420 ℃.The recovery of (NH4)2SO4 by using automatic kjeldahl analyzer was 100.26%, which was suitable for quantitative analysis.[Conclusion]This study provides a methodological reference for other related research.
Key words Automatic kjeldahl analyzer;Soybean;Crude protein content
作者簡介 游思亮(1984—),男,湖北武漢人,實驗師,碩士,從事作物遺傳分析與生理生化檢測研究。
收稿日期 2019-01-16
大豆作為我國重要的糧食作物,已有5 000多年的栽培歷史,其種子含有豐富的植物蛋白。同時,大豆的蛋白質含量作為衡量大豆品質好壞的一項重要指標被重點關注。目前,測定大豆蛋白質含量的方法是國標方法GB/T 5511—2008中推薦的凱氏定氮法[1]。
凱氏定氮法自1833年被丹麥化學家凱道爾創立以來,因為其結果準確、成本低廉、操作相對簡單等特點,被當作測定不同類型樣本蛋白質含量的黃金標準[2],隨后更是發展出了常量、微量、半微量凱氏定氮法以及自動定氮法。凱氏定氮法的原理是將催化劑和濃硫酸同時加入樣品中,加熱消化,樣品中的有機氮與硫酸反應生成硫酸銨;然后加入過量的堿,并蒸餾使硫酸銨轉化為氨氣,氨氣被硼酸吸收反應生成硼酸銨;隨后用標準滴定鹽酸溶液滴定,由于硼酸中有甲基紅和溴甲酚綠指示劑,通過指示劑顏色變化可判斷滴定終點,最后根據滴定鹽酸溶液的消耗量計算樣品中的含氮量,再乘以樣品對應的蛋白質系數,得到樣品的粗蛋白含量[3-5]。大豆及大豆制品中氮換算成蛋白質系數,國內多數標準采用6.25[6]。從凱氏定氮法的原理可知,這種方法實際上測的是樣品中蛋白質和非蛋白質含氮物(如核酸、生物堿、含氮類脂等),也就是粗蛋白含量[7]。而且,凱氏定氮法測定樣品總氮含量時有一定的局限性,這種方法無法測定土壤中N-O或N-N鍵結合的氮化合物,如硝態氮、亞硝態氮、硝基、亞硝基、偶氮化合物[8]等,還需要做進一步改進。
全自動凱氏定氮儀可同時消化多個樣品,且自動完成后續的蒸餾、滴定步驟,減少了人為操作導致的試驗誤差,目前被研究者廣泛使用[9]。也正因為測定步驟不需要人為參與,因此,對于使用全自動凱氏定氮儀的用戶來說,影響試驗結果最關鍵的步驟是樣品的消化。有學者討論了一些影響消化的因素,但是不夠全面[10]。筆者從多個方面詳細比較了各因素對大豆粗蛋白含量的影響,以期獲得最優化的試驗條件,為即將開展的研究打下基礎,也為相關研究者提供方法借鑒。
1 材料與方法
1.1 試驗材料
1.1.1 儀器。Kjeltec8400全自動凱氏定氮儀(FOSS)、DT220消化儀(FOSS)、CT410旋風磨(FOSS)、BS214D分析天平(Sartorius)、Milli-Q超純水機(Millipore)。
1.1.2 試劑。濃硫酸(AR);40%氫氧化鈉(AR);1%硼酸(AR);指示劑0.1%甲基紅和0.1%溴甲酚綠均用無水乙醇配制,每1 L硼酸溶液中加入7 mL甲基紅和10 mL溴甲酚綠;滴定鹽酸溶液(標定濃度為0.102 1 mol/L);配試劑所用的水均為去離子水。測定所用250 mL消化管均在試驗前用超聲波清洗儀清洗,然后用自來水和純水沖洗并烘干。
1.1.3 試材。試驗材料為遺傳轉化常用大豆品種杰克,由南京農業大學國家大豆改良中心提供。
1.2 試驗設計
該研究根據蛋白質測定國家標準方法GB/T 5511—2008,利用Kjeltec8400全自動凱氏定氮儀測定大豆種子中的粗蛋白含量。根據儀器推薦方法,取破碎后混勻的大豆粉,研究樣品量、催化劑比例、濃硫酸用量、消化時間、消化溫度對大豆粗蛋白含量的影響。每次試驗設置其中一項為變量,分別研究每個因素對測試結果的影響。設置樣品量處理分別為0.25、0.50、0.75、1.00、1.50 g;催化劑(K2SO4/CuSO4·5H2O)比例處理分別為6/0.05、6/0.1、6/0.2、6/0.5、6/1.0(g/g);濃硫酸用量處理分別為6、8、10、12、15 mL;消化時間處理為60、75、90、105、120 min;消化溫度處理為330、360、390、420、440 ℃(消化儀最高設置溫度)、250 ℃+420 ℃(0.5 h+1 h)。每個處理設置3次重復,且每個測定批次都做3個空白對照(加催化劑和硫酸,不加樣品)。
1.3 回收率的測定方法
將純度>99.5%的硫酸銨在102 ℃烘4 h,準確稱取0.15 g(精確至小數點后第4位)放入消化管,按照儀器設定程序測定硫酸銨的回收率,重復6次,以空的消化管作為空白對照,重復3次。
實際含氮量=(V-V0)×N×14.007×100/樣品重量×100%;回收率=實際含氮量/21.09×100%,式中,V為滴定所用鹽酸體積,V0為空白對照所用鹽酸體積,N為滴定鹽酸的當量濃度(精確至小數點后第4位),樣品重量單位為mg。
2 結果與分析
2.1 稱樣量對大豆粗蛋白含量的影響
大豆屬于粗蛋白含量比較高的樣品,對于這類樣品,需要適當控制樣品總量,儀器要求的樣品總含氮量不能超過200 mg,但是樣品量太少會放大測試過程中的人為操作以及儀器誤差,使測定結果不準。在K2SO4/CuSO4·5H2O為6 g/0.2 g、濃硫酸用量為10 mL、消化時間為90 min、消化溫度為420 ℃時,不同稱樣量條件下測得的結果如圖1所示。稱樣量為0.5 g時結果最大,且與稱樣量0.75 g結果差異顯著,隨著稱樣量增大,測量結果下降。這一點從試驗情況可以驗證,當稱樣量≤0.75 g時,消化液呈現清澈藍綠色或者綠色;當稱樣量≥1.0 g時,消化液呈現渾濁的黑色,渾濁的黑色表明樣品消化不完全。所以,對于大豆這種蛋白質含量比較高的樣品,應該控制稱樣量不能超過0.75 g,以0.50 g左右為宜。
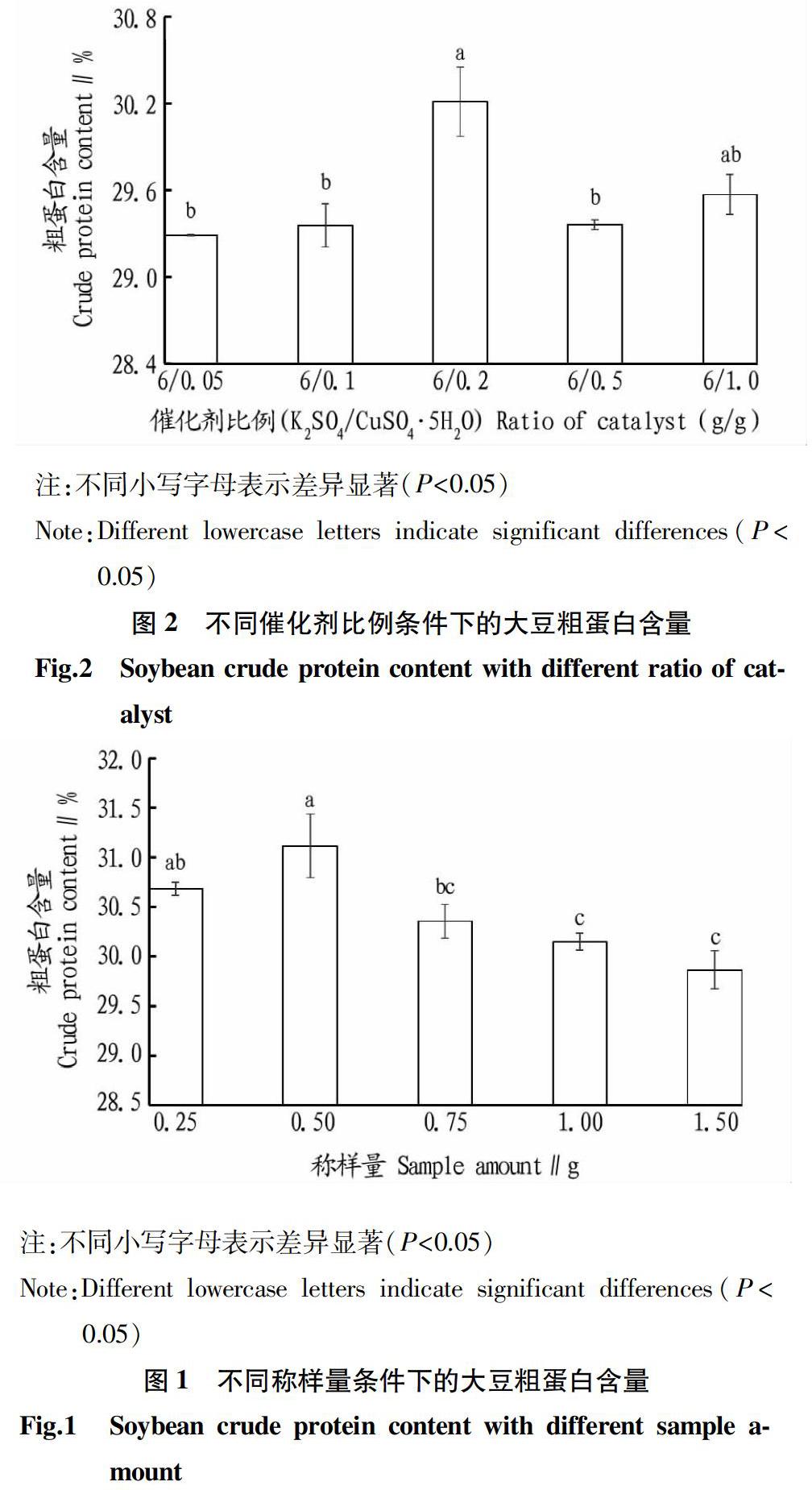
2.2 催化劑比例對大豆粗蛋白含量的影響
硫酸鉀和硫酸銅作為催化劑在化學反應過程中有著不同的作用。硫酸鉀可提高濃硫酸的沸點,促進有機物分解,硫酸銅可加快反應速度,并作為堿性反應指示劑。如果催化劑加入量太少,樣品消化時間會延長,如果催化劑加入太多,樣品消化不完全,會使結果偏低。在稱樣量為0.5 g、濃硫酸用量為10 mL、消化時間為90 min、消化溫度為420 ℃時,不同的催化劑比例條件下測得的結果如圖2所示。當催化劑比例K2SO4/CuSO4·5H2O為6 g/0.2 g時,測量結果最大,除了與6 g/1.0 g處理組結果差異不顯著,與其他處理組均差異顯著,所以,應該選擇加入催化劑比例K2SO4/CuSO4·5H2O為6 g/0.2 g。
2.3 濃硫酸用量對大豆粗蛋白含量的影響
消化用的濃硫酸對純度和濃度要求較高,應該使用分析純及以上規格的濃硫酸。消化時如果濃硫酸用量過少,會導致樣品無法完全分解,使得測試結果偏低,如果用量過多,會導致試劑浪費并產生環境污染。同時,濃硫酸的使用量需要根據樣品的類型進行調整,對于高脂或高碳水化合物的樣品,需要適當加大濃硫酸用量。目前常用的硫酸鉀和濃硫酸添加比例有2種,一種是1 g樣品中加入7 g硫酸鉀和12 mL硫酸,另一種是1 g樣品中加入10 g硫酸鉀和20 mL硫酸[11]。 在稱樣量為0.5 g、K2SO4/CuSO4·5H2O為6 g/0.2 g、消化時間為90 min、消化溫度為420 ℃時,不同濃硫酸使用量條件下測得的結果如圖3所示。當硫酸用量在8 mL時,測量結果最大,顯著高于12 mL處理組,與其他處理組差異不顯著,所以,應選擇8 mL硫酸用量比較合適。
2.4 消化時間對大豆粗蛋白含量的影響
消化時間太短會使得樣品無法充分消化分解,試驗結果偏低,消化時間太長則影響試驗效率,一般消化時間以消化液變成藍綠色清澈透明的液體之后,繼續消化30 min為宜。在稱樣量為0.5 g、K2SO4/CuSO4·5H2O為6 g/0.2 g、濃硫酸用量為8 mL、消化溫度為420 ℃時,不同消化時間條件下,測得的結果如圖4所示。隨著消化時間的延長,測定結果上升,在105 min時結果最大,105 min消化時間的結果除與120 min差異不顯著外,與其他處理組結果差異顯著,所以消化時間選定105 min比較合理。
2.5 消化溫度對大豆粗蛋白含量的影響
較高的消化溫度能保證樣品被快速消化,但是在消化前段,由于蛋白質尚未轉化成銨鹽,溫度過高會使含氮物質揮發,致使檢測結果偏低。因此,消化前段溫度應控制在250~300 ℃,后段可將溫度控制在360~410 ℃[12]。在稱樣量為0.5 g、K2SO4/CuSO4·5H2O為6 g/0.2 g、濃硫酸用量為8 mL、消化時間為105 min時,不同消化溫度條件下,測得的結果如圖5所示,當消化溫度高于420 ℃,測定結果之間差異不顯著,而且低溫加高溫與直接高溫處理組之間結果差異不明顯,所以,實際操作過程中可以直接高溫消化。390 ℃的處理組與420 ℃處理組差異達到顯著水平,與440 ℃處理組差異達到極顯著水平。而且隨著消化溫度繼續降低,測定結果也隨之降低,390 ℃與360 ℃處理組測定結果差異顯著。綜合以上結果,消化溫度對大豆粗蛋白測定結果的影響巨大,對于大豆樣品,應該選擇≥420 ℃的消化溫度。另外,由于消化儀的最高設置溫度為440 ℃,為了儀器安全考慮,可以選擇稍低一點的420 ℃作為消化溫度。
2.6 儀器的準確性和穩定性驗證試驗
通過測定已知含氮量硫酸銨的回收率來評價凱氏定氮儀的準確性和穩定性,純度≥99.5%的硫酸銨理論含氮量為21.09%。6次測定結果的回收率分別為99.26%、100.01%、100.58%、100.62%、100.60%、100.48%,儀器對硫酸銨的回收率平均值是100.26%,RSD為0.54%,符合回收率99.5%~100.5%的定量要求,說明儀器準確性和穩定性良好。
3 結論與討論
利用Kjeltec8400全自動凱氏定氮儀來測定大豆種子粗蛋白含量,較為優化的消化條件為稱樣量0.5 g、催化劑比例K2SO4/CuSO4·5H2O為6 g/0.2 g、硫酸用量8 mL、消化時間105 min、消化溫度420 ℃。
雖然凱氏定氮法有諸多優點,但不可否認它也有缺點,如檢測時間長、所用試劑有很強的腐蝕性、測定的氮是總有機氮而不是蛋白質氮等。近年來,近紅外光譜法作為一種新興的蛋白質測定技術,由于其測定時間短、不用消耗任何化學試劑、試驗過程無污染、樣品基本不用預處理、結果準確性幾乎可媲美傳統凱氏定氮法等優點,正在越來越多的領域得到應用[13-17],在某些應用領域甚至有可能取代傳統方法,有很好的應用前景。
參考文獻
[1] 中華人民共和國衛生部.谷物和豆類 氮含量測定和粗蛋白質含量計算 凱氏法:GB/T 5511—2008[S].北京:中國標準出版社,2008.
[2] LYNCH J M,BARBANO D M.Kjeldahl nitrogen analysis as a reference method for protein determination in dairy products[J].J AOAC Int,1999,82(6):1389-1398.
[3] MICHALOWSKI T,ASUERO A G,WYBRANIEC S.The titration in the Kjeldahl method of nitrogen determination:Base or acid as titrant[J].J Chem Educ,2013,90(2):191-197.
[4] SEZPLAZA P,MICHALOWSKI T,NAVAS M J,et al.An overview of the Kjeldahl method of nitrogen determination.Part I.Early history,chemistry of the procedure,and titrimetric finish[J].Crit Rev Anal Chem,2013,43(4):178-223.
[5] SEZPLAZA P,NAVAS M J,WYBRAINIEC S,et al.An overview of the Kjeldahl method on nitrogen determination.Part II.Sampling preparation,working scale,instrumental finish,and quality control[J].Crit Rev Anal Chem,2013,43(4):224-272.
[6] 國家市場監督管理總局.飼料中粗蛋白的測定 凱氏定氮法:GB/T 6432—2018[S].北京:中國標準出版社,2018.
[7] 丁衛新.全自動定氮儀在小麥粗蛋白檢驗中的應用與研究[J].糧食加工,2012,37(4):24-26.
[8] KUBOTA T,OSHIDA T,YANAI K,et al.Improvement of the conditions for the determination of total nitrogen in fish meal in Kjeldahl method and its comparison with Dumas method[J].Bunseki Kagaku,2011,60(1):67-74.
[9] 史瑋,孫瑩,徐振斌.凱氏定氮法測定糧食蛋白質含量方法研究[J].糧食科技與經濟,2013,38(5):31-32.
[10] 徐新娟,黃中文,王偉,等.全自動凱氏定氮儀測定大豆蛋白質方法的研究[J].黑龍江農業科學,2016(2):108-110,121.
[11] 馬丹.凱氏定氮法測定食品中蛋白質含量[J].計量與測試技術,2008(6):57-58.
[12] 羅小芬.淺談凱氏定氮法測定蛋白質準確度的操作技巧及關鍵點[J].現代食品,2017(19):99-100.
[13] DABKIEWICZ V E,DE MELLO PEREIRA ABRANTES S,CASSELLA R J.Development of a nondestructive method for determining protein nitrogen in a yellow fever vaccine by near infrared spectroscopy and multivariate calibration[J].Spectrochimica acta part A:Molecular and biomolecular spectroscopy,2018,201:170-177.
[14] INGLE P D,CHRISTIAN R,PUROHIT P,et al.Determination of protein content by NIR spectroscopy in protein powder mix products[J].J AOAC Int,2016,99(2):360-363.
[15] MOURYA V,KUMAR V,RANI A,et al.Nearinfrared reflectance spectroscopy for protein content in soybean flour and screening of germplasm across different countries[J].Agricultural research,2016,5(1):29-34.
[16] 溫冰消,劉衛國,李虹橋,等.基于近紅外法的鮮食大豆品質快速分析技術[J].分子植物育種,2018,16(12):4062-4067.
[17] 趙影,王文和,滕嬌琴,等.兩種儀器測定國產大豆粗蛋白含量的比較[J].糧食儲藏,2018,47(4):37-39,44.

