消糖靈片和消糖靈膠囊中格列本脲含量及含量均勻度測定
賀凡珍,黃財順,楊 娟,李 哲,許潤娟
(中山市食品藥品檢驗所,廣東 中山 528437)
消糖靈片和消糖靈膠囊均為治療糖尿病的中西藥復方制劑,其處方由黃芪、白芍、人參等十一味中藥和化學藥格列本脲組成。現行消糖靈片質量標準[1]有性狀、黃芪甲苷薄層鑒別、人參皂苷Re和人參皂苷Rg1鑒別、黃連對照藥材鑒別、格列本脲含量均勻度檢查、格列本脲含量測定、芍藥苷含量測定等項目;消糖靈膠囊質量標準[2]僅有性狀、黃連對照藥材鑒別、人參皂苷Re和人參皂苷Rg1鑒別項目。現有文獻對消糖靈片和消糖靈膠囊的研究較少,有少數文獻報道對消糖靈膠囊中芍藥苷、鹽酸小檗堿的成分進行含量測定[3-5],針對其中的化學藥成分格列本脲,左宏笛[6]采用高效色譜法(HPLC)測定消糖靈片中格列本脲的含量,劉淑花等[7-12]對消糖靈膠囊中化學藥品成分格列本脲進行含量測定,但沒有文獻報道對其進行含量均勻度檢查。本文參照消糖靈片質量標準中格列本脲的含量測定及含量均勻度檢查方法,建立消糖靈膠囊中格列本脲的含量測定及含量均勻度測定方法,并同時測定消糖靈片和消糖靈膠囊中格列本脲的含量及含量均勻度,比較兩種劑型對格列本脲成分的控制。
1 儀器與材料
1.1 儀器
Waters eAlliance e2695-2998高效液相色譜儀(美國沃特世公司);超聲波清洗機(天津瑞普);Millipore Integral-5超純水機(德國默克公司)。
1.2 材料
消糖靈片(廣東先通藥業,批號:20171005,20171004,20171006,20171003,20171103,20171104,20171106,20171105,20171107,20171108);消糖靈膠囊(遼寧綠丹藥業,批號:20161209,20170310,20161107,20170204,20161004,20170306,20170302,20170401,20161205,20160966,20170402);消糖靈膠囊(煙臺中亞醫藥保健酒公司,批號:170229,170230,170123,160917,170301,160713,170403,160609,170506);消糖靈膠囊(湖南正清制藥集團,批號:1702203,1706212);格列本脲對照品(中國食品藥品檢定研究院,批號:100135-201105);甲醇(色譜純,德國默克公司);甲醇(分析純,廣州化學試劑廠)。
2 方法
2.1 色譜條件
色譜柱:Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm);流動相:甲醇-磷酸二氫銨溶液(取磷酸二氫銨1.725 g,加水300 ml使溶解,用磷酸調pH 3.5)(68:32),流速:1.0 ml/min,檢測波長:230 nm;進樣量:20 μl。
2.2 溶液的制備
2.2.1 對照品溶液的制備
2.2.1.1 片劑對照品溶液的制備 精密稱取格列本脲對照品12 mg,置入50 ml量瓶,加甲醇12 ml,超聲處理使溶解,放冷,加流動相至刻度,搖勻。精密量取5 ml置入50 ml量瓶,加流動相至刻度,搖勻,濾過,即得(每1 ml相當于格列本脲24 μg)。
2.2.1.2 膠囊對照品溶液的制備 精密稱取格列本脲對照品14 mg,置入50 ml量瓶,加甲醇12 ml,超聲處理使溶解,放冷,加流動相至刻度,搖勻。精密量取5 ml,置入100 ml量瓶,加流動相至刻度,搖勻,濾過,即得(每1 ml相當于格列本脲14 μg)。
2.2.2 供試品溶液的制備
2.2.2.1 片劑供試品溶液的制備 取格列本脲片10片,除去薄膜衣,精密稱定,研細,混勻,取約0.8 g,精密稱定,置入具塞錐形瓶,精密加入流動相50 ml,密塞,稱定重量,超聲處理(功率100 W,頻率40 kHz)30 min,取出,放冷,稱定重量,用流動相補足減失的重量,搖勻,濾過,即得。
2.2.2.2 膠囊供試品溶液的制備 取膠囊內容物,混合均勻,研細,取約0.4 g,精密稱定,置入具塞錐形瓶,精密加入流動相25 ml,密塞,稱定重量,超聲處理(功率100 W,頻率40 kHz)30 min,取出,放冷,稱定重量,用流動相補足減失的重量,搖勻,濾過,即得。
3 方法學考察
3.1 專屬性試驗
精密量取對照品溶液、消糖靈膠囊供試品溶液、消糖靈膠囊缺格列本脲陰性供試品溶液各20 μl,按2.1項色譜條件進樣分析,格列本脲與相鄰成分達基線分離,且陰性對照無干擾(見圖 1~3)。
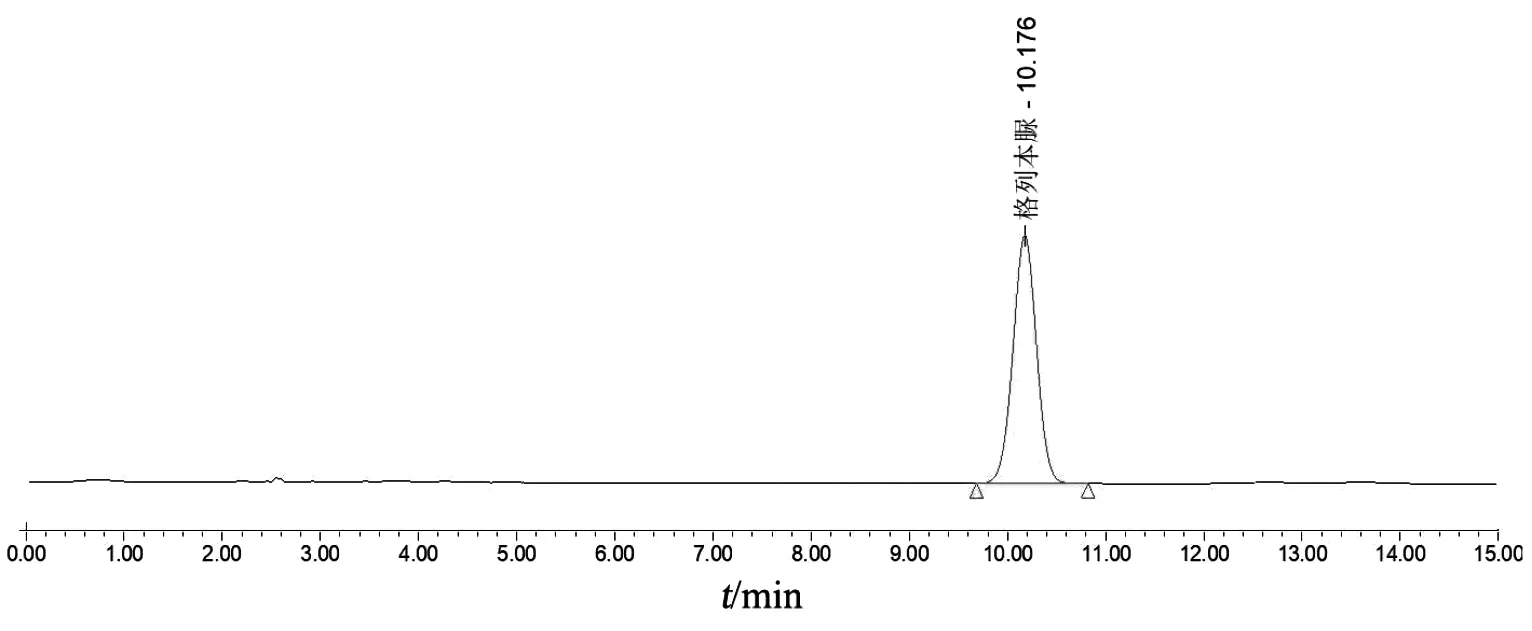
圖1 格列本脲對照品溶液色譜圖
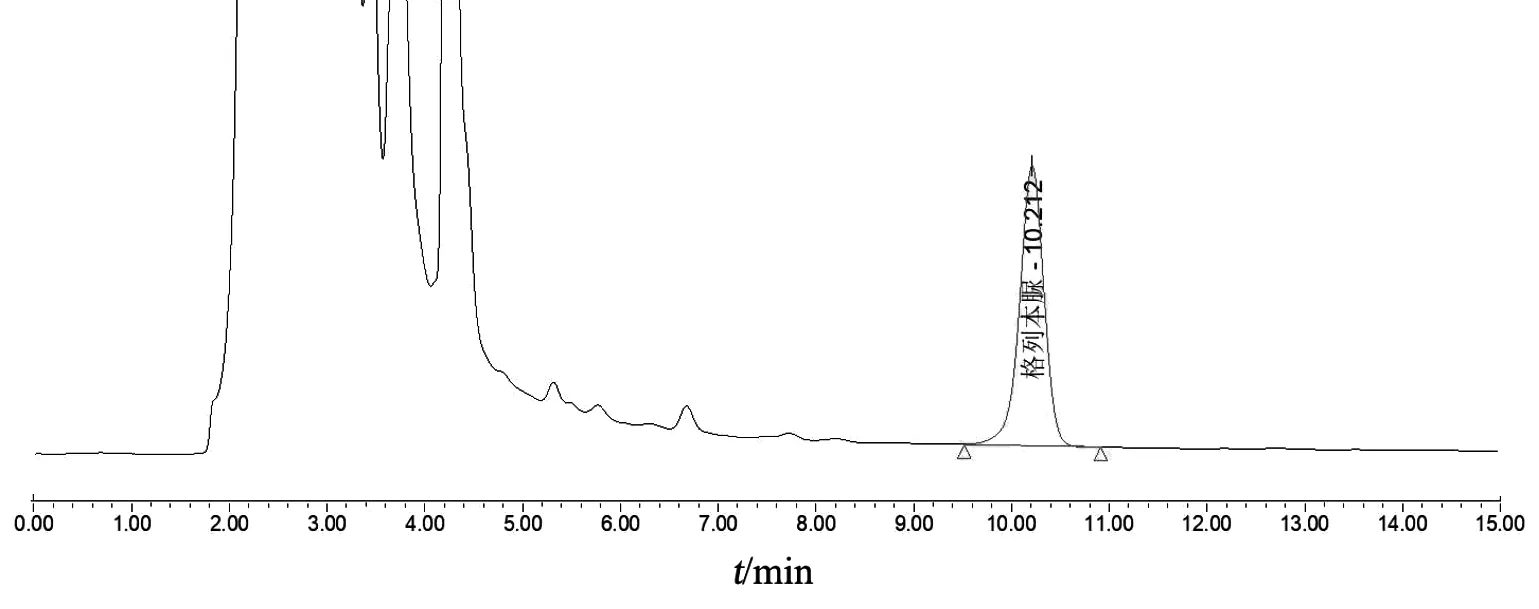
圖2 消糖靈膠囊供試品溶液色譜圖
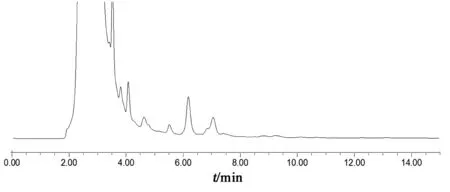
圖3 消糖靈膠囊缺格列本脲陰性供試品溶液色譜圖
(因陰性供試品為自制,各味藥材的品種和來源可能與企業原料有所不同,導致陰性供試品與消糖靈膠囊供試品其他峰差別較大)
3.2 定量限
精密吸取逐級稀釋得到的格列本脲對照品溶液(2.88311 μg/ml),按2.1項色譜條件進樣測定。信噪比約為10:1時,對應的格列本脲的進樣量為0.057662 μg,即本方法中格列本脲的定量限為0.057662 μg。
3.3 線性試驗
精密稱取格列本脲對照品約14 mg,置入50 ml量瓶,加甲醇12 ml,超聲處理使溶解,放冷,加流動相至刻度,搖勻,精密量取適量,分別稀釋制成每1 ml約含2.8,7.0,14,28,42,56 μg的系列濃度的溶液,按2.1項色譜條件進樣測定,以濃度(μg/ml)與其峰面積進行線性回歸,回歸方程為:Y=63 586X+12 151,r=1.000,線性范圍為2.91~58.26 μg/ml。
3.4 精密度試驗
精密量取格列本脲對照品溶液(14 μg/ml)20 μl,按2.1項色譜條件,連續進樣分析6次,計算格列本脲峰面積的RSD(n=6)為0.1 %,試驗結果表明本方法的精密度良好。
3.5 重復性試驗
取批號為20170310的消糖靈膠囊樣品6份,按2.2.2.2項方法制備供試品溶液,按2.1項色譜條件進樣測定,結果消糖靈膠囊中格列本脲的平均含量(n=6)為標示量的112.0 %,RSD為1.1 %。
3.6 穩定性試驗
取消糖靈膠囊3.5項下重復性試驗樣品,按2.1項色譜條件,在0,2,4,8,12,24 h依法測定格列本脲的峰面積,結果RSD(n=6)為0.2 %,表明溶液中格列本脲在24 h內穩定。
3.7 耐用性試驗
3.7.1 不同品牌色譜柱對分離度的影響 分別采用Shiseido CAPCELL PAK C18MG Ⅱ(4.6 mm×250 mm,5 μm),Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm),Shimadzu Inertsil ODS-SP(4.6 mm×250 mm,5 μm)為色譜柱進行檢測。結果表明,各色譜柱的分離效果均良好,分離度均>4.5。
3.7.2 柱溫對分離度的影響 對比了20.0,25.0,30.0 ℃ 3個不同溫度下各色譜峰的分離情況。結果表明,3個不同柱溫下,除色譜峰的保留時間稍有差別外,各峰的分離度均>3.9。
3.7.3 流動相比例對分離度的影響 對比了甲醇-磷酸二氫銨(72:28),甲醇-磷酸二氫銨(65:35),甲醇-磷酸二氫銨(68:32)對分離效果的影響。結果顯示,采用不同比例的甲醇-磷酸二氫銨為流動相,各峰的峰型及分離度均良好。最終選擇出峰時間適宜的甲醇-磷酸二氫銨(68:32)為流動相。
3.8 加樣回收試驗
采用加樣回收法,精密稱取同批號一樣品(批號20170310)9份,平均分為3組,按低、中、高濃度(0.8,1,1.2倍)分別加入適量格列本脲對照品,按2.2項方法制備供試品溶液,按2.1項色譜條件進樣測定,結果格列本脲的平均回收率(n=9)為99.9 %,RSD為1.2 %,結果見表1。
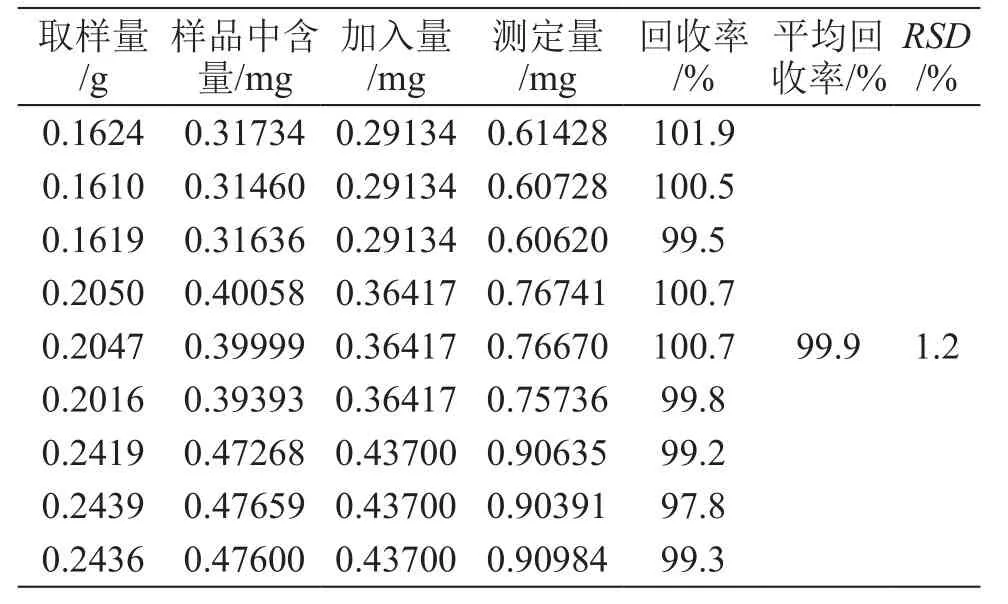
表1 加樣回收試驗結果(n=9)
4 樣品測定
4.1 含量測定
4.1.1 片劑含量測定 參照消糖靈片質量標準中含量測定項,測定10批消糖靈片的含量,結果以相對于標示量的百分比表示,以下同,見表2。
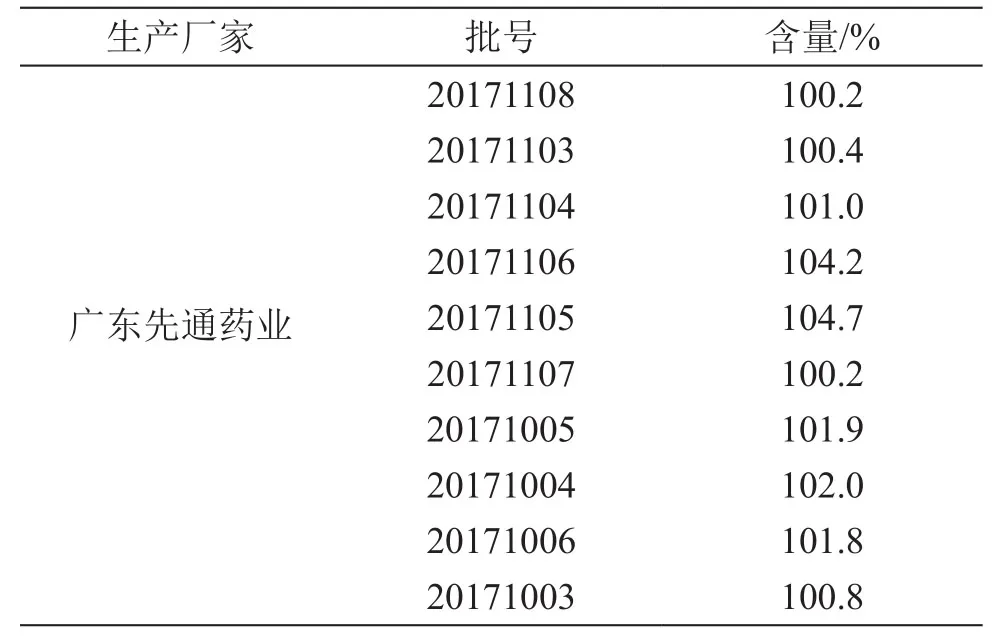
表2 消糖靈片中格列本脲含量測定結果
4.1.2 膠囊含量測定 精密稱取22批消糖靈膠囊樣品各約0.4 g,按2.2項方法制備供試品溶液,按2.1項色譜條件進樣測定,以外標法計算格列本脲含量,結果見表3。
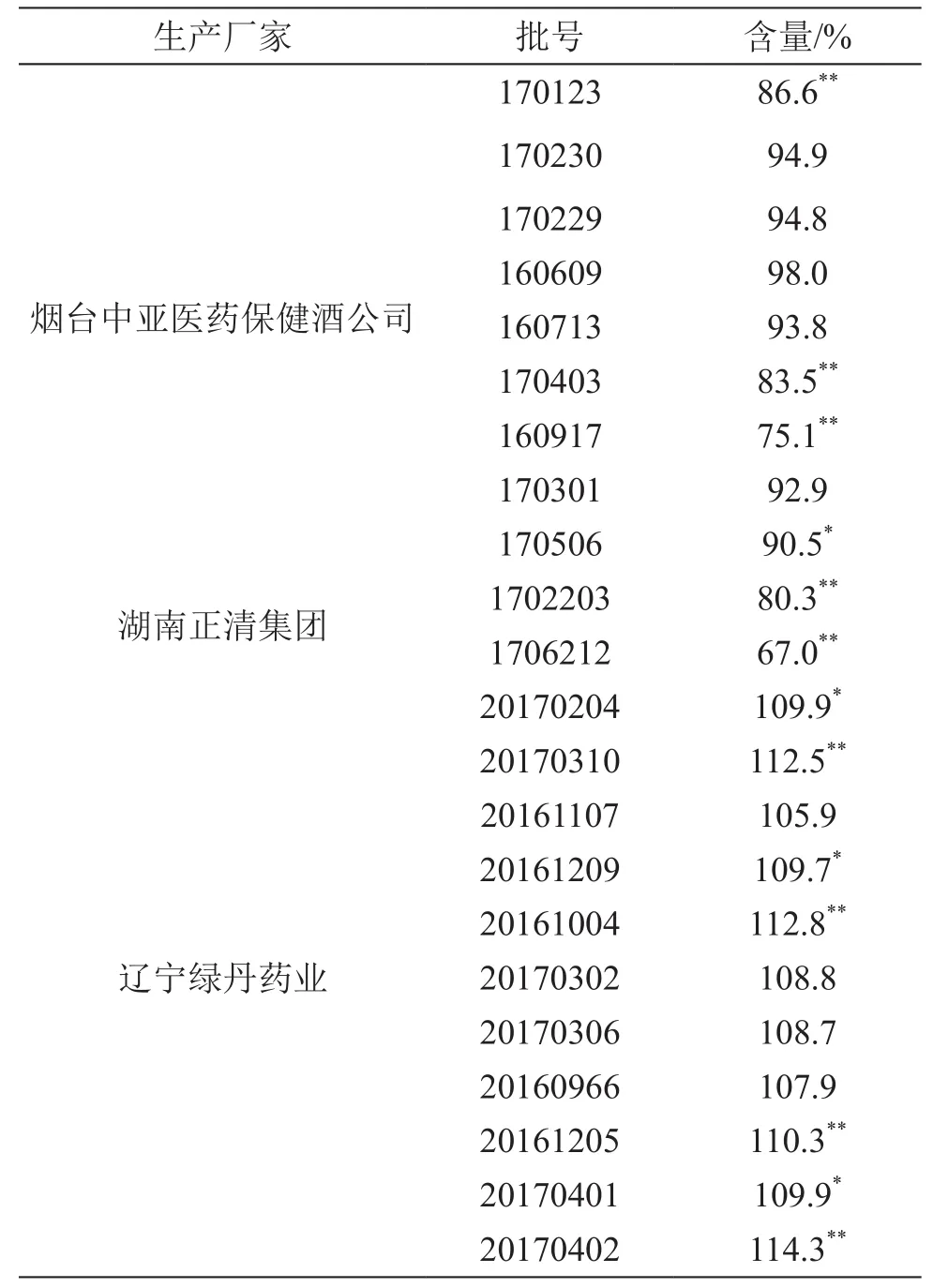
表3 消糖靈膠囊中格列本脲含量測定結果
4.2 含量均勻度測定
《中國藥典》2015年版四部0941含量均勻度檢查法規定[13]:除另有規定外,片劑、硬膠囊劑、顆粒劑或散劑等,每一個單劑量標示量小于25 mg或主藥含量小于每一個單劑量重量25 %者均需檢查含量均勻度。消糖靈片每片含格列本脲1.05 mg,消糖靈膠囊每粒含格列本脲僅0.7 mg,兩種劑型均為中西藥復方制劑且符合進行含量均勻度檢查的要求,西藥成分的含量不均勻將造成藥品無效或藥品蓄積,使副作用增加,針對膠囊劑的質量標準中尚無含量均勻度項的現狀,參照已有的片劑質量標準中的含量均勻度項,進行測定。
4.2.1 片劑含量均勻度測定 參照消糖靈片質量標準,取消糖靈片1片,置入具塞錐形瓶,精密加入格列本脲含量測定項下的流動相50 ml,密塞,稱定重量,超聲處理(功率100 W,頻率40 kHz)至片劑完全崩解,取出,放冷,稱定重量,用流動相補足減失的重量,搖勻,濾過,取續濾液作為供試品溶液,按含量測定項下方法測定,計算結果,結果見表4。
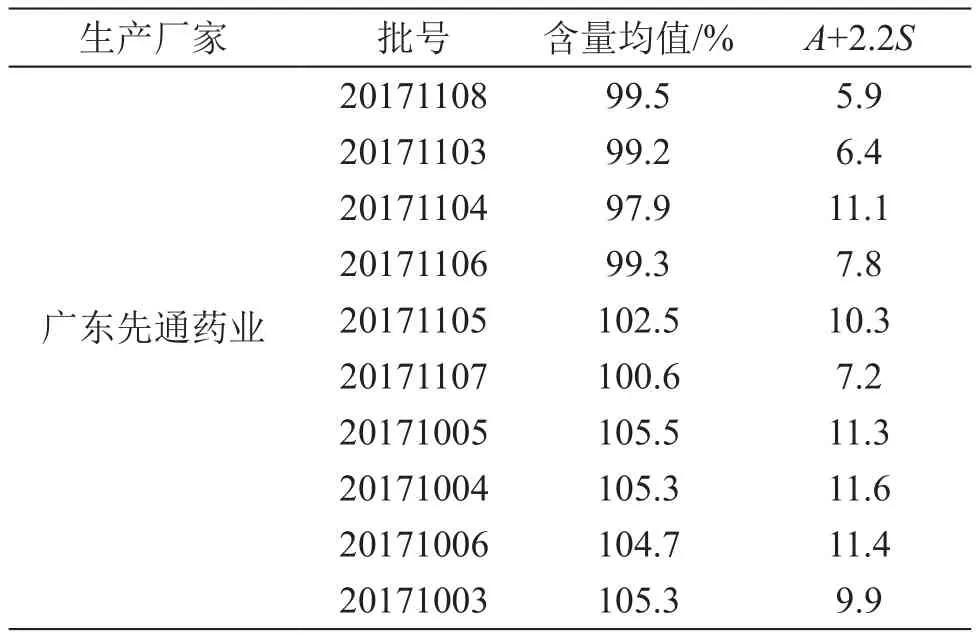
表4 消糖靈片中格列本脲含量均勻度測定結果
4.2.2 膠囊含量均勻度測定 應用本文建立的HPLC含量測定方法,進行消糖靈膠囊中格列本脲含量均勻度檢查。取消糖靈膠囊1粒,置入具塞錐形瓶,精密加入流動相25 ml,密塞,稱定重量,超聲處理(功率100 W,頻率40 kHz)至膠囊完全崩解,取出,放冷,稱定重量,用流動相補足減失的重量,搖勻,濾過,作為供試品溶液,平行處理10份,照含量測定項下的方法測定,計算結果,結果見表5。
5 討論
5.1 檢測波長的選擇
根據格列本脲對照品溶液紫外掃描結果,格列本脲的最大吸收波長在230 nm和300 nm附近,其中230 nm處主峰的響應值高,靈敏度較好,故選擇230nm為檢測波長。
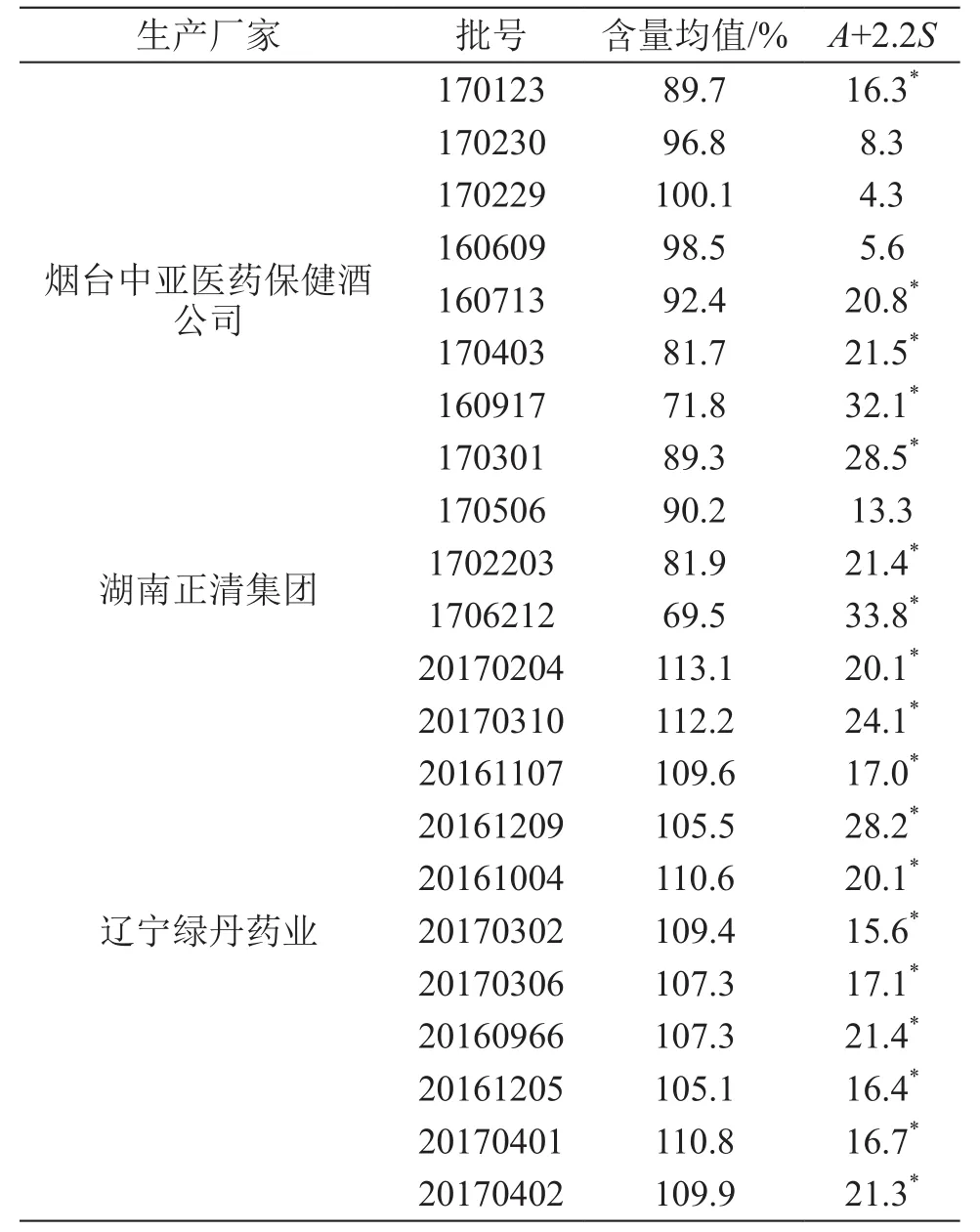
表5 消糖靈膠囊中格列本脲含量均勻度測定結果
5.2 提取溶劑考察
分別采用甲醇和流動相作為提取溶劑,結果發現二者提取效率相當,為了節約成本和減少環境污染,采用流動相作為提取溶劑。
6 小結
由含量結果可見,消糖靈片中的格列本脲含量均為標示量的90.0 %~ 110.0 %,含量均勻度A+2.2S≤15.0,均符合現行質量標準要求。消糖靈膠囊中格列本脲含量相差懸殊,不同廠家、甚至同一廠家不同批次間的含量都不穩定。由于兩個品種的質量標準不同,導致不同品種規格的消糖靈制劑的質量存在差異,且市售兩個品種的價格也存在較大差異。特別是消糖靈膠囊為一種中西藥復方制劑,無化學藥成分的含量測定要求,容易造成該品種的化學藥含量不均勻或超出合理的使用范圍,從而影響藥品的安全性,嚴重者甚至造成患者使用后的化學藥積蓄過量,副作用增加。因此建立制劑中的格列本脲含量測定及含量均勻度測定方法,對藥品的質量控制有重要作用。

