高糖環境下成骨細胞通過MCP-1/c-fos/NFATC1通路促進破骨細胞分化
孫駿,張磊,趙威,馬洪冬,王新棟,李海天,楊茂偉
(1. 中國醫科大學附屬第一醫院骨科,沈陽 110001; 2. 錦州醫科大學附屬第三醫院手足外科,遼寧 錦州 121000)
近年來糖尿病發病率日益升高,對人類的健康產生了嚴重的威脅。糖尿病可以導致多種并發癥,如心血管疾病、神經疾病等,特別是糖尿病導致的糖尿病性骨質疏松,極易出現致殘甚至致死的嚴重后果,帶來嚴重的經濟及社會負擔[1]。成骨細胞、破骨細胞作為人體內骨代謝系統的重要組成部分,在骨穩態的維持中起到關鍵作用。已有大量的研究[2-3]證實高糖對于成骨細胞具有抑制作用,然而關于高糖對破骨細胞的作用目前仍然存在爭議。有研究[5]表明,高糖降低破骨細胞的分化和功能,但還有研究[6]觀察到相反的結果。2種細胞在體內并不是單獨存在的,已有研究[7]證實二者間存在多種交流途徑,可以相互調控。還有研究[8]證實,成骨細胞可以分泌多種細胞因子,促進破骨細胞的形成。其中單核細胞趨化蛋白-1 (monocyte chemoattractant protein-1,MCP-1) 對破骨細胞的分化、形成至關重要,MCP-1可以加速破骨細胞前體細胞的募集,并促進破骨細胞的分化、成熟,從而發揮骨吸收功能[9]。破骨細胞的分化成熟是一個復雜的調控過程,c-fos/NFATC1通路在此過程中發揮關鍵作用,c-fos、NFATC1任一缺失將導致破骨細胞前體細胞無法分化為成熟的破骨細胞[10]。本研究旨在證實高糖環境下共培養體系中成骨細胞對破骨細胞分化的影響,并探究MCP-1/c-fos/NFATC1信號通路在破骨細胞分化中的作用。
1 材料與方法
1.1 細胞培養及相關試劑
小鼠成骨樣細胞株MC3T3-E1及小鼠單核細胞株Raw264.7購自中國科學院細胞庫,分別用含10%胎牛血清的α-MEM、DMEM HG培養基 (美國 Hyclone公司)培養,培養基內加入1%青鏈霉素 (美國Invitrogen公司),置于37 ℃、5%CO2培養箱中培養,每2 d換液1次。核因子-κB受體活化因子配體 (receptor activator of nuclear factor-κB ligand,RANKL)、巨噬細胞集落刺激因子、小鼠MCP-1 ELISA試劑盒購自美國R&D公司;Bindarit (MCP-1抑制劑) 購自美國MCE公司;抗MCP-1抗體購自美國CST公司;抗c-fos抗體、抗NFATC1抗體購自英國Abcam公司。
1.2 方法
1.2.1 共培養體系的構建以及高糖環境的加載:應用膜孔徑為0.4 μm的6孔Transwell共培養系統(美國Corning公司) 構建共培養體系。簡而言之,MC3T3-E1細胞密度15 000/cm2,接種于Transwell共培養系統下層。Raw264.7細胞密度3 000/cm2,接種于上層小室。此系統應用α-MEM培養基 (培養基基礎糖濃度5.5 mmol/L),補充以10%胎牛血清,1%青鏈霉素,并加入50 ng/mL RANKL和30 ng/mL巨噬細胞集落刺激因子。為了探究高糖環境對共培養體系的影響,分別設置正常組 (糖濃度5.5 mmol/L)、高糖組(糖濃度20.5 mmol/L) 以及高糖 (糖濃度20.5 mmol/L) +Bindarit (10 ng/mL) 組,共培養4 d后檢測相關指標。
1.2.2 成骨細胞MCP-1分泌測定:培養后,提取各組培養基上清液,離心去除殘留細胞。應用小鼠MCP-1試劑盒檢測上清液中MCP-1含量。具體步驟按照制造商方案進行。
1.2.3 TRAP染色測定:培養后,破骨細胞用4%多聚甲醛固定20 min,并根據試劑盒 (美國Sigma-Aldrich公司) 說明進行染色。含有3個或更多個細胞核的暗紅細胞計為TRAP+多核細胞。
1.2.4 Western blotting檢測:處理后,4 ℃下在細胞中加入含有蛋白酶和磷酸酶抑制的裂解緩沖液裂解30 min,隨后在4 ℃下以12 000 g離心30 min后收集含有總蛋白質的上清液。總蛋白提取后,用BCA法測定蛋白質濃度,通過12%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離樣品 (50 μg蛋白質),并在60 V下轉移到聚偏二氟乙烯膜上2 h。用含有5%脫脂乳的封閉緩沖液封閉膜2 h。然后在4 ℃以1∶100至1∶1 000稀釋的一抗孵育過夜。隨后,將膜與二抗 (抗小鼠或抗兔) 一起溫育。IgG以1∶6 000或1∶10 000稀釋并與辣根過氧化物酶偶聯,在室溫下孵育2 h。用EC3成像系統 (美國UVP公司) 顯現條帶,使用ImageJ軟件測量每個條帶的光密度與內參蛋白β-actin的比值。
1.3 統計學分析
2 結果
2.1 高糖環境促進成骨細胞MCP-1的表達與分泌
為了探究高糖環境對成骨細胞-破骨細胞共培養系統中成骨細胞MCP-1表達與分泌的影響,檢測成骨細胞MCP-1的表達。結果 (圖1A) 顯示,與正常組相比,高糖組中成骨細胞的MCP-1表達明顯升高。隨后檢測了MCP-1在本系統培養基上清中的含量。結果 (圖1B) 顯示,與正常組相比,高糖組培養基上清MCP-1的含量同樣明顯增加。這些結果表明,高糖環境促進了成骨細胞-破骨細胞共培養系統中成骨細胞MCP-1的表達與分泌。
2.2 MCP-1激活c-fos/NFATC1信號通路促進破骨細胞的分化形成
為了探討MCP-1/c-fos/NFATC1信號通路對破骨細胞分化的影響,首先檢測破骨細胞分化形成指標TRAP染色。結果 (圖2A) 顯示,與正常組相比,高糖組中TRAP+細胞數量明顯增多,而高糖+Bindarit組TRAP+細胞數量顯著減少。接下分別檢測各組破骨細胞c-fos、NFATC1蛋白的表達。結果 (圖2B) 顯示,與正常組相比,高糖組中的破骨細胞c-fos、NFATC1的表達明顯升高,而高糖+Bindarit組中破骨細胞c-fos、NFATC1的表達明顯降低。這些結果表明,高糖環境下成骨細胞可以通過MCP-1/c-fos/NFATC1信號通路調節破骨細胞的分化形成。
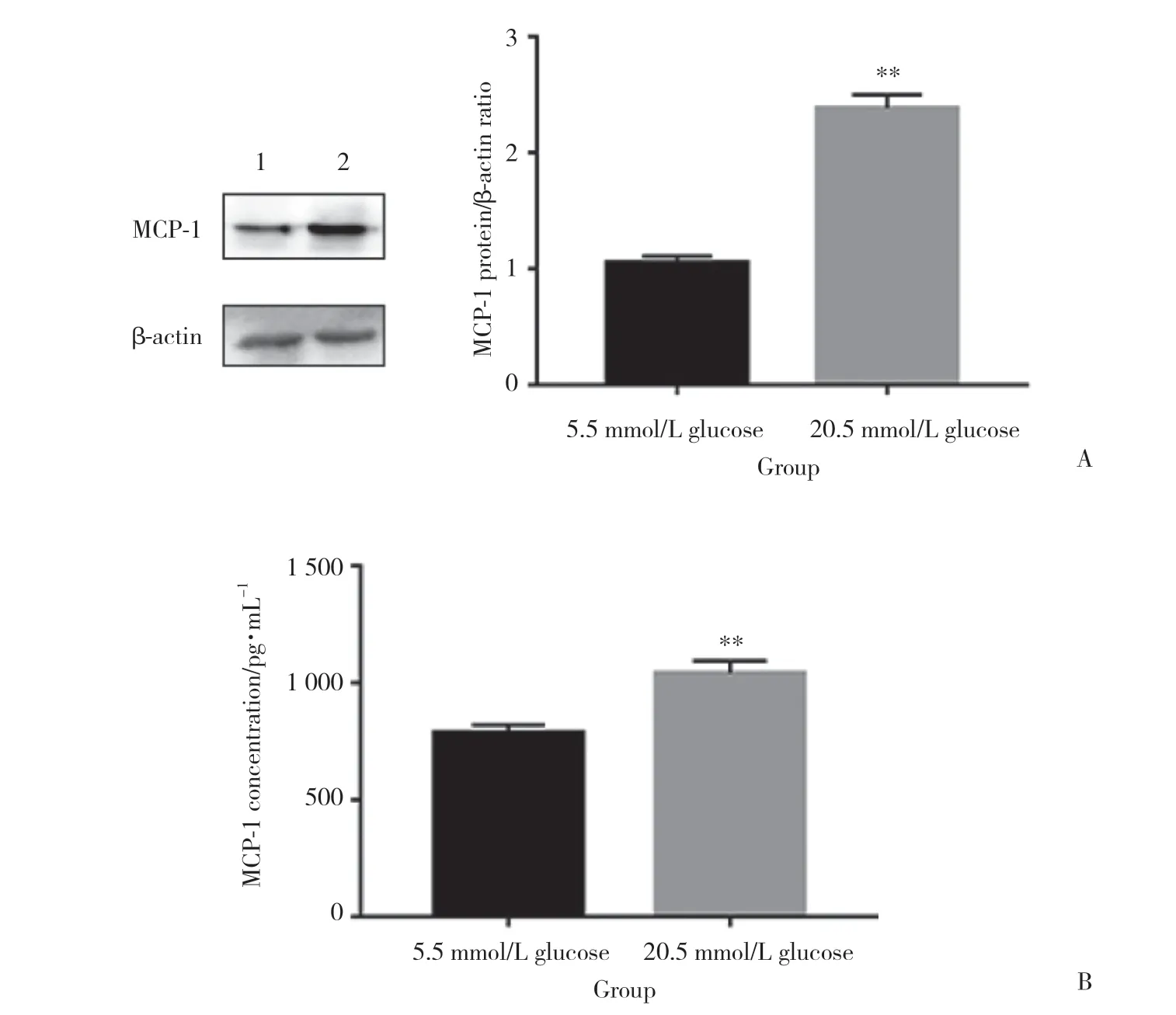
圖1 高糖促進成骨細胞MCP-1的表達與分泌Fig.1 High glucose increases the expression and secretion of MCP-1 in osteoblasts
3 討論
糖尿病性骨質疏松嚴重影響人類的健康,病理性的葡萄糖水平可以打破骨形成與骨吸收之間的平衡,造成骨質疏松的發生。本課題組前期研究[3-4]發現,糖尿病動物模型中存在嚴重的骨質疏松,并且體外細胞實驗發現高糖對成骨細胞表現為抑制作用。
目前的研究多數局限于高糖對于單獨的成骨細胞或破骨細胞的作用,然而在體內,成骨細胞與破骨細胞并非單獨存在,關于高糖情況下二者之間是否存在相互作用仍然知之甚少。此外,現有研究對于高糖對破骨細胞的作用仍存在大量爭議。已有研究[8]證實,作為高度發達的終末細胞,旁分泌途徑是成骨細胞與破骨細胞之間交流的重要途徑之一。因此,應用成骨細胞-破骨細胞共培養體系作為模型能夠更好的反映生物體內的環境,更有利于探究其中的復雜機制。

圖2 MCP-1/c-fos/NFATC1信號通路參與調控破骨細胞的分化Fig.2 MCP-1/c-fos/NFATC1 pathway is involved in osteoclastogenesis
Transwell共培養系統是目前比較成熟且應用廣泛的一個系統,是探究2種細胞間相互作用的極佳方式。在本系統中,2種細胞在共同的環境中生長而不相互接觸,而細胞分泌的細胞因子在上清液中可以自由交換。本研究采用了透光度良好的、孔徑為0.4 μm的PET膜6孔Transwell系統,既往研究[17]證實了該系統中成骨細胞具備相應的活性,并能使破骨細胞前體細胞分化為成熟的破骨細胞并具備骨吸收功能。
MCP-1是一種趨化因子,能大量募集單核細胞并促進單核細胞的融合。有研究[11]顯示,關節置換術后假體松動的患者呈現MCP-1陽性,因此MCP-1可能與破骨細胞的形成密切相關。為了進一步明確高糖環境下成骨細胞對破骨細胞分化的影響,本研究首先分析了高糖環境下共培養體系中成骨細胞分泌MCP-1的變化。結果顯示,高糖顯著促進成骨細胞的MCP-1分泌。有趣的是,本研究發現,高糖環境下單獨培養成骨細胞時,上清中MCP-1含量很低,甚至無法測出。這似乎是由于共培養系統中破骨細胞對成骨細胞的分泌同樣有重要的調控作用 (數據未顯示)。這也表明了共培養系統能夠較好的反映體內真實環境。Bindarit能夠抑制MCP-1,可以有效的降低培養基中MCP-1的含量[12]。而在本系統內加入Bindarit后,破骨細胞的分化水平顯著下降。這些結果提示,成骨細胞可以通過MCP-1的分泌來調控破骨細胞的分化形成。
c-fos/NFATC1信號通路的激活對破骨細胞分化至關重要。研究顯示,破骨細胞形成是由MAPK(p38、JNK和ERK) 和NF-κB途徑嚴格調節的多步驟過程,在此過程中誘導c-fos和NFATC1的表達,在破骨細胞分化的過程中這些途徑的消除會嚴重降低破骨細胞的形成和骨吸收功能。還有研究[13-15]表明,c-fos敲除小鼠出現完全缺乏破骨細胞的表型。鑒于此信號通路對破骨細胞分化的關鍵作用,本研究探究了MCP-1對此信號通路的影響,結果證明了MCP-1能顯著促進共培養體系中破骨細胞的分化,而應用Bindarit后c-fos、NFATC1的表達也隨之降低,TRAP+細胞數量下調。
總而言之,本研究結果表明,高糖促進成骨細胞-破骨細胞共培養體系中成骨細胞的MCP-1分泌,進而激活MCP-1/c-fos/NFATC1信號通路,促進破骨細胞的分化。這些結論為治療糖尿病性骨質疏松提供了一些思路。然而,這個共培養模型仍存在一定的不足,其并不能完美還原生物體內骨細胞-成骨細胞-破骨細胞的接觸環境。目前新出現了一種3D培養模型[16],通過植入羥基磷灰石模擬骨基質,能更精確的反映骨細胞、成骨細胞、破骨細胞三者在生物體內的真實接觸情況,這將成為后續研究的方向。

